外周血IL—6、TNF—α早期检测对急性胰腺炎相关肺损伤及其性质的临床预测价值
2018-02-24林燕张发钦李海涛
林燕 张发钦 李海涛
【摘要】 目的:探讨早期检测外周血白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)对急性胰腺炎(AP)相关急性肺损伤(ALI)及其性质的临床预测价值。方法:选取发病72 h内于本院首次就诊的AP患者90例,根据有无发生ALI及其性质(一过性、持续性)将其分为non-ALI组和ALI组(一过性ALI亚组、持续性ALI亚组)。比较各组入院时、入院第3天外周血IL-6、TNF-α水平。结果:本组47例(52.2%)未发生ALI(non-ALI组),43例(47.8%)发生ALI(ALI组),其中18例(41.9%)为一过性ALI(一过性ALI亚组)、25例(58.1%)为持续性ALI(持续性ALI亚组);入院时、入院第3天,ALI组IL-6、TNF-α水平均高于non-ALI组(P<0.05);入院第3天,ALI组IL-6、TNF-α均高于入院时(P<0.05),但non-ALI組与入院时比较差异均无统计学意义(P>0.05)。进一步亚组分析显示,入院第3天,持续性ALI亚组IL-6、TNF-α水平均高于入院时(P<0.05),但一过性ALI亚组与入院时比较差异均无统计学意义(P>0.05)。结论:早期检测外周血IL-6、TNF-α水平可以预测AP相关ALI的发生,并有助于评判ALI严重程度和转归情况。
【关键词】 急性胰腺炎; 急性肺损伤; 白介素-6; 肿瘤坏死因子-α
急性肺损伤(acute lung injury,ALI)是急性胰腺炎(acute pancreatitis,AP)临床上最常见全身并发症之一,以进行性低氧血症和呼吸窘迫为主要表现,严重者可发展为急性呼吸窘迫综合征,是AP早期死亡的主要原因之一[1]。ALI的发生既与AP时胸腹腔压力升高所导致的胸腔积液、肺不张、气道陷闭有关,更与全身炎症反应密不可分[2]。一系列细胞因子和炎症介质的大量激活和释放,将AP早期炎症反应级联放大进而导致靶器官功能损伤,是全身炎症反应综合征(SIRS)和多器官功能障碍(MODS)的主要致病机制[3]。在众多细胞因子和炎症介质中,白介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)被大量动物实验和临床研究广泛证实参与了ALI的发生与发展[4-5],但是否可用于临床预测ALI的发生及其严重程度尚不明确。为此本研究选取90例AP患者,探讨外周血IL-6、TNF-α早期检测对AP相关的ALI及其性质的临床预测价值,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年3-12月本院收治的90例AP患者,其中男52例,女38例;年龄27~70岁,平均(47.5±15.8)岁;发病24 h内入院42例、24~48 h入院30例、48~72 h入院
18例;AP病因学诊断:胆源性49例、酒精性11例、高脂血症性13例、暴饮暴食7例、其他10例。
(1)诊断标准:遵循2012年亚特兰大AP分级和分类系统标准[6]。(2)纳入标准:符合AP诊断标准;于发病72 h内首次就诊。(3)排除标准:诊断不明确者;由外院转入者;存在免疫缺陷状态者;既往合并心、肝、肾严重疾患者;长期服用环氧酶抑制剂者;入院前2周内接受肠外营养支持者。本研究通过医学伦理委员会审批,签署知情同意书。
1.2 治疗原则 参照2012年亚特兰大AP分级和分类系统,以及中国急性胰腺炎诊治指南[6-7]。
1.3 观察指标及判定标准 (1)ALI发生情况及其性质评估:参照2012年亚特兰大AP分级和分类系统推荐的改良Marshall评分系统评估有无发生ALI,并评估ALI性质属于一过性还是持续性。ALI诊断标准为氧合指数(PaO2/FiO2)≤300 mm Hg,其中一过性ALI定义为临床症状和指标48 h内恢复,持续性ALI定义为临床症状和指标持续48 h以上。
(2)IL-6、TNF-α检测:采用酶联免疫吸附法(ELISA)检测入院时、入院第3天外周血IL-6、TNF-α水平。试剂盒购自上海润裕生物科技有限公司,操作严格按照试剂盒说明书进行。
1.4 统计学处理 使用SPSS 23.0软件对所得数据进行统计分析,不符合正态分布的计量资料用M(Q25,Q75)表示,组间比较采用Mann-Whitney U非参数检验,组内比较采用Wilcoxon符号秩和检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 本组47例(52.2%)未发生ALI(non-ALI组),43例(47.8%)发生ALI(ALI组),其中18例(41.9%)为一过性ALI(一过性ALI亚组)、25例(58.1%)为持续性ALI(持续性ALI亚组)。
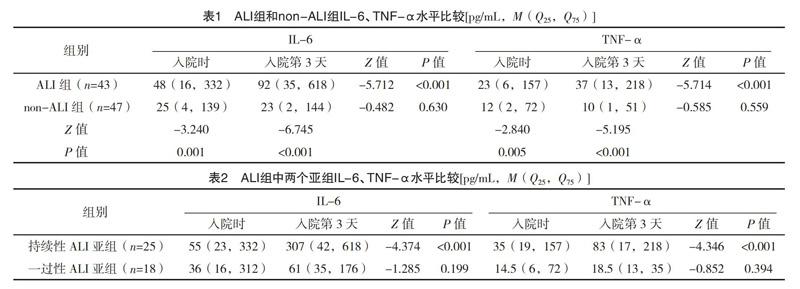
2.2 ALI组和non-ALI组IL-6、TNF-α水平比较入院时、入院第3天,ALI组IL-6、TNF-α水平均高于non-ALI组(P<0.05);入院第3天,ALI组IL-6、TNF-α均高于入院时(P<0.05),但non-ALI组与入院时比较差异均无统计学意义(P>0.05)。见表1。
2.3 ALI组中两个亚组IL-6、TNF-α水平比较 进一步亚组分析,入院第3天,持续性ALI亚组IL-6、TNF-α水平均高于入院时(P<0.05),但一过性ALI亚组与入院时比较差异均无统计学意义(P>0.05)。见表2。
3 讨论
临床上,AP可划分为轻度、中度和重度,轻者属于自限性疾病,重者可能出现胰腺坏死感染、器官功能衰竭等严重的局部和全身并发症而危及生命[8]。换言之,AP既可表现为自限性的局部炎症,也可由局部炎症扩大进展为全身炎症反应,并引发SIRS和MODS,甚至多器官功能衰竭[9]。其中,细胞因子和炎症介质在这一病理生理变化过程中扮演着重要角色[10]。
肺脏是AP过程中最常受累的胰外器官,AP局部炎症导致中性粒细胞、巨噬细胞、淋巴细胞的定向迁移,并激活和释放大量炎症介质和细胞因子,一旦炎症反应失控引发瀑布样炎症级联反应,IL-6、TNF-α等过度激活并随之大量释放入血,则极易导致SIRS[11-12]。一旦这些失控的促炎介质随血液循环进入肺组织,可导致毛细血管内皮细胞损伤和血管通透性增加,大量富含蛋白水解酶、氧自由基的渗出液进入肺泡间隙,将进一步损伤血管内皮细胞和肺间质细胞,进而导致间质性肺水肿[13],进而发生ALI甚至急性呼吸窘迫综合征,临床表现为进行性低氧血症、呼吸窘迫、X线下双肺浸润性阴影,如救治不及时,则显著增加AP早期病死率。前期研究表明,早期检测外周血IL-6有助于临床预测AP严重程度和预后[14-15]。Malmstr?m等[16]也进一步发现,IL-6、IL-8、TNF-α等细胞因子和炎症介质有助于早期预测AP并发器官功能衰竭的风险,其中IL-6、IL-8可用于预测呼吸、循环、肾功能衰竭和多器官功能衰竭,而IL-18主要用于预测呼吸和肾功能衰竭。目前,国内外逐渐认识到AP并发器官功能衰竭的性质类型不同,其预后存在显著差异,出现一过性(48 h内恢复)器官功能衰竭的AP预后要明显好于并发持续性(持续48 h以上)器官衰竭者,并将器官功能衰竭性质类型正式确立为中度和重度AP的划分指征[17]。因此,寻找一种指标可以早期预测持续性器官功能衰竭的临床价值最大。本研究检测了90例发病72 h内首次就诊的AP患者入院时、入院3天时外周血IL-6、TNF-α水平,通过对比未发生和发生ALI患者以上指标发现,入院时、入院第3天,ALI组IL-6、TNF-α水平均高于non-ALI组(P<0.05);入院第3天,ALI组IL-6、TNF-α均高于入院时(P<0.05),但non-ALI组与入院时比较差异均无统计学意义(P>0.05)。进一步亚组分析显示,入院第3天,持续性ALI亚组IL-6、TNF-α水平均高于入院时(P<0.05),但一过性ALI亚组与入院时比较差异均无统计学意义(P>0.05)。这就提示早期动态检测外周血IL-6、TNF-α水平还有助于早期识别ALI的性质到底是持续性还是一过性,并预测ALI的临床转归情况。这有望为临床筛选重中之重ALI病例提供了新的参考指标,有助于集中医疗资源救治危重病例。Samanta等[18]也发现IL-1β、IL-6、IL-8、TNF-α在AP并发ALI早期显著升高,而IL-10显著下降。以上研究结果在一定程度上也为AP治疗过程中血液净化技术、免疫营养制剂的临床应用提供了新的理论基础[19-21]。
综上所述,早期检测外周血IL-6、TNF-α水平可以预测AP相关ALI的发生,并有助于评判ALI严重程度和转归情况。不足之处在于,本研究为单中心数据,病例数较少,且发病至入院时间从数小时至72 h不等,因此研究结论尚有待于前瞻性大样本临床研究加以验证。同时,今后也需要对IL-6、TNF-α临床预测价值的最佳截断值进行界定。
参考文献
[1] Zhou M T,Chen C S,Chen B C,et al.Acute lung injury and ARDS in acute pancreatitis:Mechanisms and potential intervention[J].World J Gastroenterol,2010,16(17):2094-2099.
[2] Elder A S,Saccone G T,Dixon D L.Lung injury in acute pancreatitis:mechanisms underlying augmented secondary injury[J].Pancreatology,2012,12(1):49-56.
[3] Zerem E.Treatment of severe acute pancreatitis and its complications [J].World J Gastroenterol,2014,20(38):13879-13892.
[4] Song R,Yu D,Park J.Changes in gene expression of tumor necrosis factor alpha and interleukin 6 in a canine model of caerulein-induced pancreatitis[J].Can J Vet Res,2016,80(3):236-241.
[5] Li N,Wang B M,Cai S,et al.The Role of Serum High Mobility Group Box 1 and Interleukin-6 Levels in Acute Pancreatitis:A Meta-Analysis[J].J Cell Biochem,2018,119(1):616-624.
[6] Banks P A,Bollen T L,Dervenis C,et al.Classification of acute pancreatitis--2012:revision of the Atlanta classification and definitions by international consensus[J].Gut,2013,62(1):102-111.
[7]中華医学会消化病学分会胰腺疾病学组,中华胰腺病杂志编辑委员会,中华消化杂志编辑委员会.中国急性胰腺炎诊治指南(2013年,上海)[J].中华消化杂志,2013,33(4):217-222.
[8] Greenberg J A,Hsu J,Bawazeer M,et al.Clinical practice guideline:management of acute pancreatitis[J].Can J Surg,2016,59(2):128-140.
[9] Maheshwari R,Subramanian R M.Severe Acute Pancreatitis and Necrotizing Pancreatitis[J].Crit Care Clin,2016,32(2):279-290.
[10] Sharma D,Jakkampudi A,Reddy R,et al.Association of Systemic Inflammatory and Anti-inflammatory Responses with Adverse Outcomes in Acute Pancreatitis:Preliminary Results of an Ongoing Study[J].Dig Dis Sci,2017,62(12):3468-3478.
[11]曹均强,汤礼军.全身炎症反应综合征在急性胰腺炎肺损伤中的研究进展[J].中华消化外科杂志,2015,14(11):975-979.
[12] Bonjoch L,Casas V,Carrascal M,et al.Involvement of exosomes in lung inflammation associated with experimental acute pancreatitis[J].J Pathol,2016,240(2):235-245.
[13] Landahl P,Ansari D,Andersson R.Severe Acute Pancreatitis:Gut Barrier Failure,Systemic Inflammatory Response,Acute Lung Injury,and the Role of the Mesenteric Lymph[J].Surg Infect(Larchmt),2015,16(6):651-656.
[14]張翔,王雅纯,黎昌炫,等.急性胰腺炎患者血清降钙素原,白细胞介素-6,肿瘤坏死因子-α动态监测及临床意义[J].中国急救复苏与灾害医学杂志,2016,11(8):791-794.
[15] Sternby H,Hartman H,Johansen D,et al.IL-6 and CRP are superior in early differentiation between mild and non-mild acute pancreatitis[J].Pancreatology,2017,17(4):550-554.
[16] Malmstr?m M L,Hansen M B,Andersen A M,et al.Cytokines and organ failure in acute pancreatitis:inflammatory response in acute pancreatitis[J].Pancreas,2012,41(2):271-277.
[17] Sarr M G.2012 revision of the Atlanta classification of acute pancreatitis[J].Pol Arch Med Wewn,2013,123(3):118-124.
[18] Samanta J,Singh S,Prasad R,et al.Elevated Levels of IL-6 and IL-8 Predict Development of Respiratory Failure in Patients With Acute Pancreatitis[J].Gastroenterology,2016,150(4):S708.
[19]许建民,刘兰霞,田湘萍,等.重症急性胰腺炎并发腹腔间隔室综合症血液滤过前后IL-6及腹内压的变化[J].中华内分泌外科杂志,2017,11(3):202-206.
[20] Lei Q C,Wang X Y,Xia X F,et al.The role of omega-3 fatty acids in acute pancreatitis:a meta-analysis of randomized controlled trials[J].Nutrients,2015,7(4):2261-2273.
[21]周瑞祥,胡朝梁.重症急性胰腺炎早期血液净化治疗的抗炎作用和时机探讨[J].中国中西医结合急救杂志,2017,24(5):508-511.
(收稿日期:2018-05-04) (本文编辑:董悦)
