新亚特兰大标准下急性坏死性胰腺炎的CT/MRI评价
2018-02-20杨丹丹张小明
杨丹丹 林 峤 张小明
急性胰腺炎(acute pancreatitis,AP)是胰腺常见的炎症性疾病,发病机制不明确,临床病程复杂,其发病率仍在逐年上升。临床上大多数是自限性轻型AP,但仍有约20%的病例发展为重症AP,其与组织坏死密切相关[1]。在“急性胰腺炎2012年修订版亚特兰大分类标准(revised Atlanta classification,RAC)”[2]中,AP可分为急性间质水肿性胰腺炎(acute interstitial edema pancreatitis,AIEP)和急性坏死性胰腺炎(acute pancreatitis,ANP),ANP又可分为三种类型。坏死性胰腺炎促进器官衰竭的发展,虽然近年来诊疗水平不断提升,但ANP的死亡率仍远高于AIEP[3]。并且,坏死组织可继发感染,一旦形成感染性坏死,死亡率将会大大增加。因此,在临床工作中,ANP应该受到高度的重视。
影像学检查对ANP的评价有着举足轻重的作用,它能够客观全面地评价ANP,能够随访观察坏死的进展,为临床治疗策略的选择提供有价值的信息。在临床中,CT仍然是AP的首选检查手段,但近年来MRI也越来越多地应用起来。研究表明,不同类型和程度的ANP,其临床病程和预后也远不相同[1,4]。因此,全面地评价ANP,不仅要对ANP的类型进行定性分析,还应对坏死的程度进行定量分析,这样才能有助于临床医生做出最正确的预防和治疗的决策。掌握ANP的影像学表现对影像科医生尤为重要。目前对ANP的影像学认识并不统一和规范,因此,本文将对现阶段CT/MRI评价ANP的影像学表现进行图文综述,并阐述目前CT/MRI在评价ANP方面的局限性以及未来仍需解决的问题。
1.急性坏死性胰腺炎的定义和分型
RAC标准中[2],ANP是指存在胰腺实质和/或胰周组织的坏死;可分为三种类型,即独立胰周坏死、独立胰腺坏死和混合型坏死(同时存在胰周坏死和胰腺坏死)。临床中,混合型坏死最常见,少数仅表现为独立胰周坏死,而独立胰腺坏死极少见。在ANP的不同病程中,可出现两种不同的坏死表现,即急性坏死性积聚(acute necrotic collection,ANC)和包裹性坏死(walled-off necrosis,WON)。ANC是ANP患者发病起至4周以内出现的胰腺和/或胰周的坏死积聚,积聚特征是“异质性”,包含炎性液体、坏死组织或胰周脂肪组织等成分,且可合并出血即出血坏死性积液。随着病程进展,若ANC迁延未愈,通常在发病2周后开始、至发病4周后坏死积聚的外周完全被炎性囊壁包裹形成WON。当坏死组织继发感染时,则形成感染性坏死。
2.急性坏死性胰腺炎的CT评价
2.1 胰腺坏死(pancreatic necrosis,PN):RAC定义PN为胰腺组织的失活,CT平扫表现为实质内低密度区,增强扫描在胰腺实质期该区域无强化(图1)。在CECT图像上,坏死程度的定量标准是坏死组织占总胰腺体积的百分比[5]:轻度坏死(<30%),中度坏死(30%~50%)和重度坏死(>50%)。
虽然目前CECT是评价胰腺坏死最主要的工具,但它在病程的早期和坏死程度较小(<30%)的情况下对坏死的发现并不理想[3,6]。在临床工作中,疾病早期(发病数天内)的CECT图像上,胰腺实质出现低强化区而不是完全未强化区的情况并不少见。RAC标准指出,因为胰腺实质坏死的演变往往需要数天,在发病的最初几天,CECT上出现的强化减低区是否为坏死尚不确定。那么,要想确定早期的低强化区是否为坏死,只能通过随访来观察该区域最终是否演变为完全未强化区,但是最佳的随访检查时间并不清楚,若检查多次则会增加辐射剂量。因此,CECT并不是早期发现胰腺坏死的最佳选择。目前,灌注CT(perfusion CT,P-CT)成为评价胰腺缺血坏死较为新颖的技术,它能通过定量分析胰腺血流灌注情况而在疾病的早期诊断胰腺坏死。Sahani等[3]采用动物模型证实了P-CT检测胰腺坏死的可行性和准确性,也发现在坏死区域,灌注参数血流量、血容量、表面通透性明显减低,对比剂平均通过时间明显增加,而这些参数在水肿区域变化并不明显。相关临床研究也得出了相似的结论[7],对比剂可能通过诱发微循环损伤而使AP恶化,且P-CT使用的对比剂(40ml)显著低于常规CECT所需的对比剂(80~100ml),从而降低了副作用发生的概率。也有研究报道[8]可采用血管造影技术来早期评价易发展为坏死的缺血区域,但血管造影具有侵袭性。
CECT评价PN的准确性除了与疾病时期有关以外,还与CT动态增强扫描观察时期有关。Noda等[9]研究表明胰腺组织在CECT胰腺实质期(pancreatic parenchymal phase,PPP)(注射对比剂后40~50秒)出现的低强化或未强化区可能是水肿或缺血而不是坏死,门静脉期(portal venous phase,PVP)(对比剂注射后70秒)图像对诊断PN至关重要,为了提高PN诊断准确性,应结合PPP和PVP两期图像进行观察。
2.2 胰周坏死(peripancreatic necrosis,PPN):RAC中PPN定义为CT图像上胰周出现的不均匀液性、非液性混杂密度积聚影(图2)。CT诊断胰周坏死并不容易,诊断依据不是采用客观和可重复的方法而是依靠主观性的间接征象,如“异质性”表现或测定胰周积聚中的CT值(液性和非液性),因此胰周积聚中的坏死物质常常被忽视,尤其是在病程的早期,因为部分病灶在早期可均匀。目前相关文献对PPN的定义不尽相同。部分文献将其定义为胰外脂肪形态的改变,这种改变在CT上要比脂肪内条纹状模糊密度增高影更加明显[4]。但是由于胰外脂肪形态的变化可能仅表示积聚的液体而不是脂肪坏死,因此该定义诊断PPN的准确性值得进一步探究。Meyrignac等[10]将胰外脂肪浸润、液体积聚或者是液体与固体成分的混杂积聚均定义为PPN;Dellinger等[11]建议凡是胰周异质性的积聚均认定为胰周坏死直到被证实。这两种定义则可能会高估PPN的发生率。Sternby等[12]研究发现不同观察者诊断PPN的一致性较差,这更加说明CT诊断PPN的主观性偏大。如何采用客观的方法准确鉴别PPN的坏死物质,还需要未来进一步研究。
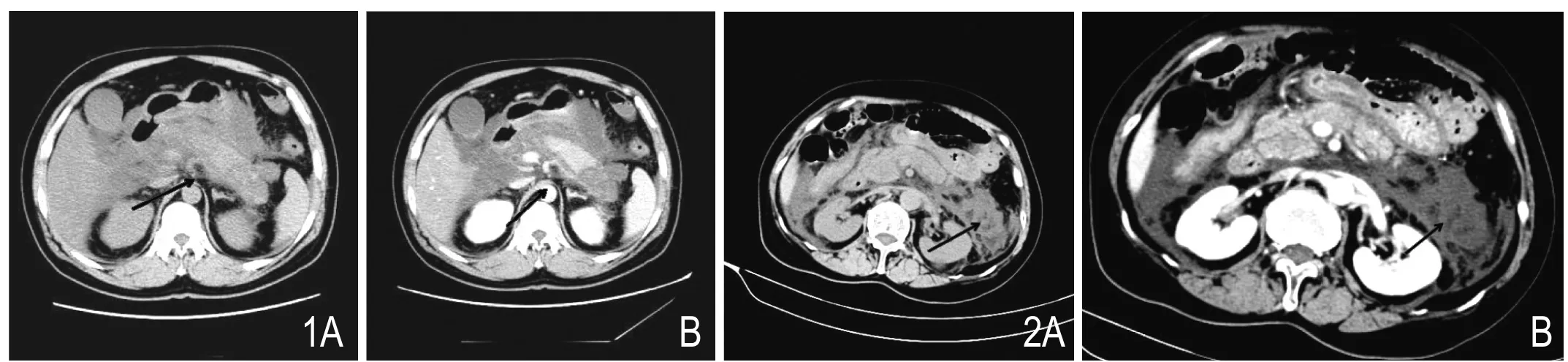
图1 胰腺尾部中度坏死。CT平扫(A)见胰尾部低密度区,增强扫描(B)该区域未见强化。图2 胰周坏死。CT平扫(A)见左肾旁前间隙片状稍低密度影,其内可见小斑片状低密度影,增强扫描(B)未见强化。
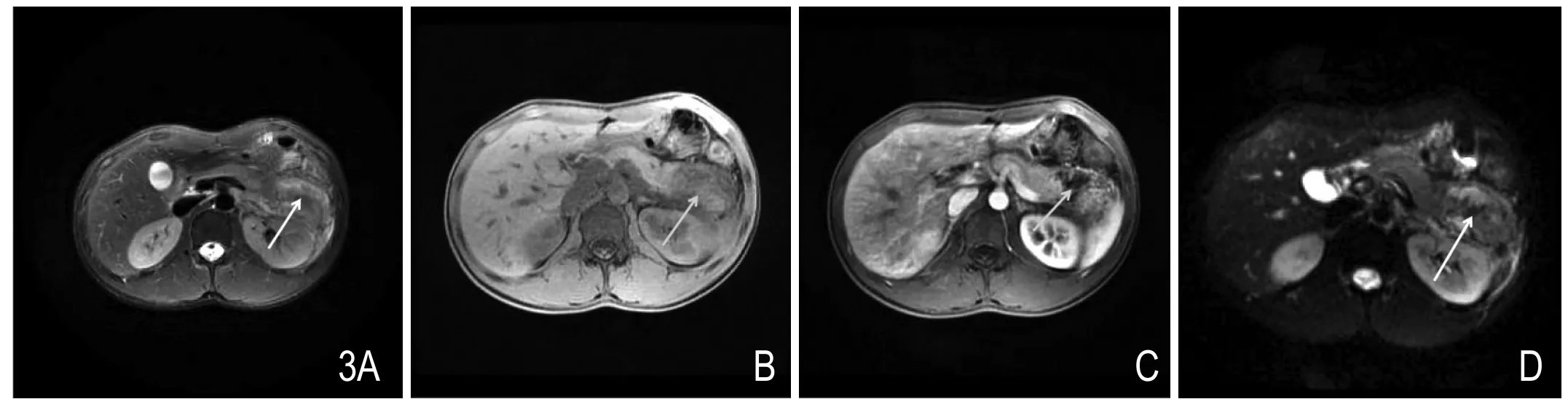
图3 胰尾轻度坏死。MR T2WI抑脂像(A)见胰尾小片状稍高、低混杂信号影,T1WI(B)上为低信号,增强扫描(C)见斑片状未强化区,DWI(D)上为高、低混杂信号。
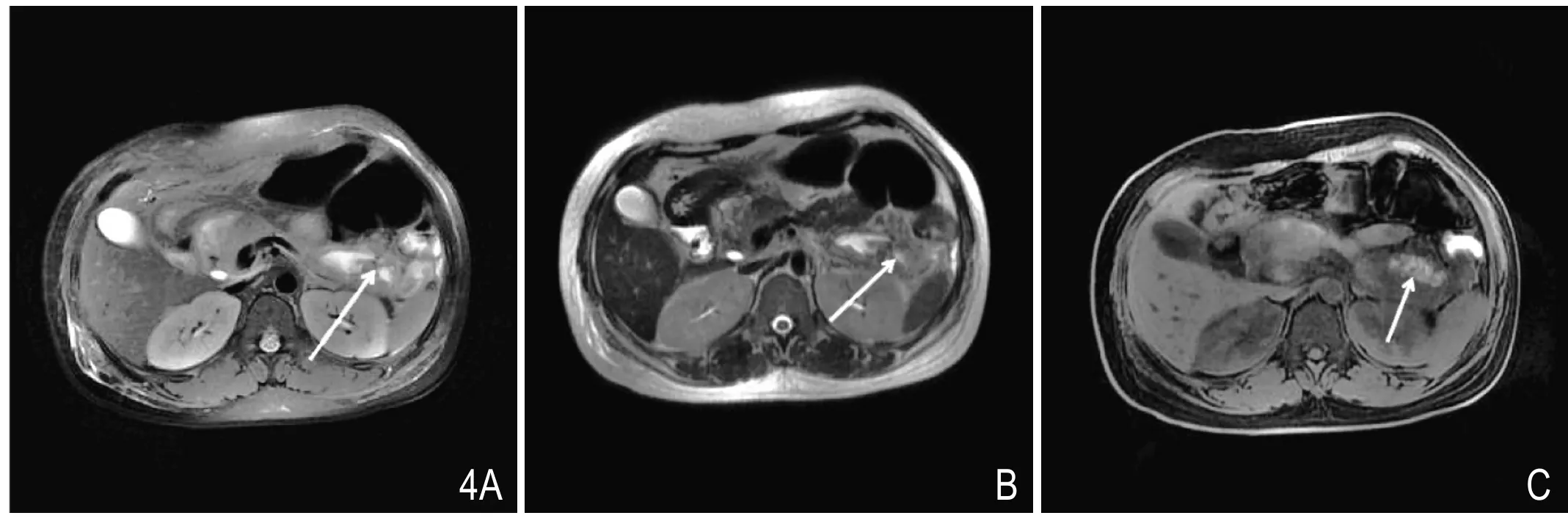
图4 胰周坏死伴出血。MR T2WI抑脂像(A)见左肾旁前间隙小片状高信号影,其内可见小结节状低信号影(提示胰周坏死),T2WI(B)上见相同区域高、低混杂信号影,T1WI抑脂像(C)相同区域内可见小斑片高信号影(提示出血)。

图5 WON并感染。CT平扫(A)见胰体前方片状低密度影(黑箭),外周可见等密度囊壁,其内可见气体影(白箭),并可见引流管;增强扫描(B)囊壁可见强化,内容物未见强化。图6 WON并感染。MR T2WI抑脂像(A)可见胰尾及胰尾旁团片影,外周可见等稍高信号包裹,其内可见高、低混杂信号及气体影;增强扫描(B)可见壁强化,内容物未见强化。
对PPN坏死程度的定量分析,目前尚无统一的标准。Koutroumpakis等[13]根据PPN的范围(即图像上累及范围最大截面横径)和累及部位的数量,将PPN的程度描述为“局限性”和“弥漫性”:局限性是指胰周坏死范围<5cm,弥漫性是指胰周坏死范围>5cm或累及部位>3个。Rana等[14]也将PPN描述为“局限性”和“弥漫性”,不同的是,该文献中“局限性”是指坏死局限于胰周组织,若坏死延伸至结肠旁沟或者进入盆腔内则为“弥漫性”。
3.急性坏死性胰腺炎的MRI评价
虽然MRI不是诊断AP的首选检查手段,但相比CT,MRI在评价ANP方面具有一定的优势[15]:①MRI无辐射危害,可以满足ANP患者随访观察的需要;②因为多序列成像的特性,MRI能够更加准确地判断胰腺坏死的存在和坏死的程度,并且能够更加敏感地区分胰周积聚中的不同成分,如炎性液体、血性液体和坏死组织碎片。
3.1 PN:在MRI上,坏死组织在T1W序列上表现为低信号;在T2W序列上也表现为低信号,若坏死组织液化则表现为高信号;增强扫描该区域无强化;弥散加权图像(diffusion weight imaging,DWI)上,坏死组织细胞破裂,水分子扩散自由,因此表现为低信号(图3)。PN的坏死程度评价见上述CT评价。MRI诊断PN的一个优势是,即使未行增强检查,平扫MRI也能达到与CECT极好的一致性,因此对有肾功能不全的患者,MRI是一个优先选择的检查方式。同样的,灌注MRI(perfusion MRI,P-MRI)也可用于早期发现坏死区域。
3.2 PPN:T2WI抑脂像显示胰周积聚的液性成分十分敏感(表现为高信号),且有利于显示高信号液性积聚内的混杂成分;坏死组织在T2WI上表现为低信号[15]。对比观察T2WI和T2WI抑脂像,PPN在MRI上表现为胰周条片状T2WI水样高信号中出现稍低信号或低信号条絮样、斑片样或小结节样碎片影,此外若在T1WI抑脂像上积液内出现稍高信号影,提示血性积液(图4)。PPN坏死程度的评价见上述CT评价。
4.WON/感染性坏死的CT/MRI评价
WON是RAC中的一个新术语,是ANC迁徙未愈被炎性囊壁包裹形成的,与假性囊肿最大的区别就是WON内容物除了液体成分外,还含有坏死物质。WON炎性囊壁,在CT上(图5)表现为等密度;在MR T1WI抑脂像上表现为稍低或等信号,少数表现为稍高信号,在T2WI抑脂像上表现为稍低或低信号,少数呈稍高信号(图6);增强图像上,囊壁呈轻-中度环形强化,内容物不强化。WON因含有坏死成分并被完全包裹,不易自行吸收,且常常并发感染,若一旦感染,则必须行外科手术治疗(经皮引流或开放手术)。因此在临床工作中,要观察胰腺或胰周坏死性积聚物有无包裹的趋势或是否已完全形成WON,为临床确定患者是否需要手术治疗提供客观的依据。坏死组织发生感染时,表示为胰腺/胰周坏死积聚中出现气体影(图5、6)。
5.小结及展望
综上所述,全面评价ANP,不仅要包括ANP的类型、程度,还应观察坏死有无包裹、有无继发感染。CT/MRI评价ANP的要点包括:①增强CT/MRI上出现胰腺组织无强化区,提示实质坏死;平扫MRI也能准确发现坏死区域。在CT/MRI上,可根据坏死组织占总胰腺体积的百分比来量化坏死程度;②CT图像上出现异质性胰周积聚,提示胰周坏死的可能,但这种判断主观性较大;MRI对胰周积聚的异质性显示更佳,其有利于区分积聚中的不同成分,可通过T2WI和T2WI抑脂像进行对比观察,提示胰周坏死的表现为T2WI抑脂像上胰周间隙液体积聚内出现低信号的坏死成分;③当坏死积聚外周出现完整的环形囊壁时,提示WON形成;④当坏死组织内出现气体时,提示感染性坏死。
CT/MRI诊断PN较为准确;P-CT或P-MRI可定量分析胰腺组织的血流灌注情况,从而早期发现坏死区域,因此,未来若能将P-CT或P-MRI加入常规扫描中,能大大提高坏死的早期发现率。现阶段,诊断PPN和鉴别胰周积聚中的坏死物质成为目前评价ANP的一个难点,在临床干预之前通过影像学来确定仍需进一步研究。CT评价PPN的主观性较大,无法客观判断胰周异质性积聚内有无坏死组织;虽然MRI在区分胰周积聚内不同成分上更加敏感,但仍然存在的问题是,当坏死组织碎片较小时尚不能很好显示,T2WI抑脂像上高信号的液体是否完全是炎性液体而不掺杂坏死细胞,常规MRI仍不能作出很好的判断。近年来,DWI及ADC值、基于体素内不相干运动的DWI模型(intravoxel incoherent motion,IVIM)在腹部的应用越来越广泛,能客观反映组织内水分子运动及其生物学行为,是否可以通过DWI及ADC值来鉴别MRI上不易发现的PPN?炎性液体和含有坏死细胞的液体之间DWI信号及ADC值是否具有差异?这些都有望成为PPN的一个研究方向。此外,最能反映临床严重程度的PPN坏死程度,其影像学定量分析也有待于进一步研究以达成共识。
