老年结直肠癌组织miRNA-21表达与浸润转移的关系研究
2018-02-15宋志军陈国庆
宋志军 陈国庆
结直肠癌属最常见的消化道肿瘤之一,流行病学调查发现近几年其发病率呈逐年增长趋势,早期确诊后5年生存率可达90%左右,但超过一半患者确诊时就已伴浸润或转移,而此类患者5年内 生存率仅达10.8%左右[1]。有报道称结直肠治疗过程中,肿瘤浸润转移是诱发治疗失败或导致患者死亡的关键因素[2]。可见,明确结直肠癌浸润转移发病机制,尽早发现对其早期诊断、靶向治疗及预后评估起关键作用的分子标记物尤为重要。而结直肠癌的发生是多种基因共同作用的结果,包括一系列多阶段、多途径分子事件,如细胞增殖过盛、凋亡功能抑制、周期失调及促生长因子过度表达等[3]。有报道称微小核糖核酸(microRNA,miRNA)可能通过控制细胞分化、凋亡,或经靶向肿瘤原癌基因或抑癌基因,直接或间接参与癌症发生、生长、侵袭、转移全过程,与肿瘤侵袭、耐药等因素有关[4]。其中,微小核糖核酸21(miero Ribonucleie Aeid21,miRNA-21)作为一种原癌基因,有资料显示,其在胃癌、胰腺癌、肝癌、肺癌等多种肿瘤组织中上调明显,推测其在肿瘤发生过程中具有类癌基因作用[5]。但目前关于老年结直肠癌组织miRNA-21表达与浸润转移的关系报道较少。基于此,本文旨在探究miRNA-21表达与结直肠癌浸润转移的关系,现将结果报道如下。
资料与方法
一、 一般资料
纳入2016年9月至2018年9月于我院收治的43例行手术治疗的老年结直肠癌患者为结直肠癌组,男26例,女17例,年龄60~78(68.75 ± 4.23)岁;肿瘤部位:直肠15例,结肠28例;TNM分期:参考美国癌症联合委员会/国际抗癌联盟结直肠癌TNM分期系统(2010 年第七版)[6], Ⅰ+Ⅱ期18例,Ⅲ+Ⅳ期25例;分化程度:高、中分化16例,低、未分化27例;浸润深度:T1+T2者16例,T3+T4者27例;淋巴结有无转移:阳性17例,阳性26例。另选取同期入院的43例健康体检者为正常组,男27例,女16例,年龄62~76(68.50 ± 4.11)岁。本研究获我院医学伦理委员会批准,两组性别、年龄等一般资料比较差异无统计学意义(P> 0.05)。
二、纳入、排除标准
1.纳入标准:(1)结直肠癌组:①符合《中国早期结直肠癌及癌前病变筛查与诊治共识》[7]中结直肠癌诊断标准,均经纤维结肠镜或活检病理检查确诊;②年龄≥60岁;③获患者知情同意。(2)正常组:①我院正常体检健康者;②年龄≥60岁;③获所有研究对象知情同意。
2.排除标准:①合并严重心、肺、肝、肾功能不全及凝血功能异常;②伴其它恶性肿瘤病史;③伴急性感染、慢性炎症性疾病;④术前接受化放疗及其他针对肿瘤的特殊治疗。
三、检测方法
1.主要仪器与试剂:主要仪器包括ABI-7300实时荧光定量聚合酶链反应(Polymerase Chain Reaction,PCR)仪(美国ABI公司)、-80 ℃超低温冰箱(美国Thermo scientific公司)、Eppendorf Centrifuge 5417R小型高速冷冻离心机(德国Eppendorf公司),其他仪器如电子分析天平、水平电泳槽等均购自上海衡平仪器仪表厂。主要试剂包括Trizol试剂(日本Takara公司)、Hairpin-itTMmiRNAs RT-PCR Quantitation Kit 试剂盒(美国ABI公司)、引物 hs-mi RNA-21(美国SBI公司),其他试剂如MMLV Reverse Transcriptase、DEPC水等均购自日本Takara公司。
2.标本采集及处理:抗凝管采集3~5 mL血液样本,将红细胞裂解液10 mL加入其中,以3000 r/min速度离心10 min,弃上清后将1 mL Trizol加入,置入-80 ℃超低温冰箱待测。另取结直肠癌组织及癌旁组织(距肿瘤边缘至少5 cm以上的正常肠道黏膜组织),离体10 min内,置入液氮中保存。之后取出,切成薄片,采用液氮研磨法,磨至粉末,并将1 mL Trizol试剂加入,置入-80 ℃超低温冰箱待测。
3.miRNA-21表达检测:采用Trizol试剂盒,以Trizol抽提法行总RNA提取,并以分光光度法行总RNA浓度和纯度检测。使用Taka逆转录试剂盒,获取cDNA,以快速实时荧光定量PCR(Real time quantitative polymerase chain reaction,RT-qPCR)仪行RT-qPCR检测,扩增条件:长度230bp,Tm58 ℃。 反应体系20 μL,其中PCR反应混合物10 μL,上游引物1 μL,下游引物1 μL,cDNA 、去离子水均为4 μL。 反应条件:95 ℃预变性3 min,95 ℃变性12 s,62 ℃退火40 s,95 ℃延伸15 s,循环40次。RT-qPCR扩增反应结束后,明确Real Time PCR扩增曲线及融解曲线,以U6snRNA为内参照,予以归一化。采用2-△△CT法,计算肿瘤组织miRNA-21相对表达量,其中-△△CT=(CTmiRNA-21-CTu6)肿瘤-(CTmiRNA-21-CTu6)正常组织。
四、 观察指标
观察结直肠癌组与正常组血清中miRNA-21表达水平,分析结直肠癌组织与癌旁组织中miRNA-21表达水平,并观察老年结直肠癌临床病理参数与miRNA-21表达的关系,探究患者血清与癌组织中miRNA-21表达水平的相关性。
五、 统计学方法

结 果
一、 结直肠癌组与正常组血清中miRNA-21表达分析
结直肠癌组患者血清中miRNA-21表达为(3.65 ± 0.30),显著高于正常组(1.23 ± 0.11),差异有统计学意义(t=49.663,P≤ 0.000),见图1。
二、结直肠癌组织与癌旁组织中miRNA-21表达分析
结直肠癌组织中miRNA-21表达为(7.14 ± 1.47),显著高于癌旁组织(2.32 ± 0.82),差异有统计学意义(t=18.777,P≤ 0.000),见图2。
三、老年结直肠癌临床病理参数与miRNA-21表达的关系
miRNA-21表达与患者性别、年龄、肿瘤部位无明显关系,但中晚期(TNM分期为Ⅰ期和Ⅱ期)者miRNA-21表达显著低于早期(Ⅲ期和Ⅳ期)者(P< 0.05),高、中分化者miRNA-21表达显著低于低、未分化者(P< 0.05),肿瘤浸润深度达T1+T2者miRNA-21表达显著低于浸润深度达T3+T4者(P< 0.05),淋巴结无转移者miRNA-21表达显著低于淋巴结转移者(P< 0.05),见表1。

注:*与正常组比较,P < 0.05

注:*与癌旁组织比较,P < 0.05
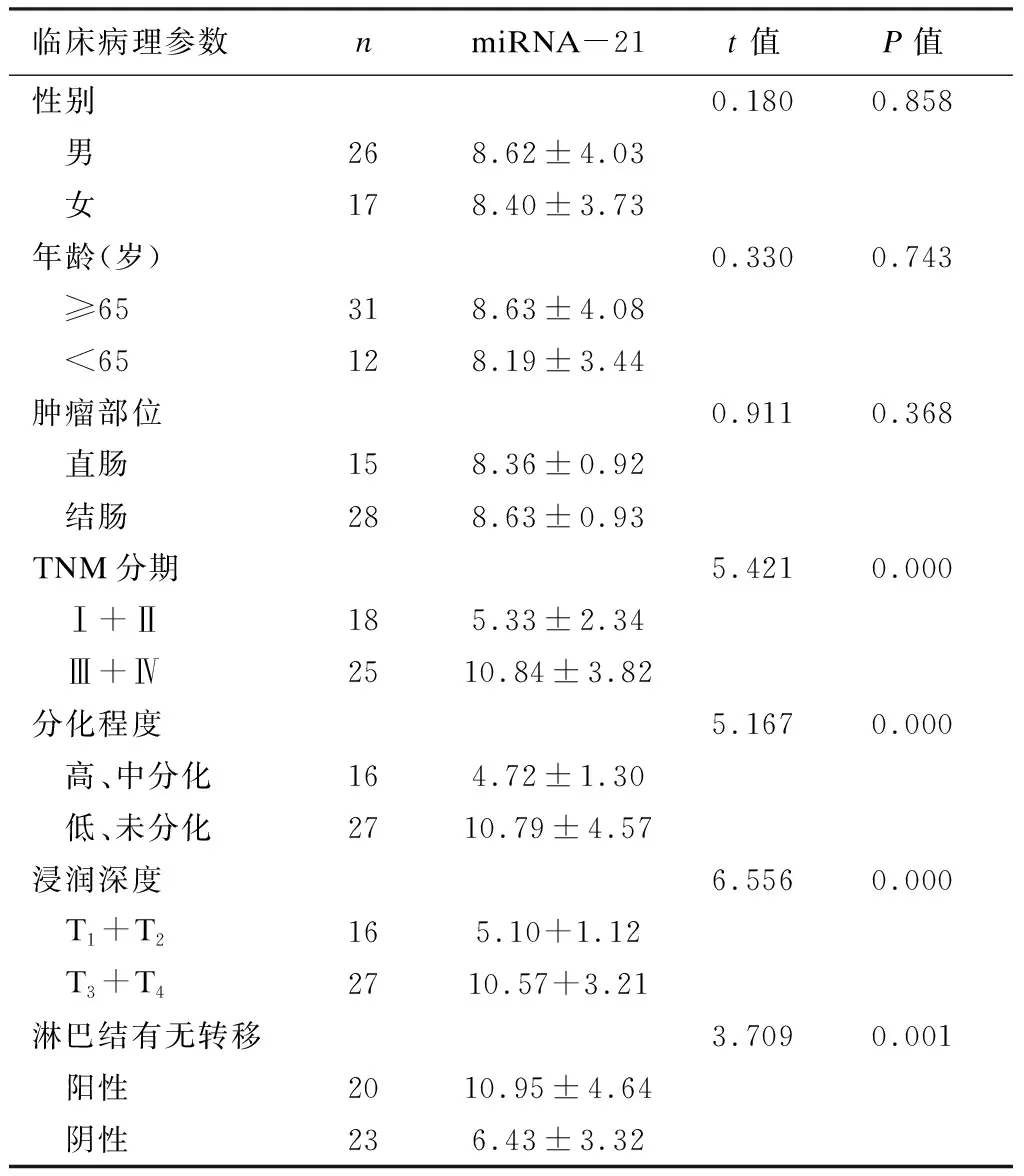
临床病理参数nmiRNA-21t值P值性别0.1800.858 男268.62±4.03 女178.40±3.73年龄(岁)0.3300.743 ≥65318.63±4.08 <65128.19±3.44肿瘤部位0.9110.368 直肠158.36±0.92 结肠288.63±0.93TNM分期5.4210.000 Ⅰ+Ⅱ185.33±2.34 Ⅲ+Ⅳ2510.84±3.82分化程度5.1670.000 高、中分化164.72±1.30 低、未分化2710.79±4.57浸润深度6.5560.000 T1+T2165.10+1.12 T3+T42710.57+3.21淋巴结有无转移3.7090.001 阳性2010.95±4.64 阴性236.43±3.32
注:T1:肿瘤侵犯黏膜下层;T2:肿瘤侵犯固有肌层;T3:固有肌层、浆膜下层被肿瘤穿透,或侵入结肠周围组织(无腹膜覆盖);T4:肿瘤侵犯其他器官或结构,或将腹膜脏层穿透。
四、 老年结直肠癌患者血清与癌组织中miRNA-21表达水平的相关性分析
经直线相关分析显示,老年结直肠癌患者血清中miRNA-21表达与癌组织中miRNA-21表达呈线性正相关(r=0.767,P< =0.000),见图3。
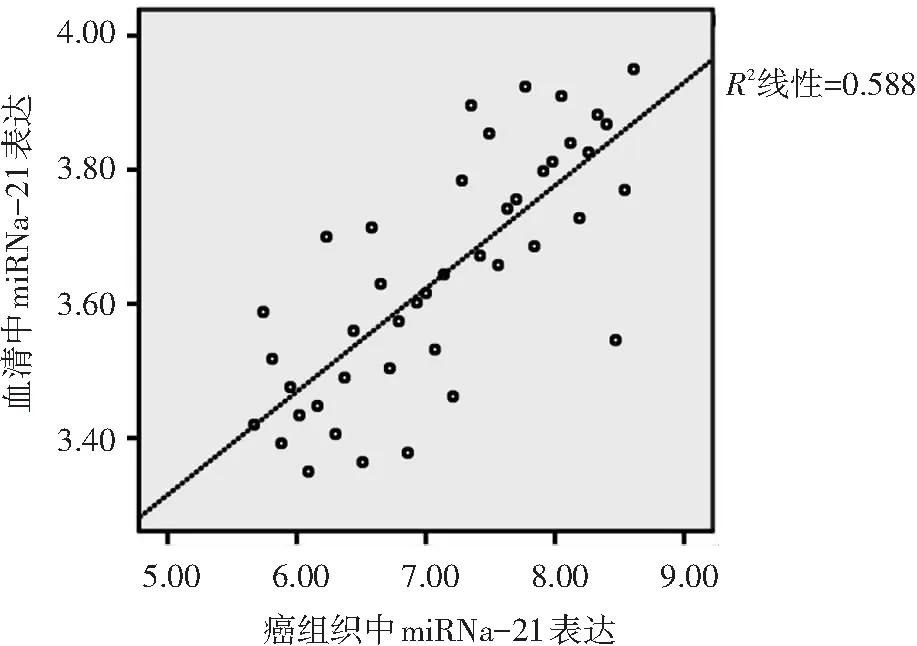
图3 血清与癌组织中miRNA-21表达的线性相关图
讨 论
结直肠癌属消化系统常见实体恶性肿瘤,目前其早期诊断及预后判断仍缺乏合适肿瘤标记物,大部分患者确诊时已达晚期。近几年,有报道称miRNA与肿瘤关系密切,以癌基因、抑癌基因方式发挥作用,在肿瘤诊断、治疗及预后评估中发挥着重要作用[8-9]。miRNA属一类新的内源性非编码RNA分子,生物体内长度为19~25,存在上千种类型,其中预测miRNA调控的靶基因占人类基因组的60%[10-11]。近年来,有资料显示,在细胞周期调控、分化增殖、发育调控、器官形成、造血等生物进程中,miRNA具有重要作用[12-14]。另有报道称,miRNA干扰肿瘤发生、生长,在肺癌、乳腺癌等多种实体瘤及白血病等非实体瘤中其表达谱与其来源的正常组织及血浆存在较大差异,如胰腺癌中miRNA-21表达上调,尤其在恶性程度高或低分化肿瘤中,这一改变更为显著[15]。而miRNA-21属于一种癌基因,编码基因定位于17q23.2,即跨膜蛋白49编码区,在肿瘤发生、进展过程中起着重要作用,在不同实性肿瘤及血液系统肿瘤中其表达显著上升,与肿瘤细胞生长、分化、凋亡、增殖、浸润转移等生物学行为有关。
本研究结果显示,结直肠癌组患者血清中miRNA-21表达显著高于正常组,且结直肠癌组织中miRNA-21表达显著高于癌旁组织,这与姚庆娟[16]等研究结论一致,证实肿瘤细胞内miRNA-21表达上调,导致抑癌基因或癌基因表达紊乱,促进肿瘤发生与发展。Slattery M L[17]等研究发现,结直肠癌组织中miRNA-21表达水平显著高于正常结肠黏膜,于肿瘤相关间质成纤维细胞中也可见其高表达。另外,本研究结果显示,老年结直肠癌患者血清中miRNA-21表达与癌组织中miRNA-21表达呈线性正相关,这与刘华[18]等报道结论相似,可能与miRNA-21生物学功能有关,提示在不同条件下miRNA-21可行使癌基因或抑癌基因的功能。可见,无论是癌组织还是血清中的miRNA-21检测,对结直肠癌的诊断均有重要意义。
本研究结果显示,miRNA-21表达与患者性别、年龄、肿瘤部位无明显关系,但与TNM分期、分化程度、肿瘤浸润深度、淋巴结转移存在明显相关性,证实老年结直肠癌组织miRNA-21过表达在肿瘤浸润转移中起着重要作用。miRNA-21表达水平与结直肠癌细胞临床分期、分化程度、肿瘤浸润深度、淋巴结转移明显相关,分化程度越低、临床分期越晚、肿瘤浸润越深、伴淋巴结转移的肿瘤组织,miRNA-21表达水平越高,可能是通过调节同增殖、细胞周期、浸润转移相关基因的表达而发挥促肿瘤发生发展的作用[19-20]。有报道表明,结直肠癌细胞中miRNA-21表达上调,高表达miRNA-21后可经下调Sec23A,干扰结直肠癌生物学功能(如癌细胞增殖、迁移及侵袭),但对凋亡能力无明显影响[21]。另外,有研究表明,miRNA-21转录后可调控磷酸酶-张力蛋白基因/磷脂酰肌醇-3激酶/蛋白激酶B通路,影响结肠癌细胞扩散[22-23]。miRNA-21可通过靶向抑制多种基因(如RECK、组织金属蛋白酶抑制剂-3等),诱导磷脂酰肌醇-3激酶/蛋白激酶B等信号通路激活,促使其下游分子基质金属蛋白酶水平上升,最终引起细胞浸润转移[24-25]。因此,笔者推测,结直肠癌组织中miRNA-21过表达会明显降低磷酸酶-张力蛋白基因表达水平,导致结直肠癌浸润转移。
综上,miRNA-21过表达影响老年结直肠癌细胞浸润转移,临床上应引起足够重视。但本文由于样本量偏少,未观察不同结肠癌细胞系miRNA-21表达水平检测结果,抑制miRNA-21的目标细胞系尚不明确,故今后仍需深入调查研究。
