NAFLD患者血清学检测的临床价值及相关性分析
2018-02-15张倩孙莉
张 倩 孙 莉
中华医学会肝病学分会脂肪肝和酒精性肝病学组的相关专家一致认为非酒精性脂肪性肝病(Non-alcoholic Fatty Liver Disease, NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤疾病[1]。NAFLD作为脂肪肝病的一种分型,目前已成为我国最常见的肝脏疾病,无论是在欧美国家还是我国经济发达地区都已成为慢性肝病的重要病因,而且发病率呈现出逐年增高的趋势[2-3]。数据表明与1983年相比,至今NAFLD的发病率已经增长了20倍左右,有学者预测到2030年NAFLD将成为美国肝硬化的主要病因和肝脏移植最常见的适应症[4-5]。目前国内NAFLD已经取代乙型肝炎上升到慢性肝病的第一位,成人NAFLD的总体发病率约为15% ~ 30%,其中非酒精性脂肪型肝炎(Non-alcoholic Steatohepatitis, NASH)占比约为20% ~ 30%[6-7]。临床中35%~65%的NAFLD患者会出现明显的肝纤维化症状,3% ~ 15%的NAFLD患者最终会发展为肝硬化[8-9]。目前,由于NAFLD缺少有效的治疗手段,所以早期的诊断与干预显得尤为重要[10]。B超和CT等影像学检查手段对中重度的NAFLD诊断应用较为成熟,但临床对早期NAFLD的诊断尚无公认的令人满意的方法[11]。虽然相关研究NAFLD与胰岛素抵抗密切相关,但现阶段胰岛素抵抗检测十分复杂不易开展,本研究对比分析了NAFLD患者与健康人群的血脂和肝功血清指标的差异,探讨血清检测方法对诊断NAFLD的临床价值,现将结果报道如下。
资料与方法
一、一般资料
选取2016年2月至2017年12月由我院体检中心诊断为NAFLD的患者60例,纳入脂肪肝组。其中男41例,女19例;年龄25 ~ 65岁,平均年龄(46.10 ± 11.04)岁。NAFLD诊断参照《非酒精性脂肪性肝病诊疗指南(2010年修订版)》中推荐的诊断标准:①无饮酒史或饮酒折合乙醇量 <140 g/周(女性 < 70 g/周);②排除病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;③肝脏影像学表现符合弥漫性脂肪肝的诊断标准且无其他原因可供解释。所有NAFLD患者的诊断均须符合以上3个条件。另选择同期体检结果为健康状态的受检者60例,纳入健康组,其中男40例,女20例;年龄23 ~ 66岁,平均年龄(45.80 ± 12.88)岁。两组性别、年龄差异无统计学意义(P> 0.05),具有可比性。本研究经院伦理委员会审核同意,所有受试者均签署知情同意书。
二、研究方法
本研究采用AU-2700型全自动生化分析仪(日本奥利巴斯公司生产)进行各项检测,宁波瑞源生物公司提供检测试剂。全部受试者均在清晨空腹状态下采取4 mL静脉血,1 h内进行血清分离,完成3 000 × g离心10 min后,依照试剂盒说明书进行规范化、标准化操作。所有生化检测均在采血24 h内完成。
所有受试者均行上腹部常规CT平扫检查,且脂肪肝组患者影像结果符合肝脏密度普遍降低及肝/脾CT值之比 < 1.0的NAFLD诊断标准。其中,轻度NAFLD:0.7 < 肝/脾CT比值 < 1.0;中度NAFLD:0.5 < 肝/脾CT比值≤0.7;重度NAFLD:肝/脾CT比值≤ 0.5。
三、观察指标
1. 比较脂肪肝组和健康组的性别、年龄等基线资料。
2. 比较脂肪肝组和健康组的血清总胆固醇(Serum Total Cholesterol, TC)、甘油三酯(Triglyceride, TG)、低密度脂蛋白胆固醇(Low-Density Lipoprotein, LDL-C)、高密度脂蛋白胆固醇(High-Density Lipoprotein, HDL-C)、谷丙转氨酶(Alanine Transaminase, ALT)、谷草转氨酶(Aspartate Transaminase, AST)、谷氨酰转肽酶(Glutamyl Transpeptidase, GGT)指标。
3. 分析脂肪肝组患者病情程度(肝/脾CT值)与TC、TG、LDL-C、HDL-C、ALT、AST、GGT各指标间的相关性。
四、统计方法

结 果
一、两组血脂指标比较
脂肪肝组的TC、TG、LDL-C水平均明显高于健康组(P< 0.05),但HDL-C的表达水平两组无明显差异(P> 0.05),见表 1。
二、两组肝功能指标比较
脂肪肝组的ALT、AST、GGT水平明显高于健康组,差异均具有统计学意义(P< 0.05),见表 2。
表1 两组血脂指标比较± s,mmol/L)

表2 两组肝功指标比较± s)
三、脂肪肝组血清指标与肝/脾CT值相关性分析
运用Spearman分析方法对肝/脾CT比值与各血清指标进行相关性分析,显示TC、TG、LDL-C、ALT、AST、GGT与肝/脾CT值均呈高度负相关(P< 0.05),而HDL-C与肝/脾CT值无显著相关关系(P> 0.05),见表 3。

表3 NAFLD患者血清指标与肝/脾CT比值相关性分析
四、各血清指标诊断NAFLD的临床价值分析
采用ROC 曲线分析发现,血清TG、ALT、GGT浓度诊断NAFLD的AUC > 0.9,具有较高准确性;血清TC、LDL-C、AST浓度诊断NAFLD的AUC在0.7 ~ 0.9间,具有一定准确性;血清HDL-C浓度诊断NAFLD的AUC < 0.7,准确性较低。见表4。
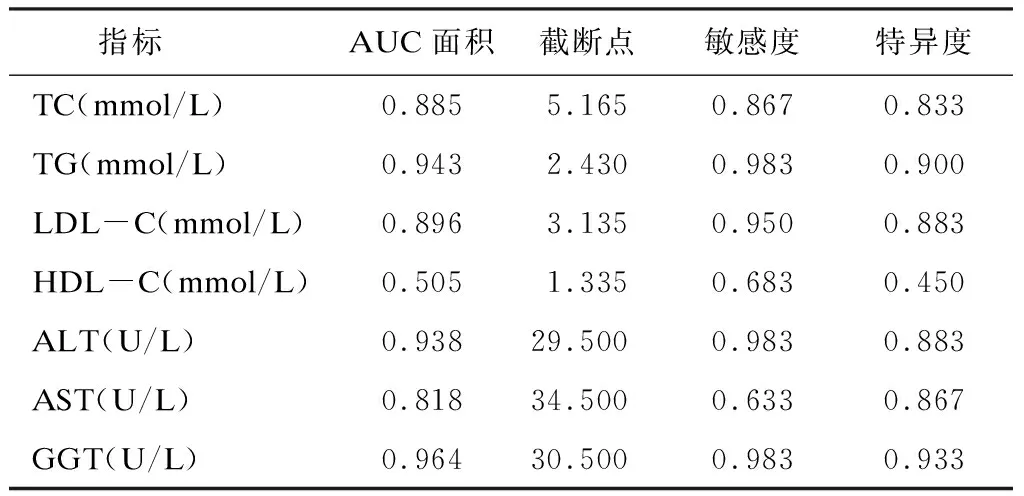
表4 各血清指标浓度诊断NAFLD的ROC分析
讨 论
自1980年Ludwig首次提出NAFLD概念以来,NAFLD一直多被认为是良性的。步入21世纪NAFLD已成为全球重要的公共健康问题和常见高发疾病,2000年以来NAFLD住院率已上升至97%。目前已成为肝脏移植第三大适应症的NASH极易发展为肝硬化和肝细胞癌,而最新的队列研究显示5年内连续肝活检由NAFLD进展为NASH的概率高达44%,有预测认为十年后NASH将成为最主要的肝脏移植原因[12-13]。
NAFLD具有起病隐匿、进展缓慢、无特异性临床症状等特点,病理学检测发现其主要以肝实质细胞脂肪变性和脂肪贮积为特征,虽然与酒精性肝病相似但却无不存在过量饮酒史[14]。NAFLD患者初期可偶尔出现全身无力、间断性上腹部不适、隐痛或饱胀感等症状;进展为NASH期可有恶心、呕吐、全身皮肤及巩膜黄染、食欲减退等非特征性症状,此期部分患者行B超或CT检查可见肝脏肿大;继续进展到终末期,可发展为肝硬化、肝癌等[15]。随着NAFLD发病率的逐年增高,由NAFLD引起的慢性肝脏损害逐渐得到了学者们的高度关注并成为研究热点,但至今NAFLD的病因、发病机制、治疗手段等仍未完全明确。
NAFLD在全球范围内普遍流行,但是流行病学和人口统计学特征却在不同人群间存在差异性。欧美国家的NAFLA多与肥胖和胰岛素抵抗(Insulin Resistance, IR)相关联,但在亚洲或我国,虽然也存在NAFLD多发于肥胖人群的特点,然而较低的体重指数(Body Mass Index, BMI)人群也会有一定的发病率[16]。我国2010年修订版的《非酒精性脂肪性肝病诊疗指南》中提出,NAFLD的危险因素有:高脂肪高热量膳食结构、多坐少运动的生活方式、IR、代谢综合征及其组分(肥胖、高血压、血脂紊乱、2型糖尿病)[17],而且临床确诊NAFLD需要排除其他一切可以导致脂肪肝的原因,例如病毒性肝炎感染、药物性肝损伤、长期大量饮酒史、肝豆状核变性、自身免疫性肝病等,除此还需结合临床症状以及实验室检查才可明确诊断[18]。
统计数据显示在绝大部分接受评估的患者中,放射学和实验室检查结果足以证实NAFLD,但是作为诊断NASH的金标准仍然是肝活检[19]。放射学和病理学检查费用高、操作复杂、存在人主观因素,不便于大面积推广,较高的费用或创伤也令群众难以接受。为了能够对NAFLD进行早期普遍的筛查与诊断,我们发现既往的研究发现相对于健康人群,高达88.5%的NAFLD患者存在脂质代谢紊乱,血脂、肝酶等血清学指标相较常人出现明显的改变[20-21]。因此,本研究检测了NAFLD患者血脂和肝酶的血清学指标,发现NAFLD患者的血清TC、TG、LDL-C、ALT、AST、GGT的水平均明显高于健康人群,HDL-C的表达水平NAFLD患者与健康人群没有明显差异性,印证了NAFLD患者存在脂质代谢紊乱的事实。运用Spearman法进行相关性分析显示,NAFLD患者的血清TC、TG、LDL-C、ALT、AST、GGT与肝/脾CT比值呈负相关性。而血清指标诊断NAFLD的ROC分析显示,血清TG、ALT、GGT浓度诊断NAFLD具有较高准确性,TC、LDL-C、AST浓度诊断NAFLD具有一定准确性。
综上所述,肝酶和血脂的血清学指标检测可对NAFLD患者在进行CT等影像学检查前进行初步的临床筛查,对NAFLD的临床诊断具有积极意义。
