杜鹃远缘杂交后代的无菌培养研究
2018-02-13资宏杨婧瑜方林川周媛
资宏 杨婧瑜 方林川 周媛

摘要:选用杜鹃(Rhododendron)品种♂胭脂蜜(Rhododendron obtusum ‘Yanzhimi)×♀春五宝(Rhododendron hybridum ‘Chunwubao)杂交种子作为试验材料,研究了不同杀菌方式、不同培养基初代培养、不同生长调节剂、低温处理及光照条件对种子萌发与生长以及添加不同浓度生长调节剂的1/2 WPM培养基对杂交无菌苗生根率的影响。结果表明,杜鹃杂交种子的最佳杀菌方式为1.5% NaClO溶液处理10 min+75%乙醇处理30 s;在经过为期20 d的4 ℃低温处理,并添加浓度为100 mg/L GA3的1/2 WPM培养基中培养杜鹃杂交种子,其发芽率最高,达到56.7%;光照对杜鹃杂交种子的萌发起促进作用,光照处理下的种子萌发率高于黑暗处理,且种子萌发的时间提前3~7 d;添加了0.5 mg/L NAA、0.1 mg/L IBA的1/2 WPM培养基使杜鹃杂交无菌苗的生根率达到了最佳。
关键词:杜鹃(Rhododendron);低温;无菌播种;发芽率;生根率;杂交不亲和
中图分类号:S681.9 文献标识码:A
文章编号:0439-8114(2018)22-0090-06
DOI:10.14088/j.cnki.issn0439-8114.2018.22.025 开放科学(资源服务)标识码(OSID):
Abstract: Taking Rhododendron cultivar "Rhododendron obtusum‘Yanzhimi×Rhododendron hybridum‘Chunwubao" as experimental materials, the effects of different methods of disinfection, initial culture of different kinds of media,different plant growth regulators, low temperature treatment and light conditions on seed germination and the growth were studied, and the effects of 8 kinds of 1/2 WPM medium supplemented with different concentrations of plant growth regulators on the rooting rate of hybrid sterile seedlings were also studied. The results showed that the optimum disinfection method for Rhododendron hybrid seeds was 1.5% NaClO solution for 10 min and 75% ethanol for 30 s. On the condition of 20 days low-temperature treatments at 4 ℃,and culturing Rhododendron hybrid seed with 100 mg/L GA3 in 1/2 WPM medium, the highest germination rate was got,and the value was 56.7%. Light irradiation promoted the germination of Rhododendron hybrid seed,the germination rate of seed under light treatment was higher than that of dark treatment,and the seed germination time was also 3~7 days earlier. On the condition of 1/2 WPM medium with 0.5 mg/L NAA and 0.1 mg/L IBA,Rhododendron hybrid sterile seedling had the highest rooting rate.
Key words: Rhododendron; low temperature; aseptic sowing; germination rate; rooting rate; cross-incompatibility
杜鵑(Rhododendron)是杜鹃花科杜鹃花属常绿或落叶灌木,是中国的十大传统名花之一,也是世界著名的观赏花卉,素有木本花卉之王的称号[1]。因其极高的观赏价值,在园林中享有“花中西施”的美誉。中国是世界杜鹃花野生种质资源的发源地之一,是杜鹃花种群量最大的国家。全世界野生杜鹃花约1 000种,其中中国占有大约570种,包括特有种420种。而目前中国杜鹃花的园艺品种总数只有不到300种,其园艺栽培品种的培育任重道远。
杜鹃在自然条件下可通过种子繁殖,生产上常采用扦插、嫁接等方式繁殖,但这些方式繁殖系数低,繁殖速度慢,且同时受季节、生长环境、母株材料等限制,不适于大量的商业化生产[2]。杂交选种是培育杜鹃品种最常用最有效的方法之一,由于杜鹃园艺栽培种的耐热性很差,所以育种家期望通过野生耐热杜鹃与栽培杜鹃的远缘杂交获得抗性强的杜鹃新品种,然而杜鹃属内远缘杂交不亲和限制了这种育种手段的应用。现有技术中杜鹃进行杂交育种时,往往重视了亲本选配等合子胚形成前期的工作,但对后期的工作缺乏系统研究,限制了杜鹃杂交尤其是种间的远缘杂交在新种质资源创制方面的运用,不利于杜鹃花种间杂交的遗传育种工作。利用杜鹃杂交种子进行无菌播种,培育试管苗,探索其最适的种子杀菌方式、基本培养基的选择、低温、生长调节剂、光照等对种子萌发的影响以及不同浓度生长调节剂对继代生根的影响,设计一种实现杜鹃花远缘杂交与组织培养的方法,以解决杜鹃种间杂交后代种子萌发率差、成苗弱、生根不良及新品种选育周期偏长等问题,并实现杜鹃花新优种质的快速高效无菌培养,同时可以将春鹃品种的优良抗逆性性状转入杜鹃高观赏性品种中。
1 材料与方法
1.1 试验材料
采用杜鹃品种♂胭脂蜜(Rhododendron obtusum ‘Yanzhimi)×♀春五宝(Rhododendron hybridum ‘Chunwubao)杂交种子,2016年11月采自中国科学院武汉植物园杜鹃种质资源圃内,干燥后收集于EP管内,室温保存。
1.2 试验方法
1.2.1 田间人工杂交授粉试验 选择处于气球状时期的大花蕾,开花前对母本进行去雄套袋,收集父本的新鲜花粉,于晴天上午9:00~12:00进行常规人工授粉,各组合至少重复50朵花,种子成熟后开裂前收集蒴果,去除果壳和杂质剥出种子,置于4 ℃冰箱干藏。
1.2.2 种子的杀菌处理 试验设置2个因子,因子1为不同浓度杀菌剂,共有5个水平;因子2为杀菌时间,共有4个水平;合计有20个处理(表1),每个处理设3个重复,每个重复接种100粒种子。先将种子用吐温20的水溶液洗涤1次,然后分别用NaClO(1.0%、1.5%、2.0%)溶液、H2O2(20%、30%)进行杀菌,随后用75%乙醇浸泡洗涤30 s,无菌水冲洗5次,每次1 min,最后将种子接种于1/2 WPM培养基,在25 ℃下培养7 d后,记录菌落数,计算种子污染率;培养第14天统计种子发芽情况,计算萌发率。
1.2.3 培养基的筛选 将杜鹃种子用相同的杀菌方式杀菌后,将种子接种于不同培养基,在25 ℃下培养,生长5周后分级统计萌发小苗的生长状况(叶片颜色、株高、根长)。选用的培养基为1/2 MS、MS、1/2 WPM、WPM,并以H2O作为空白对照培养基。
1.2.4 杜鹃种子萌发的诱导 为了筛选出更适合杜鹃种子的诱导培养基,采用GA3和NAA两种生长调节剂进行不同浓度的生长调节剂处理,以及不同时间的4 ℃低温处理,并以低温+生长调节剂组合处理的方法探索最合适的诱导杜鹃种子萌发的培养基处理。各处理分别为1/2 WPM+4 ℃低温处理0 d(A1);1/2 WPM+4 ℃低温处理5 d(A2);1/2 WPM+4 ℃低温处理10 d(A3);1/2 WPM+4 ℃低温处理20 d(A4);1/2 WPM+0 mg/L GA3(B1);1/2 WPM+5 mg/L GA3(B2);1/2 WPM+20 mg/L GA3(B3);1/2 WPM+100 mg/L GA3(B4);1/2 WPM+NAA 0 mg/L(C1);1/2 WPM+0.1 mg/L NAA(C2);1/2 WPM+0.5 mg/L NAA(C3);1/2 WPM+1.0 mg/L NAA(C4);1/2 WPM+4 ℃低温处理10 d+20 mg/L GA3(D1);1/2 WPM+4 ℃低温处理10 d+100 mg/L GA3(D2);1/2 WPM+4 ℃低温处理20 d+20 mg/L GA3(D3);1/2 WPM+4 ℃低温处理20 d+100 mg/L GA3 (D4)。其中,A1-A4为4 ℃低温处理;B1-B4为不同浓度GA3处理;C1-C4为不同浓度NAA处理;D1-D4为不同组合处理。
种子杀菌后,接种到以上培养基,每个培养基接种100粒种子,3个重复。在25 ℃环境下培养14 d,统计种子发芽数,计算萌发率。
1.2.5 培养条件 将接种后的培养基置于培养温度为25 ℃,光照度为2 000 lx,光照时间为每天12 h的培养环境下培养。设置24 h无光照的培养条件为对照组。观察并记录发芽率和幼苗生长状况。
1.2.6 组织培养 组培苗的快速繁殖,选取带芽茎段,将其接种至生根培养基中,进行生根并移栽。分别将生长3个月的杂交杜鹃苗在超净工作台上切下茎段,每个茎段带两个腋芽,将茎段基部插入含不同浓度组合的IBA与NAA的杜鹃组培苗继代培养基中,培养基基本配方为1/2 WPM+IBA+NAA+0.8%琼脂粉+活性炭0.05%,pH 5.6,设置0、0.1、0.5 mg/L IBA和0.1、0.5、1.0 mg/L NAA不同浓度生长调节剂组合,各组合见表2。将培养基置于25 ℃条件下,暗光培养30 d后置于3 000~4 500 lx下,16 h/8 h(光/暗)光周期培养,光周期下培养60 d,观察统計生根情况,计算生根率,3个重复试验。
1.2.7 各指标计算公式 种子污染率=(污染种子数/杀菌种子数)×100%;种子发芽率=(发芽种子数/无污染种子数)×100%;继代生根率=(生根株数/继代总株数)×100%。
2 结果与分析
2.1 不同杀菌方式及杀菌时间对种子的影响
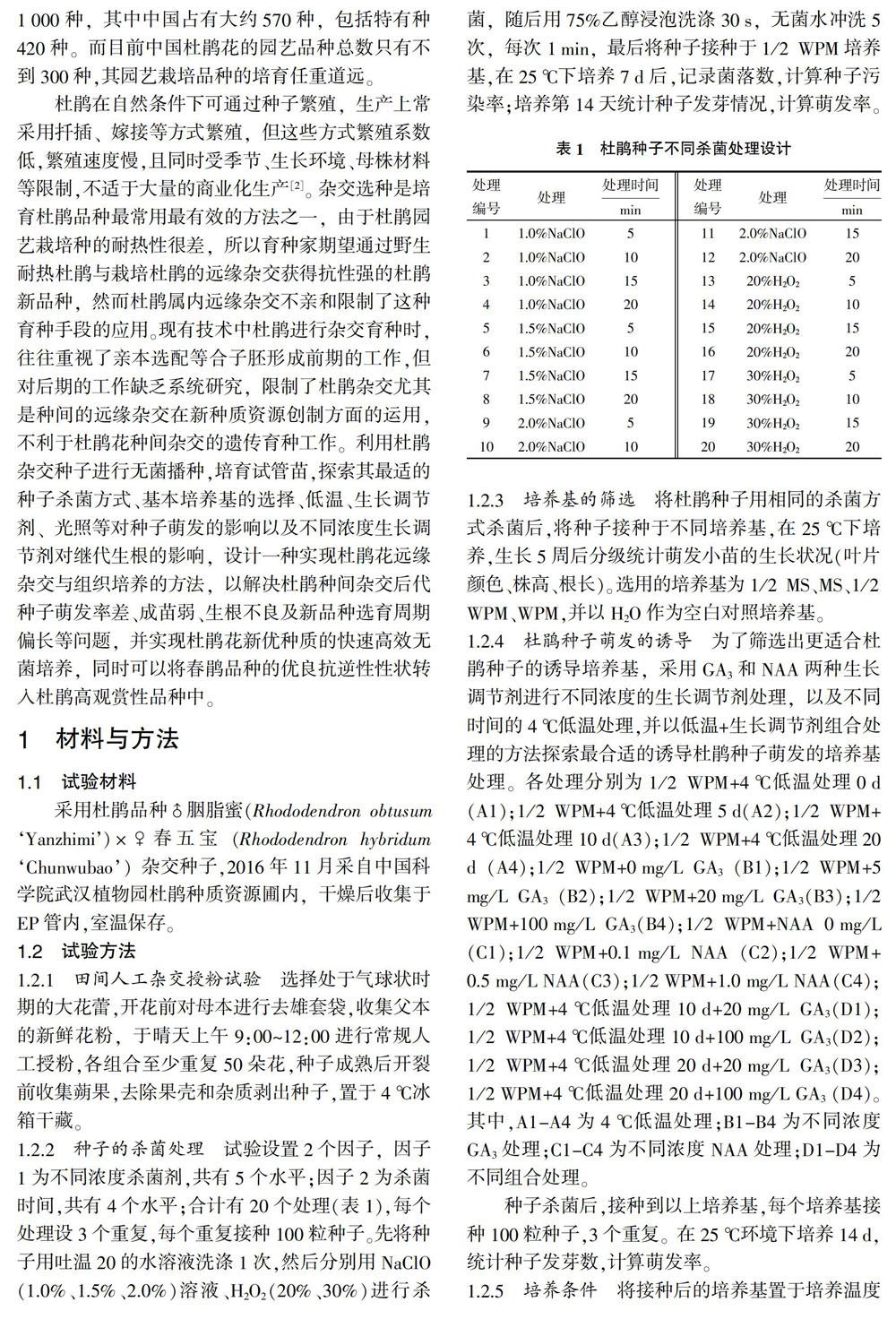
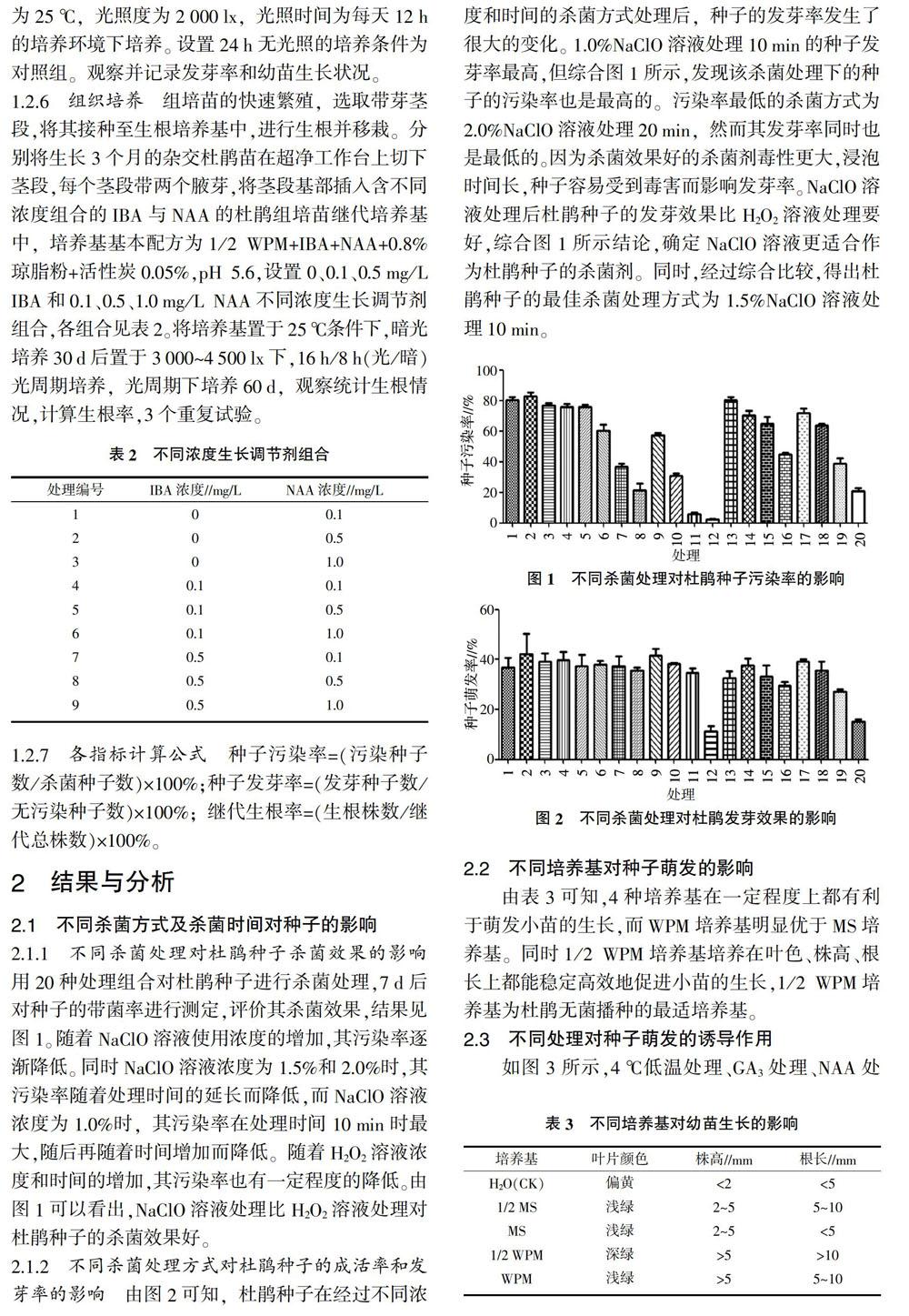
2.1.1 不同杀菌处理对杜鹃种子杀菌效果的影响 用20种处理组合对杜鹃种子进行杀菌处理,7 d后对种子的带菌率进行测定,评价其杀菌效果,结果见图1。随着NaClO溶液使用浓度的增加,其污染率逐渐降低。同时NaClO溶液浓度为1.5%和2.0%时,其污染率随着处理时间的延长而降低,而NaClO溶液浓度为1.0%时,其污染率在处理时间10 min时最大,随后再随着时间增加而降低。随着H2O2溶液浓度和时间的增加,其污染率也有一定程度的降低。由图1可以看出,NaClO溶液处理比H2O2溶液处理对杜鹃种子的杀菌效果好。
2.1.2 不同杀菌处理方式对杜鹃种子的成活率和发芽率的影响 由图2可知,杜鹃种子在经过不同浓度和时间的杀菌方式处理后,种子的发芽率发生了很大的变化。1.0%NaClO溶液处理10 min的种子发芽率最高,但综合图1所示,发现该杀菌处理下的种子的污染率也是最高的。污染率最低的杀菌方式为2.0%NaClO溶液处理20 min,然而其发芽率同时也是最低的。因为杀菌效果好的杀菌剂毒性更大,浸泡时间长,种子容易受到毒害而影响发芽率。NaClO溶液处理后杜鹃种子的发芽效果比H2O2溶液处理要好,综合图1所示结论,确定NaClO溶液更适合作为杜鹃种子的杀菌剂。同时,经过综合比较,得出杜鹃种子的最佳杀菌处理方式为1.5%NaClO溶液处理10 min。
2.2 不同培养基对种子萌发的影响
由表3可知,4种培养基在一定程度上都有利于萌发小苗的生长,而WPM培养基明显优于MS培养基。同时1/2 WPM培养基培养在叶色、株高、根长上都能稳定高效地促进小苗的生长,1/2 WPM培养基为杜鹃无菌播种的最适培养基。
2.3 不同处理对种子萌发的诱导作用
如图3所示,4 ℃低温处理、GA3处理、NAA处理都在一定程度上可以促进种子的萌发。4 ℃低温处理后种子萌发率随处理时间延长呈先上升后下降再回升趋势,并且在处理20 d后萌发率达到最大值,为44.7%。GA3处理下,随着处理浓度的增加,种子萌发率升高,最高达到46.0%。NAA处理下,随着浓度增加,萌发率呈先上升后略有下降的趋势,0.5 mg/L NAA处理的萌发率达到最高,为41.7%。综合可知,GA3处理后的种子萌发效果略优于NAA处理。设置GA3处理与低温处理组合试验,结果显示,各组合处理种子萌发率比单一处理时有一定程度的增高,4 ℃低温处理20 d+100 mg/L GA3处理的种子萌发率最高,为56.7%。
2.4 光照环境对种子萌发的影响
在采取同样杀菌液的相同杀菌处理,1/2 WPM培养基,并经过相同诱导处理条件下培养,经数据统计,黑暗处理的种子萌发受到抑制,比每天12 h光照处理下的种子萌发时间晚3~7 d,萌发率约为光照处理组的1/2(数据未列出)。
2.5 不同生长调节剂对无菌苗生根的影响
将杜鹃无菌苗进行继代试验,插入到添加了不同浓度的NAA和IBA的1/2 WPM培养基中,进行暗处理光周期处理之后,无菌杜鹃苗的生根率有差异(图4),其中,处理5和处理8组合的培养基,即同时添加0.5 mg/L NAA与0.1或0.5 mg/L IBA的培养基的生根率明显高于其他几种组合处理。
3 讨论
3.1 种子杀菌方式的选择
能否有效控制污染是杜鹃无菌播种是否成功的关键技术之一。植物无菌播种中的污染可分为外植体、培养基和无菌操作3个方面,其中培养基和无菌操作方面的污染目前已经得到有效控制,而外植体方面的污染是最为复杂也是最难控制的,其可能是细菌引起的,也可能是真菌引起的,且微生物可能是附生性的,也可能是内生性的。因此,找到一种快速高效的种子杀菌方法成为了无菌播种的重点。而种子杀菌过程最关键的是选择合适的杀菌剂和杀菌时间。一般常用的杀菌剂主要有NaClO、H2O2、升汞、硝酸银等,其中升汞的杀菌效果是最好的,但较难除去,对植物组织和细胞也有杀伤作用。所以本试验选择了相对杀菌较弱的NaClO和H2O2两种杀菌剂。NaClO和H2O2的氧化性可以氧化掉杜鹃种皮上限制杜鹃种子萌发的物质,而NaClO的强漂白性还可以增加杜鹃种子的透光能力从而促进种子的萌发[3]。
在本试验中,高浓度和长时间的NaClO和H2O2溶液处理均造成种子发芽率下降,这与沈羊城等[4]对山桐子种子杀菌的研究结果一致,推测原因为2种试剂腐蚀种皮,侵入种胚内部,造成种子活力下降甚至死亡。而NaClO处理下,杜鹃种子的萌发率要高于H2O2处理。其原因可能是,杜鹃种子上残留的NaClO杀菌液将随着培养时间的延长而分解为氯气挥发掉,从而减轻对种子的毒害。而H2O2有轻微腐蚀作用,杀菌后会进一步加大种子储存物质的外渗,从而降低了种子的活力[5]。
3.2 培养基的选择
基本培养基是植物组织培养过程中很重要的基质,为植物生长发育提供营养。由于植物的遗传特性、生物学特性不尽相同,因此不同种植物甚至同一植物的不同组织对基本培养基的要求也不相同。
Anderson等首次对杜鹃花进行组织培养研究时,总结出可广泛应用于杜鹃花属组培的Anderson 培养基,随后他对MS培养基进行了改良,称之为Anderson的改良MS培养基[6]。Read等培养耐寒落叶杜鹃时,采用的是Read培养基[7]。杨乃博[8]选用1/4 MS培养基,成功培养出春夏鹃。针对MS培养基对木本植物培养的不足,Lloyd等[9]研制并开发出了适宜于木本植物组织培养的培养基(Woody plant medium,WPM),此培养基对培养杜鹃花科的一些木本植物非常奏效。此外,邓百万等[10]培养比利时杜鹃选用N6培养基,宗宪春等[11]选用B5培养基培养毛叶杜鹃与比利时杜鹃。到目前为止,培养杜鹃花广泛选用这7种培养基。但因杜鵑的种、品种及外植体而异,究竟选用何种培养基作为基本培养基,需要由试验来确定。
基于外植体诱导与分化培养阶段沿用同种培养基进行培育的考虑,本试验选用MS、1/2 MS、WPS、1/2 WPM 4种培养基来培养杜鹃,生长5周后对无菌苗的叶片颜色、株高、根长进行分级统计,发现 1/2 WPM基本培养基培养出来的无菌小苗其生长势最好,WPM培养基略微逊色,但在株高方面仍然优于MS和1/2 MS培养基的无菌小苗。郑茜子等[12]探讨了WPM和1/2 WPM培养基的优劣,结果表明1/2 WPM明显优于WPM,且优于罗琳等[13]应用1/2改良MS培养基,这与本试验结果相一致。
3.3 生长调节剂及低温处理对种子萌发的影响
生长调节剂是植物生长和发育必不可少的调节物质。采用NAA和GA3处理后发现,NAA和GA3都在一定程度上提高了杜鹃种子的发芽率,由此可见,NAA和GA3对杜鹃种子萌发都有一定的促进作用。而对比结果表明,GA3的促进效果略高于NAA,NAA为生长素类因子,能够促进细胞伸长生长和细胞分裂,而GA3不仅可以促进细胞的生长与分裂,同时也是打破种子休眠,促进发芽的一种植物生长因子。
一般认为杜鹃种子具有一定程度的休眠性,但不同种类种子的休眠程度相差极为悬殊。成熟的种子能否萌发与种子内部生长因子的种类与含量有着直接的关系。三因子学说认为种子的休眠和发芽由赤霉素、细胞分裂素和脱落酸3因子共同调节,即萌发促进物质赤霉素、细胞分裂素和萌发抑制物质脱落酸之间的相互作用决定了种子的休眠与萌发。赤霉素是萌发必需的,在调节种子萌发中起着“原初作用”,抑制物脱落酸起着“抑制作用”,而细胞分裂素则起着“解抑作用”。赤霉素能促进由许多种不同结构引起的休眠或静止种子的萌发,是主要的调节因子,而只有脱落酸等抑制物存在时,细胞分裂素存在才是必需的。
在GA3对杜鹃种子的萌发试验中,随着外源施用GA3浓度的增加,其种子萌发率也有一定幅度的增加。莫云容等[14]研究发现高浓度GA3处理能显著提高种子萌发,金小平等[15]研究表明外源GA3可以有效提高榛子种子的发芽率,这与本试验结果相符。GA3诱导水解酶产生,催化种子内储藏物质的降解,如淀粉水解为糖,蛋白质水解为各种氨基酸,从而易于被胚利用,促进种子萌发[16]。
种子休眠和萌发与外部生态因子的关系也密不可分,低温或冷处理能释放种子休眠[17]。本试验结果显示,经过低温处理后种子的萌发率随着处理时间的增加而增加。内源赤霉素作用机理在于其能够软化胚周围组织(如种皮和主乳)[18];而低温处理能够提高种子内源赤霉素含量[19],从而解除休眠。于进英等[20]的研究结果显示,低温处理促进薰衣草种子的萌发。马丽妍等[21]的研究显示,低温及GA3处理均可导致凤丹种胚中碳氮代谢物和内源生长因子含量的变化,从而促进种子的萌发。
然而,在某些情况下,单一的低温处理或生长调节剂处理并不能达到理想效果。研究表明,如果能将GA3处理和低温层积处理结合起来,效果会更好。如于玲等[22]以低温14 d结合500 mg/L GA3处理紫斑牡丹种子,其种子萌发和幼苗生长的效果最好;侯冬花等[23]研究发现,低温与GA3综合处理对野生甜仁杏种子萌发,提高其发芽率及胚根生长速率均有极显著的促进作用。本试验设置低温+GA3处理组合,结果表明,低温处理20 d,GA3外源施用浓度为100 mg/L时,种子的发芽率达到最高,与前人的研究中低温结合GA3处理可以促进种子萌发的结果相一致,但对杜鹃幼苗生长的影响效果还待进一步的研究。
3.4 生长调节剂对无菌苗生根的影响
不同浓度NAA和IBA组合在一起对杜鹃无菌苗继代生根情况产生了不同的影响。通过对无菌苗生根情况的观察和统计表明,添加了0.5 mg/L NAA+0.1 mg/L IBA和0.5 mg/L NAA+0.5 mg/L IBA的1/2 WPM培养基的生根率明显高于其他浓度组合培养基,尤其是添加了0.5 mg/L NAA+0.1 mg/L IBA的培养基的生根情况达到了最佳。表明植物生长调节剂对无菌苗的生根有一定的促进作用,但是不同浓度组合生根情况有所差异。
4 小结
种子的无菌播种技术被广泛应用于植物繁殖中,采用种子的无菌播种可以缩短植物的育种周期,同时为后期研究杜鹃外植体的组织培养提供植物材料。目前国内对杜鹃无菌播种的研究较少,因此,本试验以杜鹃种子为材料,探究其合适的种子杀菌方式、诱导萌发处理方式、培养环境。结果表明,采用1.5%NaClO杀菌10 min为杜鹃种子的最佳杀菌方式。1/2 WPM培养基添加100 mg/L GA3,并经过20 d的低温处理,可以使杜鹃种子的发芽率达到最高,为56.7%。无论是黑暗条件还是光照条件,杜鹃种子均会萌发,但光照条件下的种子萌发率为黑暗处理的2倍,且萌发时间比黑暗处理提前3~7 d,说明光照会影响杜鹃种子的萌发。杜鹃继代最适生根培养基为添加了0.5 mg/L NAA+0.1 mg/L IBA和0.5 mg/L NAA+0.5 mg/L IBA的1/2 WPM培養基。
杜鹃的观赏价值极高,但由于其繁殖困难,很多好的杜鹃品种无法在园林中应用。本试验通过对杂交杜鹃无菌播种的培养条件及组织培养的研究,有利于野生杜鹃种质资源的收集与保护,可以快速提高其繁殖系数,优化改良杜鹃种质,对充分利用中国丰富的野生杜鹃花种质资源、丰富杜鹃花品种的遗传基础以及优化育种技术发挥重要的作用,这对于杜鹃花的原创性育种工作及产业的可持续发展显得尤为重要。
参考文献:
[1] 高文强,樊金会,赵红霞,等.杜鹃花组培快繁技术的研究[J].山东林业科技,2011,41(5):47-49.
[2] 苗永美,简 兴.杜鹃组培的研究[J].北方园艺,2004,28(3):76-77.
[3] 张茂林,樊金会.杜鹃花种子休眠打破技术的研究[J].山东林业科技,2011,41(1):19-22.
[4] 沈羊城,侯金艳,刘文博,等.山桐子种子快速高效萌发研究[J].中国农学通报,2015,31(13):5-9.
[5] 鲁黎明,安 影.不同消毒剂对烟草种子消毒效果及萌发的影响[J].种子,2012,31(4):93-95.
[6] WILBURR C,ANDERSON A. Revised tissue medium for shoot multiplication of rhododendro[J].J Amer Soc Hort Science,1984, 109(3):343-347.
[7] ECONOMOU A S,READ P E. In vitro shoot proliferation of minnesota deciduous azalea[J].Hort Science,1984,9(1):60-61.
[8] 杨乃博.春夏鹃的试管繁殖[J].植物生理学通讯,1985(5):38-39.
[9] LLOYD G B,MC COWN B H. Commercially feasiboe micropropagation of mountain laurel,Kalmia latifolia,by use of shoot-tip culture[J].Combined Proceedings,International Plant Propagators Society,1980,30:421-427.
[10] 邓百万,陈文强,高菲菲.比利时杜鹃的组织培养研究[J].氨基酸和生物资源,2002(3):25-27.
[11] 宗宪春,李振山,孙美华.二种杜鹃花快速繁殖的研究[J].牡丹江师范学院学报(自然科学版),1999(1):5.
[12] 郑茜子,袁柳祥,赵 冰,等.秦岭美容杜鹃种子组培快繁技术研究[J].北方园艺,2015,39(24):75-79.
[13] 罗 琳,白 洁,陈 超,等.美容杜鹃叶片再生及愈伤组织耐热生理研究[J].西北植物学报,2014,34(7):1377-1382.
[14] 莫云容,张培欣,邵贵芳,等.不同浓度赤霉素和双氧水对刺茄种子萌发的影响[J].北方园艺,2016,40(9):32-34.
[15] 金小平,尹 瑞.GA3对榛子种子萌发的影响[J].北方果树,2011(4):14-15.
[16] 潘学军,张文娥,樊卫国.外源激素处理对贵州毛葡萄种子发芽的影响[J].种子,2007(1):25-27.
[17] 付婷婷,程红焱,宋松泉.种子休眠的研究进展[J].植物学报,2009,44(5):629-641.
[18] 王伟青,程红焱.拟南芥突变体种子休眠与萌发的研究进展[J].植物学通报,2006,23(6):625-633.
[19] 陳庆亮,王华磊,王志芬,等.低温层积与外源GA3对肉苁蓉种子萌发及其内源GA和ABA含量的影响[J].植物生理学通讯, 2009,45(3):270-272.
[20] 于进英,黄 青,李晓鹏,等.GA3、低温冷藏和光照对真薰衣草种子萌发与幼苗生长的影响[J].种子,2012,31(5):81-84.
[21] 马丽妍,董春兰,言燕华,等.低温和GA3凤丹种子萌发及碳氮代谢物和内源激素含量的影响[J].植物资源与环境学报,2014, 23(4):40-46.
[22] 于 玲,钟 原,王 莹,等.低温和赤霉素对紫斑牡丹种子萌发和幼苗生长的影响[J].北京林业大学学报,2015,37(4):120-126.
[23] 侯冬花,呼凤兰,赵彦华.低温层积与GA3综合处理促进野生杏种子萌发初探[J].山西果树,2012(6):16,23.
