外源H2S影响黄瓜幼苗响应高盐胁迫的蛋白质组学分析
2018-02-13任绪明蒋景龙
任绪明,蒋景龙*,孙 旺,李 丽
(1 陕西理工大学 生物科学与工程学院,陕西汉中 723001;2 陕西理工大学 化学与环境工程学院,陕西汉中 723001)
土壤次生盐渍化是指由于不合理的耕作灌溉而造成的土壤盐渍化过程,其中设施栽培引起的土壤次生盐渍化较为严重。次生盐渍化会对植物造成各种各样不利的影响,如渗透胁迫、氧化胁迫、营养元素失衡、调控耐盐相关基因与蛋白表达等,最终抑制植物的生长[1]。硫化氢(hydrogen sulfide,H2S)是一种有毒气体,有“臭鸡蛋”气味,易溶于水。随着对H2S生物功能的认识,它被认为是继CO、NO之后的另一种气体信号分子[2]。研究表明,植物内源H2S是以半胱氨酸(cysteine,Cys)为底物,由半胱氨酸脱巯基酶(cysteine desulfhydrases,CDes)催化产生的[3]。H2S作为内源信号分子,能够参与植物体内诸多生理过程,如缓解光抑制伤害[4]、促进植物侧根的发育[5]和提高植物体对非生物胁迫的抵御能力[6]等。H2S在参与植物体对环境胁迫的适应能力方面发挥着重大作用[7]。朱会朋等[8]发现H2S不仅可以通过上调杨树根系胞质膜Na+/H+逆向转运体系(H+泵和Na+/H+逆向转运体)来促进Na+和H+逆向跨膜转运,而且H+泵可以通过抑制去极化激活的离子通道限制盐诱导下K+的外流。何庆元等[9]采用不同浓度H2S供体NaHS溶液喷施在盐溶液胁迫下的大豆植株上,表明在盐胁迫下抗氧化酶活性降低,但在一定浓度的NaHS喷施下,能提高抗氧化性酶的活性,达到对大豆盐胁迫的缓解作用。NaHS作为外源H2S供体之一,在溶液中会电离成Na+和HS-,而HS-是一种弱酸根离子,既会水解也会电离,在H2O分子的作用下,会水解为H2S。然而,对于H2S处理对黄瓜叶片高盐胁迫响应的蛋白质组学研究未见报道。
蛋白质组学是指从整体的角度分析细胞内动态变化的蛋白质组成成分、表达水平与修饰状态,了解蛋白质之间的相互作用与联系,揭示蛋白质功能与细胞生命活动的规律[10]。蛋白质组学分析,通常将电泳技术、质谱技术和生物信息学技术相联进行蛋白质鉴定,主要有双向凝胶电泳(2-DE)、双向荧光差异凝胶电泳(2D-DIGE)、质谱分析、生物信息学等研究技术,其中第二代蛋白组学技术如多维蛋白鉴别技术(MudPIT)、同位素亲和标记技术(ICATs)、同位素相对标记与绝对定量技术(iTRAQs)、细胞培养条件下稳定同位素标记技术(SILAC)及同位素编码的蛋白质标签(ICPL)正在不断发展[11-12]。而2-DE技术即双向凝胶电泳技术,是将蛋白质按等电点和分子量两种不同特性结合起来进行蛋白质分离的技术,具有较高的分辨率和灵敏度,已成为蛋白质特别是复杂系统中的蛋白质检测和分析的一种强有力的生化手段[13]。时朝等[14]利用双向电泳技术和质谱鉴定方法,从低温处理后的软猕猴桃中分离鉴定了11种蛋白质,鉴定结果显示,这些蛋白与光合作用、糖代谢、信号转导、抗逆和基因调控有关。牛银银等[15]利用NaCl溶液模拟盐分胁迫,对幼苗叶片蛋白进行双向电泳分析,检测到差异表达蛋白点有61个,鉴定结果表明,小麦幼苗为了满足对盐的需求,可能开启和关闭了体内的一些相关代谢途径。于涛等[16]对不同发育期的玉米上、中部籽粒进行差异表达蛋白质的分析,获得66个蛋白表达丰度显著差异,丙氨酸转氨酶、S-腺苷甲硫氨酸合成酶1(SAMS)的差异表达可能是导致粒位效应的重要原因。
本实验主要以黄瓜(CucumissativusL.)栽培品种‘春夏秋王’为试材,利用基于双向电泳的蛋白质组学技术分析200 mmol/L NaCl胁迫和15 μmol/L NaHS(H2S供体)处理后叶片蛋白质的差异表达规律,这些研究可能为阐明H2S在黄瓜高盐胁迫应答中的分子作用机制提供一定的理论依据。
1 材料和方法
1.1 实验材料
黄瓜栽培种‘春夏秋王’购自汉中市现代农业科技有限公司。选取籽粒饱满、大小一致的种子,用50 ℃温水浸泡20 min后放置于蒸馏水中吸胀3~4 h[17]。然后将种子播种于珍珠岩中,置于人工光照培养室中培养,待所有幼苗第1片真叶完全展开时,选取长势一致的幼苗分别用200 mmol/L NaCl (T组)和200 mmol/L NaCl+15 μmol/L NaHS(S组)处理7 d,以营养液处理作为对照组(CK组)。选取对照及处理组的黄瓜幼苗第2片真叶液氮速冻后移至-80 ℃超低温冰箱内保存。每个处理3次生物学重复,用于2-DE差异蛋白质组学研究。
1.2 生长指标测定
处理7 d时,测量幼苗第2片真叶的叶长(叶柄至叶尖的长度),根据龚建华等[18]的方法计算叶面积;分别取幼苗地上部和地下部,用去离子水冲洗干净,擦干水分后,用直尺测定幼苗茎长和根长,再分别称鲜重,于105 ℃杀青15 min,然后75 ℃烘至恒重,称干重[19]。
1.3 蛋白质提取与定量
黄瓜叶片总蛋白质的提取参照Wu等[20]的丙酮/三氯乙酸沉淀法(TCA),方法略有改进。取0.5 g叶片样品液氮中研磨成粉,样品悬浮于1.5 mL预冷的TCA和0.07% β-巯基乙醇的丙酮溶液中,-20 ℃沉淀过夜,其间振荡数次。离心弃上清液,加入等体积含0.07% β-巯基乙醇的冰丙酮溶液,静置1 h,4 ℃、12 000×g离心,弃上清液;重复洗涤沉淀3~4次。直至上清液清亮,将沉淀真空干燥成粉末状。在蛋白干粉中加入600 μL裂解液(7 mol/L尿素、2 mol/L硫脲、4% CHAPS、65 mmol/L DTT、40 mmol/L Tris-base)充分涡旋混匀,冰浴超声促溶,4 ℃离心1 h。吸取上清液,分装至1.5 mL Eppendorf管内,液氮速冻后保存于-80 ℃超低温冰箱。
1.4 双向电泳
第一向等电聚焦(IEF):采用长度18 cm,pH 4~7的线性干胶条,取水化液(8 mol/L尿素、2 mol/L硫脲、2% CHAPS、18 mmol/L DTT、0.002%溴酚蓝)与蛋白提取液共350 μL(含蛋白质约为500 μg),充分混匀,水化过夜。取水化后的胶条放入Manifold胶条槽中,胶面向上,覆盖适量矿物油,置于等电聚焦仪上(Ettan IPGpher 3,GE)。设置运行参数,进行电泳。参数如下:50 V 聚焦1 h;100 V 聚焦2 h;500 V 聚焦1 h;1 000 V聚焦2 h;2 000 V 聚焦1 h;5 000 V 聚焦1 h;10 000 V 聚焦2 h;10 000 V 聚焦65 000 Vh。第一向等电聚焦完成后,将胶条置于平衡缓冲液(6 mol/L 尿素、1.5 mol/L Tris-HCl (pH 8.8)、2% SDS、30%甘油、0.002%溴酚蓝)中平衡2次,每次15 min。第一次平衡在缓冲液中加入1%二硫苏糖醇(DDT);第二次平衡在缓冲液中加入2.5%碘乙酰胺(IAM)。平衡完毕后取出胶条轻轻润洗,去除多余的平衡缓冲液,准备第二向电泳。
SDS-PAGE电泳:平衡结束后,将胶条转入第二向SDS-PAGE电泳仪(Ettan DALTsix,GE),置于分离胶上端,排除气泡,0.5%琼脂糖凝胶封固胶条,进行第二向电泳。先设恒定电流15 mA电泳30 min,随后电流增大至38 mA,直至溴酚蓝迁移至凝胶底端0.5 cm处结束。电泳结束后,凝胶用超纯水清洗2 min;加入考马斯亮蓝R-250染色液染色3 h;脱色液脱色2次,各45 min;强化液(1%冰乙酸)脱色至背景清晰。
1.5 质谱鉴定与数据库分析
采用SilverFast扫描仪对凝胶进行图像扫描,分辨率为300 dpi。采用Yang等[21]的方法,使用蛋白质相对表达体积(%VOL)来表述每一个匹配蛋白质在不同处理组间的表达丰度。差异蛋白质的表达丰度分析分别以CK、T、S的凝胶作为参考胶,两两比较,只有蛋白质在至少2个重复内被发现才被认为是真实的蛋白质。本实验中,以表达丰度上调(出现)或下调(消失)差异大于等于1.5倍(Fold≥1.5),并且在统计学t检验上P<0.05为条件,对蛋白质进行筛选。差异蛋白质用MALDI-TOF/TOF-MS/MS进行鉴定,对蛋白检索结果的显著性判别标准一般认为PMF在MS/MS检索中Ions分数≥60,说明该蛋白的鉴定结果有效。
1.6 生物信息学分析
采用Blast2GO(https://www.blast2go.com/)[22]软件对被鉴定的差异表达蛋白质进行GO(Gene Ontology)功能注释。通过基因本体(GO,http://www.geneontology.org/)数据库计算每一个GO分类(term)的差异蛋白数目,按照其生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)对已鉴定的蛋白质进行比较分析[23]。
利用在线分析工具KAAS(KEGG Automatic Annotation Server,http://www.genome.jp/tools/kaas/)对目标蛋白质集合进行KEGG(Kyoto Encyclopedia of Genes and Genomes)通路注释。首先通过比对KEGG(http://www.kegg.jp/)[24]数据库,找到最相似的蛋白质,将目标蛋白质序列进行KO(KEGG Ortholog)归类,并根据KO归类自动获取目标蛋白质序列参与的通路信息。应用MultiExperiment Viewer(MeV)软件对已鉴定蛋白质进行表达量的聚类分析。
1.7 数据处理与作图
双向凝胶谱图用ImageMaster 2D Platinum 7.0软件分析,实验数据用Excel 2010软件整理,结果表示为平均值±标准误差,用SPSS21.0软件进行单因素方差分析及多重比较。应用Graphpad Prism 5、MeV和Photoshop作图。
2 结果与分析
2.1 H2S处理缓解盐胁迫对黄瓜生长的抑制
与对照组相比,在200 mmol/L NaCl溶液处理下,黄瓜幼苗出现了不同程度的伤害,具体表现为植株矮小,叶片发黄、部分还出现了失水萎蔫,甚至倒伏的现象(图 1)。与NaCl处理组相比,用15 μmol/L NaHS溶液处理后,盐胁迫对黄瓜生长的抑制作用得到了明显的缓解,叶片萎蔫程度降低,未出现倒伏等症状。
⑫⑭⑮Wolfgang Spohn,“From Nash to Dependency Equilibria”,in Giacomo Bonanno,Benedikt Lowe,Wiebe van der Hoek(eds.),Logic and the Foundations of Game and Decision Theory,Springer,2010,p.135,p.140,p.141.
经过NaCl和NaHS处理7 d后,黄瓜幼苗各项生长指标均呈下降趋势(表 1)。与对照组相比,NaCl处理后,黄瓜幼苗叶面积、茎长、根长、地上和地下部鲜重以及地上和地下部干重分别降低了89.5%、27.9%、47.5%、66.3%、58.1%、49.7%和52.6%。与NaCl处理组相比,用NaHS处理后,黄瓜幼苗的各项生长指标均有所提高,但均低于对照组,其中,叶面积、茎长、根长、地上和地下部鲜重以及地上和地下部干重分别提高了457.9%、22.5%、61.4%、112.5%、44.4%、65.8%和22.2%。结果显示,高盐胁迫会抑制黄瓜幼苗的生长,外源施加H2S供体NaHS可以缓解高盐对其的伤害。
2.2 凝胶图谱分析
对蛋白质表达图谱分析显示,CK组、T处理和S处理组分别检测到808、818和764个点形规则清晰、可重复的蛋白质,分子质量大多分布在25.0~35.0 kD (占34.6%),等电点主要集中分布在pI 5~6 (占46.2%)。比对分析发现,CK/T组、T/S组和CK/S组分别有410、409和466个蛋白质相匹配。统计学分析表明,表达丰度显著差异的(P<0.05)蛋白质共45个,去掉表达丰度过低的蛋白质,总共34个蛋白质(图 2)。
采用表达差异倍数(Fold change,R)以及统计学方法t检验,对差异表达蛋白质进行筛选(Fold change≥1.5-fold或 ≤0.67-fold,P<0. 05;图 3)。由图3所示,CK/T组有12个蛋白质表达上调和6个蛋白质表达下调,T/S组有5个蛋白质表达上调和11个蛋白质表达下调,CK/S组有7个蛋白质表达上调和4个蛋白质表达下调。
2.3 差异蛋白点的鉴定及功能分类
将34个差异表达蛋白质进行MALDI-TOF/TOF-MS鉴定分析,并采用MASCOT(http://www.atrixsci-ence.com)在线检索NCBI和 Swiss-Prot数据库。成功鉴定26个蛋白质,另8个蛋白质因匹配率太低而未得到鉴定(表 2)。

表1 NaHS处理对盐胁迫下黄瓜幼苗生长指标的影响
注:表中同列不同字母表示处理间在P<0.05水平上存在显著差异
Note: Values in each column with different letters are significantly difference among treatments atP<0.05 level
在26个成功鉴定的蛋白质中,23个可确定生物学功能(88.46%),3个为未知功能蛋白(11.54%)。这些蛋白质涉及光合作用(26.92%)、蛋白质代谢(23.08%)、能量与碳水化合物代谢(11.54%)、氨基酸生物合成(11.54%)、细胞结构相关蛋白(7.69%)、抗氧化作用(3.85%)、信号转导(3.85%)及未知功能蛋白(11.54%)等生物学过程(图 4)。

图1 NaHS处理缓解盐胁迫对黄瓜生长的抑制Fig.1 NaHS treatment alleviates the inhibition of cucumber growth under salt stress
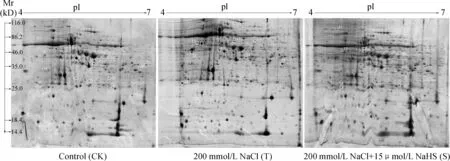
图2 双向电泳分析不同处理下黄瓜叶片蛋白质表达图谱Fig.2 Two-dimensional electrophoresis analysis of protein expression maps of cucumber leaves under different treatments
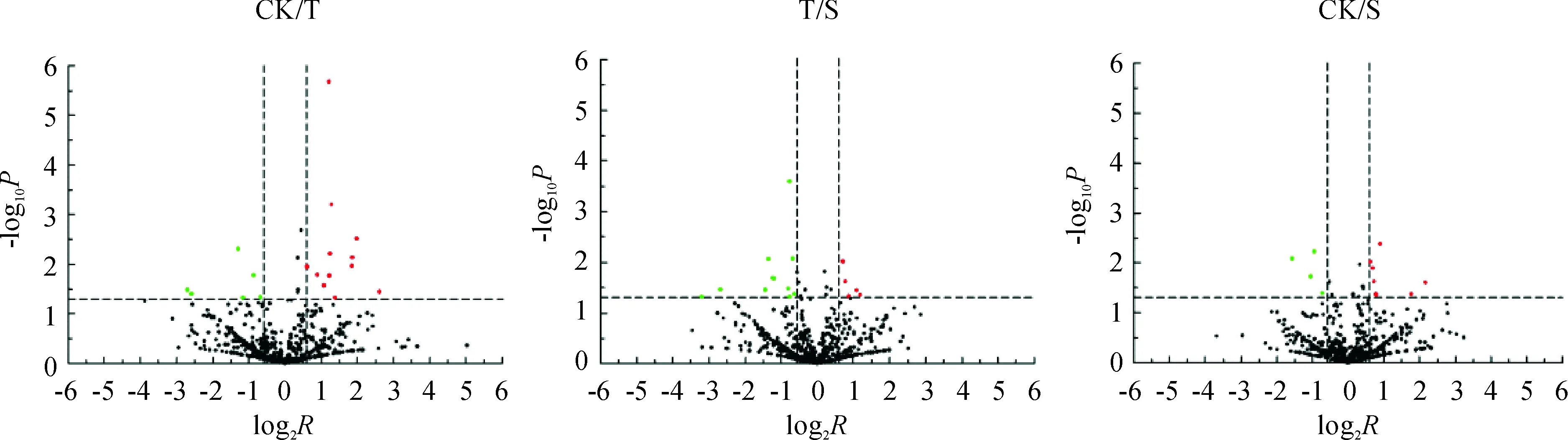
红色点表示表达量上调的蛋白质点;绿色点表示表达量下调的蛋白质点。横坐标为差异倍数(以2为底的对数变换), 纵坐标为显著性P-value值(以10为底的对数变换)图3 火山图分析黄瓜叶片不同处理组间差异表达的蛋白质情况 Red points stand for up-regulated expression of protein; Green points stand for down-regulated expression of proteins. The abscissa is the difference multiple (log transformation based on 2) and the ordinate is the significant P-value (log transformation based on 10)Fig.3 Volcano maps analysis of differential expressed proteins of cucumber leaves under different treatment groups


2.4 GO注释及KEGG通路分析
将CK组、T组与S组两两比较,获得差异表达蛋白质,并对其进行GO注释(图 5)。结果显示差异表达蛋白质生物学过程主要涉及应激反应、有机物代谢过程、胁迫响应和多细胞生物发育等。细胞组成集中分布在细胞部分和一些胞内细胞器,也有相当数量的蛋白质是位于作为胞内细胞器部分位点的蛋白质或复合体。同时,还鉴定出一些与信号相关的蛋白质。从具体的细胞功能注释结果分析,大部分的差异蛋白发挥着蛋白质结合与水解酶活性的分子功能。

图4 差异表达蛋白质功能分类Fig.4 Primary function classification of differential proteins
为了确定差异蛋白质主要参与的生物途径,在GO注释的基础上,对差异蛋白质参与的代谢通路进行进一步的分析。KEGG通路分析结果显示(图6),参与肌动蛋白细胞骨架调控的蛋白质(11个)和参与细胞凋亡的蛋白质(11个)最多,另分别有7个蛋白酶体相关蛋白质和6个蛋白质参与碳代谢。此外,还有一些蛋白质参与丁酸代谢、半胱氨酸和蛋氨酸代谢、磷酸戊糖途径、氨基酸生物合成等途径,说明NaCl胁迫下,黄瓜幼苗在适应环境过程中会伴随着蛋白质的合成与降解及消耗能量。
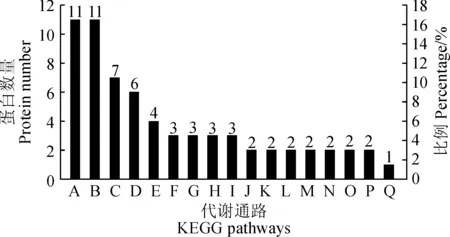
A. 肌动蛋白细胞骨架的调节;B. 细胞凋亡;C. 蛋白酶体;D. 碳 代谢;E. 生物体光合的碳固定;F. 丁酸代谢;G. 戊糖磷酸途径; H. 半胱氨酸和甲硫氨酸代谢;I. 氨基酸生物合成;J. 半乳糖代谢; K. 内质网中的蛋白质加工;L. 丙酮酸代谢;M. 二羧酸代谢;N. 柠 檬酸循环(TCA循环);O. 戊糖和葡萄糖醛酸转化;P. 溶酶体; Q. 甘氨酸, 丝氨酸和苏氨酸代谢图6 差异表达蛋白质KEGG通路分析 A. Regulation of actin cytoskeleton; B. Apoptosis; C. Proteasome; D. Carbon metabolism; E. Carbon fixation in photosynthetic organisms; F. Butanoate metabolism; G. Pentose phosphate pathway; H. Cysteine and methionine metabolism; I. Biosynthesis of amino acids; J. Galactose metabolism; K. Protein processing in endoplasmic reticulum; L. Pyruvate metabolism;M. Glyoxylate and dicarboxylate metabolism; N. Citrate cycle (TCA cycle); O. Pentose and glucuronate interconversions; P. Lysosome; Q. Glycine, serine and threonine metabolismFig.6 KEGG pathways analysis of differential expression proteins
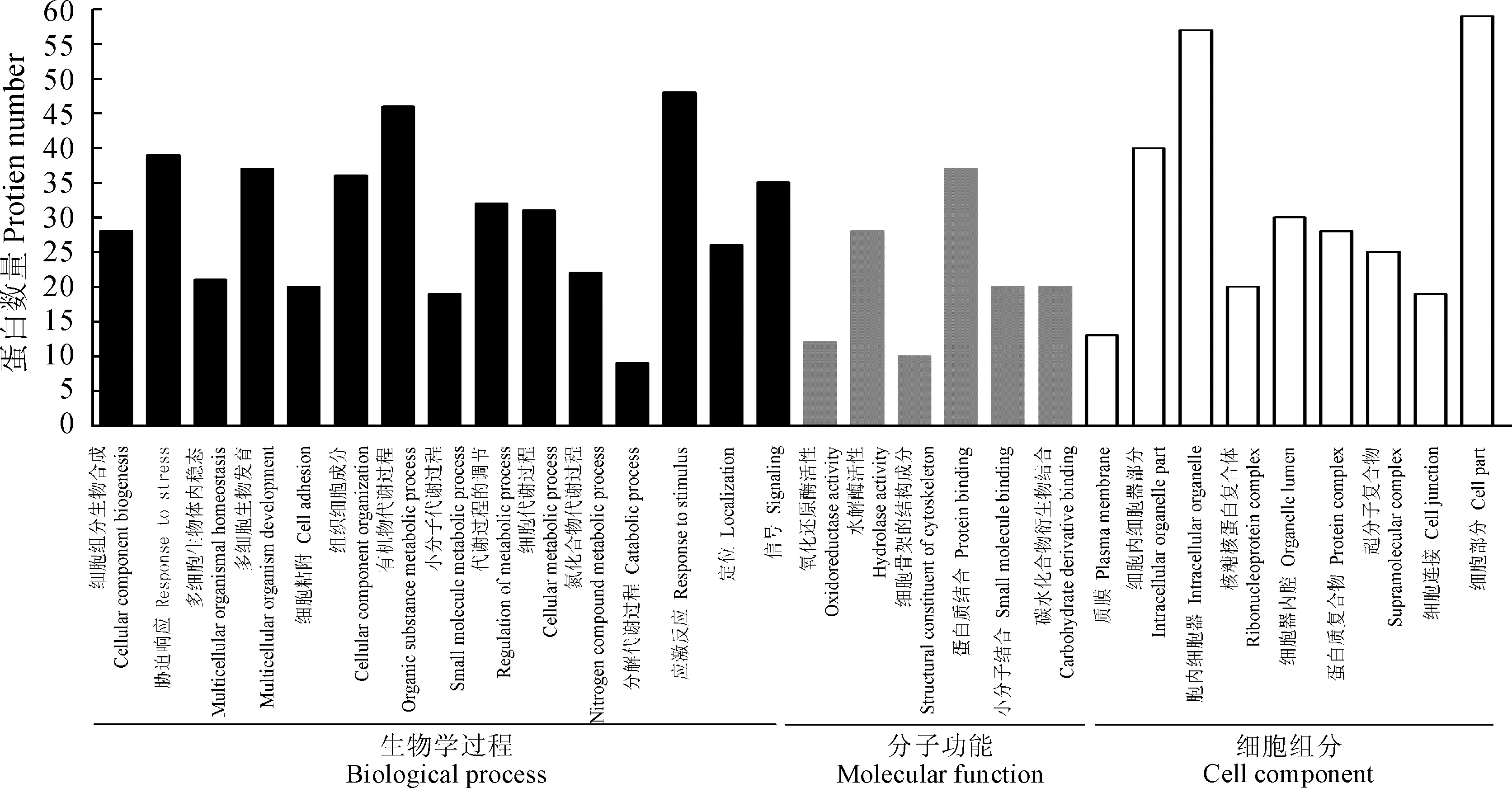
图5 差异表达蛋白的GO注释分析Fig.5 GO annotation analysis of differential expressed proteins
2.5 差异蛋白质层次聚类分析
将成功鉴定的差异蛋白质根据表达丰度进行聚类分析,使具有相似丰度变化模式的蛋白质分在同一组中,可以得到不同处理条件的黄瓜叶片蛋白质丰度变化的综合概述。通过聚类分析,可将26个蛋白质分为3组,Ⅰ组中包含5个蛋白质,除叶绿体磷酸-2-脱氢-3-脱氧庚酸醛缩酶2(蛋白点16)外,均在对照组(CK组)中表达量最高,在NaCl组(T组)中表达量最低,而在NaHS组(S组)中表达量略低于对照组,分别参与植物的信号转导(1个)、蛋白质代谢(1个)、抗氧化作用(1个)、氨基酸生物合成(1个)和细胞结构相关蛋白(1个);Ⅱ组中包含13个蛋白质,在NaCl和NaHS处理后表达量均有升高,分别参与植物的碳水化合物及能量代谢(2个)、蛋白质代谢(5个)、光合作用(2个)、氨基酸生物合成(1个)和未知功能蛋白质(3个);Ⅲ组中包括8个蛋白质,均在NaCl组(T组)表达量最高,主要参与植物光合作用(5个)、碳水化合物及能量代谢(1个)、氨基酸生物合成(1个)和细胞结构相关蛋白(1个)(图 7)。由此可知,盐处理会改变一些蛋白质的表达,NaHS处理会增强或减弱某些蛋白质的表达。
3 讨 论
3.1 光合作用相关蛋白
光合作用是绿色植物吸收光能,同化CO2和H2O,制造有机物质并释放氧气的过程,是地球上最重要的化学反应[25]。核酮糖-1,5-二磷酸羧化/加氧酶(ribulose-1,5-bisphosphate carboxylase/oxygenase)是植物进行光合作用羧化阶段固定CO2的关键酶,广泛存在于叶绿体中,肩负着光反应CO2固定和暗反应CO2释放的双重功能,对光合作用的效率有着非常重要的意义[26]。有研究认为黄瓜叶片在低温弱光下光系统Ⅰ铁硫蛋白(PsaC)的抑制效应并不引起PSⅡ损伤,而是会引起PSⅠ的失活[27]。本研究共鉴定到7种与光合作用相关的蛋白质,包括叶绿体二磷酸核酮糖羧化酶小亚基(蛋白点1和12)、叶绿体磷酸核酮糖激酶(蛋白点5)、叶绿体亚型X2蛋白质HHL1(蛋白点6)、碳酸酐酶2亚基X2(蛋白点11)和叶绿体茎环结合蛋白41 kD a型(蛋白点30和31)。其中有6个蛋白质(蛋白点1、5、6、12、30和31)均上调表达,只有蛋白点11下调表达。卡尔文循环是光合作用中碳反应的一部分,吸收的光能用于NADP+的光催化还原,建立质子梯度驱动ATP产生。卡尔文循环则利用能量(以ATP和NADPH的形式)将二氧化碳和水转化为生物体使用的有机化合物[28-29]。二磷酸核酮糖羧化酶是催化1,5-二磷酸核酮糖和CO2生成二分子甘-3-磷酸甘油酸反应的酶。在本实验中叶绿体二磷酸核酮糖羧化酶小亚基上调表达,表明黄瓜幼苗通过降低活性氧的积累来缓解盐胁迫。叶绿体茎环结合蛋白41 kD a型是一种捕光复合物,在光合作用中作为光受体捕获或释放激发态光能,对促进光合作用十分重要。叶绿体茎环结合蛋白41 kD a型上调表达,该蛋白可能参与了黄瓜的盐胁迫响应,在细胞遭受盐胁迫时起应激保护作用。碳酸酐酶是可逆催化CO2和H2O转化为碳酸、质子和碳酸氢根离子的酶,可加速无机碳的形成, 为Rubisco活性位点更快提供底物[30]。在本研究中碳酸酐酶2亚基X2下调表达,表明NaCl处理会引起叶片气孔开度变小,从而造成叶肉细胞的CO2浓度下降,最终抑制了黄瓜的光合作用过程。
3.2 蛋白质代谢相关蛋白
本研究中参与蛋白质代谢相关的蛋白质包括二硫键异构酶片段(蛋白点2)、26S蛋白酶体调节亚基同源物6B(蛋白点4)、拟定线粒体3-羟基异丁酸脱氢酶1类似蛋白(蛋白点10)、叶绿体ATP结合亚基clp A同源物CD4B(蛋白点14)、延伸因子Ts(蛋白点20)、蛋白酶体α亚基6型(蛋白点28)。其中,二硫键异构酶是一种氧化还原酶,催化蛋白质二硫键的形成,并充当分子伴侣,也参与了蛋白质的折叠,帮助新生蛋白质正确折叠[31]。本研究鉴定的二硫键异构酶片段(蛋白点2)受盐胁迫的影响而上调表达,表明盐胁迫下,黄瓜幼苗通过增强蛋白质的代谢能力,来抵御盐胁迫下可能受到的伤害。延伸因子Ts(蛋白点20)是在mRNA翻译时促进多肽链延伸的蛋白质因子。在NaHS处理下,其表达量上升,可能是黄瓜幼苗通过增强蛋白质的翻译能力,来抵御环境胁迫带来的不利影响。
3.3 能量及碳水化合物代谢相关蛋白
已有研究表明植物受到盐胁迫后,一些基础代谢,如能量代谢受到影响,通过建立一个新的平衡以抵抗外界环境[32]。植物能量代谢主要包括呼吸底物降解、呼吸链的运转和氧化磷酸化3个过程,其中呼吸底物的降解包括糖酵解、三羧酸循环、无氧呼吸、磷酸戊糖途径等多条途径[33]。本研究中鉴定出与能量及碳水化合物代谢相关的蛋白质 3个,即线粒体琥珀酸脱氢酶亚基5(蛋白点3)、成膜体定向驱动蛋白2(蛋白点26) 、假定葡萄糖-6-磷酸-1-差向异构酶(蛋白点27)。有研究表明,对拟南芥盐胁迫处理后取其根部,进行蛋白质组学研究,发现果糖-1,6-二磷酸醛缩酶的蛋白含量明显增加[34]。盐胁迫下,植物可通过增加碳水化合物的合成代谢来缓解盐胁迫,这些过程需要消耗大量的能量。在鉴定出的蛋白点26和27合成均增加,从蛋白水平表现为上调,该类蛋白质在黄瓜响应盐胁迫过程中具有调控作用。琥珀酸脱氢酶(succinate dehydrogenase, SDH)是一种酶复合物,能够同时参与柠檬酸循环和电子传递链的酶,存在于许多细菌细胞和真核生物的线粒体内膜中[35]。在柠檬酸循环的步骤中,SDH催化琥珀酸盐氧化成富马酸盐,同时将泛醌还原成泛醇。在三羧酸循环途径中,其是碳水化合物代谢的一部分。本研究中,琥珀酸脱氢酶亚基5合成降低,表明NaCl处理后,影响了黄瓜幼苗的碳水化合物代谢过程,最终表现为植株生长受到抑制。
3.4 氨基酸生物合成相关蛋白
组成蛋白质的大部分氨基酸是以埃姆登-迈耶霍夫(Embden-Meyerhof)途径与柠檬酸循环的中间物为碳链骨架生物合成的。本研究中有3个蛋白质被鉴定与氨基酸生物合成有关,包括开环异落叶松脂素脱氢酶类似蛋白(蛋白点7)、乙酰鸟氨酸脱乙酰基酶类似蛋白(蛋白点15)和叶绿体磷酸-2-脱氢-3-脱氧庚酸醛缩酶2(蛋白点16)。沈云等[36]研究表明,开环异落叶松脂素脱氢酶(secoisolariciresinol dehydrogenase, SDH)是鬼臼毒素生物合成途径中的一个关键酶,它能够特异性的催化反式构型的开环异落叶松脂素氧化脱氢生成相同构型的马台树脂醇,从而进行下一步的生物合成。该研究中蛋白点7表达上调,表明盐胁迫下,黄瓜幼苗会提升脱氢酶相关蛋白质的表达,以降低高盐的伤害。乙酰鸟氨酸脱乙酰酶属于水解酶家族,其作用于除肽键之外的碳-氮键,特别是线性酰胺中的碳-氮键。该酶类的系统名称是N(2)-乙酰基-L-鸟氨酸酰胺水解酶,参与尿素循环和氨基代谢。该蛋白质参与N(2)-乙酰基-合成L-鸟氨酸的亚途径,其本身是氨基酸生物合成的一部分。本研究中,乙酰鸟氨酸脱乙酰基酶类似蛋白(蛋白点15)表达下调,导致鸟氨酸合成降低,作为尿素循环的一部分,其在代谢上具有重要的作用。磷酸-2-脱氢-3-脱氧庚酸醛缩酶2(蛋白点16)是由D-赤藓糖-4-磷酸和磷酸烯醇丙酮酸合成的分支酸,是色氨酸活性调节物(滞后因子),其本身是代谢中间体生物合成的一部分。色氨酸是植物体内生长素生物合成重要的前体物质,在高等植物中普遍存在。该蛋白作为氨基酸代谢中参与次级代谢的蛋白质,对研究H2S缓解盐胁迫具有重要意义。
3.5 细胞结构相关蛋白
本研究鉴定到2种与细胞结构相关的蛋白质,包括多聚半乳糖醛酸酶类似蛋白(蛋白点8)和肌动蛋白类似蛋白(蛋白点18)。多聚半乳糖醛酸酶(polygalacturonase,PG)作为一种重要的细胞壁降解酶,参与植物生长发育的多个生理过程,如器官的脱落、种子发育、荚果裂开、果实的成熟软化和幼苗下胚轴伸长等[37]。肌动蛋白是细胞的一种重要骨架蛋白,在细胞运动、细胞分裂、基因表达和信息传递、能量转换以及维持细胞形态等方面都具有重要作用[38]。在高盐胁迫期间,蛋白点8和18的大量表达,对于细胞快速分裂,维持细胞形态以及运动等生命活动可能起到重要作用。
3.6 抗氧化作用相关蛋白
在逆境胁迫下,植物体会产生一些有害的化学物质,导致自身受损,自由基、活性氧是最常见的逆境有害物质。活性氧的性质极其活泼,能够与一切植物体内的生物大分子反应,从而破坏其活性构象,扰乱细胞正常代谢。但细胞中也存在着超氧化物歧化酶、过氧化物酶、过氧化氢酶等保护酶,可在干旱胁迫下清除活性氧,维持代谢平衡,保护膜结构[39]。相关研究表明,提高植物体内抗氧化酶类代谢的水平是增强植物抗逆性的途径之一[40]。本研究鉴定的过氧化物酶(Cu2+)片段(蛋白点19)蛋白质在高盐胁迫条件下的表达量增加,对提高植物的抗逆性具有重要意义。
3.7 信号转导相关蛋白
黄瓜通过信号感受器官感受外界的高盐刺激,然后把信号传递到细胞核内,从而关闭或启动一些相关基因表达以达到抵御胁迫的目的。在植物中,G蛋白是活细胞内一类具有重要生理调节功能的蛋白质,它参与调控气孔运动[41]和植物光信号转导[42]等多种跨膜信号的转导。本研究发现了1种与信号转导相关的蛋白质—鸟嘌呤核苷酸结合蛋白α-1型亚基(蛋白点21),是一种G蛋白衍生物。它与细胞信号传导、细胞周期有关,对促进细胞分裂增殖也起着重要的作用。
本研究采用丙酮/TCA沉淀法提取黄瓜叶片的总蛋白质,分辨率较高且蛋白分离效果好,可以满足2-DE的条件。利用MALDI-TOF/TOF-MS进行质谱鉴定,其中26个蛋白质成功鉴定,8个蛋白质因匹配率太低而未得到鉴定,23个蛋白质可确定其生物学功能。从表中可以看出,蛋白点1和12都为叶绿体二磷酸核酮糖羧化酶小亚基,蛋白点30和31都被鉴定为叶绿体茎环结合蛋白41 kD a型,这些蛋白质在胶上的分布位置不同,但分别被鉴定为相同蛋白,有的分子量相近或等电点相近,可能是同一个家族蛋白的不同形式,也可能与蛋白质转录翻译后存在修饰有关,如蛋白酶降解、糖基化和磷酸化修饰等结果造成的。
植物在盐胁迫下蛋白质的表达会发生变化,利用质谱鉴定技术和数据库检索可以对这些蛋白质可能的功能以及与植物抗盐性的关系进行预测。本研究中,经NaCl处理后,与光合作用相关(蛋白点1、5、6、12)、蛋白质代谢相关(蛋白点2、4、10)及氨基酸生物合成(蛋白点7)相关的蛋白质表达均上调,表明黄瓜幼苗会提高一些蛋白质的表达以抵御盐胁迫带来的伤害。与对照组相比,施加NaHS(H2S供体)后,与光合作用相关(蛋白点30、31)、能量及碳水化合物相关(蛋白点26、27)的蛋白质也表达上调,结果与形态测定相一致,黄瓜幼苗通过增加光合与能量代谢来缓解盐胁迫。下一步将在巩固黄瓜幼苗叶片双向电泳体系和图像分析技术的基础上,建立针对凝胶蛋白质进行质谱分析的制样方法,进一步对差异蛋白质进行质谱分析和同源蛋白鉴定,探索NaHS处理后对盐胁迫下黄瓜幼苗蛋白质表达的影响机制,为进一步的功能研究以及基因的表达奠定基础。
