一种改良的简易灌注分离小鼠肝细胞的方法
2018-02-13
(北京大学人民医院药剂科,北京 100044)
肝脏是人体重要的代谢器官之一,可参与多种生理病理过程[1-6]。在肝脏行使的诸多功能中,肝细胞发挥了主要作用,原代培养的肝细胞更接近于机体内环境,因此成为许多体外实验的选择,但肝细胞的分离技术要求高、原代培养的肝细胞增殖能力差,不容易成功。两步灌流法是分离肝细胞的经典方法[7],该方法分离得到的细胞数量多、存活率及纯度也较高,但该方法所需的灌流装置复杂,操作技术要求高,耗时长,而且不适宜小鼠的肝细胞分离。近年来有文献报道的Ⅳ型胶原酶消化法分离小鼠肝细胞,是一种不经血液灌流的酶直接消化法[8-9],该方法简单易行,但与传统的灌流法相比,收获的肝细胞数量减少、纯度不够高。因此,建立一种简单易行、高效的分离培养纯化肝细胞的方法十分重要。本研究采用改良的简易两步灌注法分离小鼠肝细胞,并进行原代培养,旨在为肝细胞相关课题的研究奠定基础。现将结果报告如下。
1 材料与方法
1.1 实验动物
4~12周龄C57小鼠60只,雌雄不限,由北京大学医学部动物部提供。
1.2 主要实验试剂及器材
实验所用试剂主要包括高糖DMEM(美国HYCLONE公司);鼠尾胶原(美国MILLIPORE公司);胎牛血清(FBS,美国GIBCO公司);Ⅳ型胶原酶(美国GIBCO公司)等。实验相关器材主要包括0.45 mm头皮针、200目尼龙细胞筛等。
1.3 肝细胞分离及纯化
以3 g/L戊巴比妥钠10 mL/kg体质量腹腔注射麻醉小鼠,为防止麻醉过深致术中小鼠死亡而使肝脏凝血,可在麻醉后立即腹腔注射0.05 mL肝素;麻醉后固定小鼠,乙醇消毒皮肤,依次剪开皮肤、皮下组织并充分暴露肝门静脉,肝门处筋膜少无需剥离,经肝门静脉穿线备用;用眼科剪在门静脉处剪一“V”字形切口,棉球短暂压迫止血,立即插入头皮针(连接装有20 mL灌流液注射器),动脉夹固定头皮针,再将已穿好的线结扎以防头皮针滑脱;固定头皮针针头后,可用镊子固定灌流管路以防通路扭曲产生气泡或推注时针头扭动而刺破门静脉;缓慢推入D-Hank’s灌流液(无需预热,室温即可),待肝脏逐渐膨涨并变白时剪断下腔静脉使灌流液流出,再夹闭下腔静脉继续推入灌流液,待肝脏再次膨胀后松开夹闭的下腔静脉使灌流液流出,如此反复循环2~3次,可将肝脏内的血液灌净,整个过程约需10 mL灌流液,大约推注5 min;灌流结束后将注射器里换成预热的胶原酶,推注速度略慢,肝脏膨胀后夹闭下腔静脉,静止0.5~1.0 min使酶充分发挥消化作用,再松开下腔静脉时,肝脏塌陷速度减慢,如此循环2~4次后肝脏塌陷,表面出现裂痕,有明显的肝小叶轮廓,此时可停止消化;小心取下肝脏,置入装有15 mL预冷DMEM的玻璃皿中漂洗,小心剥除胆囊、结缔组织等成分后;再将肝脏置入另一个装有15 mL预冷DMEM的玻璃皿中,将肝脏放在200目细胞筛上,微微倾斜玻璃皿,用眼科镊轻轻剥离肝包膜,可见肝脏逐步变为“烂泥状”,夹住肝门处结缔组织并在筛子上轻轻甩动肝脏,靠筛子的摩擦力将肝细胞过滤到细胞筛下面的玻璃皿中,最后再用数毫升DMEM冲洗筛子上残余的肝细胞;将含有细胞悬液的DMEM液体置入15 mL离心管中,室温静止5~8 min,一般可收获2~4 mL细胞沉淀,吸掉上清液,加入预冷的DMEM,重悬细胞,再次室温静止5~8 min以纯化细胞。
1.4 肝细胞培养
将37 ℃预热的完全培养基(含体积分数0.10 FBS的高糖DMEM)加入到已纯化的细胞沉淀中,重悬细胞并混匀以进行细胞计数,调整肝细胞悬液的细胞密度,按每孔1×106个细胞接种于铺有鼠尾胶原的6孔或12孔培养板中,在倒置显微镜下动态观察细胞的形态后,置于37 ℃的CO2培养箱中培养。4 h细胞贴壁后进行细胞换液,用吸量管或枪头用力吹打细胞,以将杂质吹下。弃培养液,吸净,直接加入37 ℃预热的新鲜培养液培养细胞,以后每24 h换液1次,细胞可存活10 d以上。
2 结 果
小鼠肝脏经以上改良的简易两步灌注法消化后,可获得分散较好的单个细胞,每只小鼠获得的肝细胞数量约为2.5×107个,细胞呈圆形、透明,包膜完整而清晰;取经3次洗涤后的肝细胞悬液加入等量锥虫蓝染液混合染色数秒钟后,滴于玻片,置显微镜下行活细胞记数,低倍镜下可见活细胞呈光亮圆形,饱满,透光度好,胞核清晰,锥虫蓝染色观察,消化后所得的细胞较少着色,细胞成活率可达85%以上。细胞培养4 h大约90%以上的肝细胞贴壁(图1),贴壁的肝细胞呈典型的黏附聚集生长,细胞由贴壁前的圆形转变为多边形,胞体变平变薄,明显增大。胞浆丰富,胞核呈圆形或椭圆形,单核或双核。细胞可稳定贴壁7~10 d(图2~3),贴壁期间细胞成活率仍大于85%,7~10 d后细胞陆续出现脱颗粒、死亡。
除细胞成活率外,研究还显示,小鼠肝细胞原代培养到第1、3、5、7和10天时均能够分泌白蛋白,细胞培养液内检测到的白蛋白的浓度分别为(1.87±0.13)、(1.98±0.32)、(3.45±0.21)、(4.12±0.15)与(3.53±0.19)g/L。结果表明分离培养的肝细胞功能良好,可用于后续实验。
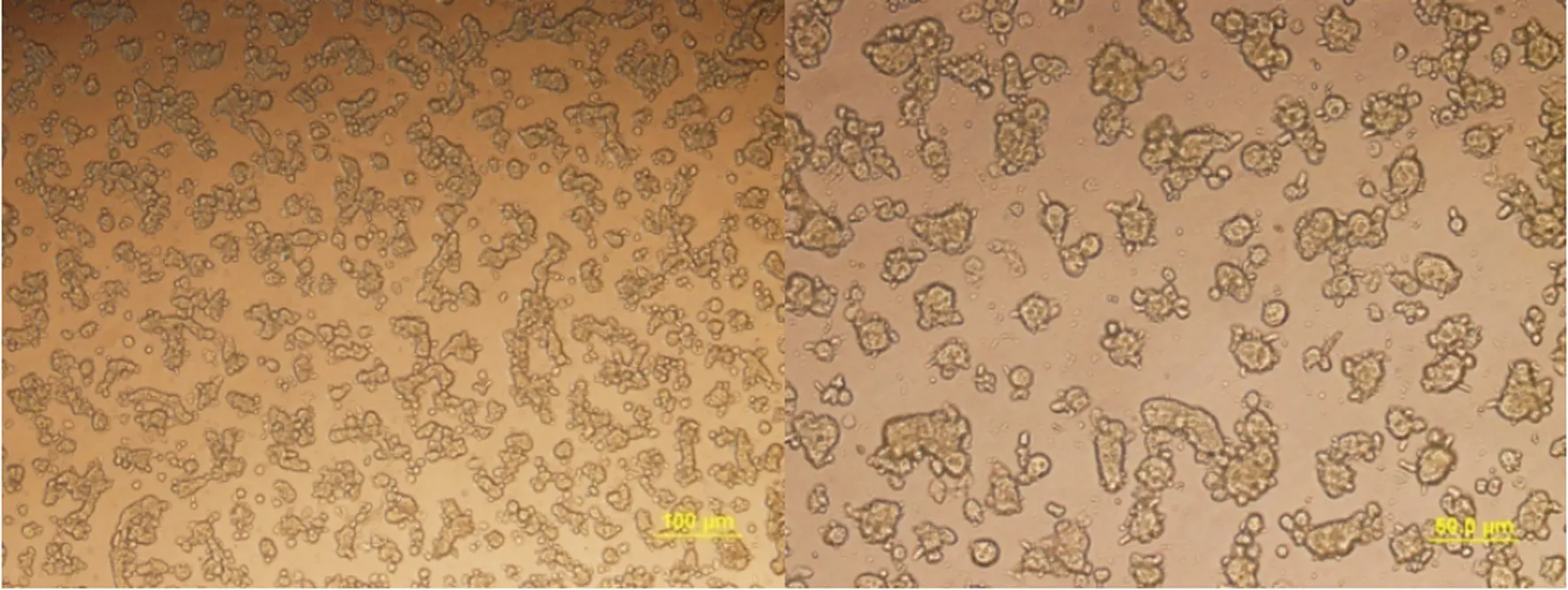
图1 肝细胞培养4 h后的形态
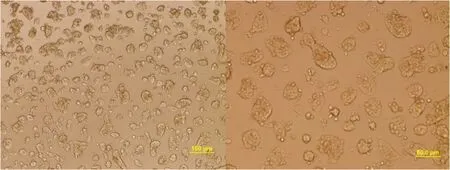
图2 肝细胞培养7 d后的形态
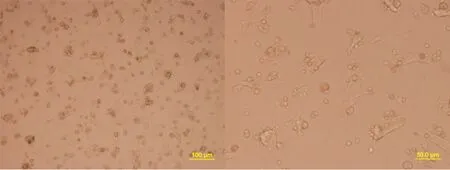
图3 肝细胞培养10 d后的形态
3 讨 论
原代培养的肝细胞是一种应用广泛的细胞模型,因其更接近体内环境,可更好地模拟体内细胞的功能,常用于药理学、分子生物学等诸多领域的相关研究[10-16]。本课题组通过长期摸索、反复实验,结合以往经典的二步灌流法[7]和Ⅳ型胶原酶直接消化法,设计了一种操作简单、省时、高效的简易灌注分离小鼠肝细胞的方法,现将经验总结如下。
3.1 小鼠的选择
C57是近交系动物,与封闭群相比,个体之间差异小,对实验反应一致,动物品种的具体选择应根据实验需求。小鼠的性别,原则上雌雄不限,但同组实验,尽量保证性别前后一致,以求实验结果的稳定。8~10周龄的小鼠是相当于成年状态,大小合适,低于4周龄的年龄偏小,门静脉细,不易插管;高于12周龄的小鼠,年龄偏大。但具体情况应根据实验需求而定,根据本课题组的经验,4~12周龄的小鼠都可以采取本方法获取较多的肝细胞。
3.2 培养基的选择
分离肝细胞时使用的培养液,最好用4 ℃预冷的DMEM(不含FBS),因低温对肝细胞有保护作用,最后培养细胞及换液时所需的培养液,要使用37 ℃预热的完全培养液。预先用“胶原蛋白”处理的培养皿,细胞贴壁效果更好。
3.3 灌流及消化过程中注意的问题
门静脉插管和胶原酶消化,是本方法的核心要素。0.45 mm的头皮针连接上装有20 mL灌流液的注射器后,首先应将管道的气泡排净,以防气泡进入肝脏导致灌流不全;将头皮针的针头稍微摩钝,以防插管时将肝门静脉刺破;用剪刀将头皮针的针柄剪出划痕,以增加固定时的摩擦力,防止滑脱。Ⅳ胶原酶应现用现配,使用HBSS液配制,浓度为1 g/L(不同批次胶原酶活力略有差异,浓度一般1 g/L),使用前,置于37 ℃水浴锅预热30 min~1 h,酶的活力更佳。
3.4 肝细胞的功能检测
本研究结果显示,经此简易灌注法分离的小鼠肝细胞可稳定贴壁7~10 d,贴壁期间细胞存活率可达85%以上,与传统方法相似[17]。通过检测培养液上清中的白蛋白的分泌情况,判断肝细胞的生物学活性和功能,结果表明本研究分离培养的肝细胞功能良好,可用于后续实验,白蛋白分泌量随着培养天数的增加而增加,培养至第7天时分泌量达高峰,随后逐渐下降,在培养的3~10 d左右为肝细胞原代培养的最佳实验阶段。成纤维细胞污染通常是导致肝脏上皮细胞培养失败的主要原因,本方法采取的简易灌注法首先在灌注胶原酶后可使肝脏充分消化;其次在停止消化后,小心剥除胆囊、结缔组织等成份,并将肝包膜撕除干净,以上措施均可很大程度上防止成纤维细胞的混杂生长。
综上所述,这种简易的灌流方法,与SEGLEN等[7]的方法相比,不需要特殊的复杂装置,与王宇明[18]简易灌流法相比,灌流装置由输液管改为注射器,手动推入,更易根据灌流情况掌控推入速度。此外,本实验的创新点还在于收集细胞时不使用离心法,而采取室温静置数分钟的方法,笔者对比了离心法和静置法收集肝细胞的数量差异,室温静置法收集的肝细胞数量明显高于离心法,可能是由于新分离的肝细胞较为脆弱,离心法会增加肝细胞的破损。根据本课题组的摸索,此方法同样适用于大鼠肝细胞的分离及原代培养[19],更换大号头皮针、适度增加灌流量、增加酶的消化时间即可,其他步骤同上。原代肝细胞已成经为科学研究中应用越来越广泛的细胞模型[20-22],期望本课题组探索的简易两步灌注法分离小鼠肝细胞,能被更多的实验室采纳应用。
