超高效液相色谱-串联质谱法同时测定5 个产地花椰菜和西兰花中的23 种酚酸类化合物
2018-02-09王纪华冯晓元
马 帅,王纪华,高 媛,王 蒙*,冯晓元*
(北京农业质量标准与检测技术研究中心,农业部农产品质量安全风险评估实验室(北京),农产品产地环境监测北京市重点实验室,北京 100097)
花椰菜(Brassica oleracea L. var. botrytis L.)又称花菜、菜花或椰菜花,花椰菜为十字花科芸苔属一年生植物。西兰花(B. oleracea L. var. italica)又名绿菜花、青花莱、嫩茎花椰菜,属十字花科芸苔属甘蓝种的一个变种,原产于意大利[1]。花椰菜和西兰花中含有酚酸类化合物、类胡萝卜素、矿物质元素和纤维素等多种功能性物质,其中酚酸类化合物尤其重要,其抗氧化能力高于VC、VE和类胡萝卜素等[2-3]。此外,已有研究表明花椰菜和西兰花中含有丰富的抗癌物质[4-5],平均营养价值及防病作用超出其他蔬菜,对人体健康有重要作用。
酚酸是指结构中带有酚类基团的有机酸,约占植物源食品中酚类化合物的1/3,多为苯甲酸和肉桂酸的羟化衍生物,主要以游离和束缚形式存在[6]。酚酸广泛存在于蔬菜、水果、豆类等植物中,近年来,大量研究表明酚酸类成分具有抗氧化、抗癌、抗炎、抗菌等生理活性作用,对防御紫外线辐射和降低多种疾病的发生等效果显著[7-9]。
目前,文献报道对于酚酸的质量评价分析方法主要有毛细管电泳法[10]、薄层色谱法[11]、液相色谱-质谱联用法[12]、气相色谱-质谱联用法[13]和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[14-15]等。在酚酸各种分析方法中,毛细管电泳法和薄层色谱法所费时间较长,一般要几到几十小时;采用气相色谱技术检测时,需先对酚酸物质衍生后再测定,酚酸沸点较高且不容易气化,过程相对繁琐。超高效液相色谱(ultra performance liquid chromatography,UPLC)比高效液相色谱(high performance liquid chromatography,HPLC)具有分离效果好、灵敏度高和峰容量大等优点;MS/MS法可以给出每一个组分的相对分子质量和丰富的结构信息,比MS灵敏度及选择性均显著提高,同时可以降低基质干扰和信噪比,测定结果更加准确可靠。UPLC-MS/MS采用多重反应监测(multiple reaction monitoring,MRM)模式进行定量分析,具有分离效率高、分析速度快、结果准确等特点,更适于多种酚酸的分离分析,在近几年得到了快速的发展。方玲玲等[16]建立了UPLC-MS/MS技术同时检测樱桃酒中没食子酸、4-羟基苯甲酸、绿原酸、香草酸和咖啡酸5 种生物活性酚酸的方法,该方法简便、快速、准确、灵敏,可用于樱桃酒中酚酸的检测。罗益远等[17]采用UPLC-MS/MS法测定何首乌中的酚酸。艾鑫卫等[18]采用HPLC-MS/MS法测定各生长期紫苏中酚类物质的含量。张娜等[19]通过超高效液相色谱法分析稻米酚酸化合物组分及其含量,该方法简便、快速、准确、可靠,不仅适合稻米中酚酸化合物的含量测定,而且对于其他谷物中酚酸化合物含量的测定也具有一定参考价值。谢越等[20]采用HPLC法同时测定滁菊样品中的9 种酚酸。目前,关于UPLC-MS/MS法花椰菜和西兰花中酚酸类化合物测定的报道较少。本研究通过对UPLC-MS/MS条件的优化,建立了UPLC-MS/MS同时测定花椰菜和西兰花中23 种酚酸类化合物的分析方法,并采用该方法对5 个不同产地的花椰菜和西兰花样品进行分析测定和比较,以期为花椰菜和西兰花功能营养评价及保健新品种开发提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
花椰菜和西兰花样品采集于北京、杭州、武汉、重庆和广州5 个产地,每个产地选取5 个有代表性的采样点,将5 份样品等比例混合为一份样品(表1)。

表1 西兰花、花椰菜的采样记录Table1 Information about vegetable samples tested in this study
酚酸标准品:没食子酸、香豆酸、3,5-二羟基苯甲酸、新绿原酸、3,4-二羟基苯甲酸、2,3,4-三羟基苯甲酸、D-(-)-奎宁酸、绿原酸、4-羟基苯甲酸、2,5-二羟基苯甲酸、咖啡酸、香草酸、丁香酸、2,3-二羟基苯甲酸、鞣花酸、对香豆酸、芥子酸、阿魏酸、异阿魏酸、3-羟基肉桂酸、2-羟基肉桂酸、水杨酸、肉桂酸(纯度均大于97%) 美国Sigma-Aldrich公司;乙腈、甲醇(HPLC级) 美国Fisher公司;甲酸 (HPLC级)美国Sigma公司;抗坏血酸、氢氧化钠、盐酸(均为分析纯) 上海安谱公司。
1.2 仪器与设备
ACQUITY UPLC仪-Xevo TQ三重四极杆质谱仪(配MassLynx V.4.1软件) 美国Waters公司;BUCHI-R-210旋蒸蒸发仪 瑞士Büchi公司;A11分析研磨机、KS260摇床 德国IKA公司;Milli-Q超纯水机 美国Mimpore公司;ME104E电子天平 瑞士梅特勒公司;Vortex Genie 2多用途旋涡混合器 美国Scientific Industries公司;N-EVAP氮吹仪 美国Organomation公司;pHS-3C精密pH计 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 酚酸提取
1.3.1.1 样品研磨
取花椰菜和西兰花样品可食部位切成小块,使用研磨机液氮研磨为粉末,保存于-20 ℃备用。
1.3.1.2 游离型酚酸的提取
取2 g样品于50 mL离心管中,加入20 mL提取液(80%甲醇溶液含有1%抗坏血酸),涡旋振荡10 s,室温超声提取30 min,8 000 r/min离心5 min后将上清液转移至50 mL容量瓶中。重复上述提取步骤一次,合并上清液,定容至50 mL,混匀后,过0.22 μm滤膜,备用。
1.3.1.3 游离酯型酚酸的提取
取2 g样品于50 mL离心管中,加入20 mL提取液(80%甲醇溶液含有1%抗坏血酸),涡旋振荡10 s,室温超声提取30 min,8 000 r/min离心5 min后将上清液转移至100 mL旋蒸瓶中。重复上述提取步骤一次,合并上清液,于旋转蒸发仪减压浓缩至10 mL以内。转移浓缩液至100 mL离心管中,加入20 mL 4 mol/L NaOH溶液,冲入氮气密封。40 ℃气浴振荡避光水解2 h,后用4 mol/L HCl溶液调节pH 2,加入20 mL正己烷,室温振荡20 min,去除正己烷层。用20 mL乙酸乙酯萃取2 次,合并萃取液于旋蒸瓶中,在旋转蒸发仪上35 ℃减压浓缩至进干。用10 mL 50%甲醇溶液溶解,混匀后,过0.22 μm滤膜,备用。
1.3.1.4 结合型酚酸的提取
取1.3.1.3节步骤离心后的残渣,于100 mL离心管中,加入20 mL 4 mol/L NaOH溶液,冲入氮气密封。40 ℃气浴振荡避光水解2 h,后用4 mol/L HCl溶液调节pH 2,加入20 mL正己烷,室温振荡20 min,去除正己烷层。用20 mL乙酸乙酯萃取两次,合并萃取液于旋蒸瓶中,在旋转蒸发仪上35 ℃减压浓缩至进干。用10 mL 50%甲醇溶液溶解,混匀后,过0.22 μm滤膜,备用。
1.3.2 酚酸标准溶液的配制
分别准确称取23 种酚酸标准品各10 mg,用甲醇溶解并定容至10 mL,配制成1 mg/mL的各酚酸标准储备液,在-20 ℃保存,可以使用12 个月。酚酸混合标准工作液采用梯度稀释法现用现配。
1.3.3 UPLC-MS/MS分析
色谱柱:Waters Acquity UPLC HSS T3 column(2.1 mm×150 mm,1.8 μm),柱温45 ℃,样品室温度10 ℃,进样量5 μL,流动相为0.1%甲酸溶液(A)和0.1%甲酸-乙腈溶液(B),流速0.3 mL/min,采用梯度洗脱,0~0.5 min,95% A;0.5~5 min,95%~70% A;5~95 min,70%~10% A;9.5~9.75 min,10%~95% A;9.75~12 min,95% A(表2)。

表2 流动相梯度条件Table2 Gradient mobile phase for UPLC
采用电喷雾电离源,采用MRM模式进行检测,负离子模式扫描,离子源温度为150 ℃,脱溶剂气温度为500 ℃,去溶剂气流量为1 000 L/h,锥孔气流速为150 L/h。目标化合物的质谱分析参数见表3。
2 结果与分析
2.1 UPLC-MS/MS条件优化
酚酸类化合物分离的流动相体系主要包括甲醇-水和乙腈-水[21-22],实验考察两种不同流动相体系以及在流动相中添加甲酸对酚酸类化合物分离效果的影响。结果发现,采用乙腈作为流动相时的分离效果明显优于甲醇,在流动相中加入0.1%甲酸可减少色谱峰的拖尾,增强样品中待测物的保留,提高了分离效果和灵敏度。因此,本实验采用0.1%甲酸的乙腈溶液-0.1%甲酸溶液作为流动相。
在质谱条件优化中,考察正、负两种离子模式测定23 种目标化合物的响应特点。结果显示,23 种目标化合物在负离子模式下均有较强的响应,经反复实验,发现各目标成分在检测条件下具有良好的稳定性、较好的峰形和响应值。因此,选用负离子模式进行分析。
2.2 前处理条件优化
花椰菜和西兰花基质复杂,通常需要一定的前处理去除色素及其他干扰物以提高酚酸提取效率。目前对于酚酸类检测前处理主要有乙酸乙酯液液萃取法[23-24]和固相萃取法[25]。乙酸乙酯萃取主要是利用多酚在乙酸乙酯和水中的分配系数不同分离,该法为目前提取酚酸最为常用方法。HLB固相萃取法是一种基于反相保留的提取方法,并对各种极性非极性物质都有均衡吸附作用。固相萃取法相比于传统液液萃取法操作较为简便。研究对两种前处理方法进行比较,结果表明,乙酸乙酯萃取法的回收率高于固相萃取法,因此选用乙酸乙酯萃取法。
2.3 方法学考察结果
2.3.1 线性方程、检出限和定量限结果
精密吸取1.3.2节的混合对照品溶液,置于10 mL容量瓶中,依次逐级稀释,配制成一系列质量浓度的混合对照品溶液,按照1.3.3节的条件进行分析。以对照品的峰面积(Y)对相应质量浓度(X)进行线性回归,得到回归方程和线性相关系数。以各化合物信噪比为3时对应的质量浓度为最低检测限,结果见表4,23 种酚酸类化合物在1.0~500.0 μg/L范围内呈现良好的线性关系,相关系数(r2)均不低于0.992。混合对照品的色谱图见图1。
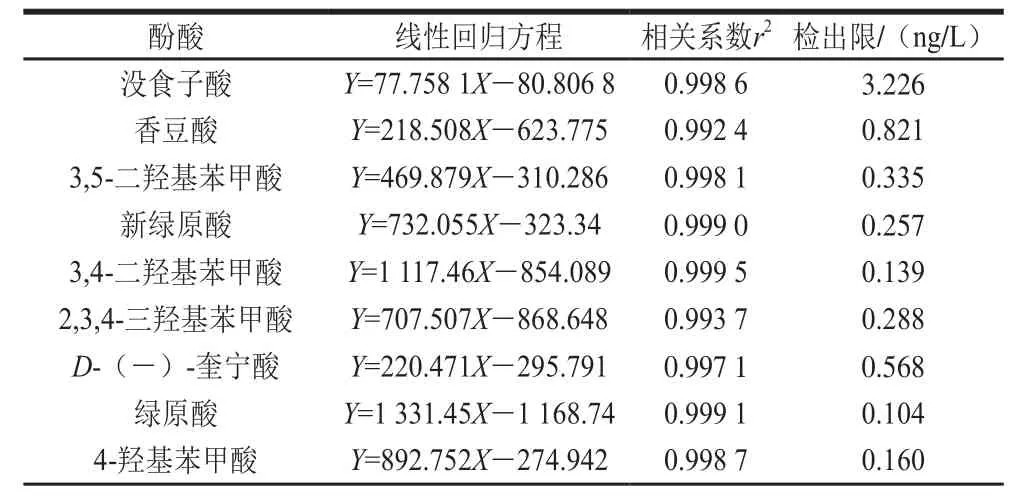
表4 目标化合物的线性方程、相关系数和检出限Table4 Linear equations, correlation coefficients (r2) and limits of detection(LODs) for target compounds
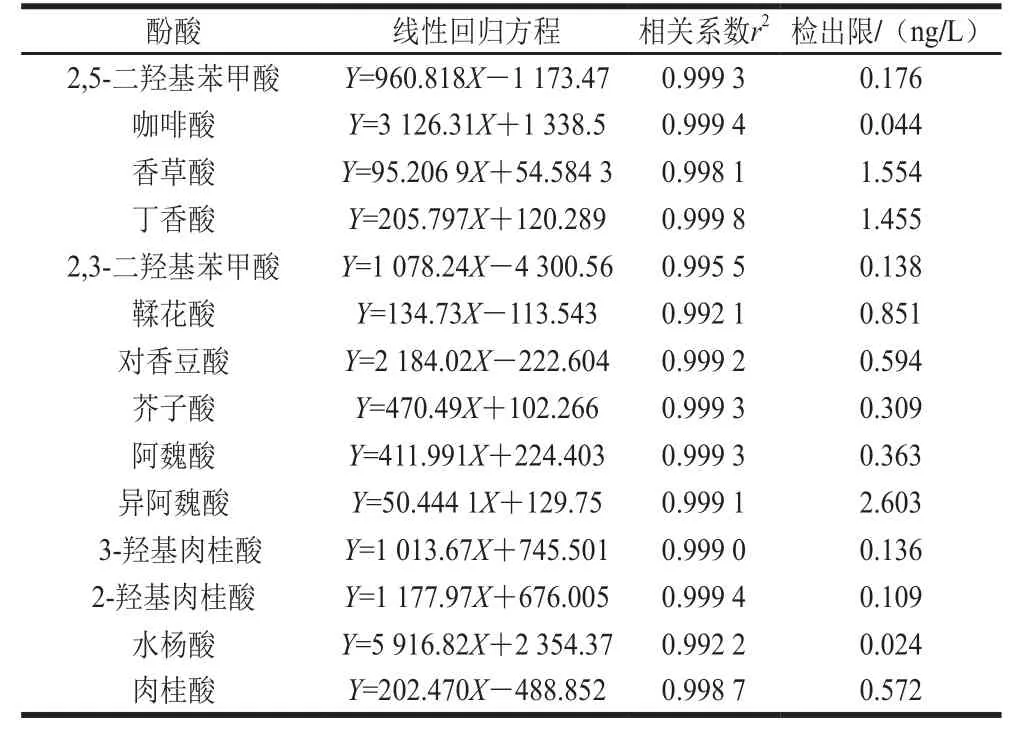
续表4
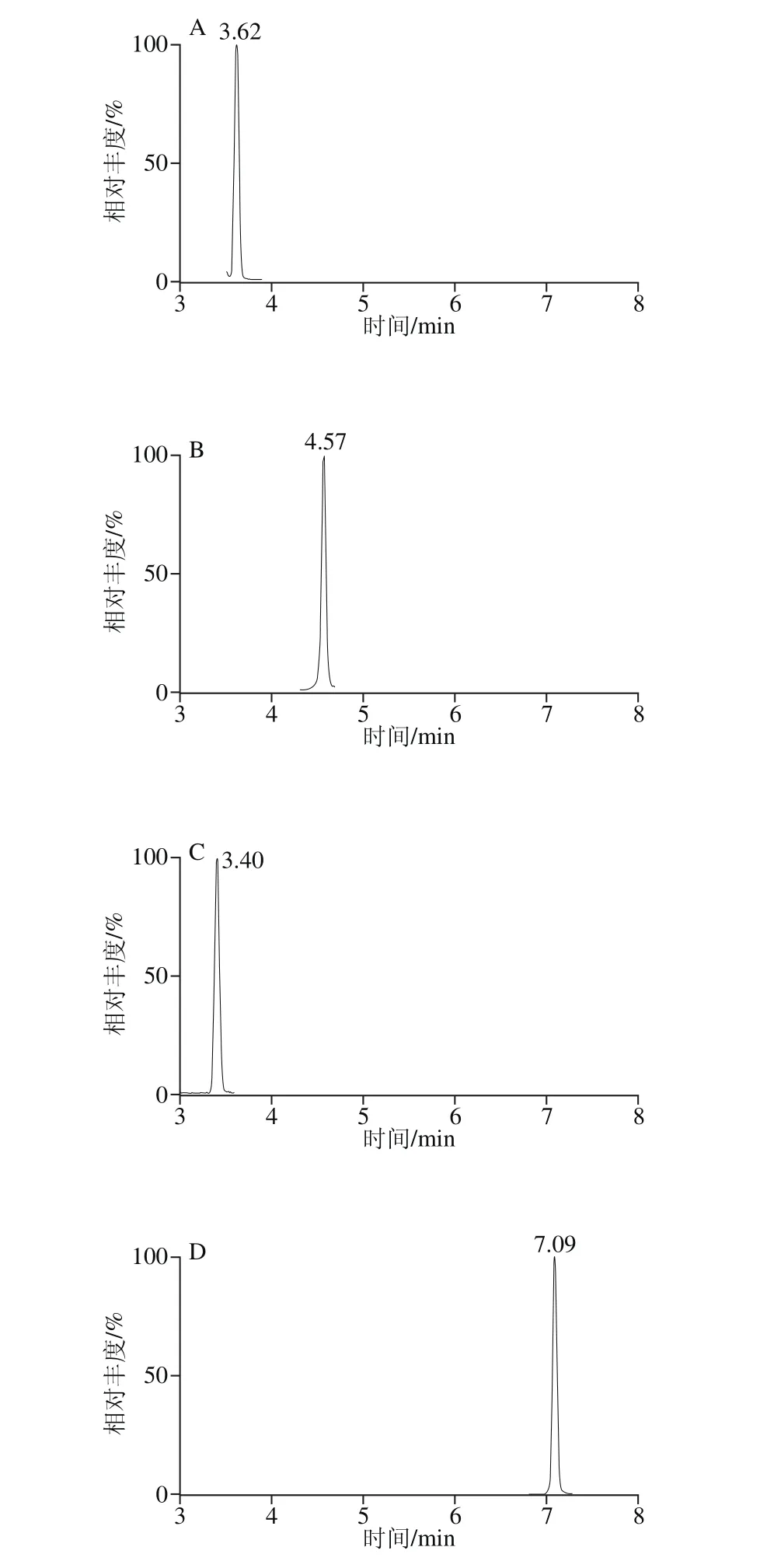
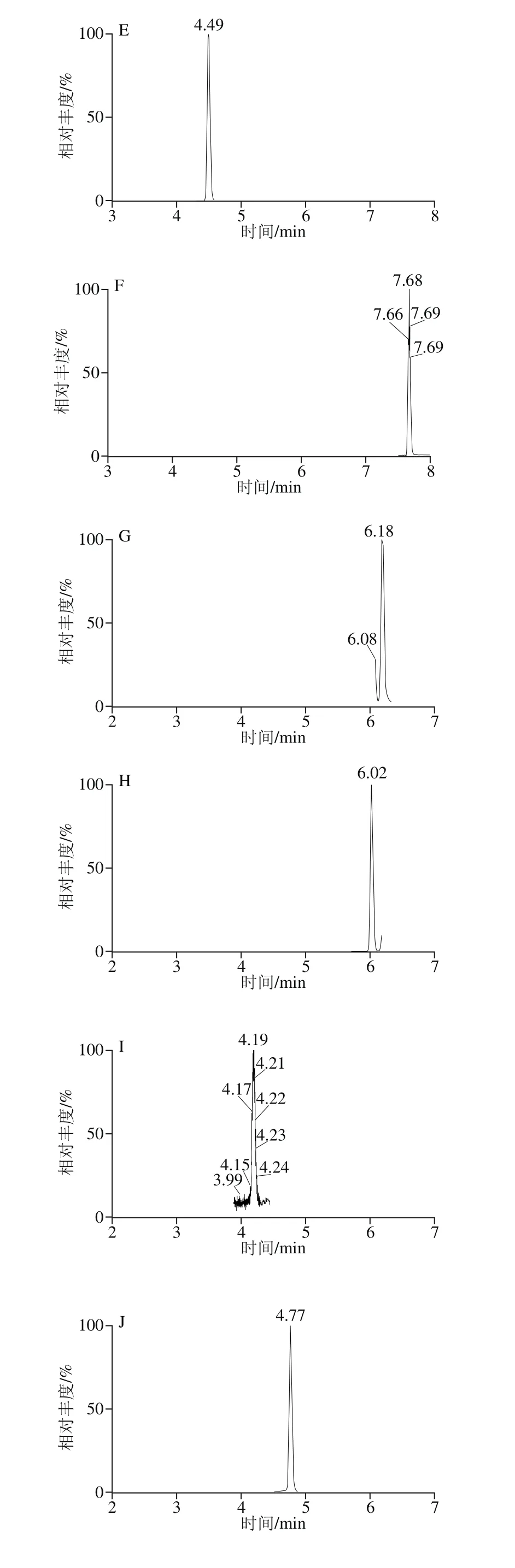
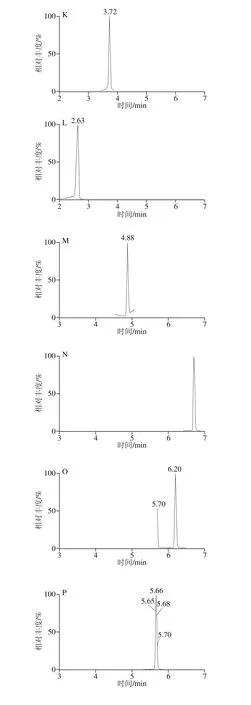
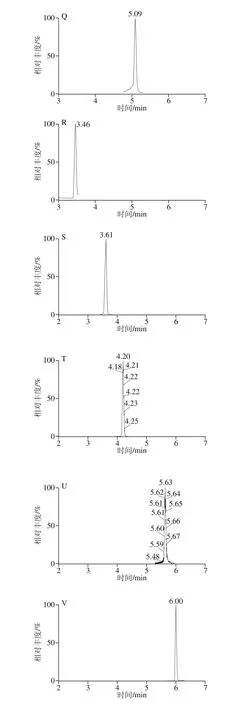
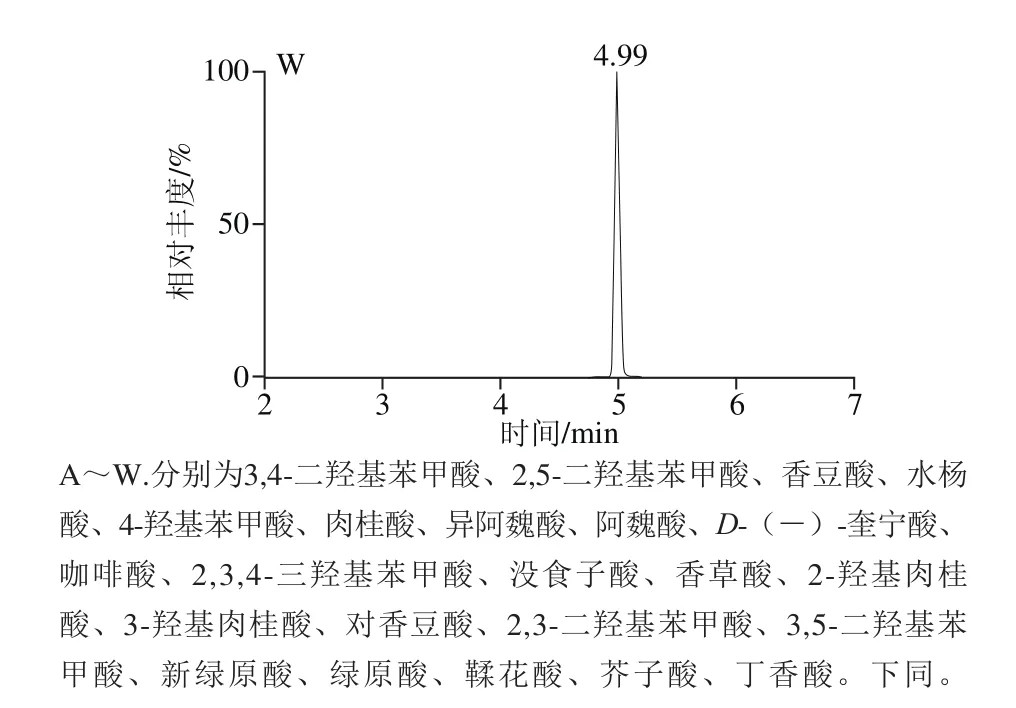
图1 23 种目标成分混合对照品的MRM色谱图Fig. 1 MRM Chromatograms of twenty-three components in reference substances
2.3.2 精密度、稳定性和重复性实验结果
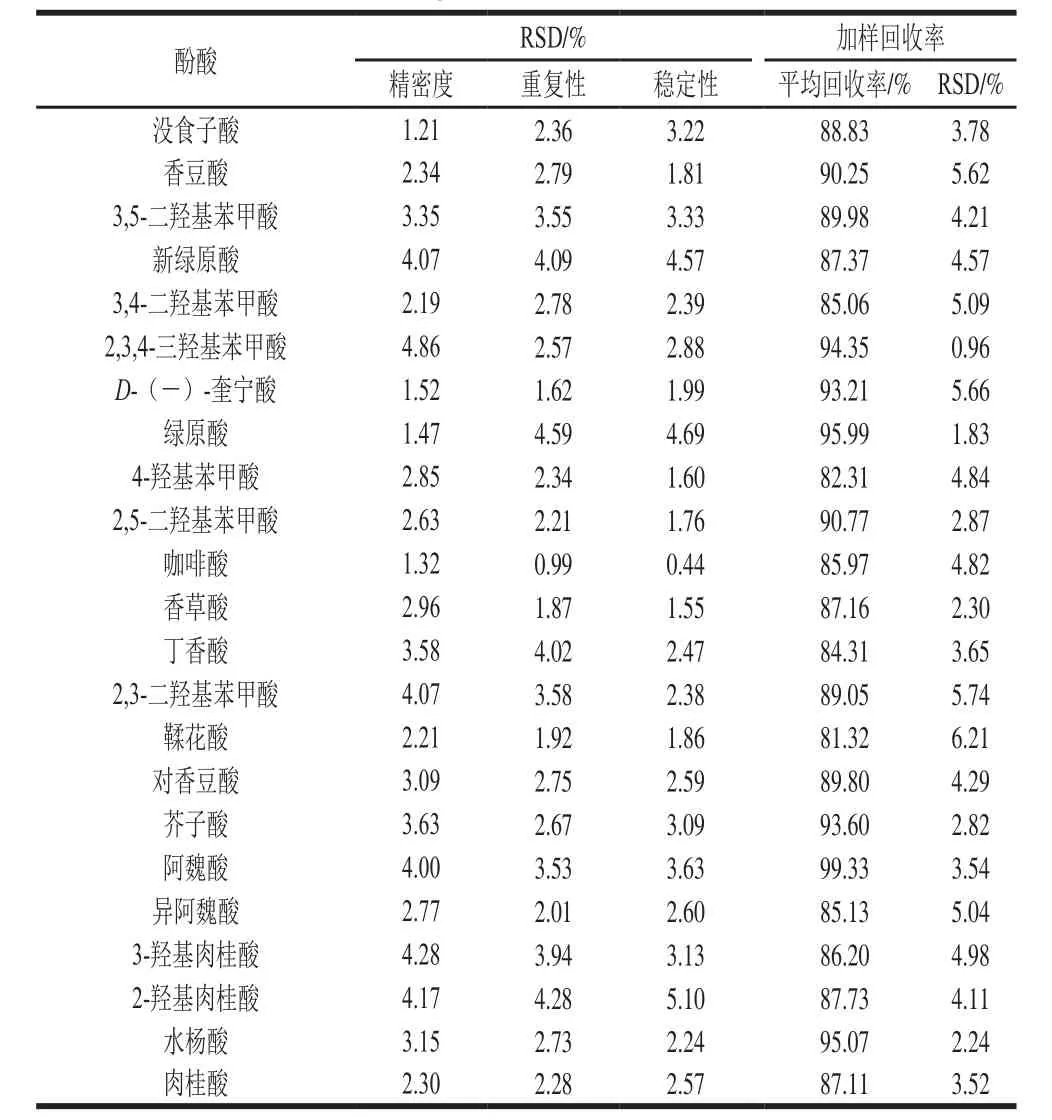
表5 目标化合物的方法学考察结果Table5 Figures of merit of the method
取100 ng/mL的混合对照品溶液,在1 d内连续进样6 次,计算23 种目标成分峰面积的相对标准偏差(relative standard deviation,RSD)。取同一样品供试品溶液,分别在0、2、4、6、12、24 h进样6 次,测定23 种目标化合物峰面积的RSD,考察其稳定性。取同一样品,按照2.3.1节方法平行制备3 份供试品溶液,分别进样测定峰面积,计算23 种目标成分峰面积的RSD,考察方法的重复性。结果表明,仪器精密度良好,23 种目标化合物在24 h内稳定,方法的重复性好,结果见表5。方法精密度、重复性和稳定性良好,RSD均小于5.10%。
2.3.3 加标回收率实验结果
取2 g(6 份)已知含量的西兰花样品于离心管中,分别加入100 ng/g的对照品溶液,按照1.3.1节的方法制备加样回收率供试品溶液,进行测定并计算目标化合物的回收率及RSD,结果见表5。加标回收率为81.32%~100.39%,RSD均不大于6.21%。加标回收样品(100 ng/g)的MRM色谱图见图2。
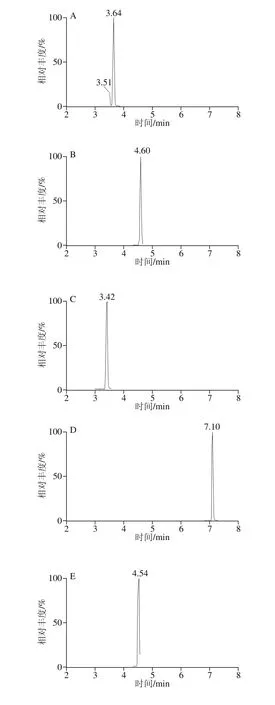
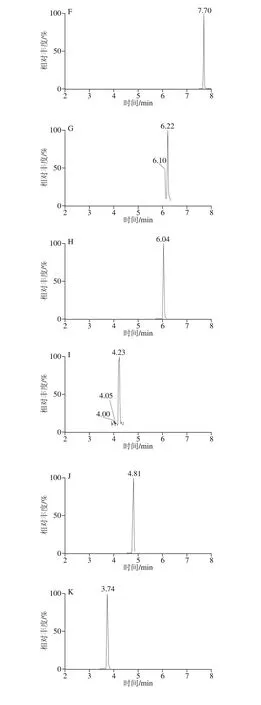
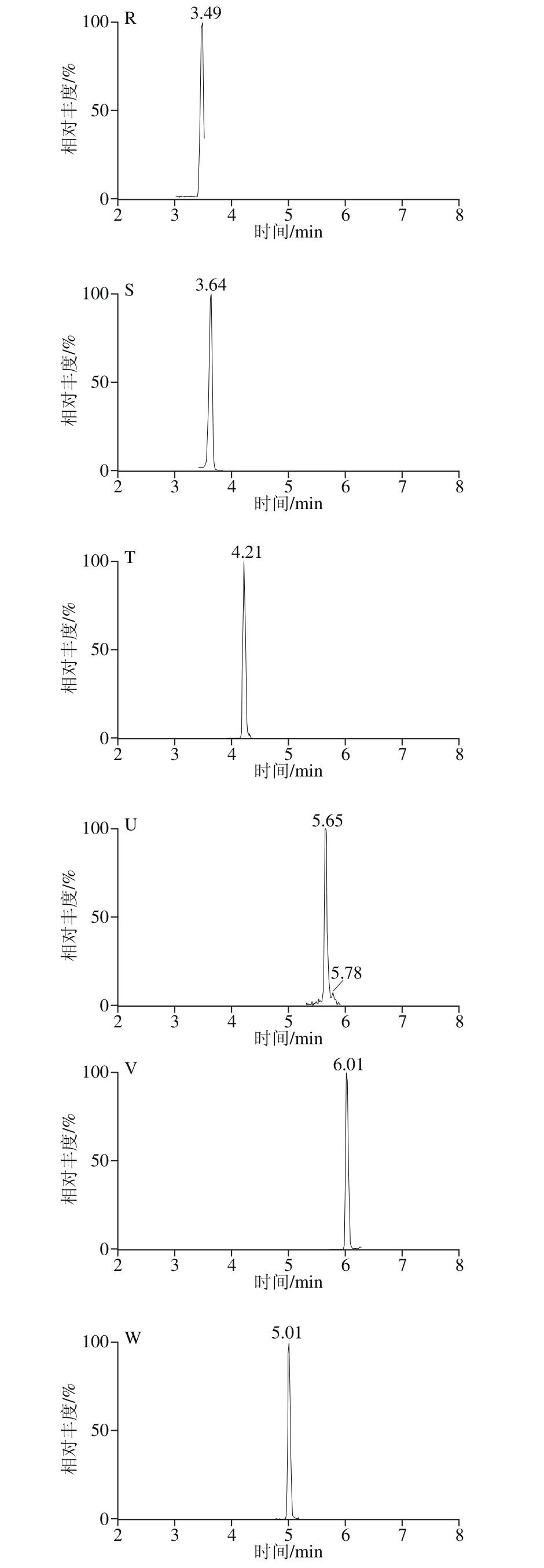
图2 加标回收样品(100 ng/g)的MRM色谱图Fig. 2 MRM Chromatograms of spiked samples (100 ng/g)
2.3.4 实际样品测定结果
按照1.3.1节方法制备5 个产地的花椰菜和西兰花样品,按照1.3.3节方法测定,根据相应的线性计算供试样品23 种酚酸的含量,结果见表6、7。测定样品的MRM色谱图见图3。
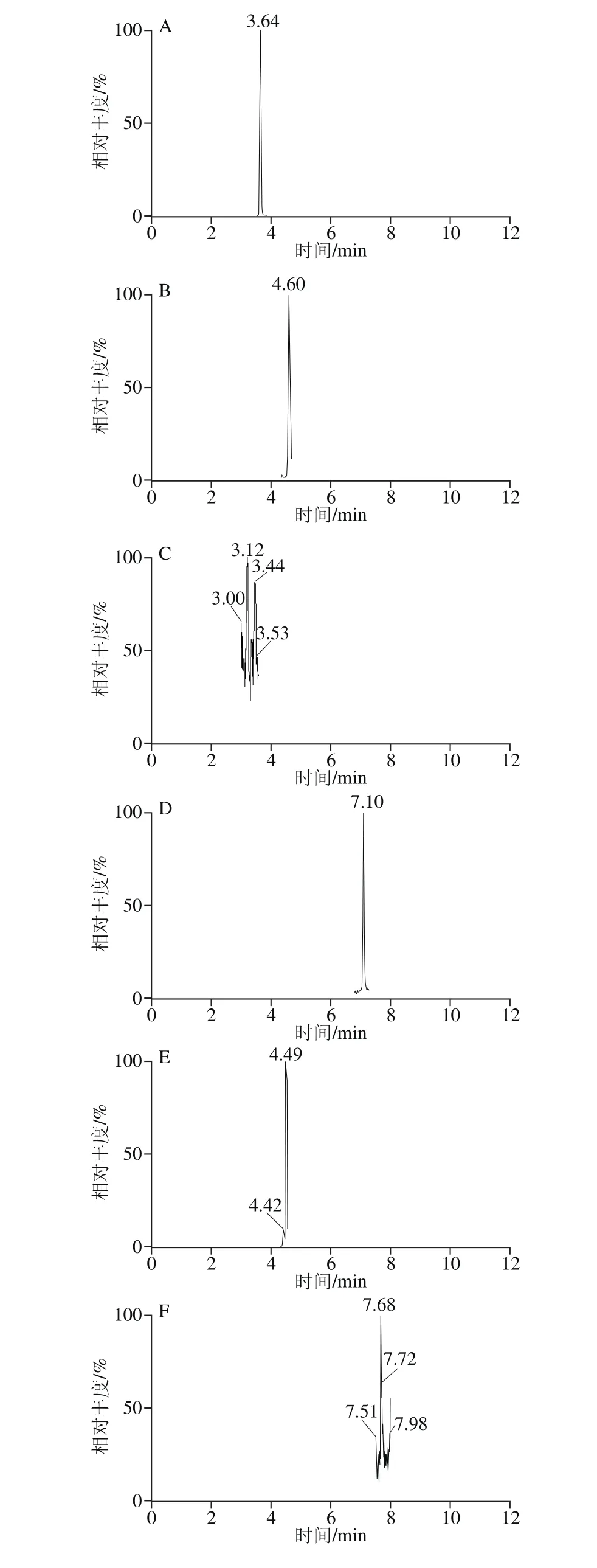
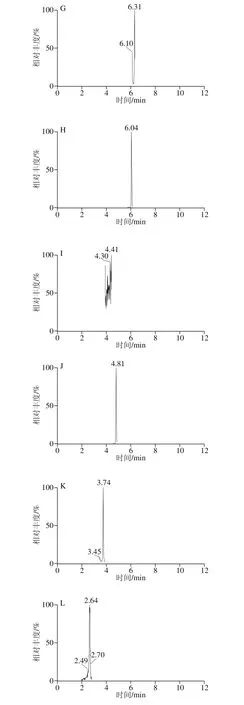
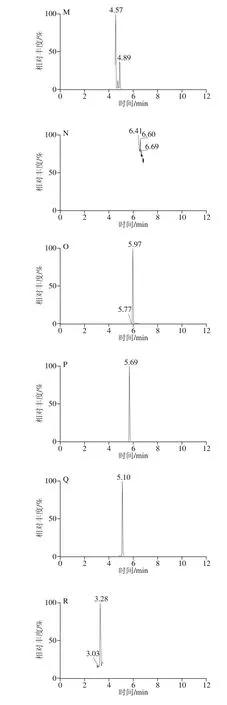
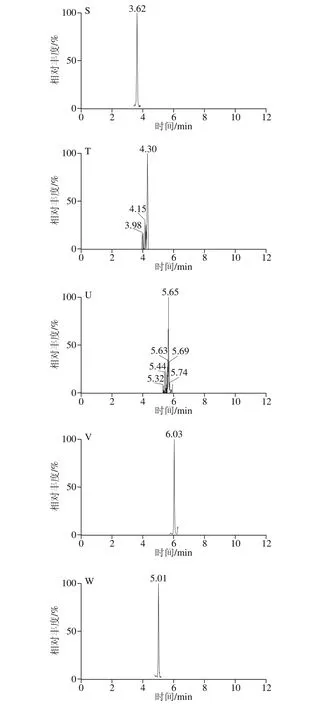
图3 测定样品的MRM色谱图Fig. 3 MRM chromatograms of real samples
如表6所示,花椰菜中共检出9 种酚酸。其中,游离形态酚酸检出芥子酸(0.11~0.13 mg/kg)和对羟基苯甲酸(0.43~1.19 mg/kg),不同产地的游离酚含量差异显著。酯型酚含量为0.32~4.28 mg/kg,其中产地北京的花椰菜中酯型酚含量均显著高于其他4 个产地,可能是由于贮运造成酯型酚降解。结合酚检测出3 种,芥子酸(0.87~1.59 mg/kg)、阿魏酸(0.30~0.99 mg/kg)和对香豆酸(0.28~0.53 mg/kg)。不同产地花椰菜中所检出的3 种形态的酚酸含量有差异显著,这可能与花椰菜品种、采收成熟度及贮运时间等有关。与文献[26-27]的研究结果比对发现,本研究检出的2,3-二羟基苯甲酸和对羟基苯甲酸文献中未见报道,文献中绿原酸和丁香酸的检测在本研究中未检出,可能是由于前处理和检测方法不一致。
西兰花中共检出10 种酚酸,如表7所示,其中,游离形态酚酸检出2 种:新绿原酸含量为0.82~3.09 mg/kg,对羟基苯甲酸含量为0.29~1.10 mg/kg。酯型酚中芥子酸(24.61~62.89 mg/kg)和阿魏酸(21.08~43.26 mg/kg)含量较高,其余几种酯型酚含量均低于10 mg/kg。结合酚检出芥子酸(3.40~5.99 mg/kg)、阿魏酸(4.61~7.83 mg/kg)和对香豆酸(0.59~0.80 mg/kg)。不同产地西兰花中所检出的3 种形态的酚酸含量差异显著,这可能与西兰花的品种、采收成熟度及贮运时间等有关。与文献[28-29]研究结果比对发现,本研究检出的2,3-二羟基苯甲酸、原儿茶酸、龙胆酸和对羟基苯甲酸文献中没有报道,绿原酸本研究未检出,可能是由于前处理和检测方法不一致。
表6 不同产地花椰菜中不同形态酚酸含量(s,n=3)Table6 Contents of phenolic acids in cauliflower from different producing areas s, n= 3)
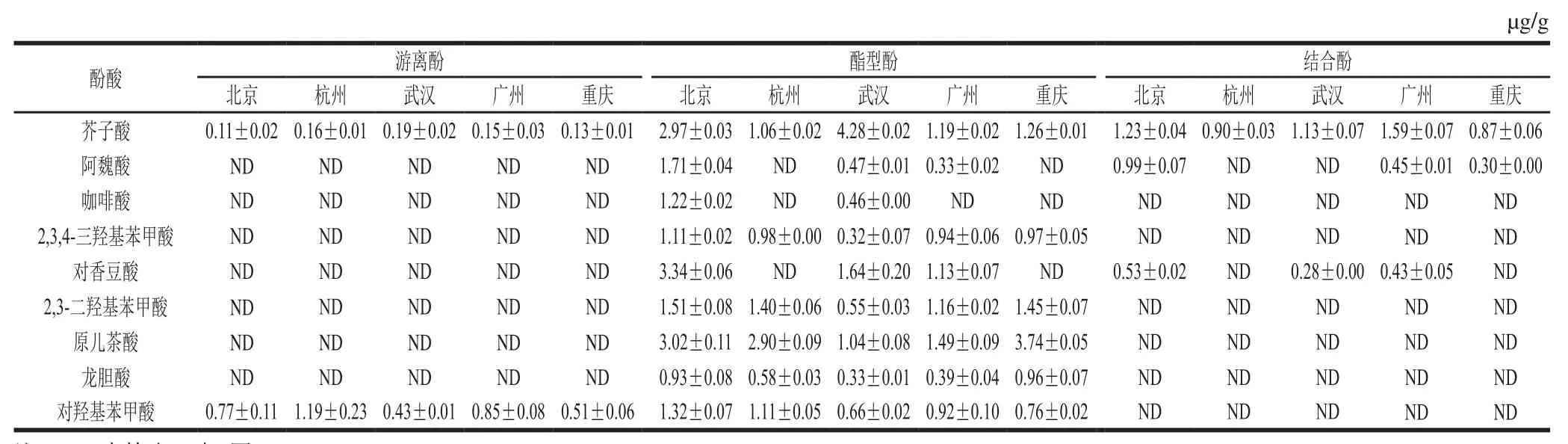
表6 不同产地花椰菜中不同形态酚酸含量(s,n=3)Table6 Contents of phenolic acids in cauliflower from different producing areas s, n= 3)
注:ND.未检出。表7同。
?
表7 不同产地西兰花中不同形态酚酸含量s,n=3)Table7 Contents of phenolic acids in broccoli from different producing areass, n= 3)
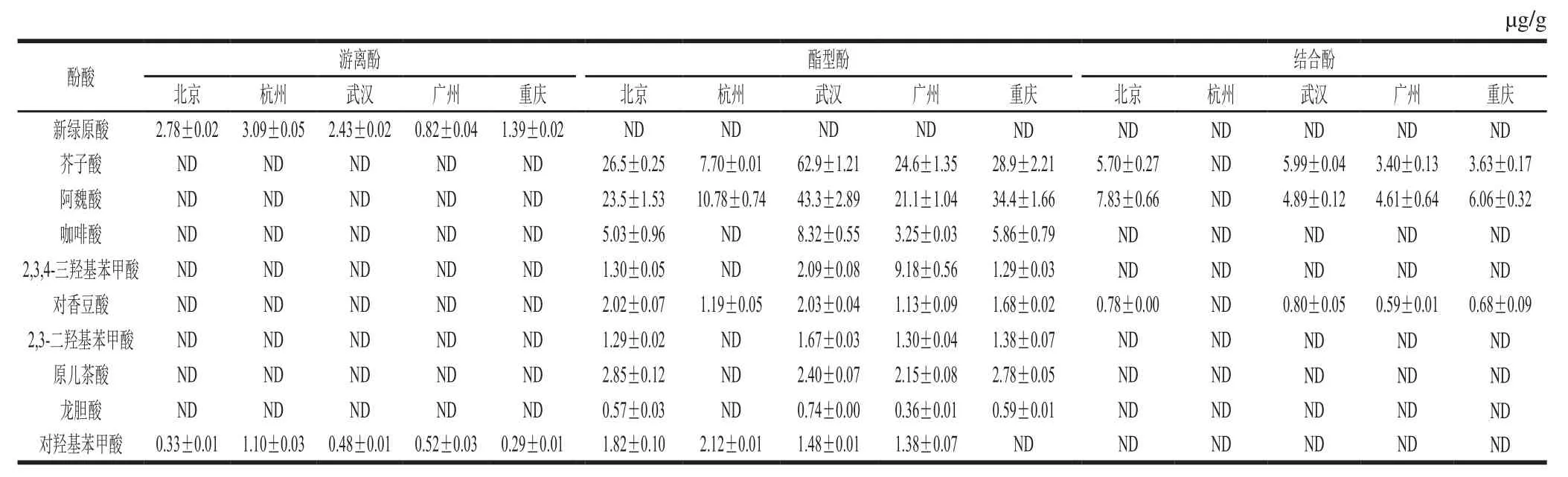
表7 不同产地西兰花中不同形态酚酸含量s,n=3)Table7 Contents of phenolic acids in broccoli from different producing areass, n= 3)
?
3 结 论
酚酸类化合物的准确定性定量分析是开展蔬菜营养品质研究及功能性食品研发必备的技术基础。目前已有一些采用普通高效液相色谱测定紫山药、果蔬汁和紫苏中酚酸类化合物的研究报道[18,30-31]。但是普通高效液相色谱存在分析时间较长、分离度较差等问题,难以实现多种酚酸的联合分析测定。本研究通过UPLC-MS/MS法,在9 min内快速有效地分离23 种酚酸化合物,显著提高了酚酸类化合物的分离效率,采用MRM模式进行定性定量分析,方法灵敏度及选择性均显著提高,同时可以降低基质干扰和信噪比,测定结果更加准确可靠。本研究建立的UPLC-MS/MS法能够快速、准确地测定花椰菜和西兰花中23 种酚酸化合物,23 种化合物的线性关系良好,相关系数r2均不低于0.992,回收率在81.32%~100.39%之间,RSD均不大于6.21%。该方法显著缩短了分析时间,而且稳定性好、灵敏度高,可以为花椰菜和西兰花等蔬菜中酚酸类功能营养评价及保健新品种开发提供技术支持。
[1] FOWKE J H, LONGCOPE C, HEBERT J R. Brassica vegetable consumption shifts estrogen metabolism in healthy postmenopausal women[J]. Cancer Epidemiology, Biomarkers & Prevention, 2000,9(8): 773-779. DOI:10952093.
[2] PODSEDEK A. Natural antioxidants and antioxidant capacity of brassica vegetables: a review[J]. LWT-Food Science and Technology,2007, 40: 1-11. DOI:10.1016/j.lwt.2005.07.023.
[3] 郭长江, 杨继军. 蔬菜、水果抗氧化作用的研究进展[J]. 中国公共卫生, 2001, 17(1): 87-88. DOI:1001-0580(2001)-01-0087-02.
[4] KECK A S, FINLEY J W. Cruciferous vegetables: cancer protective mechanisms of glucosinolate hydrolysis products and selenium[J]. Integrative Cancer Therapies, 2004, 3(1): 5-12.DOI:10.1177/1534735403261831.
[5] BOHR V. Repair of oxidative DNA damage in nuclear and mitochondrial DNA, and some changes with aging in mammalian cells[J]. Free Radical Biology & Medicine, 2002, 32(9): 804-812.DOI:10.1016/S0891-5849(02)00787-6.
[6] XU G H, YE X Q, CHEN J C, et al. Effect of heat treatment on the phenolic compounds and antioxidant capacity of citrus peel extract[J].Journal of Agricultural and Food Chemistry, 2007, 55: 330-335.DOI:10.1021/jf062517l.
[7] KRIS-ETHERTON P M, HECKER K D, BONANOME A, et al. Bioactive compounds in foods: their role in the prevention of cardiovascular disease and cancer[J]. The American Journal of Medicine, 2002, 113(Suppl 9B): 71S-88S. DOI:10.1016/S0002-9343(01)00995-0.
[8] BECKMAN C H. Phenolic-storing cells: keys to programmed cell death and periderm formation in wilt disease resistance and in general defence responses in plants?[J]. Physiological and Molecular Plant Pathology, 2000, 57(3): 101-110. DOI:10.1006/pmpp.2000.0287.
[9] KIM K H, TSTO R, CUI S W, et al. Pheonlic acid profiles and antioxidant activities of wheat bran extract and the effect of hydrolysis conditions[J]. Food Chemistry, 2006, 95: 466-473. DOI:10.1016/j.foodchem.2005.01.032.
[10] IRAKLI M N, SAMANIDOU V F, BILIADERIS C G, et al.Development and validation of an HPLC-method for determination of free and bound phenolic acids in cereals after solid-phase extraction[J].Food Chemistry, 2012, 134: 1624-1632. DOI:10.1016/j.food chem.2012.03.046.
[11] 张雪. 薄层色谱法检测何首乌大黄素方法的建立[J]. 食品工业科技,2008, 29(9): 271-272. DOI:10.13386/j.issn 1002-0306.2008.09.083.
[12] XU L Y, DONG Q, HU F Z. Simultaneous quantitative determination of eight active components in Polygonum multiflorum Thunb by RPHPLC[J]. Journal of Chinese Pharmaceutical Sciences, 2009, 18(4):358-365. DOI:1003-1057(2009)4-358-04.
[13] 赵艳玲, 蒋湘宁. 植物叶片酚酸类物质微量提取分离与GC-MS分析[J].山东林业科技, 2012, 19(2): 8-11. DOI:1002-2724(2012)02-0008-04.
[14] SPÁCIL Z, NOVÁKOVÁ L, SOLICH P. Analysis of phenolic compounds by high performance liquid chromatography and ultra performance liquid chromatography[J]. Talanta, 2008, 76: 189-199.DOI:10.1016/j.talanta.2008.02.021.
[15] SÁENZ-NAVAJAS M P, FERREIRA V, DIZY M, et al.Characterization of taste-active fractions in red wine combining HPLC fractionation, sensory analysis and ultra performance liquid chromatography coupled with mass spectrometry detection[J].Analytica Chimica Acta, 2010, 673: 151-159. DOI:10.1016/j.aca.2010.05.038.
[16] 方玲玲, 肖作兵, 牛云蔚, 等. 超高效液相色谱串联质谱法测定樱桃酒中的5 种酚酸[J]. 食品与发酵工业, 2011, 37(6): 172-175.DOI:10.13995/j.cnki.11-1802/ts.2011.06.044.
[17] 罗益远, 刘娟秀, 刘廷, 等. UPLC-MS/MS法同时测定何首乌中二苯乙烯、蒽醌、黄酮及酚酸类成分[J]. 质谱学报, 2016, 37(4): 327-334. DOI:10.7538/zpxbyouxian.2016.0016.
[18] 艾鑫卫, 胡思平, 龚姮姮, 等. 高效液相色谱-串联质谱法测定各生长期紫苏中酚类物质的含量[J]. 食品科学, 2016, 37(18): 126-132.DOI:10.7506/spkx1002-6630-201618021.
[19] 张娜, 王国祥, DANIEL A J, 等. 超高效液相色谱法分析稻米酚酸化合物组分及其含量[J]. 中国农业科学, 2015, 48(9): 1718-1726.DOI:10.3864/j.issn.0578-1752.2015.09.05.
[20] 谢越, 俞浩, 汪建飞, 等. 高效液相色谱法同时测定滁菊样品中的9 种酚酸[J]. 分析化学, 2013, 41(3): 383-388. DOI:10.3724/SP.J.1096.2013.20820.
[21] WANG C J, ZHAO J B, CHEN F, et al. Separation, identification, and quantitation of phenolic acids in Chinese waxberry (Myrica rubra)juice by HPLC-PDA-ESI-MS[J]. Journal of Food Science, 2012, 77:272-277. DOI:10.1111/j.1750-3841.2011.02563.x.
[22] HAO M L, BETA T. Qualitative and quantitative analysis of the major phenolic compounds as antioxidants in barley and flaxseed hulls using HPLC/MS/MS[J]. Journal of the Science of Food and Agriculture,2012, 92(10): 2062-2068. DOI:10.1002/jsfa.5582.
[23] 李永库, 李晓静, 欧小辉. 果汁中9 种酚酸类化合物的RP-HPLCPAD分析[J]. 食品与发酵工业, 2007, 33(7): 135-138. DOI:10.13995/j.cnki.11-1802/ts.2007.07.033.
[24] 王莉娜, 胡雪莲. 采用SPE-HPLC测定啤酒中15 种酚酸化合物[J].食品与发酵工业, 2014, 40(7): 144-148. DOI:10.13995/j.cnki.11-1802/ts.2014.07.007.
[25] 吕海涛, 邓锐. 高效液相色谱法测定苹果汁中8 种酚类化合物[J].理化检验: 化学分册, 2009, 45(2): 125-127. DOI:1001-4020(2009)02-0125-03.
[26] DENG G F, LIN X, XU X R, et al. Antioxidant capacities and total phenolic contents of 56 vegetables[J]. Journal of Functional Foods,2013, 5(1): 260-266. DOI:10.1016/j.jff.2012.10.015.
[27] NG Z X, CHAI J W, KUPPUSAMY U R. Customized cooking method improves total antioxidant activity in selected vegetables[J].International Journal of Food Sciences and Nutrition, 2011, 62(2):158-163. DOI:10.31 09/09637486.2010.526931.
[28] VILLARREAL-GARCÍA D, NAIR V, CISNEROS-ZEVALLOS L,et al. Plants as biofactories: postharvest stress-induced accumulation of phenolic compounds and glucosinolates in broccoli subjected to wounding stress and exogenous phytohormones[J]. Frontiers in Plant Science, 2016, 7(837): 45-49. DOI:10.3389/fpls.2016.00045.
[29] NICOLETTO C, SANTAGATA S, PINO S, et al. Antioxidant characterization of different Italian broccoli landraces[J].Horticultura Brasileira, 2016, 34(1): 74-79. DOI:10.1590/S0102-053620160000100011.
[30] 于东, 方忠祥, 杨海花, 等. 紫山药酚酸类化合物鉴定及含量测定[J]. 中国农业科学, 2010, 43(12): 2527-2532. DOI:10.3864/j.issn.0578-1752.2010.12.017.
[31] 邵亮亮, 李红艳, 陈万勤, 等. 反相高效液相色谱法同时测定果蔬汁饮料中的11 种酚酸化合物[J]. 分析试验室, 2013, 32(11): 75-78.DOI:10.13595/j.cnki.issn1000-0720.2013.0303.
