戴尔有孢圆酵母对葡萄酒香气的影响
2018-02-09原苗苗姜凯凯孙玉霞王世平
原苗苗,姜凯凯,孙玉霞*,王世平
(1.山东省农业科学院农产品研究所,山东省农产品精深加工技术重点实验室,农业部新食品资源加工重点实验室,山东 济南 250100;2.齐鲁工业大学 山东省微生物工程重点实验室,山东 济南 250353)
葡萄汁的自然发酵是一个复杂的生物过程,由不同种属的酿酒酵母和非酿酒酵母进行,酿酒酵母在乙醇发酵中起到主要作用。通常认为,非酿酒酵母与高挥发酸和乙酸乙酯以及不良气味化合物的产生有关[1-2]。但现在越来越多的科学家认识到非酿酒酵母其实能为葡萄酒带来很多正面的影响,合理的利用可以提高葡萄酒香气的复杂性。近年来,对于非酿酒酵母对葡萄酒香气成分的影响,国内外学者做了大量的研究工作。Powles等[3]研究发现,美极梅氏酵母协同酿酒酵母共同培养时,萜烯和内酯等芳香族化合物含量变化显著。Maturano等[4]研究了德巴利菌株与发酵体系中香叶醇含量的变化规律成线性关系,研究表明,葡萄酒中香叶醇的含量与β-葡萄糖苷酶的活性成正比。基于非酿酒酵母菌在产生葡萄酒香气物质方面的启示,Horecka等[5]采用分离于早期韩国坎贝尔葡萄原料中的非酿酒酵母菌,进行了高品质风味葡萄酒的酿造,相关研究充分揭示了非酿酒酵母菌在助推或改良葡萄酒呈味物质等方面的重要作用;Fleet[6]关于酵母的综述强调了非酿酒酵母对葡萄酒感官特性的潜在积极作用。此外,非酿酒酵母产生的许多发酵产物,例如乙酸己酯、乙酸异戊酯和乙酸苯乙酯对葡萄酒发酵的特色果香贡献最大[7-8]。研究发现,参与酒精发酵的非酿酒酵母能够提高主要香气物质的含量,从而使得葡萄酒酒香更复杂[7,9-11]。
戴尔有孢圆酵母能产生更高浓度的高级醇、酯类、萜烯和酚醛以及其他物质如2-苯乙醇、芳樟醇、甲基香草醛[12-14],给葡萄酒带来独特的花香和果香,增加感官复杂性,产生自然发酵的效果。与酿酒酵母相比,戴尔有孢圆酵母通常表现出耐高渗透压[15-16],对氮和氧的需求较高[17-18],产生较低的挥发性酸、乙醛和乙偶姻,低/中等产量的甘油、琥珀酸、多糖、挥发性硫(3-巯基-1-己醇,有百香果、葡萄柚和柑橘香气)和其他化合物[14,16,19-21]。这些特点使它成为推动葡萄酒品质改善的良好助力。
目前,国内对戴尔有孢圆酵母在葡萄酒发酵中的研究相对较少,戴尔有孢圆酵母对国产葡萄酒的品质影响需要进一步研究。本实验以新疆赤霞珠葡萄和山东乳山赤霞珠葡萄为原料,分别选用酿酒酵母、戴尔有孢圆酵母单独发酵以及二者混合发酵,发酵结束后测定葡萄酒的各项理化指标,用气相色谱-质谱联用仪测定其挥发性化合物含量,以期为戴尔有孢圆酵母在国产葡萄酒酿造中的应用起到一定的指导作用。
1 材料与方法
1.1 材料与试剂
新疆共青团农场和山东乳山的赤霞珠葡萄,2015年成熟期采摘。
酿酒酵母D254 上海杰兔工贸有限公司;酿酒酵母FX10、戴尔有孢圆酵母ALPHATDn.sacch烟台通商国际贸易有限公司。
偏重亚硫酸钾(分析纯) 天津市科密欧化学试剂有限公司;氢氧化钠(分析纯) 天津市风船化学试剂科技有限公司;氯化钠(分析纯) 国药集团化学试剂有限公司;4-甲基-2-戊醇(色谱纯,98%)美国Aldrich公司;乙酸乙酯、丁酸乙酯、乙酸异戊酯、己酸乙酯、庚酸乙酯、乳酸乙酯、癸酸乙酯、辛酸乙酯、1-丙醇、异丁醇、正丁醇、1-己醇、庚醇、1-辛醇、苯甲醇、2-壬酮、己酸、辛酸、癸酸标准品 美国Sigma公司;正己烷(色谱纯) 德国Meker公司;GF254薄层色谱硅胶 青岛海洋化工厂;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
固相微萃取手动进样手柄、50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷复合萃取头 美国Supelco公司;GC-7890B/MS-5977A气相色谱-质谱联用仪、VF-WAXms色谱柱(30 m×0.32 mm,0.25 μm) 美国Agilent公司。
1.3 方法
1.3.1 葡萄酒的酿造
将新疆和乳山赤霞珠葡萄样品各5 kg除梗和破碎后,分别放入6 个容积为5 L的带盖广口瓶中,添加偏重亚硫酸钾,使总SO2质量浓度达到50 mg/L;室温浸渍24 h,分别在新疆赤霞珠葡萄的3 个广口瓶中,单独添加0.3 g/L酿酒酵母D254,单独添加0.3 g/L戴尔有孢圆酵母,混合添加0.15 g/L酿酒酵母D254和0.15 g/L戴尔有孢圆酵母;分别在山东乳山赤霞珠的3 个广口瓶中,单独添加0.3 g/L酿酒酵母FX10,单独添加0.3 g/L戴尔有孢圆酵母,混合添加0.15 g/L酿酒酵母FX10和0.15 g/L戴尔有孢圆酵母。
相同环境室温发酵,发酵期间,每天通过比重计测定葡萄酒比重,直到比重小于0.996、残糖小于4 g/L,进行皮渣分离。酒样放置于玻璃瓶中,密封于-40 ℃贮存待测。
1.3.2 葡萄酒理化指标测定
根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定葡萄酒中还原糖、总酸、挥发酸含量和乙醇体积分数等基本指标。
1.3.3 挥发性化合物测定
葡萄酒样的挥发性化合物采用顶空固相微萃取-气相色谱-质谱联用技术测定[22-23]。色谱分析在配备有5977A MSD的Agilent 7890B气相色谱仪上进行。挥发性化合物用VF-WAXms(30 m×0.32 mm,0.25 μm)毛细管气相色谱柱分离。具体操作:取8 mL葡萄酒,1.5 g NaCl和20 μL 2.00 g/L的4-甲基-2-戊醇(内标物)以及转子,置于15 mL顶空瓶中。后将顶空瓶放置于45 ℃的可加热磁力搅拌器上,预热10 min,进行萃取,萃取50 min后,进样。解吸10 min,结束后,柱子在40 ℃条件下保持2 min,然后以6 ℃/min的速率升到230 ℃,保持15 min。载气为氦气,平均线速率为25 cm/s。采用不分流进样模式。所有质谱在电子能量70 eV条件下冲击,质量扫描范围为30~400 u,在每秒3.9 次扫描速率条件下获得。
1.3.4 挥发性化合物的定性定量分析
定性分析:采用气相色谱-质谱联用仪进行分析鉴定。分析结果运用计算机谱库(NIST 11)进行初步检索和分析,再结合文献进行人工谱图解析,确定挥发性物质的各个化学成分。
定量分析:对于已有标样的物质,利用其在模拟酒溶液中的标准曲线进行外标法定量;对没有标样的物质利用化学结构相似、碳原子数相近的标样香气物质的标准曲线进行半定量。
1.4 数据处理
采用SPSS 19.0软件进行数据分析,多组间比较采用One-Way ANOVA法。采用SPSS 19.0软件进行主成分分析得到得分图,从而获得样品分类信息。
2 结果与分析
2.1 混合发酵实验葡萄酒基本指标分析

表1 新疆赤霞珠葡萄酒基本指标Table1 Properties of Xinjiang Cabernet Sauvignon wine
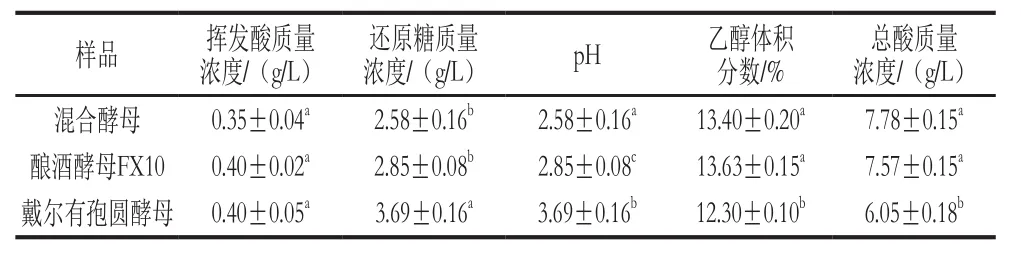
表2 山东赤霞珠葡萄酒基本指标Table2 Properties of Shandong Cabernet Sauvignon wine
由表1可知,戴尔有孢圆酵母与酿酒酵母D254混合发酵新疆赤霞珠葡萄得到的葡萄酒中挥发酸质量浓度比酿酒酵母D254以及戴尔有孢圆酵母单独发酵产生的挥发酸质量浓度低;由表2可知,戴尔有孢圆酵母与酿酒酵母FX10混合发酵乳山赤霞珠葡萄得到的葡萄酒中挥发酸质量浓度也较低。研究表明,戴尔有孢圆酵母对酒精型饮料的香味起到积极贡献,但比酿酒酵母单独发酵产生较低的挥发酸,这与文献[16,24-25]中描述的一致。戴尔有孢圆酵母的乙酸产生机制与酿酒酵母不同,在酿酒酵母中,乙酸是酿酒酵母应对葡萄汁中高糖浓度引起的高渗透压而产生的副产物[26],而戴尔有孢圆酵母的乙酸产生机制需要进一步研究。由表1、2可知,酿酒酵母单独发酵产生的葡萄酒乙醇体积分数最高,戴尔有孢圆酵母单独发酵以及酿酒酵母和戴尔有孢圆酵母混合发酵的葡萄酒酒精度明显降低,由此可见,戴尔有孢圆酵母的酒精发酵能力较酿酒酵母弱,可能是对厌氧环境比较敏感,会降低葡萄酒的乙醇体积分数[27-29],与之前的研究结果一致。
2.2 混合发酵实验葡萄酒挥发性化合物种类与质量浓度

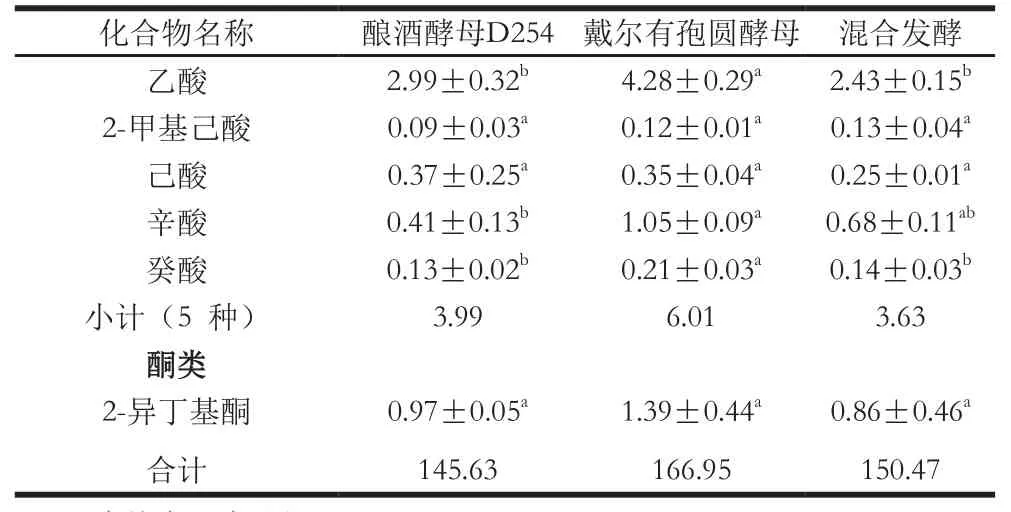
表3 新疆赤霞珠葡萄酒挥发性化合物质量浓度Table3 Contents of volatile compounds in Xinjiang Cabernet Sauvignon wine
续表3

表4 山东赤霞珠葡萄酒挥发性化合物质量浓度Table4 Contents of volatile compounds in Shandong Cabernet Sauvignon wine

续表4
如表3、4所示,新疆赤霞珠葡萄发酵共检测到42 种挥发性化合物;乳山赤霞珠葡萄发酵共检测到56 种挥发性化合物。2 组实验结果表明,戴尔有孢圆酵母单独发酵产生的挥发性化合物总量最高,其次是戴尔有孢圆酵母与酿酒酵母混合发酵,最少的为酿酒酵母单独发酵。
2.3 不同酵母发酵葡萄酒的挥发性化合物差异性分析
2.3.1 酯类
葡萄酒的特征果香成分主要是酯类物质[30]。由表3可知,采用新疆赤霞珠葡萄发酵的葡萄酒共检测到18 种酯类,其中酿酒酵母D254和两者混合发酵产生17 种酯类,戴尔有孢圆酵母发酵产生16 种酯类。由戴尔有孢圆酵母单独发酵新疆赤霞珠葡萄产生的酯类质量浓度最高,为38.32 mg/L,其次是酿酒酵母D254单独发酵,质量浓度为32.42 mg/L,产酯最少的为混合发酵,质量浓度为28.00 mg/L。在检测到的18 种酯类中,戴尔有孢圆酵母单独发酵产生12 种酯:乙酸乙酯、乳酸乙酯、辛酸甲酯、辛酸乙酯、壬酸乙酯、癸酸甲酯、癸酸乙酯、辛酸-3-甲基丁酯、月桂酸乙酯、9-癸烯酸乙酯、肉豆蔻酸乙酯、戊酸乙酯,其质量浓度为本组实验中最高。在混合发酵的葡萄酒中,乳酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯和戊酸乙酯的质量浓度仅次于戴尔有孢圆酵母单独发酵。
由表4可以看出,采用乳山赤霞珠葡萄进行的发酵实验中,共检测到24 种酯类,酿酒酵母FX10和戴尔有孢圆酵母单独发酵分别产生20 种和23 种酯,两者混合发酵产生21 种酯。戴尔有孢圆酵母单独发酵产生38.69 mg/L的酯,质量浓度为最高,其次是混合发酵,质量浓度为35.27 mg/L。最少为酿酒酵母FX10单独发酵,质量浓度为34.59 mg/L;对于实验中检测到的24 种酯,戴尔有孢圆酵母单独发酵产生的15 种酯质量浓度最高,分别为乙酸乙酯、乙酸己酯、辛酸甲酯、辛酸乙酯、己酸异戊酯、壬酸乙酯、癸酸甲酯、癸酸乙酯、琥珀酸-2-乙酯、苯乙酸乙酯、月桂酸乙酯、肉豆蔻酸乙酯、癸酸-3-甲基丁酯、棕榈酸乙酯和N-乙基甲酸乙酯;在混合发酵的葡萄酒中,乙酸乙酯、琥珀酸-2-乙酯、肉豆蔻酸乙酯和棕榈酸乙酯质量浓度仅次于戴尔有孢圆酵母单独发酵。
戴尔有孢圆酵母具有较强的产生乙基酯的能力,主要是乙酸乙酯(微带果香,甜香)、辛酸乙酯(有玫瑰、橙子花香,及清凉水果香)和癸酸乙酯(椰子果香气,舒适,脂肪酸味带甜),且其单独发酵更有利于酯类的产生。辛酸乙酯的生产似乎是戴尔有孢圆酵母的特征之一,在Viana等[8]的研究中,相对于酿酒酵母和其他几种非酿酒酵母,戴尔有孢圆酵母辛酸乙酯的产量也是最高的。
2.3.2 醇类
醇类主要来源于发酵、氨基酸的转化及亚麻酸降解物的氧化[31]。葡萄酒中的高级醇质量浓度低于300 mg/L时,有助于提高自身的复杂性[32]。但当质量浓度超过400 mg/L,杂醇将会作为一个消极的品质因数,影响葡萄酒的感官品质。由表3可知,在采用新疆赤霞珠葡萄发酵实验中,共检测到18 种醇类,戴尔有孢圆酵母单独发酵产生的酒液,共检测到14 种醇类,且其醇类总量也最高,为121.23 mg/L,其次是混合发酵的酒液,质量浓度为117.98 mg/L,酿酒酵母D254单独发酵产生的醇类最少,为108.25 mg/L。在检测到的18 种醇类之中,戴尔有孢圆酵母单独发酵产生的8 种醇类,异丁醇、正己醇、2,3-丁二醇、正辛醇、丙二醇、癸醇、苯乙醇、3-乙基-2-庚醇质量浓度在3 个发酵实验中最高。混合发酵中产生的正己醇、2,3-丁二醇、丙二醇和苯乙醇质量浓度仅次于戴尔有孢圆酵母单独发酵。苯乙醇质量浓度的增加可能与戴尔有孢圆酵母中β-葡萄糖苷酶的活性有关[33],也有可能是酵母中β-葡萄糖苷酶的活性与L-苯丙氨酸的代谢共同作用的结果[34]。
如表4所示,采用山东乳山赤霞珠葡萄发酵实验中,共检测到22 种醇类,戴尔有孢圆酵母、酿酒酵母FX10单独发酵以及两者混合发酵分别检测到21、18 种和19 种醇类,醇类总量分别为209.71、188.88 mg/L和189.88 mg/L,戴尔有孢圆酵母单独发酵产生的醇种类最多、总量最高。
2.3.3 酸类
葡萄酒中通常表现出来的奶酪味以及脂肪味与葡萄酒中存在的有机酸密切相关[35-36]。由表3可知,采用新疆赤霞珠葡萄发酵实验,戴尔有孢圆酵母单独发酵产生的有机酸类质量浓度最高,为6.01 mg/L,其次是酿酒酵母D254单独发酵,为3.99 mg/L,产有机酸最少的为混合发酵,为3.63 mg/L。戴尔有孢圆酵母单独发酵产生的乙酸、辛酸和癸酸质量浓度是最高的,高于其他2 个菌种。
由表4可知,采用乳山赤霞珠葡萄发酵实验,发酵结束后酒液共检测到7种有机酸,其中戴尔有孢圆酵母单独发酵产生的有机酸为7 种,酿酒酵母FX10单独发酵酒液检测到5 种有机酸,两者混合发酵酒液也检测到5 种有机酸。戴尔有孢圆酵母单独发酵检测到3.69 mg/L,为3 个发酵中最多。Azzolini等[33]研究发现,戴尔有孢圆酵母有利于有机酸的积累,这与本实验的研究结果一致,戴尔有孢圆酵母产生的辛酸和癸酸质量浓度显著高于其他2 个菌种,而乙酸质量浓度显著低于酿酒酵母FX10。
2.3.4 山东、新疆产区赤霞珠葡萄酒香气主成分分析
以山东、新疆2 个产区葡萄为原料,分别用酿酒酵母和戴尔有孢圆酵母发酵的葡萄酒进行香气主成分分析,其中主成分1占总变量的39.1%,主成分2占总变量的31.5%,前2 个主成分的累计方差贡献率为70.6%,绘制主成分得分图如图1所示。尽管选用不同的酿酒酵母和非酿酒酵母,2 个产区的葡萄酒仍可进行完全的区分,说明产地即葡萄园的风土是影响葡萄酒香气成分的最主要因素。有戴尔有孢圆酵母参与发酵的葡萄酒与仅使用酿酒酵母酿造的葡萄酒也有较大的差异,后者的香气与异丁醇、正己醇、2,3-丁二醇、正辛醇、3-乙基-2-庚醇和4-甲基-1-戊醇等醇类物质有较大的相关性;而前者的香气则与辛酸乙酯(青苹果味、果香、草莓香)、癸酸乙酯(白兰地味、果香、葡萄香)、月桂酸乙酯(花生的香气)、肉豆蔻酸乙酯(椰子、鸢尾花香气)、棕榈酸乙酯(坚果、奶油香气)等脂肪酸乙酯有较大的相关性,增加了葡萄酒的复杂性。此外,由图1也可以看出,非酿酒酵母对新疆产区的葡萄酒香气影响更大。

图1 山东、新疆葡萄产区不同酵母菌发酵葡萄酒香气主成分得分图Fig. 1 PCA score plot of PC1 against PC2 for aroma compounds in wines fermentated by different yeast strains from grapes grown in Shandong and Xinjiang
3 结 论
本实验选用新疆共青团农场赤霞珠葡萄和山东乳山赤霞珠葡萄为原料,分别使用酿酒酵母、戴尔有孢圆酵母单独发酵以及两者混合进行葡萄酒酿造。发酵后得到的葡萄酒样中,混合发酵产生的挥发酸较少。对于挥发性化合物,戴尔有孢圆酵母单独发酵产生的挥发性化合物种类较其他2 个多,质量浓度较其他2 个高。本实验表明,对于不同产区的酿酒葡萄原料,相较于不同的酿酒酵母菌株,戴尔有孢圆酵母参与发酵均有利于提高葡萄酒挥发性化合物的种类和质量浓度,尤其是乙基酯的质量浓度,增加葡萄酒的香气和复杂度。另外,本实验中使用戴尔有孢圆酵母单独发酵的葡萄酒发酵比较完全,但有研究表明,戴尔有孢圆酵母对厌氧环境比较敏感,单独发酵时获得的葡萄酒发酵不完全[16,37]。因此,使用戴尔有孢圆酵母单独发酵存在一定的风险,可以选择戴尔有孢圆酵母与酿酒酵母混合发酵提高葡萄酒香气。对于非酿酒酵母来说,有关戴尔有孢圆酵母的研究大部分集中于混合发酵葡萄汁以提高葡萄酒质量方面,对于其相关基因方面的研究鲜有报道,从分子水平上探究其对香气成分代谢的影响势在必行。此外,世界上葡萄酒生产国依靠野生酵母(分离于葡萄表皮、葡萄园土壤、发酵葡萄汁)自然发酵生产的葡萄酒无论在复杂感、结构、香气、地域特色等方面都具有一定的优势[38],因此,对于非酿酒酵母及其对葡萄酒质量的影响研究具有重要意义。
[1] MOREIRA N, PINA C, MENDES F, et al. Volatile compounds contribution of Hanseniaspora guilliermondii and Hanseniaspora uvarum during red wine vinifications[J]. Food Control, 2011, 22(5): 662-667. DOI:10.1016/j.foodcont.2010.07.025.
[2] SWIEGERS J H, PRETORIUS I S. Yeast modulation of wine flavor[J].Advances in Applied Microbiology, 2005, 57: 131-175. DOI:10.1016/S0065-2164(05)57005-9.
[3] POWLES J, SAVAGE P, WU E, et al. Motif-based evidence that a plastid translocon component acts like a rhomboid protease substrate in yeast mitochondria[J]. Botany, 2011, 89(7): 499-511. DOI:10.1139/b11-039.
[4] MATURANO Y P, RODRIGUEZ A L A, TORO M E, et al. Multienzyme production by pure and mixed cultures of Saccharomyces and non-Saccharomyces yeasts during wine fermentation[J]. International Journal of Food Microbiology, 2012, 155(1/2): 43-50. DOI:10.1016/j.ijfoodmicro.2012.01.015.
[5] HORECKA J, CHU A M, DAVIS R W. IPO: plasmids and methods for simplified, PCR-based DNA transplant in yeast[J]. Yeast, 2014, 31(5):185-193. DOI:10.1002/yea.3006.
[6] FLEET G H. Wine yeast for the future[J]. Fems Yeast Research, 2008,8(7): 979-995. DOI:10.1111/j.1567-1364.2008.00427.x.
[7] HERNÁNDEZ-ORTE P, CERSOSIMO M, LOSCOS N, et al.The development of varietal aroma from non-floral grapes by yeasts of different genera[J]. Food Chemistry, 2008, 107(3): 1064-1077.DOI:10.1016/j.foodchem.2007.09.032.
[8] VIANA F, GIL J V, GENOVÉS S, et al. Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J]. Food Microbiology, 2008, 25(6): 778-785.DOI:10.1016/j.fm.2008.04.015.
[9] CIANI M, COMITINI F, MANNAZZU I, et al. Controlled mixed culture fermentation: a new perspective on the use of non-Saccharomyces yeasts in winemaking[J]. Fems Yeast Research, 2010,10(2): 123-133. DOI:10.1111/j.1567-1364.2009.00579.x.
[10] ANFANG N, BRAJKOVICH M, GODDARD M R. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc[J]. Australian Journal of Grape and Wine Research, 2009, 15(1): 1-8.DOI:10.1111/j.1755-0238.2008.00031.x.
[11] HERRAIZ T, REGLERO G, HERRAIZ M, et al. The influence of the yeast and type of culture on the volatile composition of wines fermented without sulfur-dioxide[J]. American Journal of Enology and Viticulture,1990, 41(4): 313-318.
[12] KING A, DICKINSON J R. Biotransformation of monoterpene alcohols by Saccharomyces cerevisiae, Torulaspora delbrueckii and Kluyveromyces lactis[J]. Yeast, 2000, 16(6): 499-506. DOI:10.1002/(SICI)1097-0061(200004)16:6<499::AID-YEA548>3.0.CO;2-E.
[13] PLATA C, MILLAN C, MAURICIO J C, et al. Formation of ethyl acetate and isoamyl acetate by various species of wine yeasts[J]. Food Microbiology, 2003,20(2): 217-224. DOI:10.1016/S0740-0020(02)00101-6.
[14] RAYNAL C, WARDROP F, PILLET O, et al. An innovative tool for winemakers sequential inoculation with a non-Sacchoromyces yeast and a Saccharomyces cerevisiae yeast[J]. Wine Viticulture Journal, 2011,26(1): 22-32.
[15] ALVES-ARAUJO C, PACHECO A, ALMEIDA M J, et al. Sugar utilization patterns and respiro-fermentative metabolism in the baker’s yeast Torulaspora delbrueckii[J]. Microbiology, 2007, 153(3): 898-904.DOI:10.1099/mic.0.2006/003475-0.
[16] BELY M, STOECKLE P, MASNEUF-POMARÈDE I, et al. Impact of mixed Torulaspora delbrueckii-Saccharomyces cerevisiae culture on highsugar fermentation[J]. International Journal of Food Microbiology,2008, 122(3): 312-320. DOI:10.1016/j.ijfoodmicro.2007.12.023.
[17] HANSEN E H, NISSEN P, SOMMER P, et al. The effect of oxygen on the survival of non-Saccharomyces yeasts during mixed culture fermentations of grape juice with Saccharomyces cerevisiae[J]. Journal of Applied Microbiology, 2001, 91(3): 541-547. DOI:10.1046/j.1365-2672.2001.01426.x.
[18] HANL L, SOMMER P, ARNEBORG N. The effect of decreasing oxygen feed rates on growth and metabolism of Torulaspora delbrueckii[J]. Applied Microbiology and Biotechnology, 2005, 67(1):113-118. DOI:10.1007/s00253-004-1695-2.
[19] RENAULT P, MIOT-SERTIER C, MARULLO P, et al. Genetic characterization and phenotypic variability in Torulaspora delbrueckii species: potential applications in the wine industry[J]. International Journal of Food Microbiology, 2009, 134(3): 201-210. DOI:10.1016/j.ijfoodmicro.2009.06.008.
[20] CIANI M, COMITINI F, MANNAZZU I, et al. Controlled mixed culture fermentation: a new perspective on the use of non-Saccharomyces yeasts in winemaking[J]. FEMS Yeast Research, 2010,10(2): 123-133. DOI:10.1111/j.1567-1364.2009.00579.x.
[21] ZOTT K, THIBON C, BELY M, et al. The grape must non-Saccharomyces microbial community: impact on volatile thiol release[J].International Journal of Food Microbiology, 2011, 151(2): 210-215.DOI:10.1016/j.ijfoodmicro.2011.08.026.
[22] BARBOSA C, FALCO V, MENDES-FAIA A, et al. Nitrogen addition influences formation of aroma compounds, volatile acidity and ethanol in nitrogen deficient media fermented by Saccharomyces cerevisiae wine strains[J]. Journal of Bioscience and Bioengineering, 2009, 108(2): 99-104.DOI:10.1016/j.jbiosc.2009.02.017.
[23] MENDES-FERREIRA A, BARBOSA C, FALCO V, et al. The production of hydrogen sulphide and other aroma compounds by wine strains of Saccharomyces cerevisiae in synthetic media with different nitrogen concentrations[J]. Journal of Industrial Microbiology, 2009,36(4): 571-583. DOI:10.1007/s10295-009-0527-x.
[24] SADOUDI M, TOURDOT-MARÉCHAL R, ROUSSEAUX S, et al. Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J]. Food Microbiology, 2012,32(2): 243-253. DOI:10.1016/j.fm.2012.06.006.
[25] VIANA F, GIL J V, GENOVÉS S, et al. Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J]. Food Microbiology, 2008, 25(6): 778-785.DOI:10.1016/j.fm.2008.04.015.
[26] BLOMBERG A, ALDER L. Physiology of osmotolerance in fungi[J].Advanced in Microbiology and Physiology, 1992, 33: 145-212.DOI:10.1016/S0065-2911(08)60217-9
[27] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5): 873-882.DOI:10.1016/j.fm.2010.12.001.
[28] BENITO S, MORATA A, PALOMERO F, et al. Formation of vinylphenolic pyranoanthocyanins by Saccharomyces cerevisiae and Pichia guillermondii in red wines produced following different fermentation strategies[J]. Food Chemistry, 2011, 124(1): 15-23.DOI:10.1016/j.foodchem.2010.05.096.
[29] CONTRERAS A, HIDALGO C, HENSCHKE P A, et al. Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J]. Applied and Environmental Microbiology, 2013, 80(5): 1670-1678. DOI:10.1128/AEM.03780-13.
[30] SWIEGERS J H, PRETORIUS I S. Yeast modulation of wine flavor[J].Advances in Applied Microbiology, 2005, 57: 131-175. DOI:10.1016/S0065-2164(05)57005-9.
[31] 王华, 李华, 刘拉平, 等. 菠萝果酒香气成分的GC-MS分析[J]. 西北农林科技大学学报, 2005, 33(4): 144-146. DOI:10.3321/j.issn:1671-9387.2005.04.033.
[32] RAPP A, MANDERY H. Wine aroma[J]. Experientia, 1986, 42(8): 873-884. DOI:10.1007/BF01941764.
[33] AZZOLINI M, FEDRIZZI B, TOSI E, et al. Effects of Torulaspora delbrueckii and Saccharomyces cerevisiae mixed cultures on fermentation and aroma of Amarone wine[J]. European Food Research and Technology, 2012, 235(2): 303-313. DOI:10.1007/s00217-012-1762-3.
[34] TRINH T T T, WOON W Y, YU B, et al. Effect of L-isoleucine and L-phenylalanine addition on aroma compound formation during Longan juice fermentation by a co-culture of S. cerevisiae and Williopsis saturnus[J]. South African Journal of Enology and Viticulture, 2010,31(2): 116-124. DOI:10.21548/31-2-1408.
[35] MOLINA A M, GUADALUPE V, VARELA C, et al. Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J]. Food Chemistry, 2009, 117(2): 189-195.DOI:10.1016/j.foodchem.2009.03.116.
[36] PALOMO E S, DÍAZ-MAROTO M C, VIÑAS M A G, et al. Aroma profile of wines from Albillo and Muscat grape varieties at different stages of ripening[J]. Food Control, 2007, 18(5): 398-403. DOI:10.1016/j.foodcont.2005.11.006.
[37] TAILLANDIER P, LAI Q P, JULIEN-ORTIZ A, et al. Interactions between Torulaspora delbrueckii and Saccharomyces cerevisiae in wine fermentation: influence of inoculation and nitrogen content[J].World Journal of Microbiology and Biotechnology, 2014, 30(7): 1959-1967. DOI:10.1007/s11274-014-1618-z.
[38] ROJAS V, GIL J V, PIÑAGA F, et al. Studies on acetate ester production by non-Saccharomyces wine yeasts[J]. International Journal of Food Microbiology, 2001, 70(3): 283-289. DOI:10.1016/S0168-1605(01)00552-9.
