饮用水遗传毒性评价方法建立和应用
2018-02-08唐光媛尹洁晨龚煜范焦志刚黄书奇朱光灿
唐光媛 王 洁 尹洁晨 严 庆 龚煜范焦志刚 曹 猛 黄书奇 朱光灿 刘 冉
(1东南大学公共卫生学院,南京 210009)(2东南大学能源与环境学院,南京 210096)
生活饮用水卫生安全与人体健康关系密切.国内外流行病学研究表明,饮用水中多种污染物具有“三致”效应,长期暴露于受污染的饮用水会增加食管癌、胃癌、肾癌和膀胱癌等恶性肿瘤的发病风险[1-3].疾病、肿瘤的发生与遗传物质的改变密切相关.因此,将遗传毒性检测应用于水质安全评价,可预防疾病发生,并从生物学角度评价饮用水的安全问题.
近年来,越来越多的短期检测生物试验被用于饮用水遗传毒性的检测,但多为单个试验[4-5].然而,环境样品中污染物为复合型污染物,单一的毒性试验无法检测所有污染物的作用机理.
本文选用国际公认度最高的Ames试验为基础,以人的外周血淋巴细胞胞质分裂阻滞微核试验和彗星试验作为补充,建立了一组遗传毒性测试体系,并将其应用于盐城某水厂饮用水处理过程单元出水的安全评价中.
1 材料与方法
1.1 仪器与试剂
实验试剂包括标准品敌克松、甲基磺酸甲酯标准品(质量分数大于99%,德国Dr公司)、2-氨基芴、丝裂霉素标准品(质量分数大于98%,美国sigma公司)、S9(江苏齐氏生物科技有限公司)、彗星检测试剂盒(美国Cell Biolabs公司)、淋巴细胞分离液(美国MP公司).
实验仪器包括固相萃取装置(美国Supelco公司)、平行浓缩仪(北京普立泰科仪器有限公司)、水平电泳仪(北京君意东方电泳设备有限公司)和生物智能导航仪(日本Olympus公司).
1.2 水样前处理
采用XAD-2型树脂柱富集水样中有机物.树脂前处理参照《城市供水致突变物的测定标准》(CJT 150—2001),用丙酮、乙醚、甲醇各蒸馏回流8 h,水样过柱流速约为40 mL/min.富集完成后,真空干燥树脂柱.加入3倍柱体积的色谱纯丙酮、甲醇(体积比为3∶7)混合溶剂浸泡,以3 mL/min流速收集洗脱液于玻璃试管中,倒入平行浓缩仪浓缩至1 mL左右,加DMSO定容至2.0 mL,并于-20 ℃保存备用.
1.3 Ames试验
本文试验采用的测试菌株TA98和TA100由上海市疾病预防控制中心馈赠,菌种特性符合试验要求.试验在加S9和不加S9混合液的条件下进行,试验水样设计为3个剂量组,浓度分别为2.0,1.0,和0.5 L/皿,各剂量设置3个平行样.同时,设计溶剂对照组(DMSO)和阳性对照组(未加S9情况下,TA98采用50 μg/皿敌克松,TA100采用1 μL/皿甲基磺酸甲酯;添加S9情况下,TA98,TA100均采用10 μg/皿2氨基芴).平板掺入后,37 ℃培养48 h,然后计数每皿的回变菌落数,试验结果以回复突变率表示.回复突变率为诱变菌落数与阴性对照菌落数的比值,若回复突变率大于2且呈剂量反应关系,则认为具有致突变作用.
1.4 胞质分裂阻滞微核试验
采集健康成人外周血于肝素抗凝管中,每0.4 mL抗凝血加入0.2 mL PHA和适量完全培养基(含体积分数为10%的 FBS),使染毒体系为5 mL.轻柔混匀后放置于培养箱(37 ℃,含体积分数为5%的CO2),培养44 h后加入0.1 mL细胞松弛素B.继续培养至48 h后染毒,水样浓度设置为1.000,0.500,0.250,0.125 L/孔.阳性对照为丝裂霉素C(终浓度为0.1 μg/mL),阴性对照采用溶剂DMSO.继续培养至72 h,收取细胞.KCL溶液低渗处理后,经体积比为3∶1的甲醇和乙酸混合液预固定一次,再经体积比为5∶1的甲醇和乙酸混合液固定2次,离心弃上清,零高度滴片,采用体积分数为10%的Giemsa染液染色15 min.利用倒置显微镜观察,每组计数1 000个以上双核细胞,计算微核细胞率和污染指数.微核细胞率为1 000个双核细胞中含有微核的细胞数,污染指数v以水样微核细胞率与阴性对照微核细胞率比值表示,v<1.5视为基本无污染,1.5≤v<2.0为轻度污染,2.0≤v<3.5为中度污染,v≥3.5则为重度污染.
1.5 彗星试验
取新鲜抗凝全血,用等体积PBS稀释,置于淋巴细胞分离液上,2 200 r/min离心22 min.离心结束后,小心吸取白膜层到另一离心管中.PBS调节细胞浓度为1.0×105个/mL.染毒体系为1 mL,水样浓度设置为1.000,0.500,0.250,0.125 L/管,37 ℃下染毒1 h,离心去上清液,用PBS冲洗一次.最后,采用PBS将细胞重悬,并稀释成细胞浓度为1.0×105个/mL.
参照试剂盒中方法,将细胞悬液与琼脂糖按体积比1∶10的比例混合,铺到OxiSelectTMComet Slide玻璃板上,静置15 min.然后,放置于裂解液中裂解60 min,碱性处理后于电压23 V、电流300 mA的条件下水平电泳25 min.取出玻璃板,分别用蒸馏水和酒精洗去电泳液,自然晾干,采用VistaDNA染料染色15 min.利用生物智能导航仪观察细胞,以尾部DNA百分数表示受损伤程度.
1.6 数据统计分析
采用SPSS 20.0软件进行统计学分析.组间差异采用单因素方差分析,两两比较采用LSD法检验.以p<0.05表示差异有统计学意义.
2 结果与分析
2.1 水样采集及评价流程
2016年9月采集盐城某水厂示范工程水样,其原水为淮河流域盐龙湖水.处理工艺为原水—预O3—混凝池—沉淀池—砂滤池—后O3—生物活性炭滤池—消毒池—出厂水.其中,混凝—沉淀—砂滤为常规处理工艺,后O3和生物活性炭(BAC)为深度处理工艺.本文试验中采集了原水、砂滤水、BAC水和出厂水共4个水样,分别代表饮用水处理过程中的原水、常规处理工艺出水、深度处理工艺出水和出厂水,每个水样采集100 L.应用建立的多效应终点、多层次遗传毒性测试体系,对水样浓集物遗传毒性不同效应终点进行检测,具体流程见图1.
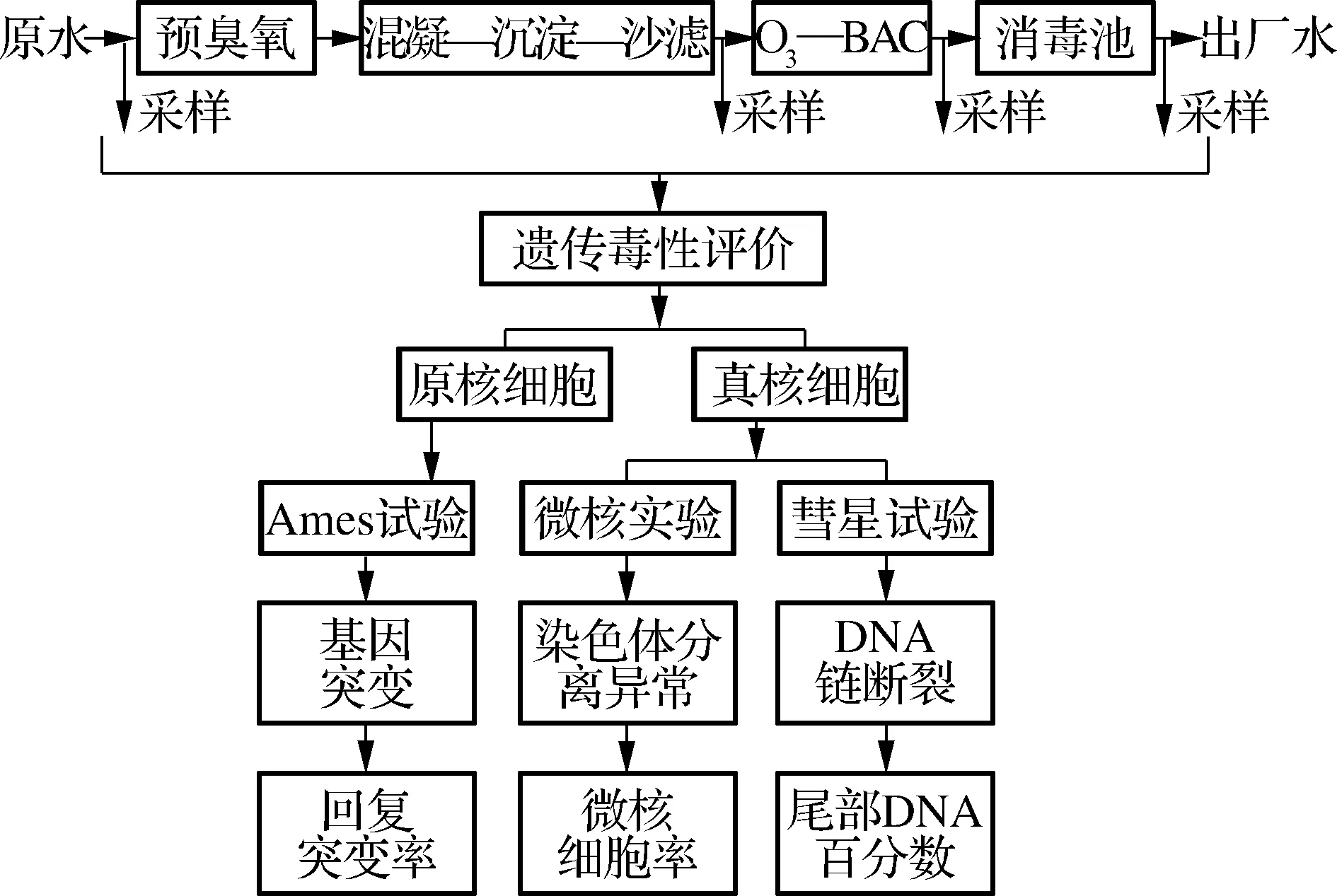
图1 工艺及评价流程
2.2 Ames试验结果
Ames试验结果见表1.由表可知,对于TA98,TA100菌株,无论是否添加S9,各水样在2.0,1.0和0.5 L/皿3个剂量下的回复突变率均小于2,未发现阳性结果.但原水、砂滤水和出厂水3个水样在未加S9和加S9的情况下,TA98,TA100菌株的回复突变率都呈现出了剂量反应关系,这可能是因为水样浓集物中具有致突变物,但在2 L剂量范围内尚未达到致突变的阳性浓度.
2.3 微核试验结果
微核试验结果见表2.由表可知,原水、砂滤水、出厂水均出现阳性结果,且3个水样都表现出较强的致染色体畸变作用.最小剂量0.125 L/孔处微核细胞率分别为(1.140±0.198)%,(1.052±0.088)%和(0.913±0.047)%,显著高于对照组,具有统计学意义(p<0.05),呈现轻度污染,且微核细胞率存在剂量反应关系.而在经过深度处理后的BAC出水中未检出阳性结果,在0.125~1.000 L/孔的剂量范围内微核细胞率与对照组结果无统计学差异.

表1 水样浓集物的回复突变率 %
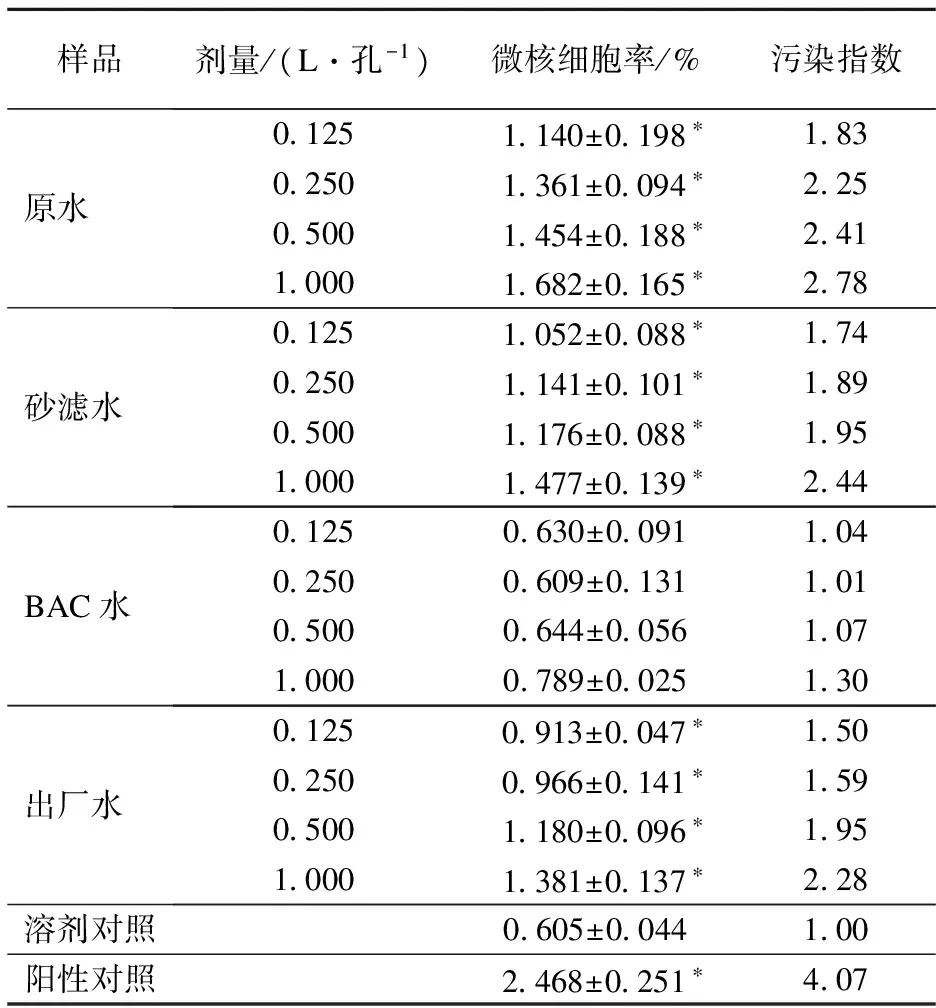
表2 水样浓集物微核试验结果
注:*表示与溶剂对照相比,差异具有统计学意义(p<0.05).
2.4 彗星试验结果
外周血淋巴细胞短期染毒后,经台盼蓝染色,细胞存活率大于95%,表明水样未显示急性毒性.彗星试验结果见表3.由表可知,各水样在不同剂量下均出现了DNA损伤,存在剂量反应关系,与溶剂对照组比较,差异具有统计学意义(p<0.05).原水、砂滤水和出厂水出现DNA损伤的最低浓度分别为0.25,0.50和0.25 L/mL,而BAC水只在高剂量组1.00 L/mL出现了损伤,DNA损伤程度从大到小依次为原水、出厂水、砂滤水和BAC水.
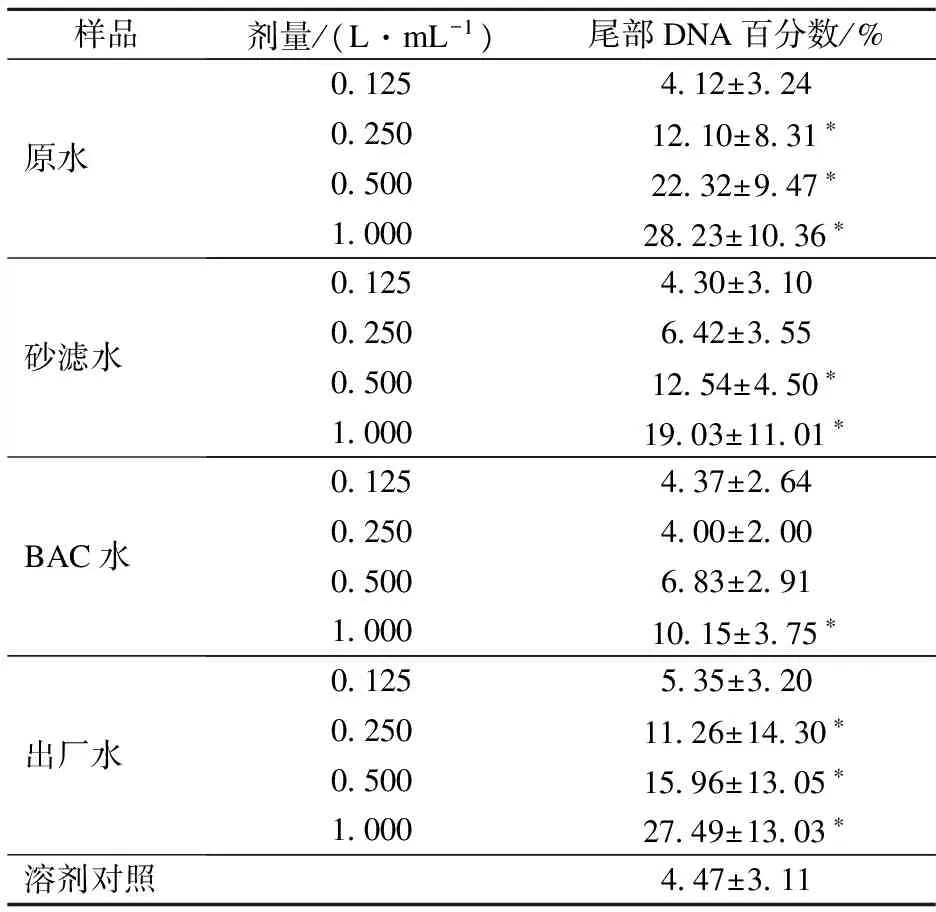
表3 水样浓集物彗星试验试验结果
注:*表示与溶剂对照相比,差异具有统计学意义(p<0.05).
2.5 结果分析
将所建立的多效应终点、多层次遗传毒性测试体系应用于饮用水处理过程评价,发现原水、砂滤水和出厂水都表现出不同程度的遗传毒性,混凝—沉淀—砂滤的常规处理工艺对饮用水中致突变物去除效果较差,这与国内相关研究结果一致[6].究其原因可能是由于常规处理对浊度、细菌具有较好的去除效果,但对于水中溶解性有机物(尤其是分子量较小的有机物)去除效果不明显.文献[7]指出,饮用水中致突变作用主要由分子量小于800的多环芳烃引起,而生物活性炭可以很好地吸附小分子有机物.本文试验中O3—BAC深度处理工艺后水样致突变性显著降低,说明在常规处理后加入O3—BAC深度处理工艺可有效去除水中致突变性有机物,提高水质安全性.而经过氯化消毒后,水样的微核细胞率和DNA损伤程度显著上升,这可能是与氯化消毒产生的消毒副产物有关,如致突变物三卤甲烷、卤乙酸和亚硝胺类[8-9]等.
从检测结果可知,Ames试验在此次检测剂量范围内未见阳性结果,灵敏度低于微核和彗星试验.但Ames试验为国际公认的检测环境污染物致突变性的首选试验,也是水环境遗传毒性检测应用最多的测试体系,可检测点突变类型,结果稳定可靠[10].然而文献[11]表明,对于同一水样的遗传毒性检测,细菌和哺乳动物细胞的结果可能存在差异.因此,单独采用Ames原核菌株诱变系统无法预测所有潜在的遗传学机制.将原核菌株与哺乳动物真核细胞相结合,建立多层次遗传毒性分析系统,能够较好地解决致突变物的遗传毒性评价在种属外推上的问题.
目前,哺乳动物细胞体外遗传毒性试验方法中应用较多的是微核试验和彗星试验[12].微核试验检测的是细胞分裂过程中染色体或染色单体的无着丝点断片或纺锤丝受损伤情况,是经国际验证、短期检测结构相近的致癌物与非致癌物的最佳方法,已广泛应用于环境污染物致突变性检测中.彗星试验可反映DNA单链和双链断裂、DNA不完全切除的修复情况,检测更为灵敏,且在检测含氯化合物时优于Ames试验和微核试验,检测谱更宽[13].将3个试验结合,可更全面地检测不同遗传学终点,互相补充、验证,减少假阳性和假阴性结果,能客观反映水体中遗传毒性水平,对饮用水安全作出更为科学可靠的评价.
3 结论
1) 将建立的多效应终点、多层次的饮用水遗传毒性测试体系应用于盐城某饮用水处理过程中各个单元出水检测.结果表明,水厂饮用水处理过程中遗传毒性变化趋势为先降低后升高,O3—BAC处理后水样遗传毒性明显下降,而消毒后水样毒性显著上升.
2) 3个不同遗传终点的测试体系在饮用水遗传毒性检测中的灵敏度存在差异,Ames试验灵敏度低于微核和彗星试验.
3) 以Ames试验为基础,结合微核试验以及彗星试验进行进一步的验证,既可以检测原核生物与真核生物,还可以同时检测基因突变、染色体损伤、DNA链断裂3个遗传学终点,适用于饮用水的遗传毒性和致突变机理研究.
)
[1] Mi J, Peng W, Jia X, et al. A case-control study on the relationship of crocidolite pollution in drinking water with the risk of gastrointestinal cancer in Dayao County[J].Journalofhygieneresearch, 2015,44(1): 28-32.
[2] Steinmaus C, Ferreccio C, Yuan Y, et al. Elevated lung cancer in younger adults and low concentrations of arsenic in water [J].AmJEpidemiol, 2014,180(11): 1082-1087.
[3] Gan W, Guo W, Mo J, et al. The occurrence of disinfection by-products in municipal drinking water in China’s Pearl River Delta and a multipathway cancer risk assessment[J].SciTotalEnviron, 2013,447: 108-115. DOI:10.1016/j.scitotenv.2012.12.091.
[4] Lu W Q, Chen D, Wu X J, et al. DNA damage caused by extracts of chlorinated drinking water in human derived liver cells (HepG2)[J].Toxicology, 2004,198(1/2/3): 351-357. DOI:10.1016/j.tox.2004.02.011.
[5] Mehinto A C, Jia A, Snyder S A, et al. Interlaboratory comparison of in vitro bioassays for screening of endocrine active chemicals in recycled water[J].WaterRes, 2015,83: 303-309. DOI:10.1016/j.watres.2015.06.050.
[6] 吴南翔, 李新伟, 陶核, 等. 饮用水深度处理过程中有机提取物的致突变性[J]. 环境与健康杂志, 2008, 25(2): 107-111. DOI:10.3969/j.issn.1001-5914.2008.02.005.
Wu Nanxiang, Li Xinwei, Tao He, et al. Removal of organic mutagen in tap water[J].JournalofEnvironmentandHealth, 2008,25(2): 107-111. DOI:10.3969/j.issn.1001-5914.2008.02.005.(in Chinese)
[7] Noot D K, Anderson W B, Daignault S A, et al. Evaluating treatment processes with the Ames mutagenicity assay [J].JournaloftheAmericanWaterWorksAssociation, 1989,81(9): 87-102.
[8] Liu Q, Zhang L P, Liu W J, et al. Genotoxicity of drinking water during chlorine and chloramine disinfection and the influence of disinfection conditions using the umu-test[J].EnvironmentalScience, 2010,31(1): 93-98.
[9] Zhang S H, Miao D Y, Tan L, et al. Comparative cytotoxic and genotoxic potential of 13 drinking water disinfection by-products using a microplate-based cytotoxicity assay and a developed SOS/umu assay[J].Mutagenesis, 2016,31(1): 35-41. DOI:10.1093/mutage/gev053.
[10] Lü X, Lu Y, Yang X, et al. Mutagenicity of drinking water sampled from the Yangtze River and Hanshui River (Wuhan section) and correlations with water quality parameters[J].SciRep, 2015,5: 9572. DOI:10.1038/srep09572.
[11] 刘楠楠.饮用水处理过程遗传毒性评价方法研究与应用[D].北京:中国科学院生态环境研究中心,2013.
[12] Chen T, Xu Y, Liu Z, et al. Evaluation of drinking water treatment combined filter backwash water recycling technology based on comet and micronucleus assay[J].JEnvironSci(China), 2016,42: 61-70. DOI:10.1016/j.jes.2015.05.020.
[13] 王涛, 衡正昌, 张遵真. 彗星试验检测环境致癌物的敏感性评价[J]. 卫生毒理学杂志, 2001, 15(1): 58-60.
Wang Tao, Heng Zhengchang, Zhang Zunzhen, et al. Evaluation of the sensitivity of comet assay to environmental carcinogens[J].JournalofHealthToxicology, 2001,15(1): 58-60. (in Chinese)
