支气管哮喘在胃食管反流病中的作用研究
2018-02-06巴突尔艾克木古丽帕丽哈里甫吾布力卡斯木吾拉木克力木阿不都热依木
巴突尔·艾克木, 古丽帕丽·哈里甫, 吾布力卡斯木·吾拉木, 克力木·阿不都热依木,2
(1新疆医科大学研究生院, 乌鲁木齐 830011; 2新疆维吾尔自治区人民医院微创、疝和腹壁外科, 乌鲁木齐 830001)
胃食管反流病(gastroesophageal reflux disease, GERD)被认为与众多呼吸系统疾病相关,尤其与支气管哮喘关系尤为密切。反流可能通过调控迷走神经反射、引起微量误吸等方式加重气道梗阻并引发或加重哮喘,抑酸类制剂也因此在难治性哮喘、慢性咳嗽等疾病治疗中被越发广泛地使用[1]。然而近来不少研究开始关注哮喘对GERD的影响[2-4],认为哮喘同时也可能是GERD加重的因素。食管动力异常作为GERD最常见的病因之一,在一定程度上可能受呼吸道功能的影响,但目前关于哮喘与食管动力方面的研究报道较少。本研究通过分析支气管哮喘患者的高分辨率食管测压(high resolution manometry, HRM)、食管24 h pH监测等数据,探讨支气管哮喘的反流特点及其对食管动力的作用,进一步阐明哮喘对GERD的影响。
1 资料与方法
1.1一般资料收集2013年1月-2017年6月于新疆维吾尔自治区人民医院普外微创研究所行HRM、食管24 h pH监测的82例患者的临床资料,其中男性39例,女性43例,患者年龄 28~80 岁,平均年龄(49.94±11.59)岁。
GERD合并哮喘组(22例)入选标准:(1)年龄>18岁;(2)无食管及上腹部手术史,无消化性溃疡;(3)无原发性食管功能异常(贲门失弛缓症,弥漫性食管痉挛,胡桃夹食管,系统性硬皮病、巨大食管裂孔疝等);(4)根据胃食管反流病诊断标准被确诊GERD;(5)根据支气管哮喘诊断标准被确诊为非危重型哮喘并无其他严重呼吸道疾病; GERD非哮喘组(39例)入选标准:符合上述(1)~(4)条件并排除支气管哮喘及其他严重呼吸道疾病的患者;阴性组(21例)入选标准:符合(1)~(3)标准并排除GERD及哮喘诊断且不合并其他严重呼吸道疾病的患者。GERD合并哮喘组、GERD非哮喘组和阴性组在年龄、性别、BMI等差异均无统计学意义(P>0.05),具有可比性,见表1。
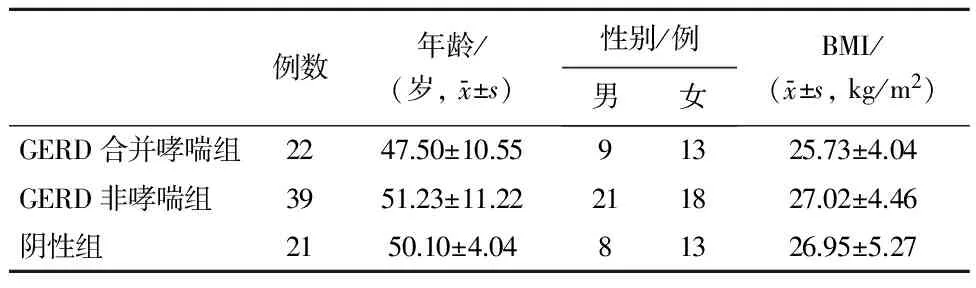
表1 3组一般情况比较
1.2方法
1.2.1 HRM检查 HRM检查前5 d停止服用钙离子通道阻滞剂、促动力剂、硝酸甘油等药物并空腹8 h。HRM采用360通道固态高分辨率食管测压系统及其分析软件。被检者取坐位从一侧鼻孔插入电极导管, 待3~4个电极通过胃食管连接处后妥善固定导管。测压时患者平卧,充分适应后采集静息状态食管压力水平30 s,后嘱患者湿咽5 mL温水10次,每次吞咽间隔30 s。完成监测后拔出导管,分析并报告结果。
1.2.2 食管24 h pH监测 检查前 5 d 停用抗酸、抑酸药。食管24 h pH监测应用便携式 24 h 食管动态 pH 监测仪及其分析软件。校准后,被检者取坐位经一侧鼻腔插入测酸定位电极,将电极置于食管下括约肌(lower esophageal sphincter,LES)近端上5 cm 处并固定导管。嘱患者记录期间进食、平卧及出现胃食管反流症状的时间。食管24 h pH监测结束后拔出导管后上传数据,分析并报告结果。
2 结果
2.13组食管动力学比较GERD合并哮喘组食管上括约肌(upper esophageal sphincter,UES)残余压较GERD非哮喘组低(P<0.05),但3组在LES长度、LES静息压、LES残余压、UES静息压、UES残余压以及食管远端收缩积分(distal contractile integral,DCI)差异均无统计学意义(P>0.05),见表2。
2.23组食管酸暴露比较GERD合并哮喘组患者食管24 h pH监测中pH≤4(酸反流)的总次数较阴性组多(P<0.05),但与GERD非哮喘组比较差异无统计学意义(P>0.05);GERD患者DeMeester评分较阴性组较高(P<0.05),但GERD合并哮喘组与GERD非哮喘组之间比较差异无统计学意义(P>0.05);3组4

表2 3组患者食管动力学比较
注:与GERD非哮喘组比较,*P<0.05。

表3 3组患者食管酸暴露比较[M(P25,P75)]
注:与阴性组比较,*P<0.05。
3 讨论
支气管哮喘患者中GERD的发生率相当高[5],然而反流究竟是哮喘的始动因素还是继发改变尚无定论。由于近年来的研究导向,胃食管反流对呼吸道功能的作用正逐渐清晰,但以哮喘为代表的呼吸系统疾病对GERD发生发展的影响成为了目前亟待深入研究的课题。
支气管哮喘作为一种常见的呼吸道疾病,既可以改变肺容积,又能对呼吸方式产生影响,2种因素在胃食管反流中均发挥着明显作用。具体来讲,吸气时膈肌收缩下移使胸腔容积扩大并形成负压,正常肺组织在胸腔内充分扩张,空气便可借由气道形成的压力梯度被吸进肺内;当支气管阻力升高或肺顺应性下降时,胸腔需要制造更大的负压以帮助肺组织尽可能扩张,吸气时造成的胸腔负压也越大,这时食管反流也越容易发生,尤其在一过性食管下括约肌松弛(transient LES relaxation,TLESR)期间[6]。
本研究发现,GERD合并哮喘患者LES长度与其余2组基本无异,其LES静息压、残余压较非哮喘组和阴性组略高,但差异无统计学意义;DCI在3组间亦无明显差异,提示哮喘对食管下括约肌形态和功能以及食管远端收缩能力没有明显影响。GERD患者UES静息压稍高,但差异无统计学意义,但合并哮喘的GERD患者UES残余压较不合并哮喘的GERD患者明显降低,提示哮喘与GERD中UES残余压的降低有关。
UES最基本的作用即在反流发生时阻止胃液流入咽部[7],根据食管扩张情况UES可作出收缩或舒张反应,如反流液或气体引起食管远端扩张时UES会选择收缩以自我保护。Babei等[8]发现体位、反流物的物理性质以及食管内压变化速度与幅度均可影响UES压力,然而尚无研究报道支气管哮喘或气道功能异常可能对UES产生直接影响。可能的理论之一是哮喘患者的过度通气,这也是哮喘引起反流的机制之一,研究证实正常人呼吸频率和潮气量的增高均可增加反流事件的发生次数,进而对食管动力和食管括约肌压力产生影响,这一现象在胃食管连接部(esophagogastric junction,EGJ)功能失调时更加明显[9]。过度通气对食管蠕动也有显著负作用,可造成食管自净能力降低和排空障碍[10]。除此之外食管-支气管反射理论亦可对此作出解释。气道和食管的神经元经过孤束核交汇于脑干,支气管阻塞或痉挛与胃食管反流可借此双向通道彼此影响,即气道反应可诱发反流,反流亦可影响气道功能。Zerbib等[11]对支气管哮喘患者行激发试验时发现TLESR和总反流事件增加,由此推断这与食管-气管共同传导通路相关。因此,尽管支气管功能影响UES的机制尚不明了,但UES压力降低的确与GERD患者中哮喘的发生密切相关。
本研究同时分析了各组患者食管24 h pH监测数据,发现GERD合并哮喘组在酸反流、弱酸反流以及反流总次数上均略高于其余2组,但其中只有pH≤4的酸反流事件数与阴性组间差异有统计学意义,而与GERD非哮喘组比较差异并无统计学意义。比较3组近端反流所占百分比后发现,组间亦无明显差异。本研究将DeMeester评分纳入比较旨在分析哮喘对GERD患者酸暴露水平有无影响,结果显示GERD无论有无合并哮喘,DeMeester评分差异并无统计学意义,即哮喘并没有加重胃食管反流中的酸暴露。
本研究仍存在许多局限性,因HRM检查对严重支气管哮喘患者具有一定的风险性,研究入选对象皆为非危重哮喘患者,并且未能联合患者肺功能检查对其疾病严重性作进一步分级评估;GERD和哮喘可能彼此影响,相互加剧。本研究未能纳入GERD合并哮喘患者的相关详细病史并进一步分析GERD症状与哮喘症状何者较先出现,在病程中起主导作用。
哮喘并不能加重或减轻GERD患者食管酸暴露水平,对LES长度、功能以及远端食管收缩力等食管动力学指标并无明显影响,但可以降低UES残余压,其机制与食管动力障碍引起的UES功能失调可能不同。积极治疗哮喘可能对控制GERD及其相关并发症起到重要作用,然而哮喘在GERD中的作用仍有待进一步探究。
[1] 刘东华. 埃索美拉唑治疗支气管哮喘合并胃食管反流疗效观察[J]. 现代中西医结合杂志, 2015(32):3602-3604.
[2] HOUGHTON L A, LEE A S, BADRI H, et al. Respiratory disease and the oesophagus:reflux, reflexes and microaspiration[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(8):445-460.
[3] AMARASIRI W A, PATHMESWARAN A, DE SILVA A P, et al. Gastric motility following ingestion of a solid meal in a cohort of adult asthmatics[J].J Neurogastroenterol Motil, 2013, 19(3):355-365.
[4] TARIQ K, BARBER C, GOVE K, et al. Role of gastro-oesophageal reflux in severe asthma:experience from the wessex severe asthma cohort[J]. Eur Respir J, 2015, 46(suppl 59):PA4578.
[5] 刘映霞, 江山平, 谭艳芳. 抗反流药物治疗对支气管哮喘伴胃食管反流患者哮喘症状影响的荟萃分析[J]. 中华结核和呼吸杂志, 2010, 33(11):823-830.
[6] GAUDE G S, HATTIHOLI J, BHOMA G, et al. Prevalence of GERD in bronchial asthma and COPD:assessment using FSSG scale and gastroesophageal endoscopy[J]. J Evol Med Dent Sci, 2014, 3(22):6087-6095.
[7] HONG C M, GALVAGNO S M J R. Patients with chronic pulmonary disease[J]. Med Clin North Am, 2013, 97(6):1095-1107.
[8] BABAEI A, DUA K, NAINI S R, et al. Response of the upper esophageal sphincter to esophageal distension is affected by posture, velocity, volume, and composition of the infusate[J]. Gastroenterology, 2012, 142(4):734-743.
[9] COCK C, JONES C A, HAMMER M J, et al. Modulation of upper esophageal sphincter (UES) relaxation and opening during volume swallowing[J]. Dysphagia, 2017, 32(2):216-224.
[10] KWIATEK M A, PANDOLFINO J E, HIRANO I, et al. Esophagogastric junction distensibility assessed with an endoscopic functional luminal imaging probe(EndoFLIP)[J]. Gastrointest Endosc, 2010, 72(2):272-278.
[11] ZERBIB F, GUISSET O, LAMOULIATTE H, et al. Effects of bronchial obstruction on lower esophageal sphincter motility and gastroesophageal reflux in patients with asthma[J]. Am J Respir Crit Care Med, 2002, 166(9):1206-1211.
