Toll样受体4在棕榈酸诱导RAW264.7巨噬细胞炎症反应中的作用及机制
2018-02-02闫美玲秦寅鹏王文一张弋
闫美玲,秦寅鹏,王文一,张弋△
肥胖、高血脂和糖尿病等代谢疾病均伴随血清炎症因子如肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)等的升高,亦往往伴随免疫细胞(如巨噬细胞)向脂肪组织浸润,通常称之为炎性状态[1-2]。研究显示,这些代谢疾病通常伴随着血清自由脂肪酸(free fatty acids,FFA)浓度的升高[2-3]。FFA 是高脂饮食的主要成分,过量的FFA可引起脂毒性,损伤正常细胞并引起炎症发生,其中饱和脂肪酸对炎症的影响尤为突出[4]。棕榈酸是人和小鼠循环系统中主要的饱和脂肪酸,可引起脂肪细胞和胰岛β细胞的炎症反应,诱导细胞凋亡及胰岛素抵抗的发生[5-6]。Toll样受体 4(toll-like receptor 4,TLR4)是模式识别受体家族中的重要一员,在炎症和免疫方面发挥重要作用[7-8]。TLR4是炎症信号传导的门户蛋白,可激活细胞内促炎性反应信号通路,进而诱导炎症细胞因子的表达[9]。然而,棕榈酸能否诱导脂肪组织浸润的巨噬细胞启动炎症反应,TLR4是否参与介导炎症反应,目前仍不明确。本研究旨在建立棕榈酸诱导的RAW264.7巨噬细胞炎症反应细胞模型,探讨TLR4在此过程中的作用及相关机制。
1 资料与方法
1.1 一般资料 (1)动物与细胞。无特定病原体(specified pathogens free,SPF)级健康雄性C57BL/6J小鼠20只,购自北京华阜康生物科技股份有限公司,体质量15~17 g,4~5周龄。小鼠巨噬细胞RAW264.7购自中国科学院典型培养物保藏委员会细胞库。(2)主要仪器与试剂。DMEM培养基、碳酸氢钠溶液和胎牛血清购自美国Invitrogen Gibco公司;Trizol、逆转录试剂盒和荧光实时定量PCR试剂盒购自大连宝生物工程技术公司;PCR引物购自上海生物工程有限公司;小鼠抗小鼠β-actin单克隆抗体、小鼠IL-6、TNF-α和MCP-1的酶联免疫吸附试验(ELISA)试剂盒购自武汉博士德生物工程有限公司;Western细胞裂解液、核因子κB(Nuclear factor κB,NF-κB)p65 兔抗小鼠抗体、Cy3标记山羊抗兔IgG(H+L)和NF-κB激活-核转运检测试剂盒购自江苏碧云天公司;小鼠NF-κB p65 ELISA试剂盒购自美国R&D公司;兔抗小鼠TLR4多克隆抗体和兔抗小鼠NF-κB p65多克隆抗体(S536)购自美国Abcam公司;HRP标记抗小鼠二抗,HRP标记抗兔二抗购自北京中杉金桥公司。
1.2 方法
1.2.1 C57BL/6J小鼠肥胖模型建立 20只小鼠适应性喂养1周后称量空腹体质量并标号,随机数字表法分为正常对照(Control)组和高脂饲料(High-Fat Diet)组,每组10只。对照组正常饮食,高脂饲料组建立高脂饲料(high-fat diet,HFD)诱导的肥胖小鼠模型[10]。实验中基础饲料参照AIN-96G配制,高脂饲料在基础饲料基础上添加10%猪油、10%蛋黄粉。实验期间饲养温度20~25℃,昼夜明暗交替日光灯照明,自由饮水。高脂饮食诱导18周后,采用精密电子天平称量小鼠的体质量。用10%水合氯醛腹腔注射麻醉后,测其体长(鼻尖到肛门外沿的长度),计算 Lee’s指数,Lee’s指数=[体质量(g)×103/体长(cm)]1/3。
1.2.2 脂肪组织的采集 高脂饮食诱导结束后,小鼠禁食12 h,不禁水,称量体质量。采用10%水合氯醛腹腔注射麻醉。麻醉后依据以下步骤采集血液和组织样本:(1)打开腹腔,取腹主动脉血 0.2~0.5 mL,3 000 r/min离心 15 min,取上清液,贮存于-80℃冰箱保存备用。(2)采血完毕后开胸,以灭菌磷酸盐缓冲液(PBS)经心尖灌流至组织变白后,依次分离肾周、肠系膜和附睾部位脂肪组织,将其放入盛有预冷PBS的玻璃培养皿中洗净,用滤纸吸干组织液后称质量,随后放入EP管中,于-80℃冰箱保存待用。
1.2.3 FFA水平的测定 采用铜皂分光光度法测定小鼠血清中的FFA水平。(1)标准品溶液的配制:采用含2%甲醇的氯仿-庚烷(4∶3,V/V)配置 1.60、0.80、0.40、0.20、0.10、0.05 mmol/L棕榈酸标准品溶液。(2)铜试剂工作液的配制:取10 mL 0.5 mmol/L Cu(NO3)2,10 mL 1.0 mmol/L 三乙醇胺和 3.5 mL 1 mmol/L NaOH,用双蒸水稀释至100 mL,同时加入33 g NaCl,调pH 至8.1。(3)采用移液器准确吸取30µL血清,加入10 mL玻璃离心管中,加入含2%甲醇的氯仿-庚烷提取液1 mL。同样准确吸取30µL标准品溶液,加入10 mL玻璃离心管中,加入含2%甲醇的氯仿-庚烷提取液1 mL。(4)涡旋2 min,硅酸50 mg 120℃激活后加入,再涡旋4 min,2 000 r/min离心5 min。(5)采用玻璃移液管准确量取上层溶液0.8 mL转移至加有0.4 mL铜试剂的玻璃管中,涡旋5 min,2 000 r/min离心3 min。(6)采用玻璃移液管准确量取上层溶液0.6 mL转移至10 mL玻璃离心管中。(7)37℃氮气吹干。(8)加入0.3 mL乙醇,37℃水浴溶解15 min,然后涡旋5 min。(9)加入0.1 mL二苯基卡巴肼溶液,涡旋15 s,取0.2 mL加至96孔板中。(10)酶标仪490 nm检测吸收值。
1.2.4 细胞培养方法及处理 小鼠巨噬细胞RAW264.7采用含10%胎牛血清的DMEM培养。培养条件:37℃、5%CO2的恒温培养箱。采用加热溶解的方法制备棕榈酸白蛋白复合物,再用细胞培养基将复合物配制成150µmol/L和300µmol/L。实验分为空白对照(Control)组、无FFA牛血清白蛋白(Bovine serum albumin,BSA)组(作为棕榈酸的对照)、棕榈酸150µmol/L组和棕榈酸300µmol/L组,分别采用配制好的不含白蛋白的DMEM培养基、含1%BSA的DMEM培养基、含棕榈酸150µmol/L的白蛋白复合物和300µmol/L的白蛋白复合物分别刺激RAW264.7细胞24 h后收集各组细胞。
1.2.5 荧光实时定量PCR检测 实验中取得的脂肪组织标本和收集的细胞均以Trizol试剂提取总RNA,逆转录成cDNA,按照PCR试剂盒说明书配制反应体系,最后应用荧光实时定量PCR仪分析TNF-α、IL-6和MCP-1转录水平,以β-actin为内参,数据结果以相对量表示。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火延伸30 s,共40个循环。引物序列见表1。

Tab.1 The specific primer sequences表1 引物序列表
1.2.6 炎症细胞因子TNF-α、IL-6、MCP-1和NF-κB p65水平的测定 细胞处理完成后,采集细胞培养上清,按照小鼠炎症细胞因子ELISA试剂盒说明书测定TNF-α、IL-6、MCP-1和NF-κB p65的水平。
1.2.7 Western blot检测TLR4和NF-κB p65磷酸化蛋白水平 细胞处理完成后以含0.1%PMSF的Western细胞裂解液裂解细胞提取蛋白,采用BCA法测定蛋白浓度,采用Western blot检测TLR4和NF-κB p65磷酸化蛋白表达,以β-actin为内参,计算TLR4和NF-κB p65磷酸化蛋白相对表达量。
1.2.8 NF-κB p65激活-核转运情况检测 实验细胞分为空白对照组(Control组)、BSA组(作为棕榈酸的对照组)和棕榈酸300µmol/L组,分别采用配制好的不含白蛋白的DMEM培养基、含1%BSA的DMEM培养基和含棕榈酸300µmol/L的白蛋白复合物分别刺激RAW264.7细胞24 h,按照NF-κB p65激活-核转运检测试剂盒说明书,进行固定-封闭-NF-κB p65抗体孵育-Cy3二抗孵育-细胞核染色各步操作,采用荧光显微镜观察NF-κB p65激活-核转运情况。
1.2.9 TLR4 siRNA干扰实验 TLR4 siRNA干扰采用瞬时转染方式。细胞种板后,当细胞在瓶底的覆盖率达到60%即可进行转染实验。实验分为Control组、BSA组、棕榈酸(300µmol/L)组、棕榈酸(300µmol/L)+Control siRNA 组和棕榈酸(300µmol/L)+TLR4 siRNA组。根据实验分组加入一定体积的无血清DMEM培基、无关片段转染复合物或TLR4 siRNA(40 nmol/L)转染复合物,培养箱孵育24 h后开始以棕榈酸白蛋白复合物(300µmol/L)刺激细胞24 h,然后收集细胞和上清液,检测细胞内和上清液中TNF-α、IL-6和MCP-1的mRNA水平和分泌水平。
1.3 统计学方法 统计分析采用SPSS 17.0软件。符合正态分布的计量数据以均数±标准差(±s)表示。多组均数比较采用单因素方差分析,组间多重比较采用Bonferroni检验,2组间均数比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 体质量、Lee’s指数比较 18周后,高脂饲料组体质量高于正常对照组(单位g:28.2±0.7vs.22.8±0.6,n=10,t=19.21,P<0.01),Lee’s指数亦高于正常对照组(15.3±0.2vs.14.2±0.2,n=10,t=12.08,P<0.01)。
2.2 FFA水平和脂肪组织炎症因子mRNA表达水平 高脂饲料组较正常对照组小鼠血清中FFA水平升高,内脏脂肪组织中TNF-α、IL-6和MCP-1的表达明显增加(P<0.05),见表2。
Tab.2 Comparison of serum level of FFA and mRNA expressions of inflammatory cytokines in visceral adipose tissue between two groups of mice表2 2组小鼠血清FFA和内脏脂肪组织TNF-α、IL-6、MCP-1 mRNA相对表达水平比较(n=10,±s)
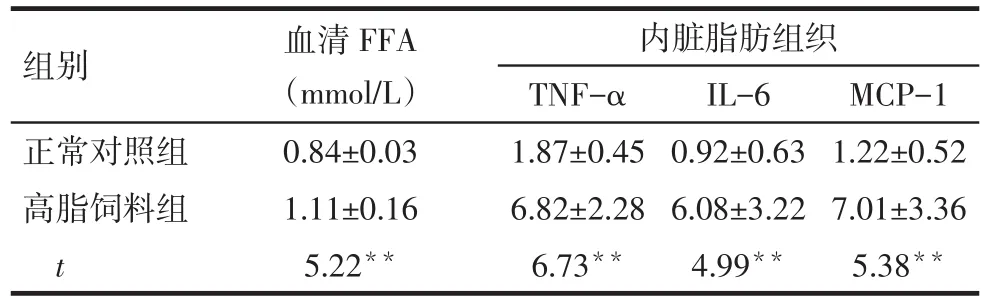
Tab.2 Comparison of serum level of FFA and mRNA expressions of inflammatory cytokines in visceral adipose tissue between two groups of mice表2 2组小鼠血清FFA和内脏脂肪组织TNF-α、IL-6、MCP-1 mRNA相对表达水平比较(n=10,±s)
**P<0.01
2.3 棕榈酸对巨噬细胞TNF-α、IL-6、MCP-1表达和分泌的影响 棕榈酸诱导巨噬细胞24 h后,与BSA组比较,棕榈酸150µmol/L组和棕榈酸300µmol/L组炎症因子TNF-α、IL-6和MCP-1的表达和分泌均明显增加(P<0.05),见表3。
2.4 棕榈酸对巨噬细胞TLR4蛋白水平和NF-κB p65磷酸化蛋白水平的影响 与BSA组比较,棕榈酸浓度组的TLR4和NF-κB p65磷酸化蛋白水平均增加(P<0.05),见图1。
2.5 棕榈酸对NF-κB p65核转运和细胞内表达水平的影响 通过荧光显微镜下可见棕榈酸处理巨噬细胞后NF-κB p65明显向细胞核内转运,细胞核内呈现致密且明亮的红色荧光,见图2。Control组、棕榈酸300µmol/L组、BSA组NF-κB p65水平分别为(70.96±5.96)、(182.63±4.10)及(68.14±4.58)ng/L(F=46.75,P<0.05),其中棕榈酸 300µmol/L 组高于BSA组,Control组与BSA组差异无统计学意义。
Tab.3 The effect of palmitic acid on mRNA expression and secretion of inflammatory cytokines(TNF-α,IL-6 and MCP-1)in RAW264.7 macrophage表3 棕榈酸对巨噬细胞炎症因子TNF-α、IL-6和MCP-1表达和分泌的影响(n=3,±s)
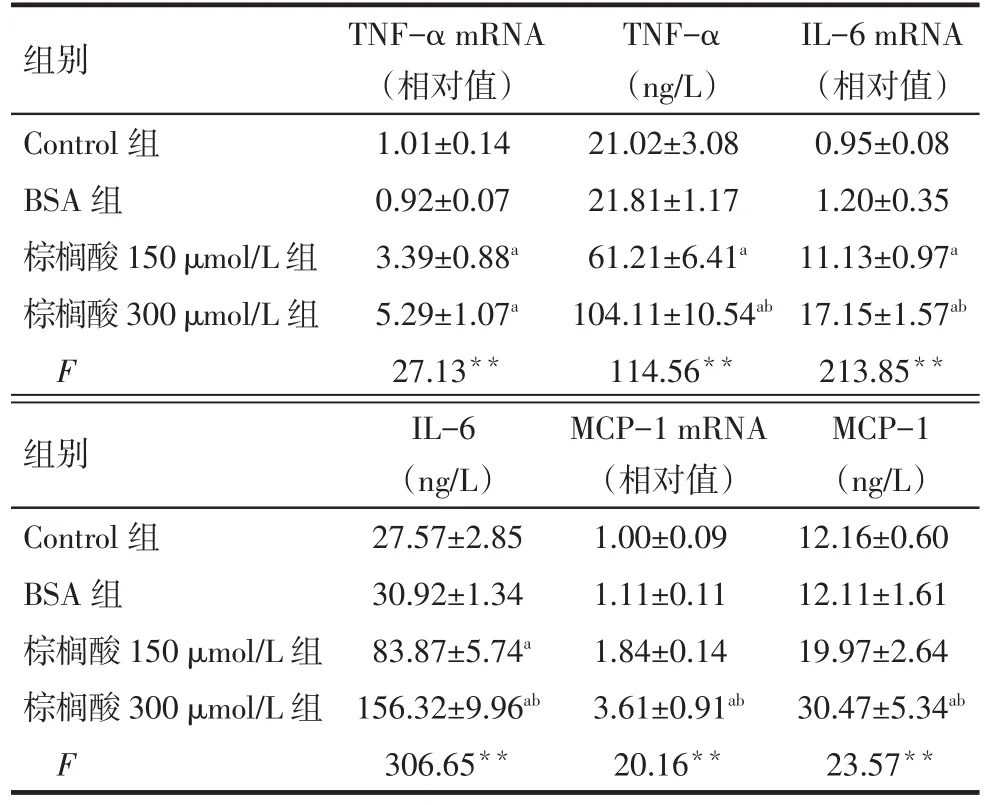
Tab.3 The effect of palmitic acid on mRNA expression and secretion of inflammatory cytokines(TNF-α,IL-6 and MCP-1)in RAW264.7 macrophage表3 棕榈酸对巨噬细胞炎症因子TNF-α、IL-6和MCP-1表达和分泌的影响(n=3,±s)
**P<0.01;a与 BSA 组比较,b与棕榈酸 150µmol/L 组比较,P<0.05;Control组仅与BSA组比较,差异无统计学意义,因处理因素不同无需与其他组比较
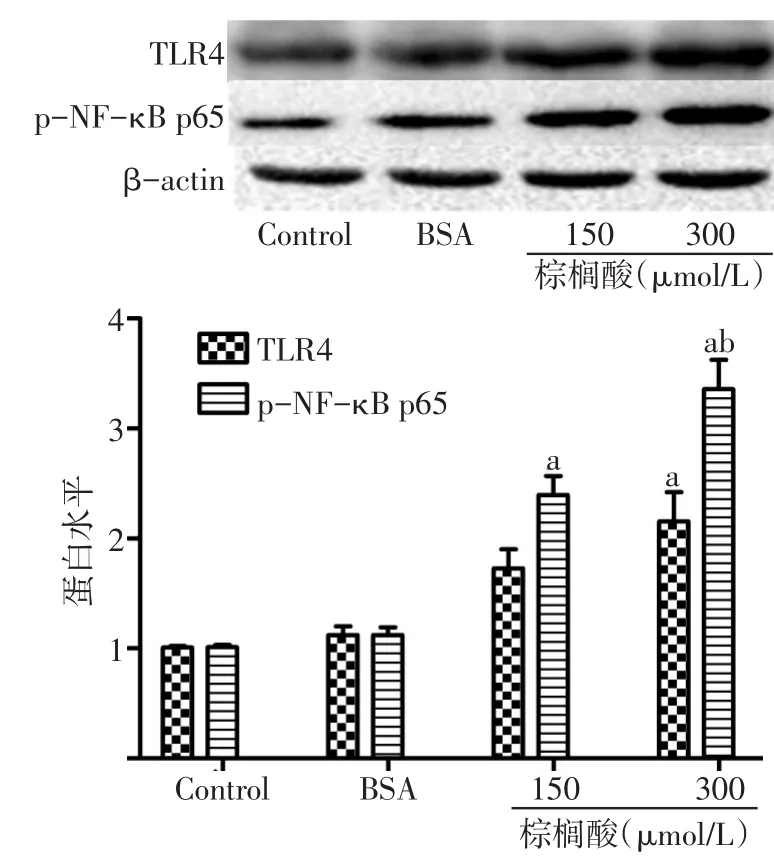
Fig.1 The effect of palmitic acid on protein expressions of TLR4 and NF-κB p65 in RAW264.7 macrophages图1 棕榈酸对巨噬细胞TLR4蛋白水平和NF-κB p65磷酸化蛋白水平的影响
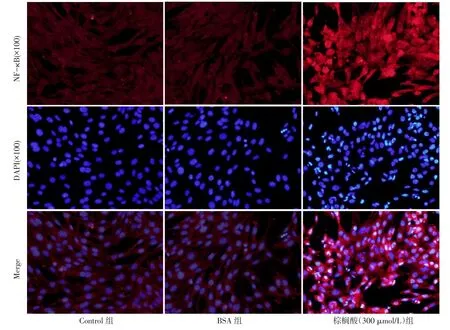
Fig.2 The effect of palmitic acid on nuclear translocation of NF-κB p65 in RAW264.7 macrophages图2 棕榈酸对巨噬细胞NF-κB p65核转运的影响
2.6 TLR4 siRNA对棕榈酸诱导巨噬细胞炎症因子表达和分泌的影响 与BSA组比较,棕榈酸组增加了 TLR4 和炎症因子(TNF-α、IL-6、MCP-1)的mRNA和蛋白表达水平;TLR4被抑制后,棕榈酸+TLR4 siRNA 组的 TLR4、TNF-α、IL-6和 MCP-1的mRNA表达和分泌水平明显低于棕榈酸组(P<0.05),见表4。
Tab.4 The effect of TLR4 siRNA on mRNA expression and secretion of inflammatory cytokines induced by palmitic acid in RAW264.7 macrophages表4 TLR4 siRNA对棕榈酸诱导巨噬细胞炎症因子表达和分泌的影响(n=3,±s)

Tab.4 The effect of TLR4 siRNA on mRNA expression and secretion of inflammatory cytokines induced by palmitic acid in RAW264.7 macrophages表4 TLR4 siRNA对棕榈酸诱导巨噬细胞炎症因子表达和分泌的影响(n=3,±s)
**P<0.01;a与BSA组比较,b与棕榈酸组比较,P<0.05;其中Control组仅与BSA组比较,棕榈酸+Control siRNA组仅与棕榈酸组比较,差异无统计学意义
3 讨论
在肥胖、高血脂和糖尿病等代谢紊乱性疾病的发生和发展过程中,往往都伴随炎症的发生并会持续存在[11-12]。研究发现,代谢性疾病中炎症的发生是代谢细胞(如脂肪细胞)产生的代谢信号启动炎性效应,从而破坏体内的代谢稳态;Gregor教授将这种代谢组织炎症状态定义为“metaflammation”,即“代谢炎症”,用来定义过剩的营养和能量引起代谢细胞应答反应而造成的低级别的慢性炎症[2]。这种炎症状态的重要特点就是免疫细胞包括巨噬细胞、肥大细胞和自然杀伤细胞等向组织(如脂肪)的浸润,而浸润的免疫细胞会导致进一步的促炎性改变,包括激活体内促炎性信号通路,并产生大量的炎症细胞因子,进一步破坏机体的代谢稳态[13-14]。代谢疾病往往也伴随血浆自由脂肪酸水平的升高。研究发现,肥胖和2型糖尿病患者血浆自由脂肪酸的浓度从200~400µmol/L的基础水平可升高到800~1 500µmol/L[15]。在本研究建立的高脂饮食诱导小鼠肥胖模型中,也观察到高脂饲料组小鼠血清FFA水平较正常对照组明显增加。同时,与正常对照组比较,高脂饲料组小鼠体内TNF-α、IL-6和MCP-1的表达明显增加,提示C57BL/6J小鼠高脂饮食诱导后,肥胖发生的同时引起了内脏脂肪组织的促炎性改变。
自由脂肪酸可以分为饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。多项研究认为,饱和脂肪酸与肥胖、胰岛素抵抗和心血管疾病的高风险密切相关[7,16]。棕榈酸是体内主要的饱和脂肪酸,碳链长度16,占血浆总自由脂肪酸的30%~40%[17]。因此,本研究在结合相关文献报道的基础上,将棕榈酸的浓度定为150和300µmol/L。体内自由脂肪酸99%以上是与白蛋白结合的,因此,有关自由脂肪酸的细胞实验,需要将其与牛血清白蛋白载体制备成复合物才可跨细胞膜转运[18],因此本研究中将棕榈酸与白蛋白制成复合物来诱导巨噬细胞。
相关研究证实,棕榈酸可诱导脂肪细胞、胰岛β细胞和血管平滑肌细胞等的炎症反应,主要通过激活c-jun氨基末端激酶、κ激酶抑制因子和蛋白激酶C等,进而激活NF-κB,从而引起炎症基因的表达、炎症细胞因子的大量释放,最终导致胰岛素抵抗和动脉粥样硬化等病理过程的发生[19]。本研究结果显示,与BSA组比较,棕榈酸150和300µmol/L可增加巨噬细胞炎症因子(TNF-α、IL-6和MCP-1)的表达和细胞分泌水平,诱导巨噬细胞的炎症反应。在对棕榈酸150µmol/L和300µmol/L两组诱导炎症因子(TNF-α、IL-6和MCP-1)的表达和细胞分泌水平比较发现,棕榈酸300µmol/L组较150µmol/L组可诱导更大的炎症效应,且棕榈酸300µmol/L组棕榈酸水平更接近肥胖患者体内棕榈酸水平,所以在后续的机制研究中选择棕榈酸300µmol/L。本研究又进一步分析了棕榈酸诱导巨噬细胞炎症反应的信号机制,结果显示,与BSA组比较,棕榈酸150µmol/L和 300µmol/L两组的TLR4和 NF-κB p65磷酸化蛋白水平均增加,表明棕榈酸可诱导巨噬细胞TLR4和NF-κB p65磷酸化蛋白的表达,同时,通过NF-κB激活-核转运实验显示,棕榈酸300µmol/L组巨噬细胞细胞核内呈现致密且明亮的红色荧光,提示NF-κB p65明显向细胞核内转运,证实了NF-κB被激活,提示TLR4和NF-κB可能与棕榈酸诱导巨噬细胞炎症反应有关。TLR4的siRNA干扰实验结果显示,TLR4 siRNA干扰后,与棕榈酸组比较,棕榈酸+TLR4 siRNA组TNF-α、IL-6和MCP-1的mRNA表达和分泌水平明显降低,表明TLR4被抑制后,棕榈酸诱导的TNF-α、IL-6和MCP-1的表达和释放也被显著抑制,证实TLR4确实参与了棕榈酸诱导的巨噬细胞炎症反应。
综上所述,肥胖或高脂饮食可导致体内促炎性改变,增加巨噬细胞炎症因子的表达和释放,激活NF-κB信号通路,且TLR4与棕榈酸诱导的巨噬细胞炎症反应相关。但TLR4调控这一炎症反应的具体机制,以及是否与激活NF-κB、c-jun氨基末端激酶和蛋白激酶C等信号分子相关仍需要进一步探索。
[1]Ohashi K,Shibata R,Murohara T,et al.Role of anti-inflammatory adipokines in obesity-related diseases[J].Trends Endocrinol Metab,2014,25(7):348-355.doi:10.1016/j.tem.2014.03.009.
[2]闫美玲,夏丽莎,胡长平.代谢炎症与肥胖相关研究进展[J].中国动脉硬化杂志,2015,23(6):634-638.Yan ML,Xia LS,Hu CP,et al.Advance in research on metaflammation and obesity[J].Chinese Journal of Arteriosclerosis,2015,23(6):634-638.
[3]Coats BR,Schoenfelt KQ,Barbosa-Lorenzi VC,et al.Metabolically activated adipose tissue macrophages perform detrimental and beneficial functions during diet-induced obesity[J].Cell Rep,2017,20(13):3149-3161.doi:10.1016/j.celrep.2017.08.096.
[4]Santaren ID,Watkins SM,Liese AD,et al.Individual serum saturated fatty acids and markers of chronic subclinical inflammation:the insulin resistance atherosclerosis study(IRAS)[J].J Lipid Res,2017,P076836.doi:10.1194/jlr.P076836.[Epub ahead of print].
[5]Kennedy A,Martinez K,Chuang CC,et al.Saturated fatty acidmediated inflammation and insulin resistance in adipose tissue:mechanisms of action and implications[J].J Nutr,2009,139(1):1-4.doi:10.3945/jn.108.098269.
[6]Wei X,Song H,Yin L,et al.Fatty acid synthesis configures the plasma membrane for inflammation in diabetes[J].Nature,2016,539(7628):294-298.doi:10.1038/nature20117.
[7]Eguchi K,Manabe I.Toll-like receptor,lipotoxicity and chronic in⁃flammation:the pathological link between obesity and cardiometa⁃bolic disease[J].J Atheroscler Thromb,2014,21(7):629-639.
[8]Hu L,Yang H,Ai M,et al.Inhibition of TLR4 alleviates the inflammation and apoptosis of retinal ganglion cells in high glucose[J].Graefes Arch Clin Exp Ophthalmol,2017,225(11):2199-2210.doi:10.1007/s00417-017-3772-0.
[9]Garibotto G,Carta A,Picciotto D,et al.Toll-like receptor-4 signaling mediates inflammation and tissue injury in diabetic nephropathy[J].J Nephrol,2017,30(6):719-727.doi:10.1007/s40620-017-0432-8.
[10]饶子亮,钟志勇,谢超敏,等.高脂饲料诱导肥胖大鼠和肥胖小鼠模型的比较研究[C].中国新疆乌鲁木齐第九届中国实验动物科学年会,2010:241-246.Rao ZL,Zhong ZY,Xie CM,et al.A comparative study for high fat diet-induced obesity rats and obesity mice[C].Urumchi Xinjiang,China.The 9thconference on laboratory animal sciences,2010:241-246.
[11]Mathieu P,Lemieux I,Després JP.Obesity,inflammation,and cardiovascular risk[J].Clin Pharmacol Ther,2010,87(4):407-416.doi:10.1038/clpt.2009.311.
[12]Federico A,Dallio M,DI Sarno R,et al.Gut microbiota,obesity and metabolic disorders[J].Minerva Gastroenterol Dietol,2017,63(4):337-344.doi:10.23736/S1121-421X.17.02376-5.
[13]Sun AR,Panchal SK,Friis T,et al.Obesity-associated metabolic syndrome spontaneously induces infiltration of pro-inflammatory macrophage in synovium and promotes osteoarthritis[J].PLoS One,2017,12(8):e0183693.doi:10.1371/journal.pone.0183693.
[14]Singer K,Lumeng CN.The initiation of metabolic inflammation in childhood obesity[J].J Clin Invest,2017,127(1):65-73.doi:10.1172/JCI88882.
[15]Reaven G,Hollenbeck C,Jeng C,et al.Measurement of plasma glucose,free fatty acid,lactate,and insulin for 24 h in patients with NIDDM[J].Diabetes,1988,37(8):1020-1024.
[16]Plötz T,Hartmann M,Lenzen S,et al.The role of lipid droplet formation in the protection of unsaturated fatty acids against palmitic acid induced lipotoxicity to rat insulin-producing cells[J].Nutr Metab(Lond),2016,13:16.doi:10.1186/s12986-016-0076-z.
[17]Moon ML,Joesting JJ,Lawson MA,et al.The saturated fatty acid,palmitic acid,induces anxiety-like behavior in mice[J].Metabolism,2014,63(9):1131-1140.doi:10.1016/j.metabol.2014.06.002.
[18]Cupp D,Kampf JP,Kleinfeld AM.Fatty acid-albumin complexes and the determination of the transport of long chain free fatty acids across membranes[J].Biochemistry,2004,43(15):4473-4481.
[19]Wu D,Liu J,Pang X,et al.Palmitic acid exerts pro-inflammatory effects on vascular smooth muscle cells by inducing the expression of C-reactive protein,inducible nitric oxide synthase and tumor necrosis factor-α[J].Int J Mol Med,2014,34(6):1706-1712.doi:10.3892/ijmm.2014.1942.
