趋化因子受体CXCR4及其配体CXCL12在肝癌侵袭转移中的作用及机制
2018-02-02张引余力信张发鹏余晓雯王文龙罗志强
张引,余力信,张发鹏,余晓雯,王文龙,罗志强
原发性肝细胞性肝癌(Primary hepatocellular carcinoma,PHC)是全球范围内极具危害性的恶性肿瘤之一,我国每年至少30万人死于PHC,占全世界肝癌死亡人数的半数以上[1-2]。而肝癌细胞的侵袭与转移是导致肝癌患者死亡的主要原因[3]。趋化因子(chemokine)是细胞因子超家族成员中具有化学趋化作用的小分子蛋白质[4]。CXC趋化因子配体12(CXCL12),又称基质细胞衍生因子 1(SDF-1),是由骨髓基质细胞及其他相关的间皮细胞和上皮细胞分泌的一种趋化蛋白,包括α和β两种异构体,属于趋化因子CXC亚家族[5]。CXCR4则是高度保守的7次跨膜G蛋白偶联受体(G protein-coupled receptor,GPCR),由 352个氨基酸组成,其编码基因位于染色体2q21,其胞外N端区与配体结合,胞内区则与G蛋白偶联,C端含丝氨酸/苏氨酸可磷酸化,主要参与信号传导[6]。CXCL12能与CXCR4特异性结合,与CXCR4相互作用后启动下游信号通路,形成CXCL12/CXCR4生物轴而发挥作用,并在介导炎症及免疫反应、维持胚胎发育、调控造血、诱导血管生成、肿瘤侵袭转移等多种生理和病理过程中发挥重要作用[7-8]。新近的研究报道CXCL12/CXCR4与肿瘤细胞的侵袭和转移过程密切相关[9-10],然而其具体机制仍不清楚。本研究通过观察CXCL12/CXCR4在肝癌组织和细胞中的表达情况,旨在探讨其抑制肝癌细胞侵袭和迁移的可能机制。
1 材料与方法
1.1 病例标本 收集2013年1月—2015年6月我科手术切除的60例肝癌及对应癌旁组织标本,所有标本均经病理学检查确诊为肝细胞癌。所有患者术前均未接受放化疗,其中男32例,女28例,平均年龄(63.0±2.5)岁,标本收集后立即置于液氮保存。以上标本采集均由患者本人知情同意并通过南昌大学第二附属医院伦理委员会审核同意。
1.2 细胞及试剂 正常肝细胞7702和4种肝癌细胞Huh7、HepG2、MHCC97h、Hep3B购于中国科学院上海细胞库,DMEM、MEM培养基和胎牛血清购自美国Gibco公司。逆转录及PCR试剂盒购自TAKARA生物工程有限公司;Trizol试剂购自美国Invitrogen公司;Transwell小室购于美国Corning公司;CXCR4干扰质粒和过表达质粒及对应的空载体对照质粒均购自上海吉凯基因化学技术有限公司。CXCL12、CXCR4、血管内皮生长因子-C(VEGF-C)抗大鼠单克隆抗体购自美国Abcam公司;BALB/C裸鼠(SPF级,雄性,6只,体质量18~20 g)购自湖南斯莱克景达实验动物有限公司。
1.3 方法
1.3.1 Western blot法检测肝癌及癌旁组织中CXCL12、CXCR4的表达 将收集的肝癌组织和癌旁组织用RIPA裂解液(含PMSF)裂解后提取细胞总蛋白,BCA法测定蛋白浓度。制备的蛋白样本经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后按照凝胶面积以0.65 mA/cm2恒流电转移1.5 h将蛋白转印至PVDF膜上。含5%牛血清白蛋白的封闭液室温封闭1 h,加入1∶500稀释的一抗(CXCL12、CXCR4、Tubulin),4℃反应过夜;次日 TBST漂洗3次,加入辣根过氧化物酶标记的羊抗兔或羊抗鼠IgG二抗(1∶10 000),室温下反应 l h;TBST漂洗 3次,加入化学发光试剂显影成像,ECL发光系统曝光检测。采用Image J分析所得图像,CXCL12/Tubulin和CXCR4/Tubulin灰度比值分别表示CXCL12和CXCR4蛋白相对表达水平。
1.3.2 免疫组化检测肝癌组织和癌旁组织中CXCL12、CXCR4的表达 采用免疫组化EnVision两步法。将收集到的肝癌组织和对应的癌旁组织按照3~4µm厚度组织切片,经过脱蜡、梯度乙醇水化、PBS清洗、抗原修复后,分别滴加CXCL12、CXCR4抗体孵育,然后滴加增强复合物和二抗,37℃孵育30 min,PBS清洗后,DAB试剂盒显色,苏木精复染细胞核,盐酸乙醇分化,乙醇脱水,二甲苯透明30 min,中性树胶和盖玻片封片。用奥林巴斯显微镜采集图像,以PBS作为阴性对照,同时设空白对照,已知阳性片作为阳性对照,根据染色程度判定CXCL12、CXCR4蛋白的表达情况。
1.3.3 Real-time PCR检测肝癌组织和癌旁组织中CXCL12、CXCR4 mRNA的表达 Trizol法分别提取肝癌组织和癌旁组织中的RNA并逆转录成cDNA(反应条件:37℃15 min,85℃5 s)。然后以cDNA为模板应用SYBR®Premix Ex Taq™(Tli RnaseH Plus)进行PCR扩增。PCR反应条件:95℃30 s;95 ℃ 5 s,60 ℃ 30 s,共 40 个循环。CXCR4 引物:上游 5′-cgaggaaatgggctcaggg-3′,下游 5′-gttggtggcgtggacgatg-3′。CXCL12 引物:上游 5′-cgattcttcgaaagccatta-3′,下游 5′-cttggtggctctccacccta-3′。内参 GAPDH引物:上游 5′-aggtcggagtcaacggatttggtcg-3′,下游 5′-tggccaggggtgctaagcagt-3′。使用 2–ΔΔCt法分析肝癌组织和癌旁组织中 CXCL12、CXCR4 mRNA的表达水平,实验独立重复3次。
1.3.4 细胞培养及肝癌细胞株中CXCL12、CXCR4的mRNA表达检测 Huh7、MHCC97h、HepG2和Hep3B 4种肝癌细胞置于温度37℃、体积分数为5%的CO2培养箱中,用含10%胎牛血清的DMEM培养液常规传代培养。正常肝细胞7702用高糖型的DMEM和10%~20%胎牛血清培养。取对数生长期的各组细胞,Trizol法提取RNA,并将其反转录成cDNA,Real-time PCR法检测5种细胞中CXCL12、CXCR4的mRNA表达水平。具体步骤和统计分析方法同1.3.3,实验独立重复3次。
1.3.5 细胞转染及稳转细胞的构建 将MHCC97h细胞接种于6 cm2培养皿中,待细胞融合度生长至70%时换无血清培养基培养,按照Lipofectamine 2000转染试剂操作说明分别将20µg空载体质粒(sh-control)和20µg CXCR4干扰质粒(sh-CXCR4)转染入细胞,静置6 h后换有血清培养基继续培养。48 h后,用遗传霉素(G418)筛选阳性克隆;挑选阳性的单克隆细胞簇,在低剂量G418的条件下将单克隆细胞扩大培养,同时采用Western blot法对稳定转染的细胞株进行鉴定。转染空载质粒的细胞记为sh-control,转染sh-CXCR4质粒的细胞记为sh-CXCR4。
1.3.6 Transwell实验检测细胞的侵袭能力 取对数生长期的sh-control和sh-CXCR4 MHCC97h细胞,经胰酶消化并计数后,取约1×105个细胞加入Transwell小室,用不含血清的培养液在5%CO2、37℃封闭环境下孵育36 h,4%甲醛固定20 min,用0.1%结晶紫染色30 min,PBS洗3~5遍。显微镜下计数迁移至滤膜外表面的细胞数。实验独立重复3次。
1.3.7 划痕实验检测细胞的迁移能力 制备sh-control和sh-CXCR4 MHCC97h细胞悬液,细胞计数后种植约1×105个细胞于12孔板中,培养过夜后细胞均匀呈单层铺满于每孔中,用相同大小枪头进行划痕,每孔划痕粗细均匀,PBS清洗划下的细胞,加入不含血清的培养液,置于细胞培养箱中培养,倒置显微镜下于划痕后0 h和24 h拍照,测量划痕的宽度,计算细胞愈合率,实验独立重复3次。愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,愈合率越高表示细胞的迁移能力越强。
1.3.8 MTT实验检测sh-CXCR4表达对肝癌细胞增殖能力的影响 取对数生长期的sh-control和sh-CXCR4 MHCC97h细胞,用含10%胎牛血清的培养液配成单细胞悬液,以每孔约1 000个细胞接种到96孔板,每组细胞设置3个复孔,每孔体积200µL。2组细胞连续培养6 d,每日取适量细胞,每孔加10µL MTT溶液继续孵育4 h;终止培养,每孔加100µL DMSO,振荡10 min,使结晶物充分溶解。酶联免疫检测仪记录2组细胞490 nm波长处的吸光度值,绘制细胞生长曲线。实验独立重复3次。
1.3.9 裸鼠成瘤实验 取对数生长期的sh-control和sh-CXCR4 MHCC97h细胞,随机接种至6只裸鼠皮下,接种量为1×106个细胞/只,一般尽量在30 min内完成。种植部位选择血供丰富的腹股沟中上部,左侧接种sh-CXCR4细胞,右侧接种sh-control细胞。接种前用枪将细胞悬液充分吹散,防止细胞成团而降低细胞成活率。在接种后的5、10、20、30、40 d测量瘤体的长度和宽度,计算肿瘤体积,肿瘤体积计算公式为:V(mm3)=(长度×宽度2)/2。
1.3.10 Western blot检测VEGF-C的表达 将sh-control和sh-CXCR4 MHCC97h细胞以及裸鼠移植瘤的瘤体用含PMSF的RIPA裂解液裂解后提取细胞总蛋白。常规SDSPAGE电泳、转膜、抗体孵育、曝光、显影后分析CXCR4和VEGF-C蛋白相对表达水平,实验独立重复3次。同时参照1.3.5中的方法将CXCR4过表达质粒GV-141-CXCR4和相应空载体对照GV-141-Control分别转染至MHCC97h细胞中。培养48 h收集细胞,Western blot法检测2组细胞中VEGF-C的表达情况。
1.4 统计学方法 所有数据采用SPSS 19.0进行统计学处理,符合正态分布的计量资料以均数±标准差(±s)表示,多组样本均数比较采用方差分析,2组间比较采用t检验,计数资料进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 癌组织和癌旁组织中CXCL12/CXCR4的表达 Western blot结果显示,肝癌组织中CXCL12和CXCR4的表达水平均高于癌旁组织,差异均有统计学意义,见图1。免疫组化结果亦显示肝癌组织中CXCL12/CXCR4表达水平高于癌旁组织,见图2。Real-time PCR显示肝癌组织中CXCL12 mRNA和CXCR4 mRNA表达水平明显高于癌旁组织,见图3。
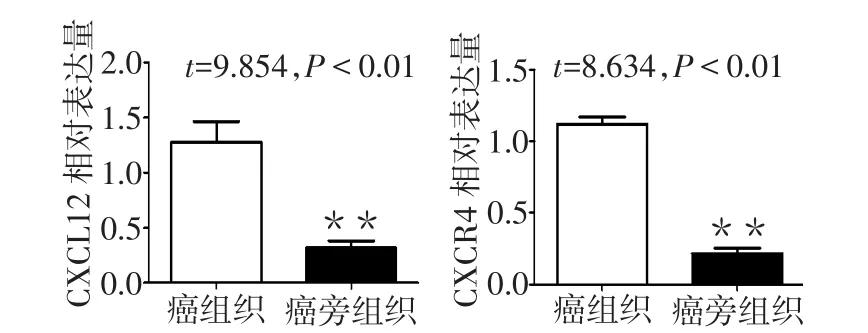
Fig.1 The expression levels of CXCL12/CXCR4 protein in liver cancer tissue and paracancerous tissue图1 肝癌组织和癌旁组织中CXCL12/CXCR4蛋白表达情况
2.2 Huh7、MHCC97h、HepG2和 Hep3B 肝癌细胞中CXCL12/CXCR4表达情况 结果显示,4种肝癌细胞中CXCL12 mRNA、CXCR4 mRNA的表达水平均高于正常肝细胞7702,见图4。后续实验选取MHCC97h作为实验细胞。
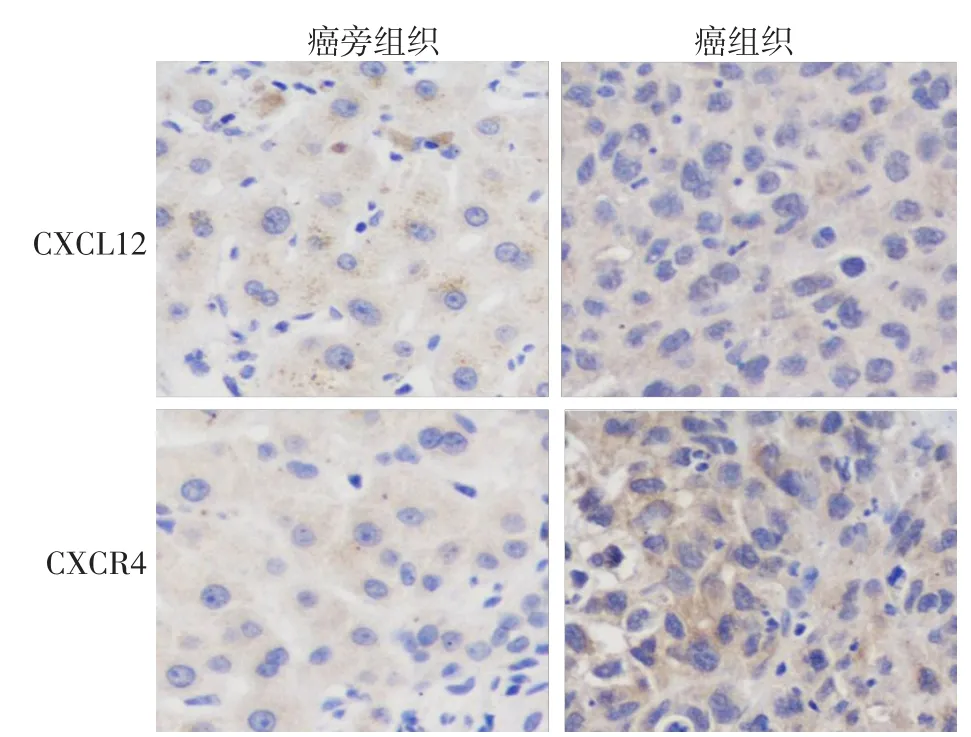
Fig.2 Immunohistochemical detection of CXCL12/CXCR4 expressions in liver cancer tissues and para-carcinoma tissues图2 免疫组化检测肝癌和癌旁组织CXCL12/CXCR4蛋白表达
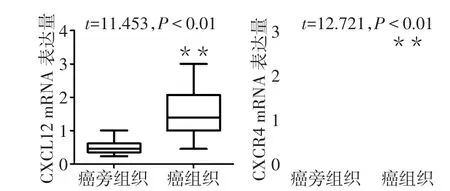
Fig.3 Real-time fluorescence quantitative detection of expressions of CXCL12/CXCR4 in liver cancer tissue and para-carcinoma tissue图3 实时荧光定量检测肝癌及癌旁组织CXCL12/CXCR4表达情况
2.3 转染sh-CXCR4对MHCC97h细胞侵袭、迁移和增殖能力的影响 Transwell实验结果显示,sh-CXCR4组的穿膜细胞数明显少于sh-control组[(16.2±4.3)个vs.(26.4±5.4)个,t=5.358,P<0.05],sh-CXCR4组细胞的侵袭能力较sh-control组明显降低,见图5。划痕实验结果显示,sh-CXCR4组细胞在划痕24 h后的愈合率明显低于sh-control组[(54.5±8.3)%vs.(83.3±4.8)%,t=4.653,P<0.05],见图 6。同时 MTT结果发现,转染 sh-CXCR4后MHCC97h细胞的生长能力较sh-control组明显降低,见图7。
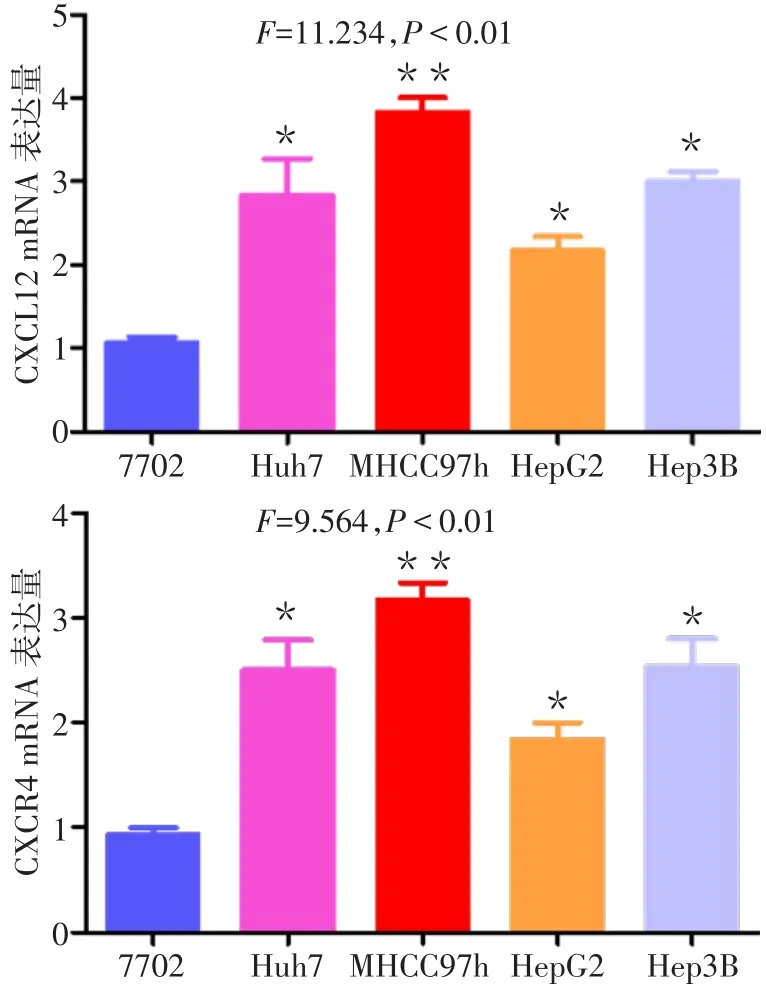
Fig.4 CXCL12 and CXCR4 mRNA expressions in liver cancer cells Huh7,MHCC97h,HepG2 and Hep3B图4CXCL12、CXCR4 mRNA在肝癌细胞Huh7、MHCC97h、HepG2和Hep3B中的表达情况
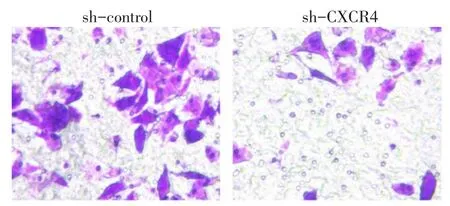
Fig.5 Comparison of the numbers of cell permeating septum between the two groups图5 2组穿膜细胞数比较
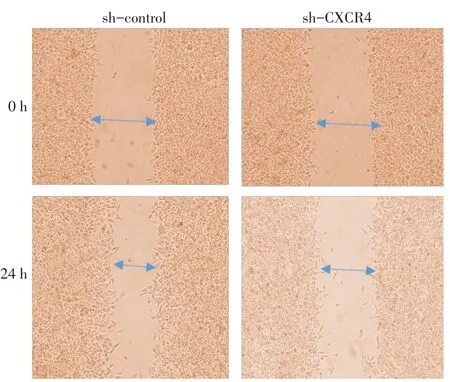
Fig.6 Results of the wound scratch assay between the two groups图6 2组细胞划痕实验结果
2.4 sh-CXCR4对裸鼠移植瘤生长的影响 将稳定转染的sh-CXCR4和sh-control MHCC97h细胞株,接种至裸鼠皮下建立人肝癌裸鼠皮下瘤模型,观察荷瘤裸鼠肿瘤内CXCR4蛋白表达及肿瘤大小,结果发现sh-CXCR4侧小鼠瘤体体积明显小于shcontrol侧,见图 8。
2.5 CXCR4的表达与VEGF-C的关系 体外细胞实验结果显示,sh-CXCR4组VEGF-C的表达较sh-control组明显下降,见图9A;相反,在MHCC97h细胞中过表达 CXCR4后,MHCC97h细胞中的VEGF-C的表达明显升高,见图9B。动物实验结果显示,接种转染sh-CXCR4的MHCC97h细胞成瘤的瘤体中VEGF-C的表达明显下降,见图10。
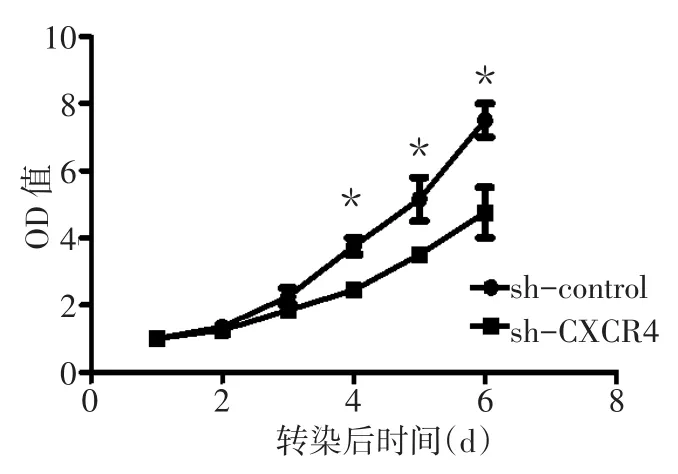
Fig.7 Comparison of the cell proliferative ability between the two groups图7 2组细胞增殖能力变化
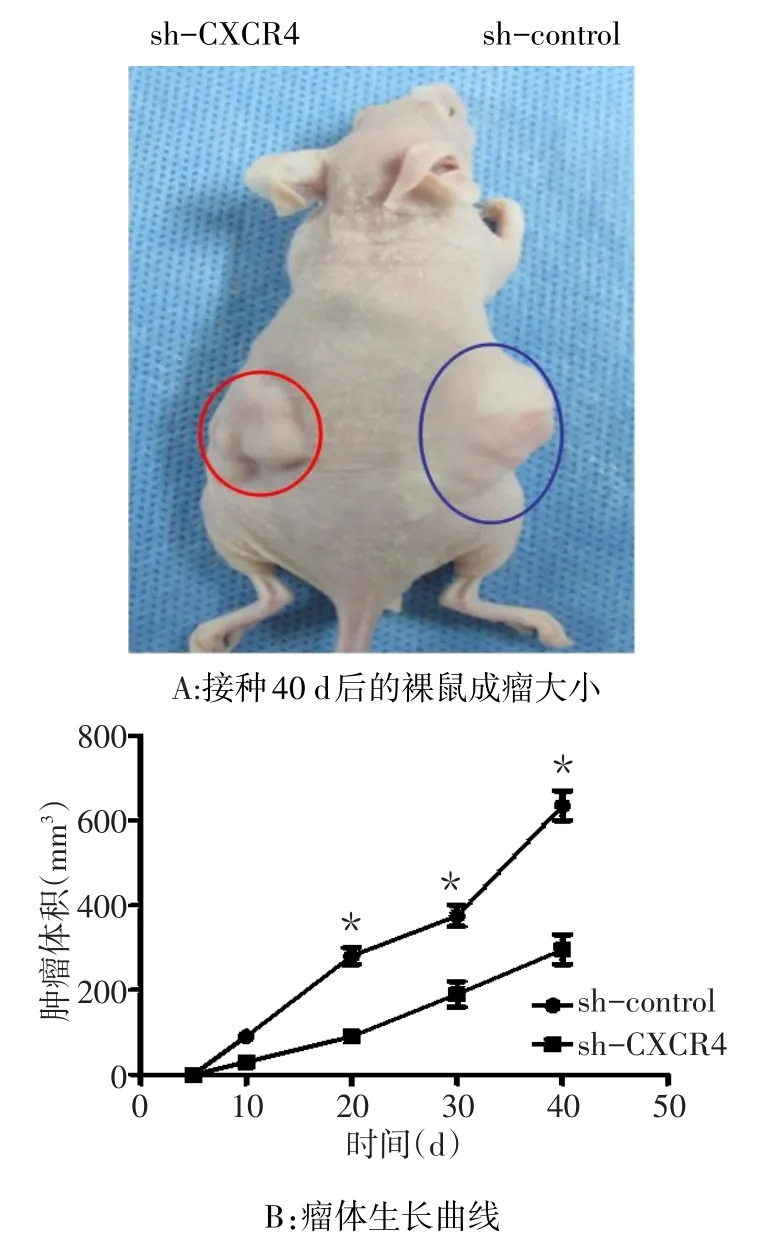
Fig.8 The growth states of subcutaneous tumors of nude mice inoculated with sh-CXCR4 and sh-control图8 接种sh-CXCR4和sh-control后裸鼠皮下肿瘤生长变化
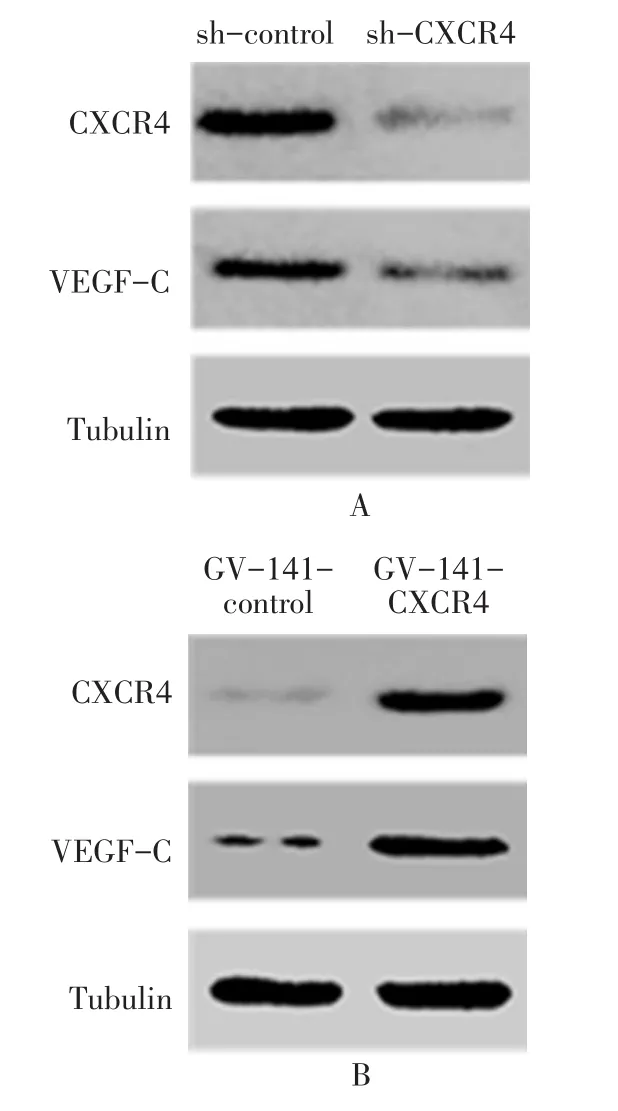
Fig.9 The expression levels of VEGF-C protein after altering the expression of CXCR4图9 改变CXCR4表达后MHCC97h细胞中VEGF-C蛋白表达变化
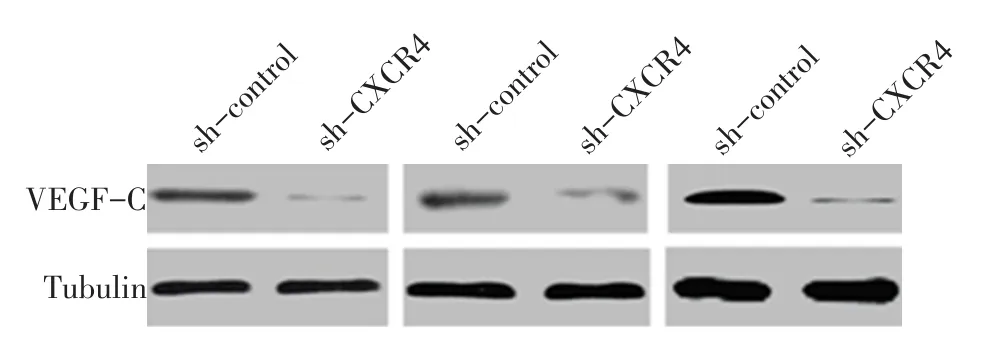
Fig.10 The expression of VEGF-C protein detected in sh-control and sh-CXCR4 groups of mice图10 sh-control和sh-CXCR4组小鼠瘤体中VEGF-C蛋白的表达情况
3 讨论
原发性肝癌是我国乃至全世界常见、且极具危害性的恶性肿瘤之一。大量研究证实原发性肝癌预后不良的主要原因在于肝癌细胞的侵袭和转移能力[11-12]。因此,研究原发性肝癌细胞侵袭和转移的具体机制有重要意义。趋化因子是细胞因子超家族中一大类具有化学趋化作用的小分子蛋白质[13]。目前研究证实,趋化因子的异常表达可影响肿瘤细胞的侵袭能力。Muller等[14]研究报道趋化因子和其对应的受体与肿瘤转移有密切的关系。目前研究已经证实至少有50多种趋化因子和20种趋化因子受体与肿瘤的发生发展有关,但是其机制仍不清楚[15-16]。CXCL12属于趋化因子CXCL亚家族中最重要的因子之一。研究证实在肝癌组织中CXCL12表达明显高于其对应的癌旁组织。过表达CXCL12可以增加肝癌细胞的侵袭和转移能力,相反,降低CXCL12的表达可以显著地抑制肝癌细胞的侵袭和转移[17-18]。然而,CXCL12在肝癌中的作用机制仍不清楚。
CXCR4是高度保守7次跨膜G蛋白偶联受体,是目前20种趋化因子受体中最重要的受体之一[19]。CXCL12可以与CXCR4结合启动下游信号通路形成CXCL12/CXCR4生物轴。研究报道人乳腺癌组织中趋化因子受体CXCR4表达明显增加。高表达CXCR4的乳腺癌患者的癌细胞转移能力明显高于低表达患者[20-22]。Scala 等[23]研究发现,黑色素瘤患者中出现高表达CXCR4的病情进展更快。另外,CXCR4阳性的食管癌患者平均总的生存时间明显短于CXCR4阴性的食管癌患者[24-25]。因此,CXCR4与许多肿瘤的发生发展存在着密切的关系,CXCL12/CXCR4轴在肿瘤转移过程中起到重要作用,这可能和肿瘤的转移过程密切有关[26-27]。在肝癌患者中,CXCL12/CXCR4轴与肝癌细胞侵袭能力的影响有待进一步的研究[28-29]。在本次实验中,笔者首先证实肝癌患者CXCL12/CXCR4存在高表达;进而通过转染CXCR4干扰质粒至肝癌细胞MHCC97h,发现CXCR4表达下调后肝癌细胞侵袭、迁移和增殖能力明显下降,这些结果证实CXCL12/CXCR4轴在肝癌的发生发展中起着关键的作用。
研究已经证实血管内皮生长因子是促进肿瘤血管新生和转移的最重要细胞因子之一[30]。吴唯等[31]研究证实,在乳腺癌细胞中CXCL12可通过AKT信号通路上调VEGF表达,进一步研究发现,通过siRNA沉默技术下调CXCL12表达后,可明显抑制乳腺癌细胞株中VEGF的表达。本研究进一步证实下调CXCR4的表达同样可以通过抑制VEGFC的表达;相反,过表达CXCR4可以明显促进VEGF-C蛋白的表达。综上,本研究证实CXCL12/CXCR4在肝癌组织和细胞中呈现高表达,在肝癌细胞中过表达CXCR4可通过抑制VEGF-C蛋白的表达促进肝癌细胞的侵袭和转移。
[1]于慧,宋爱云,丁兰萍,等.恶性肿瘤病因研究进展[J].河南肿瘤学杂志,2003,16(5):388-390.Yu H,Song AY,Ding LP,et al.Progress in the study of etiology of malignant tumors[J].Journal of Henan Oncology,2003,16(5):388-390.doi:10.3969/j.issn.1673-5412.2003.05.044.
[2]杨喆,王瑞华.原发性肝细胞性肝癌肝外侧支供血的螺旋CT检查[J].现代诊断与治疗,2010,21(3):149-151.Yang Z,Wang RH.Spiral CT examination in primary hepatocellular carcinoma with extrahepatic collateral blood supply[J].Modern Diagnosis and Treatment,2010,21(3):149-151.doi:10.3969/j.issn.1001-8174.2010.03.008.
[3]曾林,孙岩松,胡仲明.肝癌转移机制的研究进展[J].实用外科杂志,2006,23(1):314-317.Zeng L,Sun YS,Hu ZM.Progress in the study of metastasis mechanism of liver cancer[J].Journal of Practical Surgery,2006,23(1):314-317.doi:10.3969/j.issn.1671-4008.2006.01.076.
[4]龚迪和,丁克峰.趋化因子CCL28在乳腺癌中的表达及意义[J].中国癌症杂志,2014,24(4):304-309.Gong DH,Ding KF.Expression and significance of chemokine CCL28 in breast cancer[J].China Oncology,2014,24(4):304-309.doi:10.3969/j.issn.1007-3969.2014.04.011.
[5]王峰,张声.CXCR4与肿瘤的发生和发展[J].临床与病理杂志,2014,34(1):76-80.Wang F,Zhang S.CXCR4 and tumor occurrence and development of tumors[J].Clinical and Pathology Journal,2014,34(1):76-80.doi:10.11714/j.issn.2095-6959.2014.01.013.
[6]Green MM,Chao N,Chhabra S,et al.Plerixafor(a CXCR4 antagonist)following myeloablative allogeneic hematopoietic stem cell transplantation enhances hematopoietic recovery[J].J Hematol Oncol,2016,9(1):71.doi:10.1186/s13045-016-0301-2.
[7]Bianchessi V,Lauri A,Vigorelli V,et al.Evaluating the methylation status of CXCR4 promoter:A cost-effective and sensitive two-step PCR method[J].Anal Biochem,2016,519:84-91.doi:10.1016/j.ab.2016.12.016.
[8]Strien L,Joensuu K,Heikkila P,et al.Different expression patterns of CXCR4,CCR7,Maspin and FOXP3 in luminal breast cancers and their sentinel node metastases[J].Anticancer Res,2017,37(1):175-182.doi:10.21873/anticanres.11303.
[9]Vandyke K,Zeissig MN,Hewett DR,et al.HIF-2a promotes dissemination of plasma cells in multiple myeloma by regulating CXCL12/CXCR4 and CCR1[J].Cancer Res,2017,77(20):5452-5463.doi:10.1158/0008-5472.CAN-17-0115.
[10]Chang AH,Raftrey BC,D’Amato G,et al.DACH1 stimulates shear stress-guided endothelial cell migration and coronary artery growth through the CXCL12-CXCR4 signaling axis[J].Genes Dev,2017,Aug 4.doi:10.1101/gad.301549.117.[Epub ahead of print].
[11]朱虹,陈孝平.原发性肝癌转移和复发的分子机制及治疗的研究进展[J].中华肝胆外科杂志,2004,10(1):71-73.Zhu H,Chen XP.Advances in molecular mechanism and treatment of metastasis and recurrence of primary liver cancer[J].Chinese Journal of Hepatobiliary Surgery,2004,10(1):71-73.doi:10.3760/cma.j.issn.1007-8118.2004.01.034.
[12]Liu P,Long P,Huang Y,et al.CXCL12/CXCR4 axis induces proliferation and invasion in human endometrial cancer[J].Am J Transl Res,2016,8(4):1719-1729.doi:10.1074/jbc.M112.409581.
[13]姜毅楠,蔡逊,马丹丹,等.趋化因子受体1在人结肠癌中的表达及其与肿瘤转移的相关性研究[J].华中科技大学学报(医学版),2014,43(4):427-430.Jiang YN,Cai X,Ma DD,et al.The expression of chemokine receptor 1 in human colon cancer and its correlation with tumormetastasis[J].JournalofHuazhong University of Science and Technology(Medical Edition),2014,43(4):427-430.doi:10.3870/j.issn.1672-0741.2014.04.013.
[14]Muller G,Lipp M.Shaping up adaptive immunity:the impact of CCR7 and CXCR5 on lymphocyte trafficking[J].Microcirculation,2003,10(3/4):325-334.doi:10.1038/sj.mn.7800197.
[15]Najjar YG,Rayman P,Jia X,et al.Myeloid derived suppressor cell subset accumulation in renal cell carcinoma parenchyma is associated with intratumoral expression of IL-1beta,IL-8,CXCL5 and Mip-1alpha[J].Clin Cancer Res,2017,23(9):2346-2355.doi:10.1158/1078-0432.CCR-15-1823.
[16]Manfroi B,Mckee T,Mayol JF,et al.CXCL-8/IL-8 produced by diffuse large B-cell lymphomas recruits neutrophils expressing a proliferation inducing ligand APRIL[J].Cancer Res,2017,77(5):1097-1107.doi:10.1158/0008-5472.CAN-16-0786.
[17]Spender LC,Inman GJ.Fatal attractions Correlations of CXCL12-CXCR4-CXCR7 expression with disease progression in melanoma and Kaposi sarcoma[J].Br J Dermatol,2016,175(6):1140-1141.doi:10.1111/bjd.15136.
[18]Bhatia S,O’Bryan SM,Rivera AA,et al.CXCL12 retargeting of an adenovirus vector to cancer cells using a bispecific adapter[J].Oncolytic Virother,2016,5:99-113.doi:10.2147/OV.S112107.
[19]Strien L,Joensuu K,Heikkila P,et al.Different expression patterns of CXCR4,CCR7,maspin and FOXP3 in luminal breast cancers and their sentinel node metastases[J].Anticancer Res,2017,37(1):175-182.doi:10.21873/anticanres.11303.
[20]Wang D,Jiao C,Zhu Y,et al.Activation of CXCL12/CXCR4 renders colorectal cancer cells less sensitive to radiotherapy via upregulating the expression of survivin[J].Exp Biol Med(Maywood),2017,242(4):429-435.doi:10.1177/1535370216675068.
[21]Conley-Lacomb MK,Semaan L,Singareddy R,et al.Pharmacological targeting of CXCL12/CXCR4 signaling in prostate cancer bone metastasis[J].Mol Cancer,2016,15(1):68.doi:10.1186/s12943-016-0552-0.
[22]Meuris F,Carthagena L,Jaracz-Ros A,et al.The CXCL12/CXCR4 signaling pathway:A new susceptibility factor in human papillomavirus pathogenesis[J].PLoS Pathog,2016,12(12):e1006039.doi:10.1371/journal.ppat.1006039.
[23]Scala S.Molecular pathways:Targeting the CXCR4-CXCL12 Axisuntapped potential in the tumor microenvironment[J].Clin Cancer Res,2015,21(19):4278-4285.doi:10.1158/1078-0432.CCR-14-0914.
[24]Zhukovsky MA,Basmaciogullari S,Pacheco B,et al.Thermal stability of the human immunodeficiency virus type 1(HIV-1)receptors,CD4 and CXCR4,reconstituted in proteoliposomes[J].PLoS One,2010,5(10):e13249.doi:10.1371/journal.pone.0013249.
[25]Kim J,Connelly KL,Unterwald EM,et al.Chemokines and cocaine:CXCR4 receptor antagonist AMD3100 attenuates cocaine place preference and locomotor stimulation in rats[J].Brain Behav Immun,2017,62:30-34.doi:10.1016/j.bbi.2016.08.015.
[26]Tan CT,Chu CY,Lu YC,et al.CXCL12/CXCR4 promotes laryngeal and hypopharyngeal squamous cell carcinoma metastasis through MMP-13-dependent invasion via the ERK1/2/AP-1 pathway[J].Carcinogenesis,2008,29(8):1519-1527.doi:10.1093/carcin/bgn108.
[27]Gil M,Seshadri M,Komorowski MP,et al.Targeting CXCL12/CXCR4 signaling with oncolytic virotherapy disrupts tumor vasculature and inhibits breast cancer metastases[J].Proc Natl Acad Sci U S A,2013,110(14):E1291-1300.doi:10.1073/pnas.1220580110.
[28]Abdelouahab H,Zhang Y,Wittner M,et al.CXCL12/CXCR4 pathway is activated by oncogenic JAK2 in a PI3K-dependent manner[J].Oncotarget,2016,8(33):54082-54095.doi:10.18632/oncotarget.10789.
[29]Rodriguez-Nieves JA,Patalano SC,Almanza D,et al.CXCL12/CXCR4 axis activation mediates prostate myofibroblast phenoconversion through non-canonical EGFR/MEK/ERK signaling[J].PLoS One,2016,11(7):e159490.doi:10.1371/journal.pone.0159490.
[30]史冬,陈彩云,夏宗江,等.血管内皮生长因子、增殖细胞核抗原在肝癌组织中的表达及其意义[J].实用医学杂志,2009,25(1):76-77.Shi D,Chen CY,Xia ZJ,et al.The expression and significance of vascular endothelial growth factor and proliferating cell nuclear antigen in hepatocellular carcinoma[J].Chinese Journal of Practical Medicine,2009,25(1):76-77.doi:10.3969/j.issn.1006-5725.2009.01.029.
[31]吴唯,钱立元,戴荆,等.乳腺癌组织中趋化因子CXCL12及其受体CXCR4、CXCR7的表达及临床意义[J].中国普通外科杂志,2015,24(11):1577-1582.Wu W,Qian LY,Dai J,et al.The expression and clinical significance of chemokine CXCL12 and its receptor CXCR4 and CXCR7 in breast cancer tissues[J].Chinese Journal of General Surgery,2015,24(11):1577-1582.doi:10.3978/j.issn.1005-6947.2015.11.015.
