滩羊羊毛蛋白质双向电泳图谱体系的建立及优化
2018-02-02白玲荣杨佐青陶金忠
白玲荣,杨佐青,陶金忠
(宁夏大学农学院,银川 750021)
滩羊是我国唯一生产名贵二毛裘皮的特有绵羊品种,以生产美观、轻便、保暖、耐用的裘皮而著称。因其特殊的地理生态环境的长期自然选择和人工选育,造就了宁夏滩羊集产肉、产毛、产皮为一体的名贵羊种,宁夏(盐池)是我国滩羊的主产区,有“中国滩羊之乡”的称谓。在滩羊二毛期时(1月龄),其裘皮的特性更为突出,此时毛股长而弯曲,毛穗自然下垂;毛纤维细长均匀,光泽悦目,花案清晰,为宁夏五宝之一的“白宝”[1-2]。滩羊羊毛按其毛股花穗型的不同,将其分为不同的类型,其中最理想的为串字花、小串字花和软大花等[3-6]。这些类型的羊毛在其花形结构和毛型比例上都存在较大的差异,并且这些表型差异随着二毛期滩羊日龄的增加逐渐减弱甚至消失[7]。因此,对于羊毛表型差异及其变化过程中差异蛋白研究具有非常重要的意义[8]。查阅国内外相关资料,对于羊毛差异蛋白研究的文献相对较少,主要集中于对羊毛“发源地”——皮肤的研究。松杰等[9]建立了内蒙古绒山羊皮肤蛋白质双向电泳图谱条件;杨洁等[10]对细毛羊皮肤组织中毛囊蛋白质双向电泳图谱条件进行了摸索;付雪峰等[11]利用双向电泳及质谱检测技术对不同羊毛纤维直径细毛羊皮肤组织差异表达蛋白质进行了研究,结果发现94个差异表达蛋白;杨剑波等[12]成功地构建了中国美利奴羊超细型和哈萨克羊皮肤组织间抑制性消减cDNA文库,初步筛选出一批可能影响羊毛性状的差异表达ESTs;高丽霞等[13]利用双向电泳技术对内蒙古绒山羊全年12个月的皮肤毛囊蛋白质进行了研究,建立了毛囊发育周期蛋白质图谱,对图谱进行了差异蛋白比对,并对差异蛋白进行了质谱检测,发现12种差异角蛋白;Flanagan等[14]用蛋白质双向电泳图谱技术对羊毛差异表达蛋白进行了分析研究;Plowman等[15]应用凝胶和非凝胶技术对羊毛蛋白质组学进行了探讨,并对美利奴羊、洛姆尼羊和考利代羊的羊毛蛋白进行了研究。本实验旨在建立滩羊羊毛蛋白质组的双向电泳图谱体系,为滩羊二毛弯曲的形成机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 滩羊羊毛样品采自于宁夏盐池滩羊选育场,剪取滩羊体侧肩胛骨后缘处完整羊毛样品[16]。
1.1.2 试剂 固相胶条、IPG buffer和矿物油购自GE公司;碘乙酰胺(IAA)、二硫苏糖醇(DTT)、硫脲、尿素、CHAPS、Tirs-HCl、30%聚丙烯酰胺、过硫酸铵、TEMED和甘油均购自索莱宝公司。
1.1.3 仪器 等电聚焦仪,多通道垂直电泳,惠普透射扫描仪,低温离心机,NW10UVE超纯水系统。
1.2 方法
1.2.1 羊毛洗涤 将采集的羊毛先用Teric GN9于60℃洗涤2 min,再于40℃洗涤2 min,然后用40℃去离子水洗涤2 min,最后用60℃去离子水洗涤2 min,放置室温过夜干燥。将干燥的羊毛用二氯甲烷洗涤2次,每次用时5 min;再用乙醇洗涤2次,每次用时5 min;最后用超纯水洗涤 2 次,每次用时 5 min,室温干燥[17-19]。
1.2.2 样品制备
1.2.2.1 尿素裂解法 将洗涤完毕的羊毛置于研钵中,加入液氮充分反复研磨至粉末状。称取10 mg羊毛样品粉末溶于1 mL裂解液(7 mol/L尿素、2 mol/L硫脲、4%CHAPS、65 mmol/L DTT、0.5%IPG buffer、1 mmol/L EDTA、40 mmol/L Tris)中,震荡溶解 2 min,分装并根据 Bradford法[20-21]定量上样,其余放置于-80℃冰箱保存备用。
1.2.2.2 TCA/丙酮沉淀法 将洗涤完毕的羊毛置于研钵中,加入液氮反复研磨成粉状。称取10 mg样品粉末加入1mLTCA丙酮溶液中,放置4℃冰箱过夜。将样品置于4℃低温离心机中12 000×g离心30 min,弃上清,加入100%丙酮(β-巯基乙醇)震荡洗涤5 min,于低温离心机12 000×g离心20 min。再重复一遍上述的洗涤过程;然后用90%丙酮(β-巯基乙醇)再次震荡洗涤5 min,于低温离心机12 000×g离心20 min,弃上清,再次重复一遍90%的丙酮洗涤过程。最后弃上清并抽真空晾干。加入1 mL裂解液(7 mol/L尿素、2 mol/L硫脲、4%的CHAPS、65 mmol/L 的 DTT、0.5%IPG buffer、1 mmol/L 的 EDTA、40 mmol/L Tris),充分裂解后,根据Bradford法定量的结果分装,其余放置于-80℃冰箱保存备用。
1.2.3 被动上样 将GE预制的18 cm胶条(pH值为4~7,pH 值为 3~10)在室温下平衡 15 min,进行蛋白质上样(上样量分别为 200 μg,400 μg,600 μg,800 μg),根据蛋白上样体积加入一定量的水化液(8 M尿素,2%CHAPS,1%DTT,0.5%IPG buffer),使混匀上样总体积为400 μL进行水化上样。将混匀的蛋白样品加入到IPG-box水化盘中,胶面向下轻轻覆盖混合液,避免气泡的产生,盖紧IPG-box,放置15℃下被动水化18 h。
1.2.4 第一向等电聚焦 将水化完成的胶条放入等电聚焦仪中,然后将滤纸片放置在电极和胶条间,放置电极并加入适量矿物油防止溶液的挥发。设置等电聚焦程序:300 v 30 min线性,500 v 1 h快速,8 000 v 3 h线性,8 000 v 80 000 Vhr快速,500 v 12 h快速至结束;300 v 30 min线性,500 v 1 h快速,8 000 v 3 h线性,9 000 v 90 000 Vhr快速,500 v 12 h快速至结束。
1.2.5 第二向SDS-PAGE垂直电泳 将聚焦完成后的IPG胶条用5 mL的平衡液Ⅰ(6 M尿素、2%SDS、1.5 M pH值8.8 Tris-HCl、20%甘油和1%DTT),至于摇床平衡15 min,平衡后使用电泳缓冲液润洗,再将胶条置于干净水化盘,再加入平衡缓冲液Ⅱ(6 M尿素、2%SDS、1.5 M pH值8.8 Tris-HCl、20%甘油和4%IAA),放置于摇床平衡15 min。配制12%和10%的丙烯酰胺凝胶液并将其注入玻璃板夹层中,顶端留有1 cm左右的空间,用乙醇封面,以保持胶面平整。聚合时间1 h,待凝胶与上方液体分层时,表明凝胶已基本聚合。倒去SDS-PAGE凝胶顶端的乙醇,用超重水冲洗胶面。将平衡好的胶条与聚丙烯酰胺凝胶胶面完全接触,加入低熔点琼脂糖封胶液室温放置5 min,待彻底凝固后将其转移至垂直电泳槽内。向电泳槽中加入1×电泳缓冲液进行第二向电泳,待溴酚蓝指示剂达到底部边缘时停止电泳。取出凝胶,切角做记号。
1.2.6 凝胶染色及图像分析 每次凝胶用新配的考马斯亮蓝染色12 h后,用去离子水脱色48 h至背景干净,然后再用Images-Scanner扫描仪扫描,再用PD Quest 8.0软件分析双向电泳图谱的蛋白点数。
2 结果与分析
2.1 蛋白提取方法对羊毛双向电泳的影响
羊毛蛋白质制备作为其双向电泳图谱建立的关键步骤,直接影响后续条件的建立。本次实验以TCA/丙酮沉淀法和尿素裂解法两种方法进行蛋白提取。从TCA/丙酮沉淀法(图1A)双向电泳图谱中可以得到相比较于尿素裂解法(图1B)较多的蛋白点,在高丰度蛋白区可以较为明显地看出,尿素裂解法溶解羊毛蛋白不够充分,由于羊毛蛋白质主要是由角蛋白等结构蛋白组成,TCA/丙酮沉淀法较好地溶解了部分疏水性蛋白,提高了蛋白丰度和蛋白种类。选择TCA/丙酮沉淀法作为滩羊羊毛蛋白质的提取方法比较好。

图1 不同蛋白提取方法滩羊羊毛双向电泳图谱
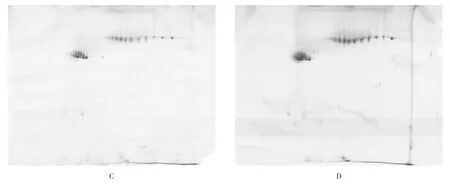
2.2 上样量对羊毛双向电泳的影响
双向电泳的蛋白上样量对双向电泳图谱蛋白点的检测是十分关键的,为了研究适合于滩羊羊毛蛋白质双向电泳的上样量,本实验选择了200、400、600和800 μg四种蛋白上样量。当蛋白质上样量为200 μg(图2C)时,只能得到高丰度蛋白,几乎看不到低丰度蛋白;当蛋白质上样量为400 μg(图2D)时,得到十分模糊的低丰度蛋白,不利于后期蛋白分析;当蛋白质上样量为600 μg(图2E)时,高低丰度蛋白都有较清楚的分辨率;当蛋白质上样量为800 μg(图2F)时,高丰度蛋白由于蛋白浓度过高,影响蛋白质的聚焦。所以相比较其他上样量,选择以600 μg作为滩羊羊毛双向电泳图谱的最适上样量。
2.3 不同pH范围IPG胶条对羊毛双向电泳的影响
本实验选择同为18 cm pH值范围为3~10和4~7的2种IPG胶条作为滩羊羊毛蛋白质双向电泳图谱条件的研究,从电泳图谱中可清楚地看到,不同pH值范围的IPG胶条对羊毛蛋白点的分布有较为明显的影响,在pH值为4~7(图3H)的图谱中高丰度蛋白与低丰度蛋白都有较为清楚的分布;而pH值为3~10(图3G)的图谱中可直观地看到其高丰度蛋白点出现堆积现象。因此,选择pH值4~7作为滩羊羊毛双向电泳的IPG胶条。
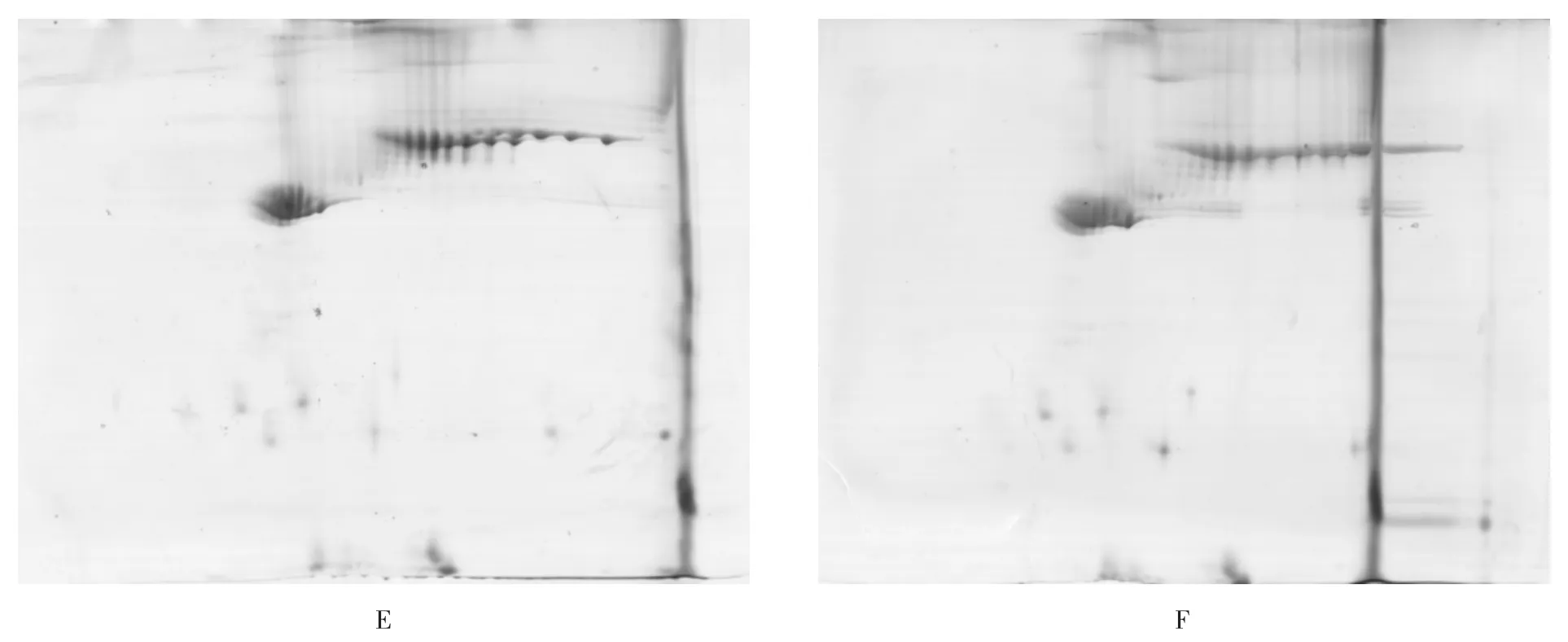
图2 不同上样量滩羊羊毛双向电泳图谱

图3 不同pH值范围的IPG胶条滩羊羊毛双向电泳图谱
3 讨论
蛋白质双向电泳技术是研究蛋白质组学的经典方法,对蛋白质分离可达到理想效果,在各组织蛋白组分离和差异蛋白研究方面起重要的技术支撑[22]。在进行蛋白质双向电泳过程中涉及到许多步骤和因素,都对蛋白质双向电泳图谱结果有较大的影响,样品的蛋白质提取是进行双向电泳的关键步骤,蛋白提取方法的选择是否合适,直接影响双向电泳图谱的分辨率和重复性及其后续差异蛋白点的鉴定。由于羊毛组织蛋白主要以角蛋白和羊毛结构蛋白组成其特殊性,本实验对TCA/丙酮沉淀法[23-25]和尿素裂解法提取滩羊羊毛蛋白质的效果进行了研究,结果发现,TCA/丙酮沉淀法检出的蛋白点数相比尿素裂解法有所增加,高丰度蛋白区蛋白点较为清晰,其原因可能是TCA/丙酮沉淀法反复沉淀洗涤羊毛蛋白,能较好地溶解某些疏水性蛋白,提高了蛋白丰度和蛋白种类,配合裂解液中高浓度的尿素和硫脲以及还原剂DTT、去污剂CHAPS等成分可增强羊毛蛋白的溶解,获得较为理想的凝胶结果图谱,得到清晰的蛋白点[26-27]。因此,选择TCA/丙酮沉淀法作为滩羊羊毛蛋白质的提取方法较为合适。
蛋白质上样量直接影响蛋白双向电泳图谱上蛋白点的分离效果,上样量过低则导致低丰度蛋白不能被分离出来,上样量过高则导致高丰度蛋白掩盖部分分子量和等电点相近的低丰度蛋白,同时还会导致横向拖带[28]。本实验选择 200、400、600、800 μg 四种不同上样量进行了滩羊羊毛蛋白图谱上样量的研究。当上样量为200 μg和400 μg时,只能得到模糊高低丰度蛋白,很明显不能满足蛋白上样量的要求,不利于后期蛋白分析;当上样量为800 μg时,高丰度蛋白由于蛋白浓度过高,电泳图谱蛋白出现聚焦现象,蛋白没有得到有效的分析。相比较其他上样量,600 μg时高低丰度蛋白都有较清楚的分辨率,羊毛蛋白得到较为理想的分离效果。因此,选择以600 μg作为滩羊羊毛双向电泳图谱的最适上样量。
双向电泳IPG胶条的选择主要根据羊毛蛋白的组成情况,查阅相关文献,选择18 cm的pH值为4~7和pH值为3~10的2种胶条。宽pH值范围的胶条用来分析总蛋白,窄pH值范围的胶条可以大大提高分辨率和灵敏度,用于分析特定的蛋白[29]。从得到的蛋白图谱可以明显地看出,pH值为4~7的蛋白点得到了有效的分离。鉴于后期对滩羊羊毛差异蛋白点的研究需要,所以选择pH值相对较窄的、具有很好分辨率的pH值为4~7作为滩羊羊毛双向电泳的胶条。
4 结论
对滩羊羊毛进行洗涤,液氮研磨处理,利用TCA/丙酮沉淀法提取蛋白,选择18 cm的pH值为4~7的IPG胶条,上样量600 μg,聚焦时间90 000 Vhr或更高,12%SDS-PAGE凝胶,建立滩羊羊毛双向电泳图谱体系,为滩羊不同时期羊毛和同一时期不同花穗型羊毛,以及滩羊羊毛与其他品种羊毛之间的差异蛋白质组学研究奠定了基础。
[1]吕亚军,王永军,陈艳瑞,等.3~30日龄滩羊羔羊能量需要量研究[J].西北农林科技大学学报(自然科学版),2009,37(4):72-73.
[2]崔明巧.盐池滩羊品种资源的保护与发展探讨[J].黑龙江畜牧兽医,2012(22):24-26.
[3]谭光兆,辛纲,郭祥涛.影响滩羊羔羊品质一些因素的分析[J].毛皮动物饲养,1985(2):39-41.
[4]Ma G W,Chu Y K,Zhang W J,et al.Polymorphisms ofFSTgene and their association with wool quality traits in Chinese Merino sheep[J].PLoS One,2017,12(4):e0174868.
[5]崔重九,许百善,王天新,等.滩羊裘皮花穗的遗传[J].宁夏农林科技,1983(4):31-34.
[6]张幼麟,崔重九.滩羊花穗的分类方法[J].宁夏农林科技,1965(12):33-34.
[7]Jacobs J R,Sommers K N,Zajac A M,et al.Early IL-4 gene expression in abomasum is associated with resistance toHaemonchus contortusin hair and wool sheep breeds[J].Parasite Immunol,2016,38(6):333-339.
[8]Li S,Zhou H,Gong H,et al.Identification of the ovine keratinassociated protein 22-1(KAP22-1)gene and its effect on wool traits[J].Genes(Basel),2017,8(1):122-126.
[9]松杰,董扬,李金泉,等.内蒙古绒山羊皮肤蛋白质双向电泳条件优化及图谱建立[J].中国畜牧兽医,2012,39(7):11-14.
[10]杨洁,付雪峰,黄锡霞,等.细毛羊皮肤组织中毛囊蛋白质2-DE图谱的建立与初步分析[J].中国畜牧兽医,2015,42(1):124-130.
[11]付雪峰,杨涵羽璐,石刚,等.不同羊毛纤维直径细毛羊皮肤组织差异表达蛋白质研究[J].中国畜牧兽医,2016,43(4):879-883.
[12]杨剑波,甘尚权,李晶,等.中国美利奴超细型与哈萨克羊毛囊兴盛期皮肤组织消减cDNA文库的构建[J].中国农业科学,2012,45(15):3154-3164.
[13]高丽霞,张燕军,张文广,等.内蒙古白绒山羊毛囊发育周期蛋白质表达谱分析[J].农业生物技术学报,2014,22(6):727-735.
[14]Flanagan L M,Plowman J E,Bryson W G,et al.The high sulphur proteins of wool:Towords an understanding of sheep breed diversity[J].Proteomics,2002,2:1240-1246.
[15]J E Plowman,S Deb-Choudhury,S Clerens,et al.Unravelling the proteome of wool:Towards markers of wool quality traits[J].Proteomics,2012,75(14):4315-4322.
[16]Zhang H,Zhang S,Zhao H,et al.Ovine hair follicle stem cells derived fromsingle vibrissae reconstitute haired skin[J].Int J Mol Sci,2015,16(8):17779-17797.
[17]Patrucco A,Cristofaro F,Simionati M,et al.Wool fibril sponges with perspective biomedical applications[J].Mater Sci Eng C Mater Biol Appl,2016,61(1):42-50.
[18]Zhao J,Liu N,Liu K,et al.Identification of genes and proteins associated with anagen wool growth [J].Anim Genet,2017,48(1):67-79.
[19]Gong H,Zhou H T,Forrest R H J,et al.Wool keratin-associated protein genes in sheep-a review[J].Genes(Basel),2016,7(6):24.
[20]Zhao Z,Liu G,Li X,et al.Characterization of the promoter regions of two sheep keratin-associated protein genes for hair cortexspecific expression[J].PLoS One,2016,11(4):e0153936.
[21]Almeida A M,Plowman J E,Harland D P,et al.Influence of feed restriction on the wool proteome:A combined iTRAQ and fiber structural study[J].Proteomics,2014,103(3):170-173.
[22]Debchoudhury S,Plowman J E,Harland D P.Isolation and analysis of keratins and keratin-associated proteins from hair and wool[J].Methods Enzymol,2015,568:279-301.
[23]甘淋,李娟,何涛,等.几种蛋白质含量测定方法的比较研究[J].泸州医学院学报,2004,27(6):500-502.
[24]Gorg A,Postel W,Gunther S.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis,2002,21(6):1037-1053.
[25]Flengsrud R,Kobro G.A method for two-dimensional electrophoresis of proteins from green plant tissues [J].Analytical Biochemistry,1989,177(1):33-36.
[26]朱金勇.镉盐诱导的牙鲆脑、鳃、肝差异蛋白质组研究[D].厦门:厦门大学,2005.
[27]谢玲,应万涛,张开泰,等.双向电泳和肽质量指纹谱技术鉴定支气管上皮细胞恶性转化相关蛋白ANX1-human[J].中国生物化学与分子生物学报,2000(16):569-573.
[28]黄愉淋,黄德伦,官俊良,等.水牛卵泡液差异蛋白质双向电泳方法的建立及质谱分析[J].畜牧兽医学报,2013,44(8):1244-1247.
[29]詹萍萍,王春琳,宋微微,等.曼氏无针乌贼墨囊蛋白质提取及双向电泳条件优化[J].宁波大学学报,2013,26(4):1-6.
