产蛋白酶海洋细菌的筛选及产酶工艺优化
2018-02-02曲均革马佳慧刘冰雪
曲均革, 马佳慧, 刘冰雪
(浙江医药高等专科学校制药工程学院,浙江宁波 315100)
蛋白酶是催化蛋白质水解的一类酶,可以将蛋白质分解成蛋白胨、多肽以及游离氨基酸,是目前应用最普遍的酶制剂之一。蛋白酶与人类生活关系密切,从生物体生理活动到疾病发生等很多方面都受到蛋白酶的影响,例如食物的消化和吸收、细胞分化和自溶、机体衰老、血液凝固、溶血作用、血压调节、炎症、癌症转移等[1-2]。目前,我国已有20多种蛋白酶应用于食品、化妆品、洗涤剂、水产、饲料等领域。对近年来国内外对微生物蛋白酶的研究趋势进行分析可知,新品种开发仍是研究蛋白酶的重中之重[3-4]。笔者从宁波洋沙山和象山海域采集样品,最终分离到一株高产蛋白酶的海洋细菌,对其进行菌种鉴定,并对其发酵条件和酶学性质进行初步研究。
1 材料与方法
1.1材料
1.1.1样品。从宁波洋沙山和象山海域采集海水样品。
1.1.2培养基。
1.1.2.1富集、活化、发酵培养基。2216E液体培养基,具体组成如下:蛋白胨5 g/L、酵母膏1 g/L、磷酸高铁0.01 g/L,人工海水定容,pH 7.6~7.8。
1.1.2.2分离培养基。酪蛋白固体培养基,具体组成如下:酪蛋白4.0 g/L、磷酸二氢钾0.36 g/L、磷酸氢二钠1.3 g/L、七水合硫酸锌0.02 g/L、七水合氯化钙0.002 g/L、酪蛋白水解物0.05 g/L,琼脂18 g/L,人工海水定容,pH 7.2~7.4[5]。
1.2方法
1.2.1富集培养。分别吸取1 mL象山海水和洋沙山海水接入2216E液体培养基中,置于摇床(150 r/min、25 ℃)培养24 h。
1.2.2初筛——平板透明圈法。用无菌海水按10倍连续梯度稀释法将富集培养后的菌悬液稀释至10-8,分别取0.1 mL 10-4~10-8稀释液,涂布接种于酪蛋白固体培养基上。于25 ℃下培养48 h后,挑选透明圈直径与菌落直径比值(Hc)较大的菌落,经平板分区划线分离法纯化后,在2216E斜面上保藏[6-9]。
1.2.3复筛——酶活力测定法。
1.2.3.1粗酶液制备。挑取初筛后有活性的菌株,将其转接于2216E培养基中,25 ℃、150 r/min条件下培养24 h。以2%的接种量转接于发酵培养基(50 mL/250 mL锥形瓶),25 ℃、150 r/min培养24 h。将发酵液在10 000 r/min、4 ℃条件下离心10 min,得粗酶液[10]。
1.2.3.2蛋白酶活力测定。
(1)绘制标准曲线。取不同浓度(20~100 μg/mL)酪氨酸溶液各1 mL,分别加入0.4 mol/L碳酸钠溶液5 mL、福林酚1 mL,置于40 ℃恒温水浴保温显色20 min,在660 nm处测吸收值。用空白管(只加水,碳酸钠溶液和福林酚试剂)作为对照,以吸光度值为纵坐标,以酪氨酸浓度为横坐标,绘制标准曲线[10]。
(2)酶活力测定。在1 mL粗酶液中加入1 mL 2%(W/V)酪蛋白溶液(不同pH缓冲液配制),40 ℃水浴反应10 min,再加入2 mL 0.4 mol/L三氯乙酸终止反应。将混合液置于40 ℃水浴中继续保温20 min,使残余蛋白质沉淀完全后离心,取1 mL上清液加入5 mL 0.4 mol/L的Na2CO3溶液和1 mL福林酚试剂,将试管振荡均匀后,于40 ℃保温发色20 min后,在660 nm处测定OD值,计算蛋白酶活力。同时另做1支空白管,空白管是将粗酶液换成发酵培养基1 mL,其他步骤同上。由上述条件规定,1 mL 酶液每分钟水解酪蛋白产生 1 μg 酪氨酸为 1个酶活力单位(U)[10]。
1.2.4菌株发酵条件优化。
1.2.4.1装液量对菌株产酶活力的影响。在250 mL 的三角瓶中分别装入 12.5、25.0、50.0、75.0和100.0 mL发酵培养基,150 r/min、25 ℃恒温振荡发酵培养24 h,每组3个平行,测定粗酶液酶活力。
1.2.4.2接种量对菌株产酶活力的影响。分别以0.5%、1.0%、1.5%、2.0%的接种量接入25 mL发酵培养基中,150 r/min、25 ℃恒温振荡发酵培养24 h,每组3个平行,测定粗酶液酶活力。
1.2.4.3培养温度对菌株产酶的影响。分别以15、20、25、30、35 ℃为发酵温度进行培养,0.5%的接种量,其他条件维持不变,每组3个平行,测定粗酶液酶活力。
1.2.4.4培养基初始pH对菌株产酶的影响。将发酵培养基初始pH分别调到3、4、5、6、7、8、9、10,培养温度为20 ℃,其他条件维持不变,每组3个平行,测定粗酶液酶活力。
1.2.4.5摇床转速对菌株产酶的影响。将摇床转速分别调到 100、150、200 r/min,培养基pH 7,其他条件维持不变,每组3个平行,测定粗酶液酶活力。
1.2.4.6发酵时间对菌株产酶的影响。分别选择 0、8、16、24、32、40 h 为发酵培养时间,转速100 r/min,其他条件维持不变,每组3个平行,测定粗酶液酶活力[10-11]。
1.2.5酶学性质研究。
1.2.5.1酶反应最适pH测定。将酶液与不同pH缓冲液配制的一系列底物在40 ℃保温,通过测定酶活力,得到酶反应的最适pH及pH对酶活力的影响。
1.2.5.2酶pH的稳定性测定。将酶液置于pH 3~10的不同缓冲液配制的一系列底物中,于40 ℃保温 60 min,测定剩余酶活力。
1.2.5.3酶反应的最适温度测定。在20~90 ℃内,以10 ℃为间隔,在不同温度条件下将酶液与底物在pH 为10的缓冲液中进行酶促反应,测酶活力。
1.2.5.4酶反应温度的稳定性测定。将酶液在不同温度下保温60 min后测剩余酶活力。相对酶活力以同一指标中最高的酶活值为100%[11-12]。
1.2.6菌种鉴定。将分离菌株在2216E培养基上培养1 d,采用TaKaRa细菌基因组DNA 提取试剂盒对菌株进行基因组DNA提取。根据细菌16S rRNA 保守序列,合成PCR扩增引物如下:上游引物F8(5’-GAGAGTTTGATCCTGGCTCAG-3’),下游引物R1492(5’-CGGCTACCTTGTTACGAC-3’) 。
反应体系(50 μL):25 μL 2×缓冲液(Mg2+plus),8 μL dNTPs 混合物(2.5 μmol/L),1 μL 引物F8和R1492(20 μmol/L),2 μL 模板DNA,0.5 μL LATaqDNA聚合酶(5 U/μL)和13.5 μL 的无菌水。
PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃1 min,72 ℃ 2 min,共30 个循环;72 ℃ 5 min。16S rDNA 基因扩增产物经PCR 产物纯化试剂盒纯化后进行测序分析。测序结果与NCBI的GenBank 进行BLAST 分析,选取相似度相近及层次差异序列进行分析,并选用Escherichiacolistrain ATCC35469(KP941759) 16S rDNA序列为外群。
2 结果与分析
2.1产蛋白酶海洋细菌的筛选结果用平板透明圈法初筛共得到15株能够产蛋白酶的菌株,其中Hc为10的有3株,Hc大于7的有3株,Hc小于5的有3株。取其中Hc较高的菌株进行发酵,测定粗酶液的酶活力,最后选取酶活力最高的PB02进行深入研究。
2.2菌株鉴定结果采用序列分析软件MEGA5.05 Alignment 程序对整理的序列进行核酸序列比对,进一步使用Phylogeny程序,以Neighbor-Joining Tree法进行系统发育树的构建。
由图1可知,PB02 16S rDNA与交替假单胞菌(Pseudoalteromonassp.)物种差异最低,相似度最高,可能为其中的一株未测序或新菌种。

图1 PB02系统发育树Fig.1 Phylogenetic tree of PB02
2.3发酵条件优化
2.3.1装液量对菌株产酶活力的影响。由图2可知,装液量为25.0 mL时,所测得的蛋白酶酶活力最高;当装液量多于25.0 mL 时,酶活力开始有逐渐下降的趋势,这可能是由于装液量过高使得培养液的溶氧量降低。所以,以25.0 mL的装液量为摇瓶发酵培养的最佳装液量。

图2 装液量对菌株产酶活力的影响Fig.2 Effects of loading volume on the enzyme activity of the strain
2.3.2接种量对菌株产酶活力的影响。发酵培养时,较大的接种量可使菌体快速地进入稳定期,但也可以使生长繁殖的时间缩短;较小的接种量可以使对数生长期延长。由图3可知,以0.5%的接种量为摇瓶发酵培养的最适接种量。

图3 接种量对菌株产酶活力的影响Fig.3 Effects of inoculum size on the enzyme activity of the strain
2.3.3培养温度对菌株产酶的影响。温度既对菌体生长有一定的影响,也对酶活力有重要的影响。由图4可知,当温度为 15~20 ℃时,蛋白酶酶活力随温度的增加有升高的趋势;当温度高于20 ℃时,酶活力有下降的趋势;以20 ℃发酵时,测得的蛋白酶酶活最高。所以确定20 ℃作为发酵培养的最适温度。
2.3.4培养基初始pH对菌株产酶的影响。由图5可知,当初始pH为6~7时,蛋白酶酶活力随初始 pH 的增大出现升高的趋势;初始pH 高于7时,酶活力有逐渐下降的趋势;初始pH为7时,测得的蛋白酶酶活力最高,所以确定7作为发酵培养基的初始 pH。
2.3.5摇床转速对菌株产酶的影响。摇床振荡培养能够使菌体与培养基充分接触,增加溶氧量,满足菌体的生长需求。底物可以更好地在体系内转移和发挥作用,有利于对不同参数的取样测定。由图6可知,以100 r/min的转速为摇瓶发酵的最适摇床转速。
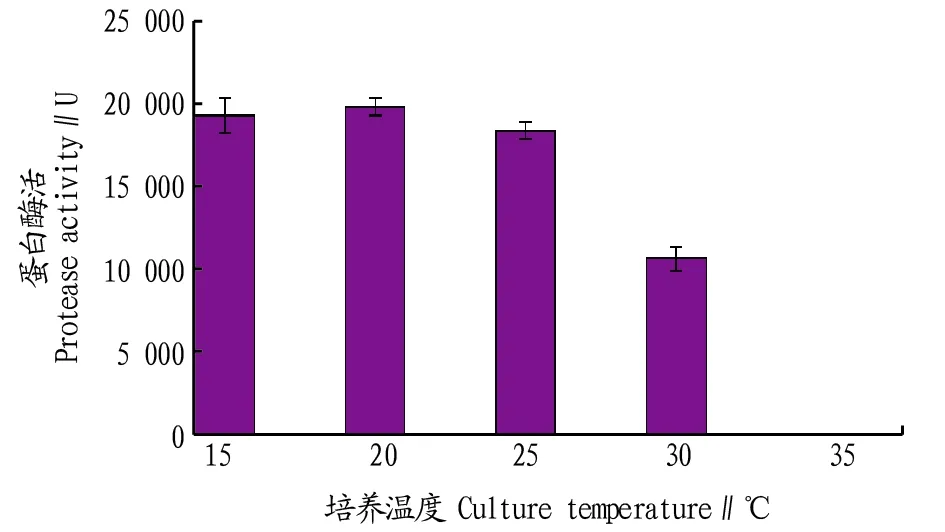
图4 培养温度对菌株产酶活力的影响Fig.4 Effects of culture temperature on the enzyme activity of the strain

图5 培养基初始pH对菌株产酶活力的影响Fig.5 Effects of the initial pH of the medium on the enzyme activity of the strain

图6 摇床转速对菌株产酶活力的影响Fig.6 Effects of rotation speed on the enzyme activity of the strain
2.3.6发酵时间对菌株产酶的影响。发酵时间分为两个阶段,一是菌体的生长阶段,二是发酵产酶阶段。由图7可知,发酵时间为0~16 h 时酶活力逐渐提高,说明这时的菌体数不断增加;发酵时间为16~32 h 时酶活力平缓下降,其中16 h 时酶活力最高,因此确定发酵时间16 h作为发酵培养的最适产酶发酵时间。
2.4酶活性质研究
2.4.1酶反应最适pH测定。将酶液与不同pH缓冲液配制的一系列底物在40 ℃保温,测得的酶活力结果表明:酶反应的最适pH为10,在pH为7~9时具有稳定的、较高的酶活力,能保持最适pH时的70%以上,pH为7、8时,酶活力为最适pH时的94%,而pH为6时,酶活力仅为最适pH时的40%,说明 PB02产生的为碱性蛋白酶(图8)。
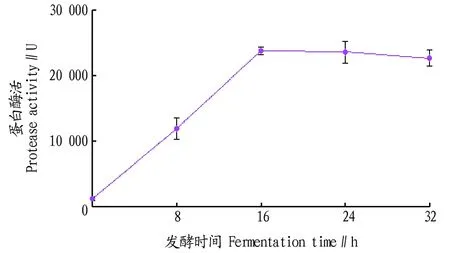
图7 发酵时间对菌株产酶的影响Fig.7 Effects of fermentation time on the enzyme activity of the strain

图8 pH对蛋白酶活力和稳定性的影响Fig.8 Effects of pH on activity and stability of protease
2.4.2酶的pH稳定性测定。将酶液置于不同pH环境中保温60 min,测定剩余酶活力结果表明:该菌产酶在pH为7~10内,酶活力均可保持在62%以上(图8)。
2.4.3酶反应最适温度测定。不同温度条件下的酶促反应结果表明:最适反应温度为40 ℃,在30~60 ℃内具有较高的酶活力,可保持在最适温度时的79%以上,而当温度升高至60 ℃时,酶活力急剧下降至最适温度时的27%(图9)。
2.4.4酶的热稳定性测定。将酶液在不同温度下保温60 min后测剩余酶活力,发现温度超过60 ℃以后,酶活力下降很快,30~60 ℃时酶活保持84%以上,而90 ℃时酶活力下降至30%(图9)。
3 结论
此次试验分别从洋沙山和象山海域采集海洋样品进行产蛋白酶海洋细菌的筛选,初筛共得到15株蛋白酶活性菌株,其中1株酶活较高的菌株PB02经16S rDNA鉴定为交替假单胞菌(Pseudoalteromonassp.)。通过产酶条件优化得出,PB02号菌培养的最适pH为7,0.5%的接种量,10%的装液量,20 ℃的培养温度,100 r/min的摇床转速,发酵时间16 h最利于产酶。酶学性质研究表明,PB02号菌产生的为碱性蛋白酶,酶反应的最适pH为10,蛋白酶在pH为7~9时具有稳定的酶活力,能保持最适pH 的70%以上。PB02号菌株不耐高温,酶反应的最适温度为40 ℃。该研究为今后对产蛋白酶海洋活性菌株的深入研究奠定了基础。

图9 温度对蛋白酶活力和稳定性的影响Fig.9 Effects of temperature on activity and stability of protease
[1] 胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):49-61.
[2] 路英华.蛋白酶的研究进展[J].生命科学信息,1991,8(2):8-10.
[3] NASCIMENTO W C A,MARTINS M L L.Production and properties of an extracellular protease from thermophilicBacillussp[J].Brazilian journal of microbiolgy,2004,35:91-96.
[4] RAI S K,ROY J K,MUKHERJEE A K.Characterisation of a detergent-stable alkaline protease from a novel thermophilic strainPaenibacillustezpurensissp.nov.AS-S24-Ⅱ[J].Applied microbiology and biotechnology,2010,85(5):1437-1450.
[5] 张晓.海洋产蛋白酶菌的分离、培养及其防污活性研究[M].青岛:中国海洋大学,2013:12.
[6] 刘婷,张天斌,林元山.产中性蛋白酶菌株的筛选及其发酵条件的优化[J].湖南农业科学,2009(5):102-104,107.
[7] 张锐.极端微生物产碱性蛋白酶菌株的筛选及发酵条件的研究[J].微生物学通报,2001,28(4):5-9.
[8] 万琦,陆兆新,高宏.低温碱性蛋白酶菌株的筛选及产酶条件的研究[J].微生物学杂志,2002,22(5):16-18.
[9] 宋明徽.产碱性蛋白酶海洋细菌筛选及发酵研究[M].大连:大连工业大学,2013:12-14.
[10] 张力元.海洋来源产蛋白酶的菌株筛选及其产酶条件的优化研究[M].保定:河北农业大学,2009:20-47.
[11] 方春玉,周健,邓静,等.泸型大曲黑曲霉产酸性蛋白酶条件的优化及其酶学性质的研究[J].食品与发酵科技,2011,47(2):13-19.
[12] 曲均革,姚晓敏,朱鹏,等.产纤维素酶海洋细菌的筛选鉴定和产酶条件优化[J].上海海洋大学学报,2012,21(6):1054-1056.
