DDX46基因慢病毒载体的构建及其在人膀胱癌细胞中的表达
2018-02-02黄邓高高元慧张淑芳彭大为
刘 熹 张 冲 黄邓高 曹 卉 高元慧 张淑芳 彭大为
膀胱癌的发病率在我国泌尿系恶性肿瘤中占居首位,在世界居第9位,1998~2008年发病率逐年增加,年均增长率4.6%[1]。膀胱癌术后高复发性和耐药性一直是一个难题,因此,探索膀胱癌发生、发展的分子机制,寻找可靠的生物标志物和有效的治疗靶点尤为重要[2]。DDX46基因,即DEAD-box解螺旋酶46基因,位于染色体5q31.1上,其编码的DDX46蛋白属于DEAD-box解螺旋酶家族成员(DEAD-box helicases,DDX),又名PRPF5或hPrp5。DDX46表达产物主要分布在核内,通过影响mRNA前体剪接调控基因表达[3]。此外,多项研究[4-5]表明,DDX46与细胞增殖、分化和器官发育密切相关,并可以调控多个肿瘤相关因子的表达。结直肠癌组织中DDX46蛋白表达高于癌旁组织,敲低DDX46基因后,结直肠癌细胞生长受到抑制[6]。本研究前期通过转录组测序和生物信息学分析发现,DDX46基因在膀胱癌组织中高特异性表达。为进一步探讨DDX46基因与膀胱癌的关系,本研究拟构建DDX46基因低表达慢病毒载体,包装并感染人膀胱癌5637细胞和T24细胞,为探讨其在膀胱癌细胞中的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞、菌种与质粒 5637细胞、T24细胞及293T细胞(中科院上海细胞所),TOP10大肠杆菌感受态细胞(TIANGEN公司),慢病毒质粒系统包括GV115载体,pHelper 1.0载体和pHelper 2.0载体(上海吉凯公司)。
1.1.2 主要试剂及仪器 限制性内切酶Age I、EcoRI和双切酶缓冲液CutSmart Buffer(NEB公司,美国),T4DNA连接酶(Fermentas公司,加拿大),Taq Plus酶(Vazyme公司,美国),质粒抽提试剂盒和DNA凝胶回收试剂盒(TIANGEN公司,北京),PCR 引物(R&F)和dsDNA寡核苷酸(捷瑞公司,上海),胰蛋白酶和酵母提取物(OXOID公司,美国),胎牛血清(Ausbian公司,澳大利亚),DMEM培养基(Corning公司,美国),TRIzolRNA 提取试剂盒(普飞,上海),逆转录M-MLV试剂盒(Promega公司,美国),氨苄青霉素(ampicillin,Amp)(Genebase公司,上海)。多重实时荧光定量PCR仪(Applied Biosystems公司,美国),RT-PCR测量仪(Agilent公司,美国),凝胶成像仪和数显式稳压电泳仪(天能公司,上海),Nanodrop 2 000分光光度计(Thermo Scientific公司,美国),NextSeq 500测序仪(Lllumina公司,美国),IX71荧光显微镜(Olympus公司,日本),CO2培养箱(Sanyo公司,日本)。
1.2 方法
1.2.1 细胞株培养 人胚肾细胞系293T及人膀胱癌细胞系5637和T24均在37℃、2.5% CO2饱和湿度、10%胎牛血清的DMEM培养基上进行培养,培养至细胞融合70%~80%后,用0.1%胰蛋白酶消化传代,取对数生长期细胞进行实验。
1.2.2 RT-PCR测人膀胱癌细胞株中DDX46 mRNA表达水平 总RNA的提取:收集细胞密度为80%时的5637和T24人膀胱癌细胞,2 000 r/min离心5 min,去上清,留下细胞沉淀物,按上海普飞公司TRIzolRNA提取试剂盒操作说明书提取总RNA,同时用Nanodrop 2000分光光度计测定所提取的RNA 的浓度及质量。然后,反转录获得cDNA,根据Promega公司逆转录M-MLV试剂盒说明书进行操作。最后,RT-PCR测DDX46 mRNA的表达水平,根据Gen Bank得知,目标基因DDX46和内参基因甘油醛磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的基因编号分别为NM 014829和NM 002046,设计引物:DDX46上游引物为5’-AAAATGGCGAGAAGAGCAACG-3’,下游引物为5’-CATCATCGTCCTCTAAACTCCAC-3’,产物扩增长度为110 bp;GAPDH上游引物为5’-TGACTTCAACAGCGACACCCA-3’,下游引物为5’-CACCCTGTTGCTGTAGCCAAA-3’,产物扩增长度为121 bp。RT-PCR反应条件(20 μL体系):95℃ 15 s,95℃ 5 s,60℃ 30 s,循环45 次;qPCR 结束后,制作熔解曲线,反应条件:95℃ 1 min;冷却至 55℃,使 DNA 双链充分结合;从 55~95℃,每增加 0.5℃,保持 4 s,同时读取吸光值,采用2-ΔCt法分析数据。
1.2.3 设计DDX46 RNA干扰靶点并合成寡核苷酸双链 以DDX46基因为模板,设计多个19~21nt RNA干扰靶点序列,经设计软件评估测定后,确定靶点序列为5’-GATTGTGATTGAAGAAGAA-3’,根据已选靶点序列设计DDX46 shRNA序列,并在两端添加合适的限制性内切酶酶切位点形成DNA寡核苷酸链,同时在正链3’端添加TTTTT终止信号,在反链5’端添加终止信号互补序列,使其完整。将合成的单链DNA 寡核苷酸链干粉溶解于退火缓冲液中(终浓度100 mol/L),90℃水浴15 min,自然冷却至室温后,最后形成带黏性末端的双链,命名为shDDX46,正义链:5’-CCGGGTGATTGTGATTGAAGAAGAATTCAAGAGATTCTTCTTCAATCAC
AATCACTTTTTG-3’,反义链:5’-AATTCAAAAAGTGATTGTGATTGAAGAAGAATCTCTTGAATTCTTCTTCAA
TCACAATCAC-3’,其中CCGG为AgeI酶切位点,AATTC为EcoRI酶切位点,G为EcoRI酶切位点互补序列。对照组则选择已成熟的普适型阴性序列5’-TTCTCCGAACGTGTCACGT-3’作为核心序列,该序列在Gen bank中进行比对显示仅和Zebrafish的2个基因有连续 16个碱基的同源性,命名为shRNA。
1.2.4 DDX46RNA干扰慢病毒载体的构建与鉴定 50 μL体系下37℃反应1 h,AgeI和EcoRI双酶切GV115载体使其线性化。通过T4DNA连接酶,将两组双链DNA与线性化载体GV115 质粒的20 μL体系在16℃条件下反应1~3 h。取10 μL连接产物转入100 μL新鲜制备的 TOP10大肠杆菌感受态细胞中,冰浴30 min,42℃热激90 s,冰浴2 min,然后加入500 μL无抗菌药物的(luria-bertani,LB)液体,于37℃、2 000 r/min震荡培养1 h,最后取150 μL菌液均匀涂抹在含有Amp(100 μg/mL)的LB固体培养基上,37℃培养箱过夜培养。挑取阳性菌落进行琼脂糖凝胶电泳检测及测序分析,选择测序正确的质粒进行后续实验。
1.2.5 重组慢病毒的包装与检测 转染前24 h,将处于对数生长期且细胞密度为5×109/mL的293T细胞接种于直径10 cm 细胞培养皿中,37℃、5% CO2培养箱内培养24 h,当细胞密度达70%~80%时,将实验组慢病毒(GV115-shDDX46RNA+pHelper 1.0+pHelper 2.0)和对照组慢病毒(GV115-shRNA+pHelper 1.0+pHelper 2.0)及相应体积的转染试剂分别转染293T细胞,培养6 h后,弃废液清洗,加入含10%血清的细胞培养基20 mL,于 37℃、5% CO2培养箱内继续培养48 h。收集细胞上清液,4℃、3 800 r/min离心10 min,除去细胞碎片,0.45 μm滤器过滤,浓缩、纯化后进行病毒质量检测,包括物理状态检测、无菌检测及病毒滴度检测,其中病毒滴度检测具体方法为荧光梯度测定:测定前1 d,以每孔4×104/mL的密度将293T 细胞接种于96孔板,每孔100 μL,于37℃、5% CO2下培养24 h后进行病毒滴度测定,根据病毒的预期滴度,取7~10个Ep管,在每个管中加入90 μL无血清培养基,取待测定的病毒原液10 μL加入到第1管中,混匀后取10 μL加入到第2管中,依次倍比稀释至最后1管;选取所需细胞孔,吸出90 μL培养基,加入90 μL 对应稀释好的病毒溶液,继续培养,24 h后加入完全培养基100 μL,3 d后观察荧光表达情况。根据表达绿色荧光蛋白(green fluorescent protein,GFP)的293T 细胞数目计算实验组和对照组的病毒滴度。
1.2.6 重组慢病毒感染膀胱癌细胞 将胰酶消化后处于对数生长期的人膀胱癌5 637细胞及T24细胞分别接种于6孔板内,待每孔细胞密度为2×105/个/ mL时,将实验组重组慢病毒shDDX46和对照组重组慢病毒shRNA分别感染这2株人膀胱癌细胞。按慢病毒复染指数(MOI值)10进行转染,实验组病毒用量为6.67 μL,病毒滴度为3×108TU/mL,而对照组病毒用量为4.00 μL,病毒滴度为5×108TU/mL,常规培养液继续培养。16 h后换液,72 h后荧光显微镜观察细胞GFP表达。
1.2.7 RT-PCR检测重组慢病毒感染膀胱癌细胞后DDX46 mRNA表达水平 取上述稳定感染后的两株细胞系,分别进行总RNA的提取,反转录获得 cDNA,RT-PCR检测重组慢病毒感染膀胱癌细胞后DDX46 mRNA表达水平,观察其受到抑制的情况,具体操作步骤同1.2.2。
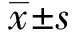
2 结果
2.1 RT-PCR检测人膀胱癌细胞株中DDX46 mRNA的表达水平 5637细胞中DDX46 mRNA的表达水平(用ΔCt值表示)为(6.53±0.08),T24细胞中DDX46 mRNA的表达水平(同上)为(8.48±0.11)。参照mRNA表达丰度标准:当ΔCt值≤12时,该细胞中基因表达丰度为高;当12<ΔCt值<16时,该细胞中基因表达丰度为中;当ΔCt值≥16时,该细胞中基因表达丰度为低。由此得知两株膀胱癌细胞系均高丰度表达DDX46。
2.2 重组慢病毒阳性克隆琼脂糖凝胶电泳结果 对照组shRNA阳性克隆PCR片段大小为307 bp,实验组shDDX46阳性克隆PCR片段大小为345 bp,阳性菌落的PCR 克隆结果与两组设计的基因大小基本一致,说明重组慢病毒构建成功,可进行后续测序。详见图1。
2.3 重组慢病毒PCR克隆后的测序结果 从上述实验组阳性克隆中选取一组进行测序,测序结果与DDX46-shRNA序列一致,说明实验组重组慢病毒shDDX46构建成功。详见图2。
2.4 重组慢病毒感染膀胱癌细胞 慢病毒感染72 h后,荧光显微镜下两组细胞均表达GFP,但实验组细胞GFP表达水平低于对照组细胞。详见图3、4。

图1 DDX46干扰慢病毒载体阳性克隆琼脂糖
注:1为阴性对照(双蒸水),排除系统中外源核酸污染导致假阳性结果;2为对照组(空载体自连对照组);3为250 bp 标记物,从上至下依次为5 kb,3 kb,2 kb,1.5 kb,1 kb,750 bp,500 bp,250 bp,100 bp;4~8均为实验组
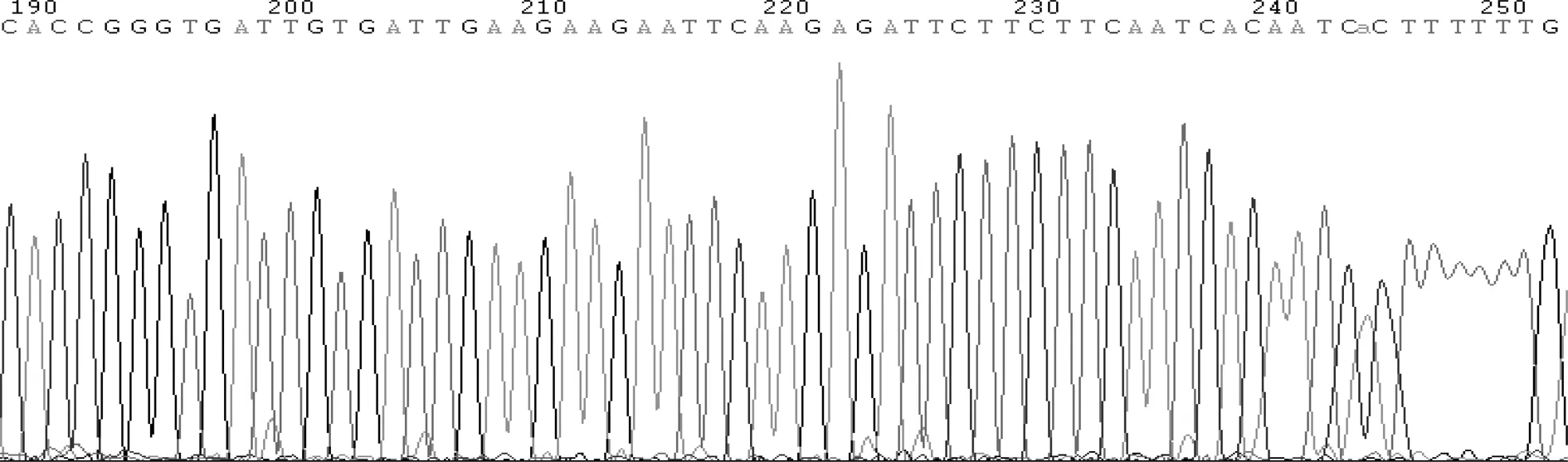
图2 重组慢病毒shDDX46 PCR克隆后的测序结果
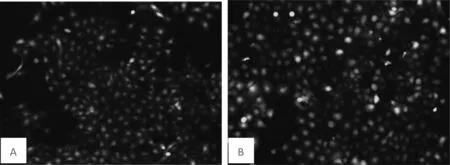
图3 重组慢病毒感染5637细胞后GFP表达的镜下结果
注:A为对照组shRNA GFP表达情况;B为实验组shDDX46 GFP表达情况

图4 重组慢病毒感染T24细胞后GFP表达的镜下结果
注:A为对照组shRNA GFP表达情况;B为实验组shDDX46GFP表达情况
2.5 RT-PCR检测重组慢病毒感染膀胱癌细胞后DDX46 mRNA的表达水平 重组慢病毒感染膀胱癌细胞后,在5637细胞中,实验组DDX46 mRNA的表达水平(用ΔCt值表示)为(0.32±0.01),低于对照组(1.00±0.10),差异有统计学意义(P=0.007),其敲减效率为67.70%;在T24细胞中,实验组DDX46 mRNA的表达水平(用ΔCt值表示)为(0.11±0.01),低于对照组(1.00±0.03),差异有统计学意义(P<0.001),其敲减效率为89.00%。
3 讨论
DEAD-box解螺旋酶家族因保守序列Ⅱ“DEAD(Asp-Glu-Ala-Asp)序列”而得名,除此之外,还含有其余8个相似序列(Q、I、Ia、Ib、III、IV、V、VI),均具有高度保守的特性[7]。其编码的相关蛋白广泛存在于众多生物中,均具有ATP酶活性、RNA结合活性、解旋活性及退火活性,在核糖体RNA的合成、前体RNA的剪接、RNA的稳定转录、运输及降解等[8-9]中占有重要的地位。20世纪80年代晚期,DEAD-box解螺旋酶家族在Linder等[10]的酵母eIF4A 转录起始因子8个同系物研究中第一次被鉴定及定义。目前,人体中已检测到43种DEAD-box 蛋白,各个蛋白中心解旋酶区域氨基酸序列虽然存在同源性,但其独特的生物特性无法被取代[11]。DEAD-box解螺旋酶家族在植物等原核生物中研究较多,DEAD-box RNA 解旋酶基因RNA解旋酶22[12](RNA helicase 22,RH22)、RCF1[13]等相继被发现。近年,随着对肿瘤的深入研究,RNA凭借其在肿瘤发生发展中的重要作用成为研究热点,DEAD-box解螺旋酶家族也逐渐被肿瘤研究学者重视,越来越多的DEAD-box蛋白被人熟知,但其功能机制仍不明了。DEAD-box解螺旋酶1(DEAD-box helicases 1,DDX1)蛋白最先在视网膜母细胞瘤细胞Y9 和RB522A 中被发现,且与MYCN基因共扩增并高表达,此后在大多数原发性肿瘤细胞系中也发现了其过表达现象,且其过表达可以使 NIH3T3细胞发生转化产生致瘤性[14]。而Han等[15]在同系小鼠模型的研究中发现,抑制DDX1可促进卵巢肿瘤的生长和转移,并有文献[16]报道,DDX5可通过激活β-actin信号通路促进非小细胞肺癌的发生与发展;DDX5在急性淋巴瘤的发生中也占有重要地位,Lin等[17]发现,构建重组shRNA慢病毒载体敲低DEAD-box解螺旋酶5(DEAD-box helicases 1,DDX5)表达后,急性淋巴瘤细胞生长受到抑制,但容易凋亡,其靶标通路为Notch通路;DDX5在膀胱癌中也有研究,Chen等[18]发现,与膀胱癌癌旁正常组织比较,癌组织中DDX5高表达,但未深入研究。
DDX46在膀胱癌中未见报道,且其在人类肿瘤中的研究也极少。多位学者[19-21]研究发现,敲除卵巢癌细胞、食管鳞状细胞癌和结肠癌细胞DDX46后,肿瘤细胞生长、生殖速度受到抑制,说明DDX46作为癌基因促进肿瘤的发生与发展。前期研究发现DDX46基因在膀胱癌组织中高特异表达,本研究利用慢病毒载体“转移基因片段容量大、安全性较好、可感染非分裂细胞、可稳定整合于靶细胞的基因组”等特点[22]将重组慢病毒shDDX46成功转入膀胱癌细胞5637、T24后有效抑制了DDX46mRNA的表达,且表达水平明显低于对照组shRNA重组慢病毒转染后的5637、T24细胞(P<0.05),说明shDDX46已发挥其沉默DDX46的作用,为进一步研究外源性DDX46在膀胱癌增殖、分化、侵袭和转移中的作用提供依据。
[1] 韩苏军,张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J].癌症进展,2013,11(1):89-95.
[2] HU H,MENG Q,LEI T,et al.Nucleophosmin1 associated with drug resistance and recurrence of bladder cancer[J]. Clin Exp Med,2015,15(3):361-369.
[3] XU Y Z,NEWNHAM C M,KAMEOKA S,et al. Prp5 bridges U1 and U2 snRNPs and enables stable U2 snRNP association with intron RNA[J]. EMBO J,2004,23(2):376-385.
[4] HIRABAYASHI R,HOZUMI S,HIGASHIJIMA S,et al. Ddx46 is required for multi-lineage differentiation of hematopoietic stem cells in zebrafish[J]. Stem Cells Dev,2013,22(18):2532-2542.
[5] HOZUMI S,HIRABAYASHI R,YOSHIZAWA A,et al. DEAD-box protein Ddx46 is required for the development of the digestive organs and brain in zebrafish[J].PLoS One,2012,7(3):e33675.
[6] LI M,MA Y,HUANG P,et al. Lentiviral DDX46 knockdown inhibits growth and induces apoptosis in human colorectal cancer cells[J]. Gene,2015,560(2):237-244.
[7] CORDIN O,BANROQUES J,Tanner N K,et al. The DEAD-box protein family of RNA helicases[J]. Gene,2006,36(7):17-37.
[8] STORY RM,LI H,ABELSON JN.Crystal structure of a DEAD box protein from the hyperthermophile methanococcus jannaschii[J].Proc Natl Acad Sci U S A,2001,98(4):1465-1470.
[9] PUTNAM A A,JANKOWSK Y E. DEAD-box helicases as integrators of RNA,nucleotide and protein binding[J].Biochim Biophys Acta,2013,1829(8):884-893.
[10]LINDER P. Birth of the DEAD box[J]. Nature,1989,33(7):121-122.
[11]LINDER P,FULLER-PACE F.Happy birthday:25 years of DEAD-box proteins[J].Methods Mol Biol,2015,12(9):17-33.
[12]CHI W,HE B,MAO J,et al. The function of RH22,a DEAD RNA helicase,in the biogenesis of the 50S ribosomal subunits of Arabidopsis chloroplasts[J]. Plant Physiol,2012,158(2):693-707.
[13]GUAN Q,WU J,ZHANG Y,et al. A dead box RNA helicase is critical for pre-mRNA splicing,cold-responsive gene regulation,and cold tolerance in arabidopsis[J]. The Plant Cell Online,2013,25(1):342-356.
[14]KANEKO S,OHIRA M,NAKAMURA Y,et al. Relationship of DDX1 and NAG gene amplification/overexpression to the prognosis of patients with MYCN-amplified neuroblastoma[J].J Cancer Res Clin Oncol,2007,133(3):185-192.
[15]HAN C,LIU Y,WAN G,et al. The RNA-binding protein DDX1 promotes primary microRNA maturation and inhibits ovarian tumor progression[J].Cell Rep,2014,8(5):1447-1460.
[16]WANG Z,LUO Z,ZHOU L,et al.DDX5 promotes proliferation and tumorigenesis of non-small-cell lung cancer cells by activating β-catenin signaling pathway[J].Cancer Sci,2015,106(10):1303-1312.
[17]LIN S,TIAN L,SHEN H,et al. DDX5 is a positive regulator of oncogenic notch1 signaling in T cell acute lymphoblastic leukemia[J].Oncogene,2013,32(40):4845-4853.
[18]CHEN R,FENG C,XU Y. Cyclin-dependent kinase-associated protein Cks2 is associated with bladder cancerprogression[J].J Int Med Res,2011,39(2):533-540.
[19]JIANG F,ZHANG D,LI G,et al. Knockdown of DDX46 inhibits the invasion and tumorigenesis in osteosarcoma cells[J].Oncol Res,2016,30(25):567-576.
[20]Li B,Li YM,He WT,et al. Knockdown of DDX46 inhibits proliferation and induces apoptosis in esophageal squamous cell carcinoma cells[J].Oncol Rep,2016,36(1):223-230.
[21]LI M,MA Y,HUANG P,et al. Lentiviral DDX46 knockdown inhibits growth and induces apoptosis in human colorectal cancer cells[J].Gene,2015,560(2):237-244.
[22]MAO Y,YAN R,LI A,et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in hek 293T cells[J].Int J Med Sci,2015,12(5):407-415.
