CryNGc蛋白在转基因玉米和大肠杆菌中表达的等同性研究
2018-02-01赵方方井乐刚尹悦佳冯树丹刘相国
赵方方, 刘 洋, 井乐刚, 尹悦佳 , 冯树丹*, 刘相国*
1.哈尔滨师范大学生命科学与技术学院, 哈尔滨 150025; 2.吉林省农业科学院农业生物技术研究所, 吉林省农业生物技术重点实验室, 长春 130033
由于BT蛋白具有广谱杀虫效果,因此能够代替化学杀虫剂在农田中广泛应用[1]。但是在BT生物杀虫剂的使用过程中,科学家们发现部分昆虫对原有的BT蛋白产生了抗性[2]。因此发现新的抗虫基因对于扩大抗虫谱和增加杀虫效果具有重要作用。
利用新的抗虫基因得到的转基因抗虫作物需要进行安全性评价。根据《转基因植物安全评价指南》对于转基因植物新表达蛋白食用安全性评价的规定,若用体外表达的蛋白质作为安全性评价的实验材料,需提供体外表达蛋白质与植物中新表达蛋白质等同性分析的资料[3]。在安全评价过程中,需要提供大量外源蛋白,而转基因作物本身产生的外源蛋白一般含量很低,而且难以富集和纯化,无法满足实验需要[4],经常需要通过原核生物或真核生物等体外表达系统来诱导表达外源基因所编码的蛋白。本实验所用的基因cryNGC是吉林省农业科学院农业生物技术研究所开发的具有自主知识产权的抗虫基因(专利号:CN104725516 A)[5]。本研究利用大肠杆菌表达系统成功表达了CryNGc抗虫蛋白,并且利用His标签纯化了该蛋白;通过SDS-PAGE、Western Blot、质谱分析对抗虫蛋白CryNGc与理论表达蛋白进行了等同性分析。CryNGc蛋白的等同性研究可以为今后该转基因作物的环境释放提供理论基础。
1 材料与方法
1.1 材料
1.1.1植物材料 转cryNGc基因抗虫玉米种子由吉林省农业科学院农业生物技术研究所提供。
1.1.2菌株与质粒 原核表达载体pCzn1、表达菌株Arctic-Express和大肠杆菌感受态TOP10菌株购自南京钟鼎生物技术有限公司。
1.1.3主要试剂与耗材 聚丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺(TEMED)购自上海生工生物工程有限公司;异丙基-β-D-硫代半乳糖苷(IPTG) 购自 Sigma 公司,Proteinlso Ni-NTA Resin Kit、琼脂糖、Blue Plus Ⅱ Protein Marker、2×EasyTaqSuperMix、Easysee Western Blot Kit、兔源二抗购自北京全式金生物公司; Cry1Ab一抗购自Abcam 生物公司;配制培养基所用的胰蛋白胨、酵母提取物购自 Oxoid 生物公司; 限制性内切酶购自 Thermo Fisher 科技公司,其他试剂均为国产分析纯。0.45 μm无菌滤器和PVDF印迹膜购自Millipore 生物公司;其他耗材购自上海生工生物工程有限公司。
1.2 方法
1.2.1原核表达载体的构建 采用基于 PAS(PCR-based accurate synthesis)的方法合成全长为 1 833bp 的基因cryNGc。依据目的基因和载体 pCzn1 的多克隆位点设计一对引物cryNGc-F:5’-CCATATGGGTTGCCCATTGTCCCATA-3’;cryNGc-R:5’-CTCTAGAGCCGAACATAAACGAGTGC-3’,上游引物和下游引物分别引入酶切位点NdeⅠ和XbaⅠ(下划线所示),经 PCR 扩增、胶回收后,将回收的基因与载体 pCzn1 连接(图1),获得重组质粒pCzn1-cryNGc;将重组质粒转入 TOP10 菌株中然后涂布于含有氨苄青霉素(Amp)的 LB固体培养基平板上,37℃ 过夜培养;挑取单克隆后,以所选单克隆为模板进行 PCR 检测获得阳性克隆;将其扩大培养后提取质粒,经酶切鉴定无误后送生物公司测序。
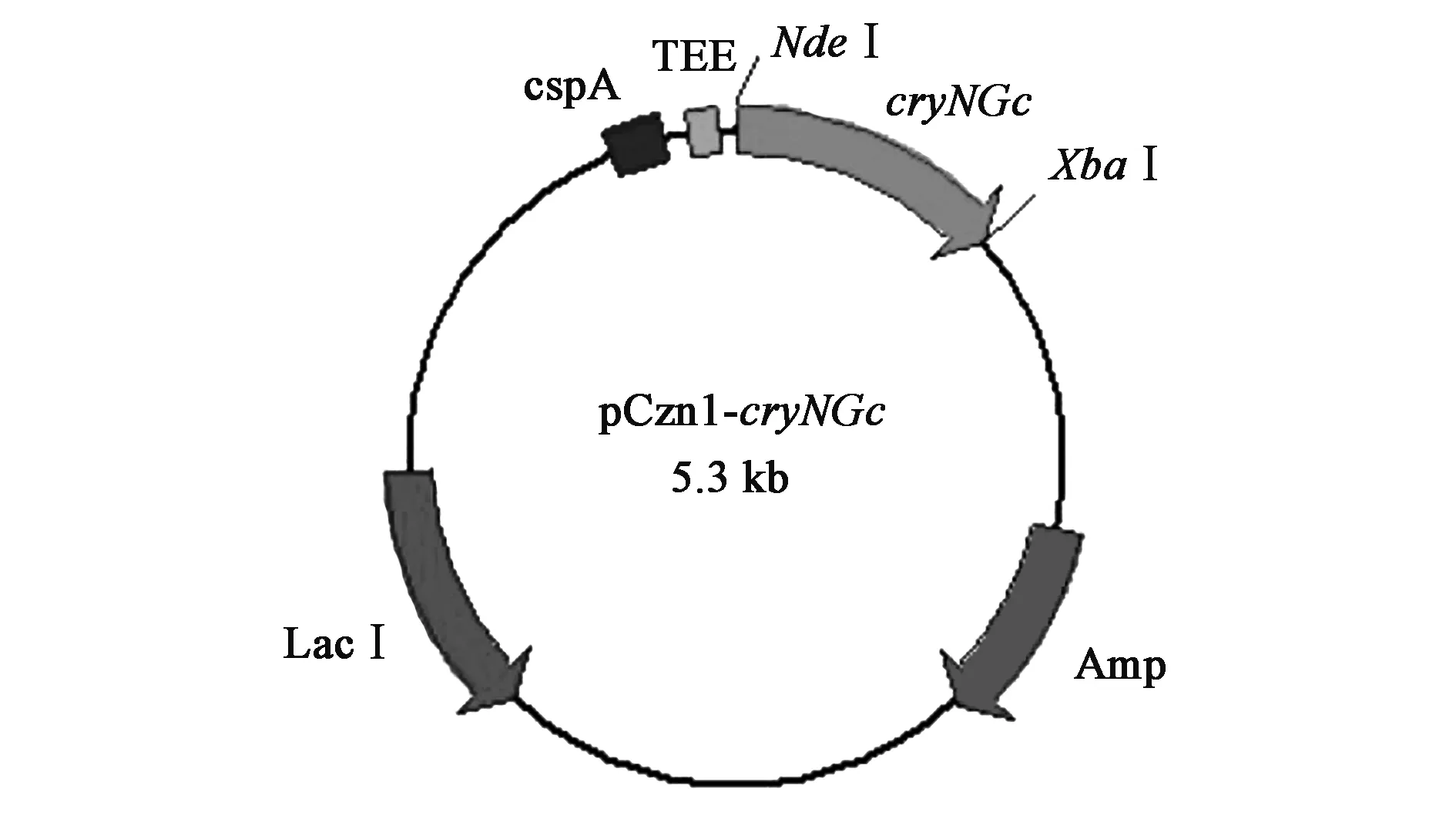
图1 原核表达载体pCzn1-cryNGc的构建Fig.1 Construction of expression vector pCzn1-cryNGc注:cspA:大肠杆菌冷休克基因启动子;TEE:烟草蚀纹病毒增强子;cryNGc:抗虫目的基因;Amp:氨苄青霉素抗性基因;LacⅠ:大肠杆菌乳糖操纵子调节基因
1.2.2重组质粒 pCzn1-cryNGc的表达 重组质粒的转化参考陈洪栋等[6]的方法;蛋白表达参考林亨咪[7]的方法,然后将每步的样品进行 SDS-PAGE 分析。
1.2.3包涵体蛋白的变复性 包涵体的变性以及复性相关实验步骤参考付明娟等[8]的方法。
1.2.4表达后重组蛋白的纯化 用 Ni-NTA Agroase 进行重组蛋白的纯化,以 5~10 倍体积的平衡缓冲液平衡柱子,待液体流尽之后,加入上述溶解之后的包涵体溶液,以 5~10 倍体积的含有 20 mmol/L咪唑的缓冲液洗脱杂蛋白2次,液体流尽后,以含有 250 mmol/L 咪唑的洗脱液洗脱目的蛋白。
1.2.5转基因玉米叶片蛋白的提取 温室种植转cryNGc基因植株,长至 5~6 叶期时采集叶片进行 PCR 检测,在已检测的植株中,选取转基因和非转基因植株各3株作为蛋白提取材料备用。转基因植株和非转基因植株每株各取 1 g,液氮研磨之后装入 15 mL 离心管中,每管中加入 6 mL 蛋白提取缓冲液(每 10 mL PBS加 1 片蛋白酶抑制剂),涡旋振荡混匀后,4℃ 12 000 g 离心 10 min,取上清即为植物总蛋白,-20℃ 保存备用。
1.2.6Western Blot 分析 取预染Marker、纯化后的 CryNGc 蛋白、诱导后的菌体蛋白、超声波破碎后的菌体蛋白、转基因玉米蛋白、空载体(pCzn1)进行 SDS-PAGE(5%浓缩胶和12%分离胶),80V 电压下跑出浓缩胶后,再将电压调至 120 V,待溴酚蓝跑出胶外停止电泳;然后进行转膜(半干转,10 V 转膜,观察预染 Marker 完全转印到膜上之后停止转膜,大约40 min),将转好的膜放入封闭液(5%的脱脂奶粉)25℃ 封闭 1.5 h 之后,进行一抗(1∶1 000)、二抗(1∶5 000)孵育,洗膜之后在暗室进行发光、压片、显影,最后对胶片进行扫描,得到结果。
1.2.7LC-MS-MS(液相色谱-串联质谱)分析
从考马斯亮蓝染色的胶上切下直径 0.3 mm 的目标蛋白胶条,以胶内消化脱色液(50%乙腈,25 mmol/L碳酸氢铵)对胶粒消化脱色2次,待胶粒脱水至完全变白时真空抽干乙腈;加入 10 mmol/L 二硫苏糖醇(DTT),56℃ 水浴锅内孵育 1 h,孵育完毕后移除多余的 DTT;加入 55 mmol/L 的碘代乙酰胺(IAM),暗室孵育 45 min,孵育完毕后移除多余的 IAM,加入 25 mmol/L 的碳酸氢铵清洗2次,每次10 min;移除碳酸氢铵,以脱色液清洗 2 次,每次 10 min,真空抽干乙腈;将1 μg/μL的胰蛋白酶用 25 mmol/L 的碳酸氢铵稀释 15 倍后加入到胶粒中,37℃ 水浴过夜消化;取 10 μL 样品上机用质谱仪检测,结果进行 Mascot 检索(http://www.matrixscience.com)比对。
2 结果与分析
2.1 原核表达载体的构建与验证
将阳性克隆扩大培养后提质粒进行酶切鉴定,结果表明(图2),已成功从原核表达载体上切得1 833 bp的目的基因,未酶切的质粒有3条带是因为质粒本身有着不同的形态所导致。将质粒送公司测序,结果表明原核表达载体 pCzn1-cryNG构建成功。

图2 表达载体 pCzn1-CryNGc的酶切验证结果Fig.2 Restriction enzyme digestion of expression vector pCzn1-CryNGc.注:M:DL 15 000 Marker;1:酶切前的质粒;2:酶切后的质粒
2.2 重组蛋白的表达和纯化
蛋白表达结果如图3A所示,CryNGc 重组蛋白以包涵体形式在沉淀中表达,上清中未见蛋白表达。箭头所示为目的蛋白条带,大小约为 65 kDa,根据理论推测蛋白大小为 60~67 kDa,实际大小在预测范围之间,在电泳过程中,电泳液的酸碱性以及电压的稳定性都会影响电泳结果,因此会存在误差,所以实验结果是可信的。本实验采用的启动子为大肠杆菌冷休克启动子,因此在图3A泳道2所示37℃时蛋白表达量小于泳道4的13℃。蛋白纯化结果如图3B所示,未纯化的包涵体蛋白和 20 mmol/L的咪唑洗涤后的蛋白都有拖尾,而以250 mmol/L咪唑洗脱之后的蛋白如箭头所示无拖尾现象,表明得到了纯化后的蛋白。
2.3 转cryNGc基因玉米总蛋白的提取和检测
转基因玉米蛋白检测结果如图4所示,和野生型玉米相比,转基因玉米有如箭头所示的目的蛋白条带,证明 CryNGc 蛋白在转基因玉米中能成功表达。

图3 CryNGc 重组蛋白的表达及纯化Fig.3 Expression and purification of recombinant CryNGc protein.注:A. CryNGc重组蛋白的表达:M: 蛋白质分子量标准; 1:未诱导的重组蛋白; 2:诱导后的重组蛋白; 3: 0.5 mmol/L IPTG诱导后的上清; 4: 0.5 mmol/L IPTG诱导后的沉淀。B. CryNGc重组蛋白的纯化:M:蛋白分子量标准; 1:未纯化的包涵体溶液; 2:20 mmol/L咪唑洗涤流出液; 3: 250 mmol/L咪唑洗脱纯蛋白。

图4 转基因玉米CryNGc蛋白的 SDS-PAGE分析Fig.4 SDS-PAGE analysis of protein CryNGc in transgentic maize.注:M: 蛋白分子量标准; 1:野生型玉米; 2:转基因玉米
2.4 Western Blot分析
Western Blot 结果如图5,阳性对照、诱导后的蛋白、破碎后的包涵体蛋白、转基因玉米蛋白都得到如图条带,空载体和转基因阴性植株无条带,cryNGc基因在大肠杆菌和转基因玉米中都能进行表达且大小一致,与阳性对照相比,泳道2条带较粗,原因是CryNGc蛋白以包涵体形式表达,在未经超声波破碎的条件下目的蛋白处于折叠状态,纯度不高,所以杂交结果不如纯化后的蛋白。可以看出蛋白的纯度高低对于Western Blot实验结果至关重要。

图5 CryNGc 原核蛋白和转基因玉米蛋白的 Western Blot 结果Fig.5 The Western Blot results of CryNGc protein in E. coli and transgenic maize.注:1:阳性对照(CryNGc纯蛋白);2:诱导后的蛋白沉淀;3:超声波破碎后的蛋白沉淀;4:转基因玉米;5:空载体;6:非转基因玉米
2.5 pCzn1-cryNGc原核蛋白和转基因玉米蛋白的质谱分析
以 CryNGc 重组蛋白和转基因玉米蛋白做质谱分析,然后将质谱结果用 Mascot 检索比对,因为cryNGc基因是从cry1Ab基因改造而来,因此以 CryNGc 重组蛋白和转基因玉米蛋白和 Cry1Ab 蛋白比对,结果如图6所示,划线部分为两种蛋白和 Cry1Ab 蛋白的成功匹配部分并且氨基酸序列相同。因为在数据库中Cry1Ab蛋白是已知的,以它为桥梁将原核表达蛋白和转基因玉米蛋白联系起来进行对比,结果证明两种蛋白在氨基酸序列上存在等同性。
3 讨论
利用原核表达的外源蛋白代替植物蛋白进行等同性实验和其他一系列验证实验对于提高实验效率有着重要的作用。但是以微生物表达的蛋白代替转基因植物中目的蛋白, 需要符合以下等同性验证标准:①两者在二维凝胶电泳中表现一致;②具有相同的结合单克隆、多克隆抗体的免疫反应性;③具有相同的翻译后修饰(如糖基化);④具有相似的氨基酸序列( N 末端 10~15 个氨基酸序列至少 3 个短的内部蛋白序列)[9]。本实验选取了免疫活性和相似的氨基酸序列两项指标。大肠杆菌表达的蛋白和植物蛋白在 SDS-PAGE 凝胶上大致位置相同,分子量相近;在 Western Blot 分析中,两种蛋白条带和阳性对照基本处于同一位置,证明两种蛋白具有相同免疫反应,这和徐海滨等[10]在研究cry1Ie基因时所得的 Western Blot结果相同,也符合cry系列抗虫基因在免疫活性的一致性;参考李敏[11]对两种蛋白做的质谱检测,结果利用 Mascot 检索比对,原核表达蛋白、植物蛋白和抗虫蛋白 Cry1Ab 的氨基酸匹配区段相同,证明两种蛋白的氨基酸组成基本一致。就目的蛋白的关键特性——氨基酸序列和免疫活性而言,实验结果表明大肠杆菌表达系统产生的目的蛋白与转基因植物目的蛋白基本是等同的,可以在后续的安全评价实验中发挥作用。尽管利用原核表达系统表达目的蛋白得到的蛋白量比较少,但是也为等同性的验证提供了可行的方法,如果利用发酵工艺在工业水平上表达和纯化蛋白,将会解决实验室所得蛋白量少的问题,为后续在环境安全评价中的蛋白等同性实验提供了可行的方法。

图6 Mascot 比对结果Fig.6 Mascot comparison results.A.原核表达蛋白和Cry1Ab蛋白氨基酸序列比对;B.转基因玉米蛋白和Cry1Ab蛋白氨基酸序列对
[1] Schnepf E, Crickmore N, Van R J,etal..Bacillusthuringiensisand its pesticidal crystal proteins[J]. Microbiol. Mol. Biol. Rev., 1998, 62(3): 775-806.
[2] 魏秋学. 棉铃虫对转Bt基因棉抗性的分子检测方法研究[D]. 南京:南京农业大学,硕士学位论文,2008.
[3] 甄二东. 利用体外培养细胞系评价外源蛋白安全性的研究[D]. 北京:中国农业科学院, 硕士学位论文,2016.
[4] 李飞武, 刘 信, 张 明,等. 国外转基因生物安全检测机构发展现状及趋势[J]. 农业科技管理, 2009, 28(3):33-36.
[5] 闫玮玉. 转cryNGc基因水稻的抗虫性研究[D]. 长春:东北师范大学,硕士学位论文,2016.
[6] 陈洪栋, 董文博, 李红民. 一种用质粒DNA转化大肠杆菌感受态细胞的实用操作技巧[J]. 生物技术通报, 2009(s1):297-299.
[7] 林亨咪. 玉米抗虫蛋白基因原核表达载体构建及活性研究[D]. 哈尔滨:黑龙江大学, 硕士学位论文,2013.
[8] 付明娟, 林接玉, 谢捷明. 包涵体蛋白复性的研究进展[J]. 医学综述, 2015(20):3657-3659.
[9] 崔浩然, 郎志宏, 朱 莉,等. 微生物蛋白与转基因作物蛋白等同性比较[J]. 生物技术通报, 2013(9):13-17.
[10] 徐海滨, 张晓霞, 李 芳,等.Cry1Ie基因在大肠杆菌中的表达及等同性鉴定[J]. 卫生研究, 2007, 36(1):45-48.
[11] 李 敏. 重组抗除草剂蛋白aroA-CC-M与转Cry1Ac-M基因抗虫玉米Bt-799的食用安全性评价[D]. 北京:中国疾病预防控制中心, 硕士学位论文,2012.
