发酵鸡血中菌种扩大培养条件的优化
2018-02-01梁肖娜孔彦文陶冬冰孔繁华韩宏娇吴尚吴尚仪岳喜庆
梁肖娜,孔彦文,陶冬冰,孔繁华,韩宏娇,吴尚,吴尚仪,岳喜庆
(沈阳农业大学食品学院,辽宁沈阳110866)
近年来,随着人们生活水平的迅速的提高,我国畜禽业的发展也伴随着突飞猛进,畜禽的数量也不断增加,因此动物血液的数量也随之增加[1]。随着畜禽工业的发展,鸡血的产量也迅速增加,但是目前我国对鸡血的使用基本上没有被开发和利用,相反而是直接被排放到畜禽屠宰场周围的环境中,对环境的影响造成极其恶劣的影响[2]。除此之外,鸡血的大量流失不仅造成了环境的严重污染,而且也使得蛋白质原料的大量的浪费。据调查研究显示,畜禽类的动物血液,尤其鸡血是一种含有极其丰富的蛋白质,大量的糖类、脂类、和氨类化学物质,含有生命体所需要的大部分的氨基酸、矿物质(钾、钠、镁、磷、铁)等物质以无机盐的形式存在[3]。因此,对于鸡血的再次开发和利用,将会为我国创造更多和更加可观的经济和社会效益。
本试验从环境和经济效益出发,利用微生物培养和发酵技术,筛选出适合鸡血发酵的优势菌株,对优势菌株的发酵和生长配方进行筛选,研究出适合菌株发酵鸡血的最佳的生长条件,可以将鸡血中大分子的蛋白质等大分子物质分解成为更加适合,或者被动物、植物直接吸收和利用的可溶性的小分子蛋白质等物质,从而为鸡血等其他类的动物血液的而进一步的研究与开发利用提供坚实的理论和试验依据[4]。
1 材料与方法
1.1 材料与试剂
新鲜鸡血:由沈阳市伟峰肉鸡加工厂提供;供式菌株,4种菌株(A7苏云金芽孢杆菌Bacillus thuringiensis、A8 希瓦氏菌 Shewanella sp.、B1 青霉菌属Penicillium citreonigrum、B4塔宾曲霉Aspergillus tubingensi):由沈阳农业大学实验室分离筛选提供;液体培养基:由沈阳农业大学实验室配制而成;牛肉膏、蛋白胨、琼脂、氯化钠、牛肉浸粉、酵母浸粉、七水硫酸镁、硝酸钠、磷酸氢二钾、硫酸亚铁、硫酸铵、甲醛、乙酰丙酮、乙酸:国药集团化学试剂有限公司。
1.2 仪器与设备
HZQ-C型恒温震荡培养箱:哈尔滨东联电子公司;TG16-WS台式高速离心机:长沙湘仪离心机仪器有限公司;UV-1600紫外/可见分光光度计:北京瑞利分析仪器公司;ACCULAB VICON电子精密天平:北京赛多利斯仪器系统有限公司;ZDX-35BI型座式自动电热压力蒸汽灭菌器:上海申安医疗器械厂;尼康生物显微镜:南京江南光电(集团)股份有限公司;DW-86L486超低温冰箱:德国Eppendorf公司;BCM-1000A生物洁净工作台:苏州市华宇净化设备有限公司。
1.3 方法
1.3.1 优势菌种生长曲线的测定
1.3.1.1 光电比浊计数法[5]
将1.1中得到的细菌优势菌株在细菌培养基上进行活化,将活化好的菌株分别接种到50 mL的细菌液体培养基中,160 r/min、37℃摇床培养,每隔2 h测定各菌株在600 nm处的吸光值,以培养时间为横坐标,OD600值为纵坐标,绘制各优势菌株的生长曲线,从而确定细菌制备种子液的最佳时间。
1.3.1.2 称干重法[6-7]
将1.1中得到的霉菌优势菌株在霉菌斜面培养基上进行活化,向活化后的菌种斜面中加入5 mL生理盐水,用接种环刮下菌苔制成菌悬液。将此菌悬液再稀释10倍后,在300 mL三角瓶中分别装30 mL液体繁殖培养基,接种500 μL孢子悬浮液,30℃摇瓶培养,每隔24小时取出三角瓶,将培养液抽滤于定量滤纸上,用蒸馏水洗涤2次~3次,100℃~105℃烘至恒重,称量菌体干重。以时间为横坐标,干重为纵坐标,绘制生长曲线从而确定霉菌制备种子液的最佳时间。
1.3.2 优势菌株种子液的制备[8]
首先用细菌和霉菌平板培养基分别对筛选分离得到的细菌和霉菌优势菌株在适宜的温度条件下进行活化培养,然后将活化好的细菌和霉菌优势菌株分别接入到装有50 mL相应液体培养基的锥形瓶中,其中细菌在37℃,160 r/min,霉菌在30℃,160 r/min的条件下恒温振荡培养至对数期取出,然后在4℃条件下,11 000 r/min,离心15 min,弃去上清液,加无菌生理盐水进行重悬,反复吹打液体,重复3次以上操作,最后将菌种浓度调至108个cfu/mL的数量级,4℃下保存备用。
1.3.3 游离氨基酸态氮含量的测定[9]
1.3.3.1 游离氨基酸态氮标准曲线的绘制
称取硫酸铵0.472 0 g于100 mL容量瓶中,加蒸馏水溶解并定容至100 mL,充分振荡混匀后放置4℃冰箱中备用,该溶液含氮量为1.0 mg/mL。使用时用移液枪吸取10 mL该溶液并定容至100 mL容量瓶,则该溶液含氮量为100 mg/mL。标准曲线的测定用移液枪分别准确吸取 0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL的100 μg/mL硫酸铵标准溶液分别放置于10 mL具塞比色管中,分别加4 mL乙酸铵缓冲溶液和4 mL显色剂,加蒸馏水定容至10 mL,混匀后剧烈震荡1 min,放入到100℃水浴锅中加热15 min,取出后冷却至室温。零管作为空白对照,将样品在400nm波长下测量吸光值,根据各浓度下的吸光度值绘制标准曲线。
1.3.3.2 鸡血发酵液中游离氨基酸态氮含量的测定
吸取待测样品1 mL定容到1 000 mL容量瓶中,充分震荡混匀备用,用移液枪吸取1 mL样品稀释液放入到10 mL具塞比色管中,分别加4 mL乙酸铵缓冲溶液和4 mL显色剂,加蒸馏水定容至10 mL,混匀后剧烈震荡1 min,放入到100℃水浴锅中加热15 min,取出后冷却至室温。将样品在400 nm波长下测量吸光值。
1.3.4 单株菌株发酵鸡血的效果测定[10]
用移液枪准确吸取2.5 mL新鲜鸡血于250 mL锥形瓶中,准确加入22.5 mL蒸馏水于上述锥形瓶中,瓶口用封口膜密封,在121℃下灭菌20 min,于无菌条件下分别将4株优势菌株种子液准确加入到锥形瓶中,种子液的添加量按照5%的比例加入到已经灭菌的新鲜鸡血中,在其自然pH值的条件下,混匀放入到恒温培养箱中,调节恒温培养箱培养条件为160 r/min、28℃,恒温发酵5天后取出,测定发酵鸡血中游离氨基酸态氮含量,每组至少3个平行。
1.3.5 混合菌株发酵鸡血的效果测定
用移液枪准确吸取2.5 mL新鲜鸡血于250 mL锥形瓶中,准确加入22.5 mL蒸馏水于上述锥形瓶中,瓶口用封口膜密封,在121℃下灭菌20 min,于无菌条件下将4株优势菌株种子液准确加入到锥形瓶中,种子液的添加量按照1∶1∶1∶1的体积比例加入到已经灭菌的新鲜鸡血中,在其自然pH值的条件下,混匀放入到恒温培养箱中,调节恒温培养箱培养条件为160 r/min、28℃,恒温发酵5天后取出,测定发酵鸡血中游离氨基酸态氮含量,每组至少3个平行。
1.3.6 混合菌株扩大培养的单因素试验
1.3.6.1 温度对混合菌株扩大培养条件的影响
准确配制自制液体培养基,装入250 mL锥形瓶中,瓶口用封口膜密封,在121℃下灭菌20 min,于无菌条件下将4株优势菌株种子液准确加入到锥形瓶中,种子液的添加量按照1∶1∶1∶1的体积比例加入,调节 pH=7,分别放在 28、30、32、34、36 ℃的中,同时调节转速为160 r/min,恒温培养12 h,等待菌液静置后,取适量上清液,分别测定5分菌液培养基的OD600吸光度值。
1.3.6.2 pH值对混合菌株扩大培养条件的影响
准确配制自制液体培养基,装入250 mL锥形瓶中,瓶口用封口膜密封,在121℃下灭菌20 min,于无菌条件下将4株优势菌株种子液准确加入到锥形瓶中,种子液的添加量按照1∶1∶1∶1的体积比例加入,分别调至pH值为4、5、6、7、8,将恒温培养箱调节在30℃、160 r/min的条件下培养12 h,等待菌液静置后,取适量上清液,分别测定5分菌液培养基的OD600吸光度值。
1.3.6.3 转速对混合菌株扩大培养条件的影响
准确配制自制液体培养基,装入250 mL锥形瓶中,瓶口用封口膜密封,在121℃下灭菌20 min,于无菌条件下将4株优势菌株种子液准确加入到锥形瓶中,种子液的添加量按照1∶1∶1∶1的体积比例加入,调节 pH=7,分别调至摇床转速为 100、120、140、160、180、200 r/min,将恒温培养箱调节在30℃的条件下培养12 h,等待菌液静置后,取适量上清液,分别测定5分菌液培养基的OD600吸光度值。
1.3.7 混合菌株扩大培养工艺条件的优化设计
试验选择温度、pH值、转速3个因素条件对混合菌株扩大培养条件进行响应面试验设计,通过Design Expert8.0.6软件对试验数据进行回归性分析和比较来预测混合菌株扩大培养的最优的工艺参数。响应面分析因素及水平见表1。
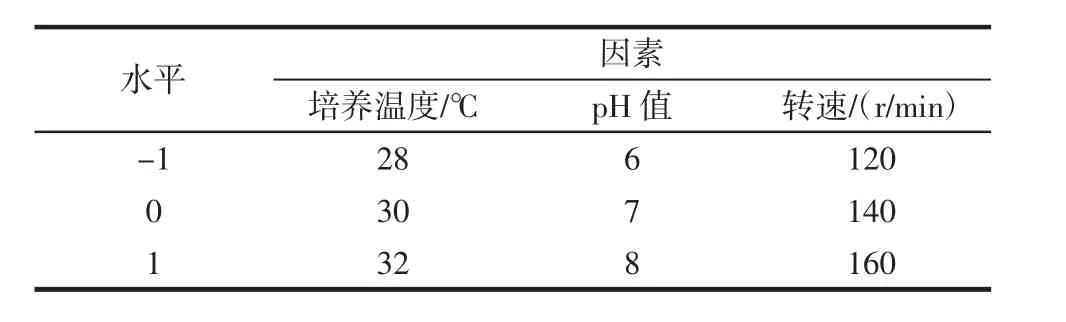
表1 响应面分析因素及水平Table 1 Factors and levels of response surface design analysis
1.3.8 试验验证
根据响应面得到的混合菌株扩大培养条件的工艺条件后,按照最佳工艺条件进行3次重复试验,最终验证响应面的试验参数是否准确可靠。
1.3.9 数据统计分析
以上试验数据均进行3次平行测定,试验结果以平均值±标准偏差表示,采用Excel、Design-expert8.0.6软件对试验数据进行分析。
2 结果与分析
2.1 菌株生长曲线的测定
细菌和霉菌的生长周期为延滞期、对数期、稳定期以及衰亡期4个特征时期。菌株生长曲线的测定见图 1、图 2。
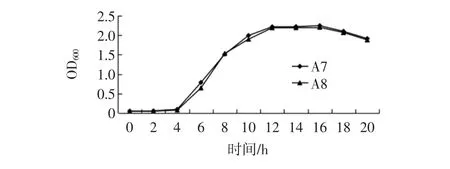
图1 两株细菌的生长曲线Fig.1 Growth curve of two bacteria strains
如图1所示,细菌A7苏云金芽孢杆菌Bacillus thuringiensis和A8希瓦氏菌Shewanella sp.的OD值在0~4 h时处于稳定状态;但是在4 h~12 h时,菌液的OD值迅速增大,此时表明在4 h~12 h时,菌株的生长正在处于对数生长期;12 h后菌液的OD值进入稳定状态并且逐渐趋于平稳,表明此时菌株进入稳定期;随着时间的增长大约在16 h后菌液的OD值逐渐降低,表明菌株逐渐进入到衰亡期。综上所述,种子液的制备时间制定在4 h~12 h之间内进行种子液的制备。从图2中可以看出,霉菌B1青霉菌属Penicillium citreonigrum、B4塔宾曲霉Aspergillus tubingensi的OD值在菌液培养的0~2 d时几乎处于稳定状态,变化不大;2 d~7 d时霉菌的菌液OD值迅速增大,可以得出此时的霉菌菌株在处于对数生长期;到菌株生长的7 d~9 d时菌液的OD值趋于稳定状态,变化微小;9 d~10 d时,菌液OD值迅速降低,此时处于衰亡期。因此,最终将种子液的最佳制备时间最终确定在2 d~7 d内。
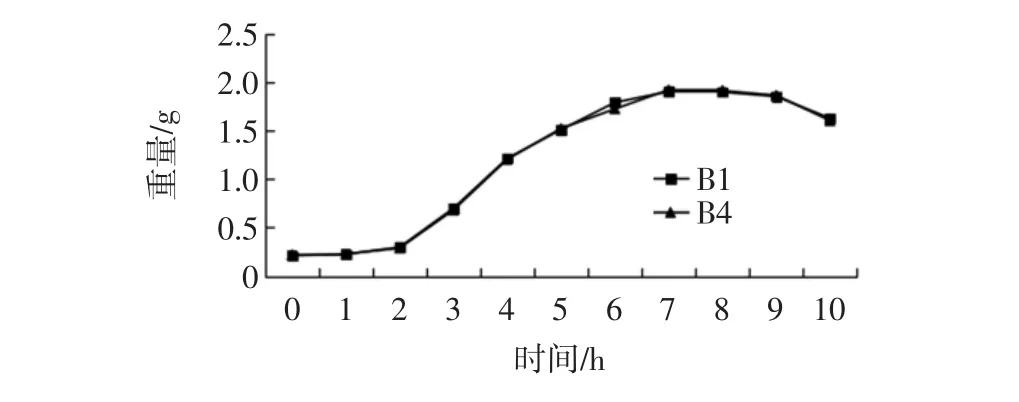
图2 两株霉菌的生长曲线Fig.2 Growth curve of two yeast strains
2.2 游离氨基酸态氮标准曲线
游离氨基酸态氮标准曲线见图3。
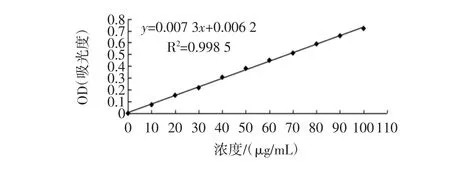
图3 游离氨基酸态氮标准曲线Fig.3 Standard curve of free amino acid nitrogen
如图3所示,试验以硫酸铵浓度为横坐标,吸光度值为纵坐标建立标准曲线,回归方程y=0.007 3x+0.006 2,相关系数R2=0.998 5,游离氨基酸态氮含量在0~100 μg/mL范围内与吸光度线性关系良好。
2.3 单株菌株发酵鸡血的效果测定
单株菌株发酵鸡血的效果见图4。
如图4所示,与空白对照组相比较,各株优势菌株对发酵鸡血中游离氨基酸态氮的影响效果均在不同程度上大于空白对照组,其中优势菌株A7和A8对鸡血中游离氨基酸态氮的影响效果与空白对照组相比,在数据统计学上均有极显著性差异(P≤0.01),A7和A8发酵鸡血中产生的游离氨基酸态氮的含量分别为30.2、30.7 μg/mL,约是空白对照组中游离氨基酸态氮的含量的2倍左右。B1和B4对鸡血中游离氨基酸态氮的影响效果与空白对照组相比,差异不显著(P>0.5)。由此可以说明,各株优势菌株对于发酵鸡血的影响效果均有影响,每株优势菌株都可以利用发酵鸡血,在一定程度上提高鸡血中游离氨基酸态氮的含量,这有可能是由于每种菌株对于发酵鸡血的能力各有差异所造成的,与各菌株在鸡血发酵过程中产生的酶类有一定的相关性。

图4 单株菌株发酵鸡血的效果Fig.4 The effect of single strain ferment chicken blood
2.4 混合菌株发酵鸡血的效果测定
混合菌株发酵鸡血的效果如图5所示。
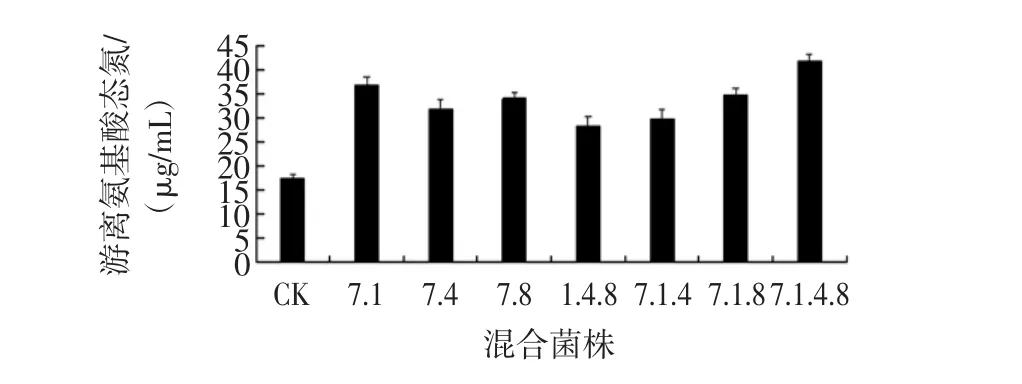
图5 混合菌株发酵鸡血的效果Fig.5 The effect of mixed ferment chicken blood
从图5中可以看出,菌株混合后发酵鸡血中游离氨基酸态氮的含量与空白对照组相比均有明显上升,各混合组菌株对游离氨基酸态氮含量的影响效果差异极其显著(P≤0.01),其中混合菌株 A7、A8、B1和B4组中游离氨基酸态氮含量约为41.7 μg/mL,约是空白对照组中游离氨基酸态氮含量的2.5倍左右。与此同时,与2.3中单株菌株发酵鸡血的效果相比较,游离氨基酸态氮含量远远高于单株菌株发酵鸡血中的含量。因此可以说明,混合菌株的共同发酵的效果最好,确定混合菌株A7、A8、B1和B4组为发酵鸡血的最佳菌株组合。
2.5 温度对混合菌株扩大培养条件的影响
温度对菌株扩大培养条件的影响结果如图6所示。
由图6可知,随着培养温度的升高,菌液OD600值也逐渐升高,当菌液培养温度达到30℃时,菌液OD600值达到最大,但是随着温度降低,菌液OD600值也开始缓慢下降。这可能是由于混合菌株在温度为30℃时,各菌株的生长代谢最为旺盛,随着温度的逐渐升高,会阻碍各菌株的正常生长和繁殖。因此最终确定混合菌株扩大培养的最佳温度为30℃。

图6 温度对混合菌株扩大培养条件的影响Fig.6 Effect of temperature on expanded culture conditions of mixed strains
2.6 pH值对混合菌株扩大培养条件的影响
pH值对菌株扩大培养条件的影响结果如图7所示。
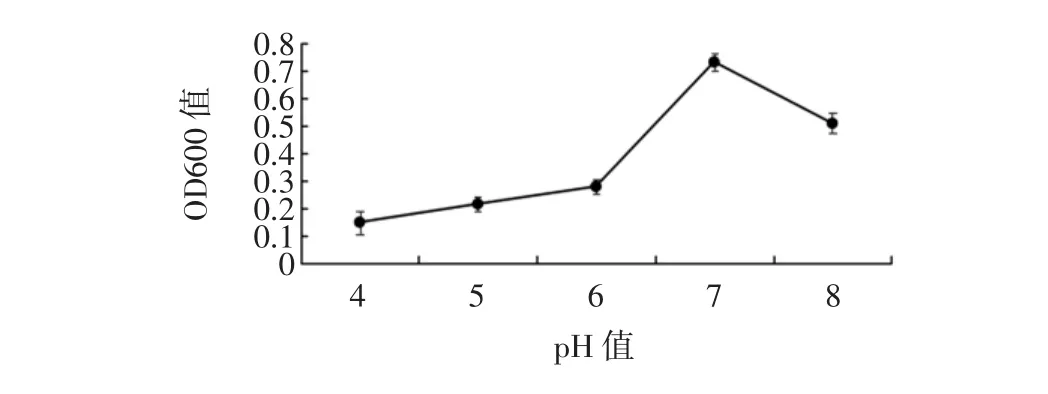
图7 pH值对混合菌株扩大培养条件的影响Fig.7 Effect of pH on expanded culture conditions of mixed strains
菌株只有在最适合培养液的pH值下,才可以促进微生物菌株的生长代谢和繁殖,否则会抑制微生物的生命活动。如图7所示,调节菌液的pH值从4到6时,菌液OD600值迅速上升,当pH值为7时,OD600值达到高峰,之后逐渐迅速降低。由此可以说明,当菌液pH值为7时,最适合各菌株的生长,因此最终确定pH值为7是混合菌株扩大培养的最佳pH值。
2.7 转速对混合菌株扩大培养条件的影响
转速对混合菌株扩大培养条件的影响结果如图8所示。

图8 转速对混合菌株扩大培养条件的影响Fig.8 Effect of speed on expanded culture conditions of mixed strains
由图8可知,随着摇床转速的逐渐提高,菌液OD600值缓慢上升,当转速增加到140 r/min时,OD600值停止增加,并且随着转速的增加,值开始迅速下降。对微生物菌液的进行搅拌,可以使菌液的流体速度增大,因此溶解氧的速度伴随增加,这时候对于微生物生长和其产物的转化有一定的促进效果。但是转速的改变可以直接影响到氧气的传递,因此最终确定摇床转速为140 r/min为混合菌株发酵的最佳转速条件。
2.8 混合菌株扩大培养工艺条件的优化设计
2.8.1 响应面试验设计结果及方差分析
响应面试验设计结果及方差分析如表2和表3所示。
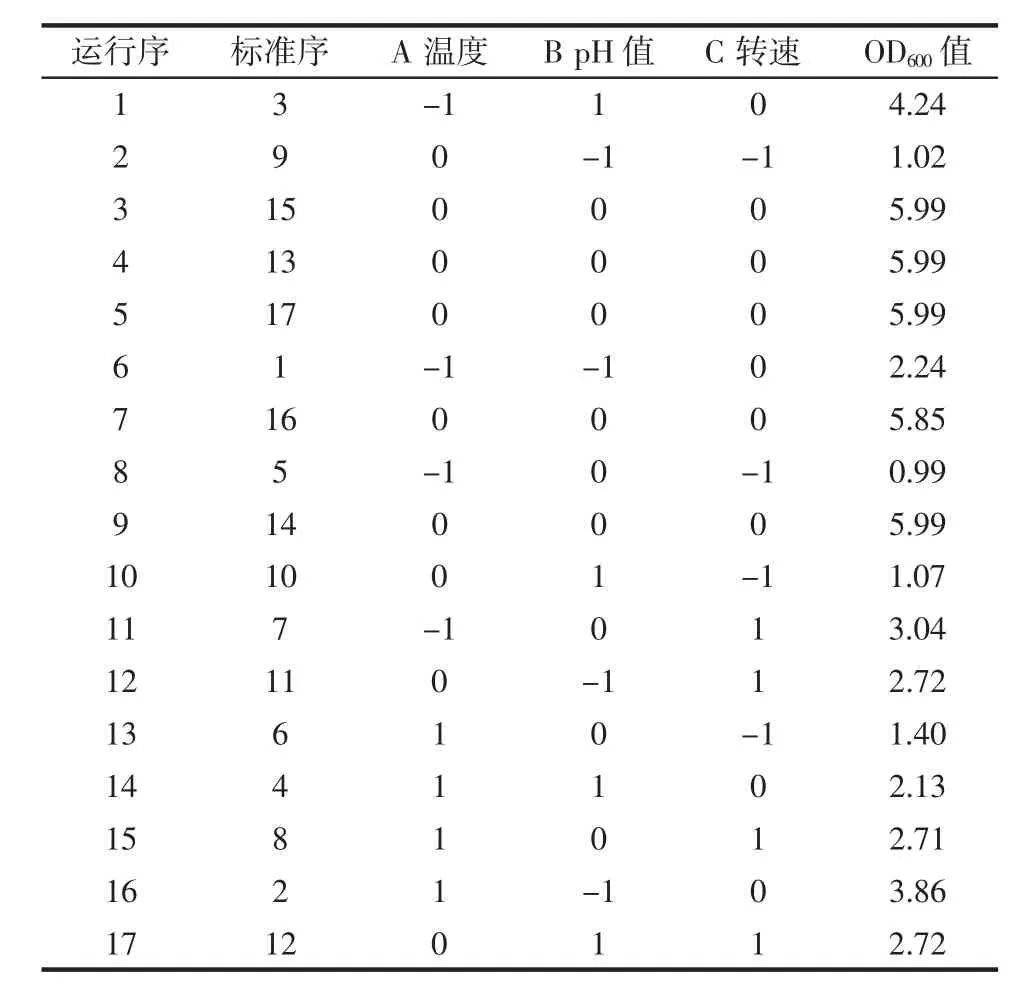
表2 响应面试验设计及结果Table 2 Design and results of response surface analysis test
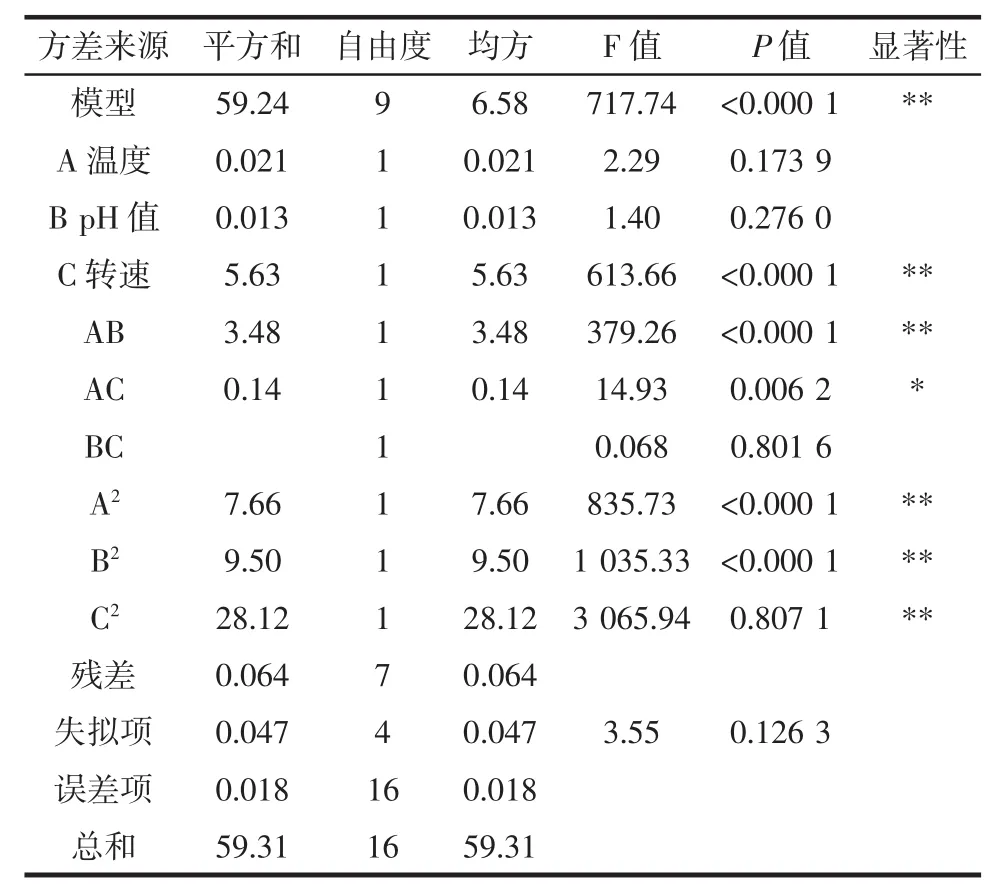
表3 方差分析表Table 3 Variance analysis of regression equation
依据表2中试验结果,利用Design Expert 8.0.6软件进行二次多元回归拟合,得到如下多元回归方程:Y=-621.143 20+24.123 63A+35.138 80B+1.994 00C-0.466 25AB-4.625 00×10-3AB-6.250 00×10-4BC-0.337 30A2-1.501 70B2-6.460 50×10-3C2

图9 温度和pH值对OD值的等高线(右)和响应曲面图(左)Fig.9 Temperature and pH on OD contour(right)and response surface map(left)
由表3可知,此模型的P<0.000 1,说明OD值与所考察的自变量之间的线性关系极显著,模型的确定系数R2=0.998 9,修正后的确定系数R2Adj=0.997 8,说明该模型可以解释99.78%的变化,拟合程度良好;其中失拟项P>0.05,影响不显著,说明所选的模型适合,可以用该模型来进行拟合试验,一次项C和二次项A2、B2、C2极显著,可以说明对响应值的影响极显著;对OD600的影响顺序依次为pH值>温度>转速,即pH值对于OD600的影响较为显著。
2.8.2 响应面各因素间的交互作用分析与优化
利用Design Expert 8.0.6软件对表2中的数据进行回归方程的的拟合,得到图9~图11的等高线和响应面图。

图10 温度和转速对OD值的等高线(右)和响应曲面图(左)Fig.10 Temperature and speed on OD contour(right)and response surface map(left)

图11 转速和pH值对OD值的等高线(右)和响应曲面图(左)Fig.11 Speed and pH on OD contour(right)and response surface map(left)
从图9种可以看出温度和pH值交互作用对OD值的影响,响应面图可以清楚的看到温度和pH值间形成响应面的曲面变化幅度都较为明显,说明温度和pH值对OD值的影响非常显著。从左侧的等高线图中可以看出,响应面的最高点也是等高线图中的最小图形的中心点,温度和pH值所形成的等高线图形接近椭圆形,说明两者间的交互作用极其明显,这与二次多元回归方程拟合的方差分析结果是相互一致的。图10结果表明,温度和转速对OD值的影响作用,可以看出,当培养温度一定时,OD值随着转速的升高而增加,但是当转速增加到140 r/min中时,OD值又开始逐渐的降低,除此之外可以看到,转速的曲面变化幅度大于温度,说明转速对OD值的影响较为显著,另外从等高线图可以看出,温度和转速交互作用显著。转速和pH值对OD值的影响作用见图11。从图中可知,pH值的曲面变化幅度较小,而转速的变化幅度较大,由此可以说明,转速对OD值的影响作用大于pH值,同时也说明转速对OD值的影响极显著,这与二次多元回归方程拟合的方差分析结果是一致的。
2.8.3 验证性试验
利用Design Expert 8.0.6软件求解回归方程可以得到,混合菌株扩大培养的最佳的工艺条件为:温度30℃、pH=7、转速140 r/min,在此最佳的条件下得到的OD值的理论值可以达到8.74。为检验方程的可靠性,在此优化的条件下进行3次重复性试验验证,最终得到3次试验的OD值分别为8.66、8.78和8.85,平均值为8.76,这与该理论值较为接近,由此可以说明该响应面对混合菌株扩大培养的最佳的工艺条件具有实际可操作性。
3 结论
本试验以鸡血作为发酵原料,研究优势复合菌种扩大培养条件,根据中心组合Box Behnken(BBD)的设计原理和响应面的分析方法,并利用利用Design Expert 8.0.6软件进行试验设计和统计分析,得到OD值与温度、pH值、转速的回归模型,并对方程进行求解得到最佳的混合菌株的发酵条件为:温度30℃、pH=7、转速140 r/min,在此条件下OD值的理论值为8.74,在此条件下经过验证性试验得到,菌液的平均OD值约为8.76,由此可以说明该试验模型是可靠合理,具有一定的实际的指导价值和意义。本试验从生产实际出发,研究鸡血等动物性食品综合性开发,为新产品的开发和利用提供新的思路和想法。
[1]高薇薇,邓海燕,谢苗,等.鸡血的利用现状与展望[J].肉类工业,2004(2):42-46
[2]谭小林.动物血液利用的新途径[J].肉类工业,1989(2):42
[3]程池,蔡永峰.可食用动物血液资源的开发利用[J].食品与发酵工业,1998(3):68-74
[4]曾利平,周红,李俊田,等.鸡血酶解工艺条件的研究[J].食品与发酵技,2010,46(2):77-80
[5]朱艳蕾.细菌生长曲线测定实验方法的研究[J].微生物学杂志,2016,36(5):108-112
[6]吴巨贤.蛋卷中霉菌生长模型研究[J].轻工科技,2013,29(8):16-17,19
[7]王宇雯.对霉菌试验中关于试验周期的研究[J].环境技术,1995(2):12-15
[8]杨国良.发酵罐培养中种子液最佳培养时间的确定[C].中国畜牧兽医学会生物制品学分会中国微生物学会兽医微生物学专业委员会2010年学术年会(第三届中国兽药大会学术论坛)论文集,2010:5
[9]王文秀,于佳,李钐,等.不同条件对纳豆菌发酵蛤蜊产物中游离氨基酸态氮含量及纳豆激酶活性的影响[J].食品科学,2015,36(9):113-116
[10]宋敏.微生物肥料的菌种筛选及发酵工艺研究[D].舟山:浙江海洋学院,2015
[11]秦鹏,王龙,赵玉卉,等.响应面法优化蛹虫草菌丝液体发酵产虫草素培养基[J].食品工业科技,2016,37(8):185-190
[12]陈畑,彭婷婷,王尧,等.响应面法优化从丝状真菌中制取壳聚糖的研究[J].广州化工,2014,42(20):80-82
[13]竹文坤,牟涛,段涛,等.响应面法优化微生物诱导碳酸钙沉积培养基[J].化工进展,2014,33(6):1533-1538
[14]PARAMITHIOTIS E,RATCLIFFE M J.Bursa-dependent subpopulations of peripheral B lymphocytes in chicken blood[J].European Journal of Immunology,1993,23:96-102
[15]COURI D,ABDELRAHMAN M S.Effect of chlorine dioxide and metabolites on glutathione dependent system in rat,mouse and chicken blood[J].J Environ Pathol Toxicol,1979,3:451-460
[16]BISHOP C.Purine Metabolism in Human and Chicken Blood,in Vitro[J].Journal of Biological Chemistry,1960,235:3228-3232
[17]LI Q,FU C.Application of response surface methodology for extractionoptimizationof germinant pumpkin seeds protein[J].Food Chemistry,2005,92:701-706
[18]SANT'ANNA M R V,ALEXANDR N,BRUCE A,et al.Chicken blood provides a suitable meal for the sand flyLutzomyia longipalpisand does not inhibitLeishmaniadevelopment in the gut[J].Parasites&Vectors,2010,3(1):1-11
[19]高树云,刘兆仁,赵三强,等.鸡血中抗菌肽的提取、纯化和抑菌效果检测[J].农业工程技术(农产品加工业),2012(6):32-34
[20]张恒,王新华,龚飞琴.鸡血中血红素的提取[J].中国家禽,1998(4):10-11
