响应面试验优化诺丽果黄酮微波辅助提取工艺
2018-01-31贾增杰李瑞杰
崔 鹏,贾增杰,李瑞杰
(1.黄河水利职业技术学院环境与化学工程系,河南 开封 475004;2.开封市绿色涂层材料重点实验室,河南 开封 475004)
诺丽又名四季果,用于医药方面已有上千年时间[1-2]。诺丽果中的成分对很多病症具有明显的效果,如抗氧化、抗真菌、抗病毒、抗肿瘤、抗衰老、降血压、糖尿病、自身免疫系统疾病、心血管疾病、痤疮等[3-5]。
黄酮类物质的提取方法有很多种,目前比较常见的有浸提法、萃取法、酶解法、超声法、微波法等。其中浸提法较为成熟,但提取缓慢,所需溶剂量过多,提取效率低。酶解法效率有所提高,但提取时间仍然较长。超声法提取速度快、溶剂使用量少、操作简便,但黄酮提取纯度不高[6-7]。萃取法消耗成本较大,现在还在研究阶段。微波提取法能够减少溶剂使用量[8-10],且大大提高提取效率,因此,本试验将单因素试验和响应面试验设计优化法相结合,研究诺丽果黄酮物质的微波辅助最佳提取工艺,以期建立一种高效、清洁、经济、实用的提取方法[11-13]。
1 材料与方法
1.1 材料与试剂
诺丽果:中国海南;芦丁标准品(纯度≥98%):中国药品生物制品鉴定所;无水乙醇(分析纯):安徽安特食品股份有限公司;亚硝酸铝(分析纯):焦作市化工三厂;氢氧化钠、硝酸铝(均为分析纯):天津市恒兴化学试剂制造有限公司;过氧化氢(分析纯):天津市富宇精细化工有限公司;硫酸亚铁(分析纯):天津市大茂化学试剂厂;水杨酸(分析纯):天津市永大化学试剂有限公司;1,1-二基-2-苦基肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯):上海如吉生物科技股份有限公司。
1.2 仪器与设备
TU-1810紫外可见分光光度计:北京普析通用仪器有限公司;ISO9001超声微波组合反应系统:南京先欧仪器制造有限公司;SHZ-D(Ⅲ)循环水真空泵:河南智诚科技发展有限公司;FA2004N电子天平:上海精密科学仪器有限公司;101-1A电热鼓风干燥箱:天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 微波辅助提取
将诺丽果洗净、自然风干后切成片状,放在烘箱中110℃干燥至质量恒定,研磨并过200目筛,置于棕色瓶备用。参照廉琪等[14-16]的方法,取一定量的样品,加入相应体积分数的乙醇,搅拌并静置15 min,在不同功率条件下,选择不同的提取时间,制得待测样品液。
1.3.2 芦丁标准曲线的绘制与黄酮提取率计算
准确称取10.000 0mg芦丁标准品,配制成质量浓度为0.2000mg/mL的标准溶液。移液管移取0、2.50mL、5.00mL、7.50 mL、10.00 mL、12.50 mL此溶液于25 mL容量瓶,依次加入5%NaNO2溶液1.00 mL、10%Al(NO3)3溶液1.00 mL和4%NaOH溶液10.00mL,每次加入试剂后均摇匀静置5min,定容于25 mL容量瓶中,摇匀并静置15 min。于波长505 nm处测定吸光度值。诺丽果中总黄酮质量浓度按照芦丁标准曲线回归方程进行计算。黄酮提取率计算公式如下:
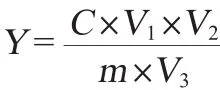
式中:Y为样品中黄酮提取率,mg/g;C为诺丽果中黄酮类化合物的质量浓度,mg/mL;V1为稀释体积,mL;V2为样品溶液体积,mL;m为样品质量,mg;V3为取样体积,mL。
1.3.3 诺丽果中总黄酮的提取单因素试验
乙醇体积分数对诺丽果黄酮提取率的影响:固定液料比30∶1(mL∶g),微波提取时间3 min,微波功率400 W,在乙醇体积分数分别为10%、20%、30%、40%、50%、60%、70%、80%条件下进行提取试验,探讨不同乙醇体积分数对诺丽果黄酮提取率的影响。
液料比对诺丽果黄酮提取率的影响:固定乙醇体积分数50%,微波提取时间3 min,微波功率400 W,在液料比分别为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1、70∶1、80∶1(mL∶g)条件下进行提取试验,探讨不同液料比对诺丽果黄酮提取率的影响。
提取时间对诺丽果黄酮提取率的影响:固定乙醇体积分数50%,液料比50∶1(mL∶g),微波功率400 W,于微波提取时间分别为1 min、2 min、3 min、4 min、5 min条件下进行提取试验,探讨不同微波提取时间对诺丽果黄酮提取率的影响。
微波功率对诺丽果黄酮提取率的影响:固定乙醇体积分数50%,液料比50∶1(mL∶g),微波提取时间3 min,于微波提取功率分别为100W、200W、300W、400W、500W、600W、700 W条件下进行提取试验,探讨不同微波提取功率对诺丽果黄酮提取率的影响。
1.3.4 响应面优化试验设计
参照蒋益花等[17-19]的方法,依据单因素试验结果,采用(Box-Behnken design,BBD)法设计4因素3水平的试验,因素分别为乙醇体积分数(A)、液料比(B)、微波辅助提取时间(C)、微波功率(D);-1、0、1(代表每个自变量的低、中、高水平);诺丽果中黄酮的提取率(Y)作为响应值,因素与水平编码见表1。
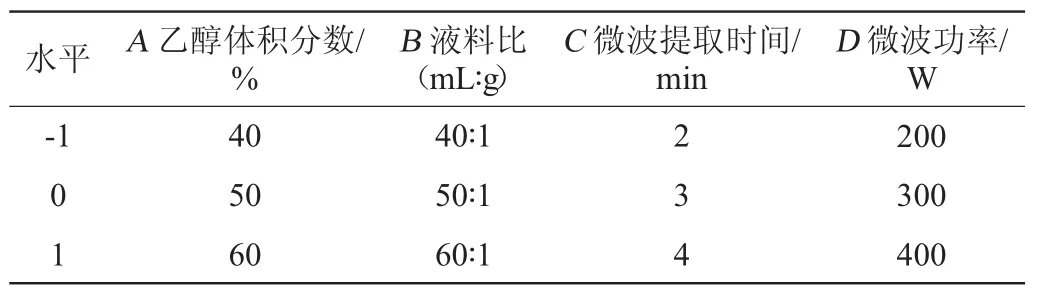
表1 诺丽果黄酮提取工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for extraction process optimization of flavonoids from Noni
1.3.5 测定方法[20-21]
(1)DPPH自由基清除率的测定
配制质量浓度0.200 0 mg/mL的DPPH溶液,放至冰箱避光保存备用。取不同质量浓度样品2.00 mL,加入已配制的DPPH溶液,摇匀,暗处反应30 min。以体积分数100%的乙醇为参比,在波长517nm处测吸光度值。DPPH自由基清除率计算公式如下:
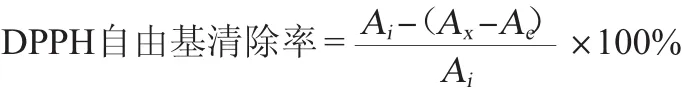
式中:Ai为DPPH溶液吸光度值;Ax为样品液和DPPH溶液吸光度值;Ae为不含DPPH溶液时样品液吸光度值。
(2)·OH清除率的测定
采用水杨酸比色法测定羟基自由基去除率[22-23]。取不同浓度梯度样品1.00 mL,加入2.00 mL FeSO4,1.50 mL水杨酸,再加入0.10 mL H2O2,摇匀,置于暗处30min。蒸馏水为参比,在波长510nm处测定吸光度值。·OH清除率计算公式如下:
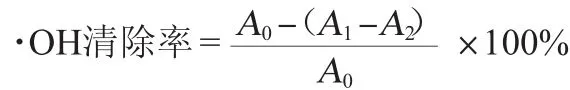
式中:A0为生成的羟基自由基溶液吸光度值;A1为样品液和生成羟基自由基溶液吸光度值;A2为样品液吸光度值。
2 结果与分析
2.1 芦丁标准曲线
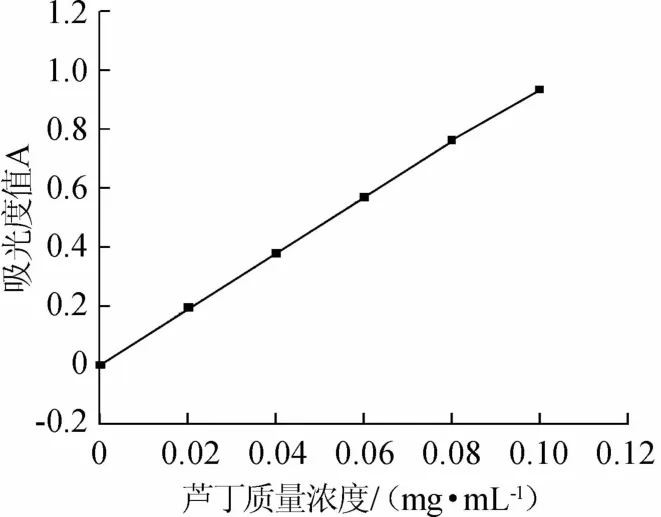
图1 芦丁标准曲线Fig.1 Standard curve of rutin
由图1可知,芦丁标准曲线线性回归方程为:A=9.3857C+0.004 4,相关系数R2=0.999 8,表明二者线性关系良好。
2.2 单因素试验结果
2.2.1 乙醇体积分数对诺丽果黄酮提取率的影响
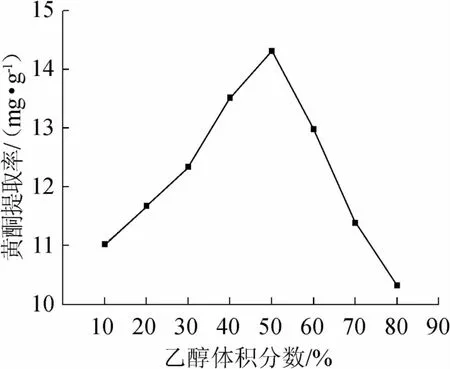
图2 乙醇体积分数对诺丽果黄酮提取率的影响Fig.2 Effect of ethanol concentration on the extraction rate of flavonoids from Noni
由图2可知,黄酮提取率随乙醇体积分数的增大呈现增加后减少的趋势。乙醇体积分数为50%时,提取率最大。推测其原因可能是水的加入使样品充分溶胀,使样品和溶剂的接触面积增加,导致了黄酮的提取率也增加。因此,选择乙醇体积分数为50%。
2.2.2 液料比对诺丽果黄酮提取率的影响

图3 液料比对诺丽果黄酮提取率的影响Fig.3 Effect of liquid-solid ratio on the extraction rate of flavonoids from Noni
由图3可知,黄酮提取率随液料比的增大呈现增加后减少的趋势。液料比为50∶1(mL∶g)时提取率最大。因此,选择液料比为50∶1(mL∶g)。
2.2.3 微波提取时间对诺丽果黄酮提取率的影响
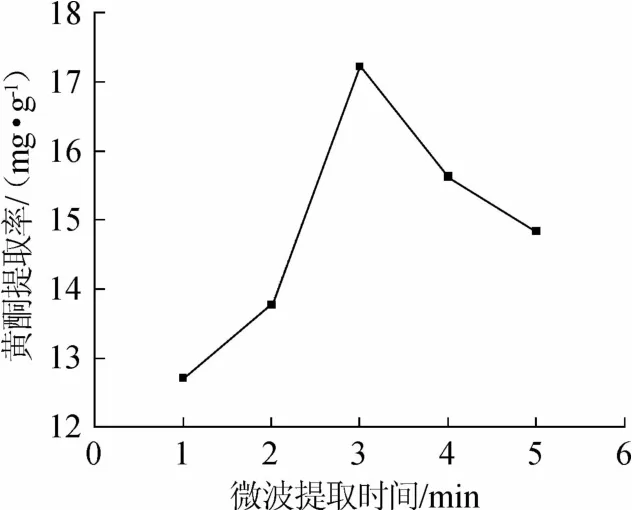
图4 微波辅助提取时间对诺丽果黄酮提取率的影响Fig.4 Effect of microwave-assisted extraction time on the extraction rate of flavonoids from Noni
由图4可知,黄酮提取率随微波提取时间的延长呈现增加后减少的趋势。微波提取时间为3min时,提取率最大。由于微波时间较长时,乙醇被蒸干情况严重,导致提取率下降。因此,选择微波时间为3 min。
2.2.4 微波功率对诺丽果黄酮提取率的影响
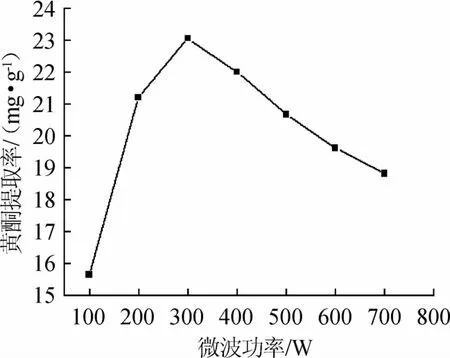
图5 微波功率对诺丽果黄酮提取率的影响Fig.5 Effect of microwave power on extraction rate of flavonoids from Noni
由图5可知,黄酮提取率随微波提取功率的增大呈现增加后减少的趋势。微波提取功率为300 W时,提取率最大。推测是由于提取温度随着提取功率的增大而升高乙醇挥发的越快,从而影响试验效果。因此,选择微波功率为300 W。
2.3 响应面法优化工艺条件
2.3.1 响应面试验设计与结果
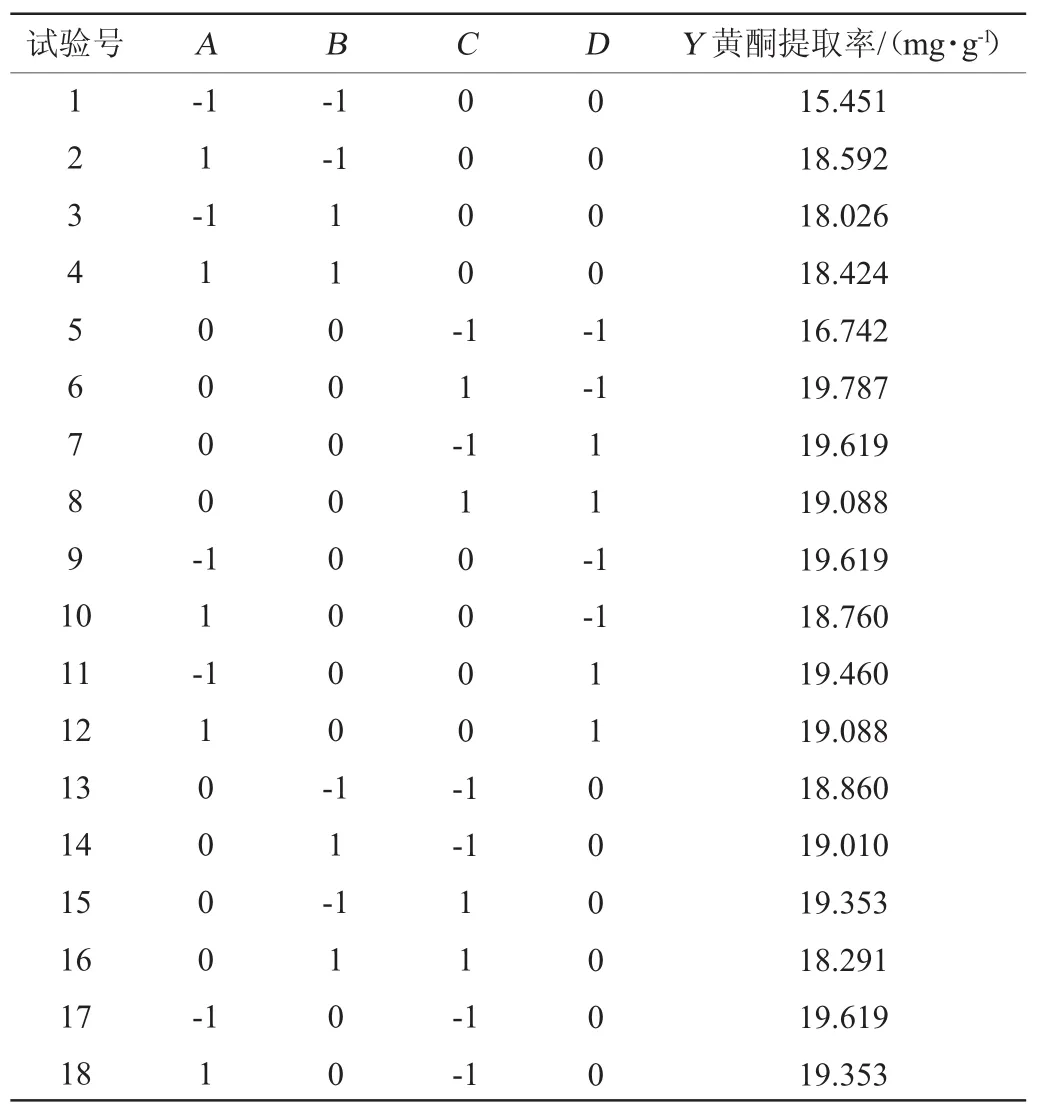
表2 诺丽果黄酮提取工艺优化响应面试验设计与结果Table 2 Design and results of response surface experiments for extraction process optimization of flavonoids from Noni
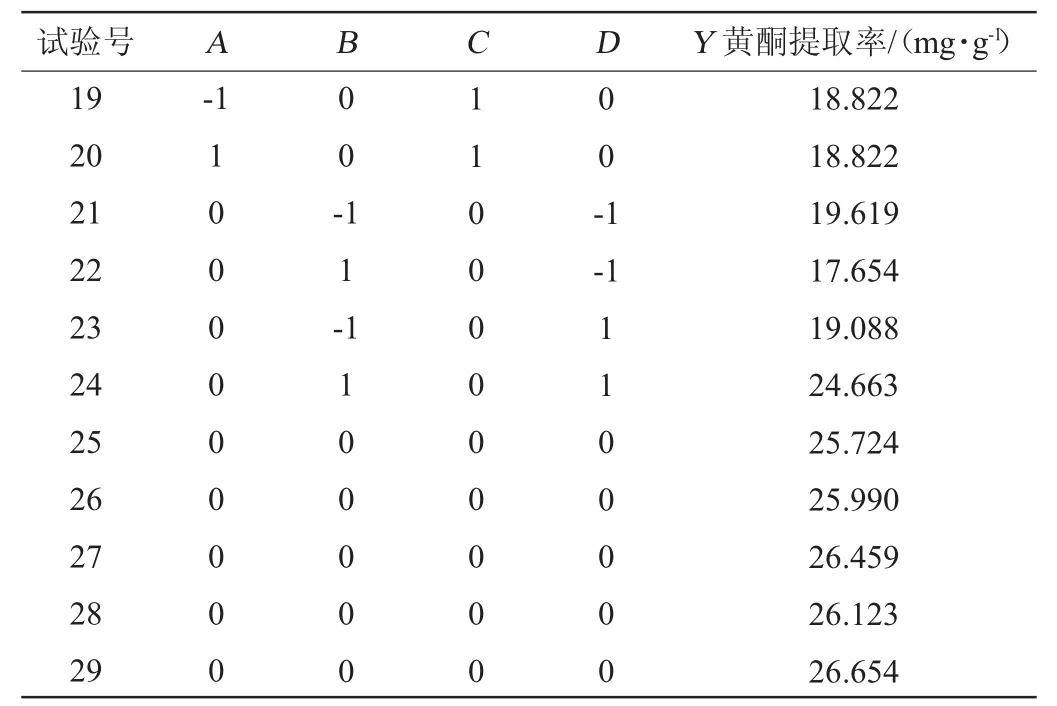
续表
2.3.2 模型的建立及方差分析
用Design-Expert8.0.6软件将模型进行分析,得到诺丽果中黄酮提取率以及所选4个因素编码值的回归方程为:
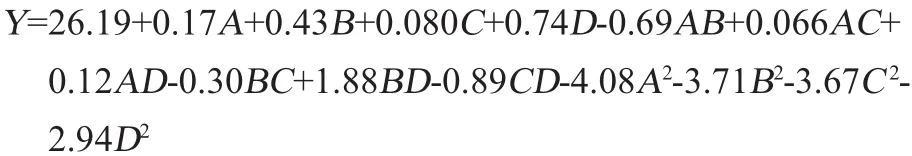
显著性检验和方差分析结果见表3。
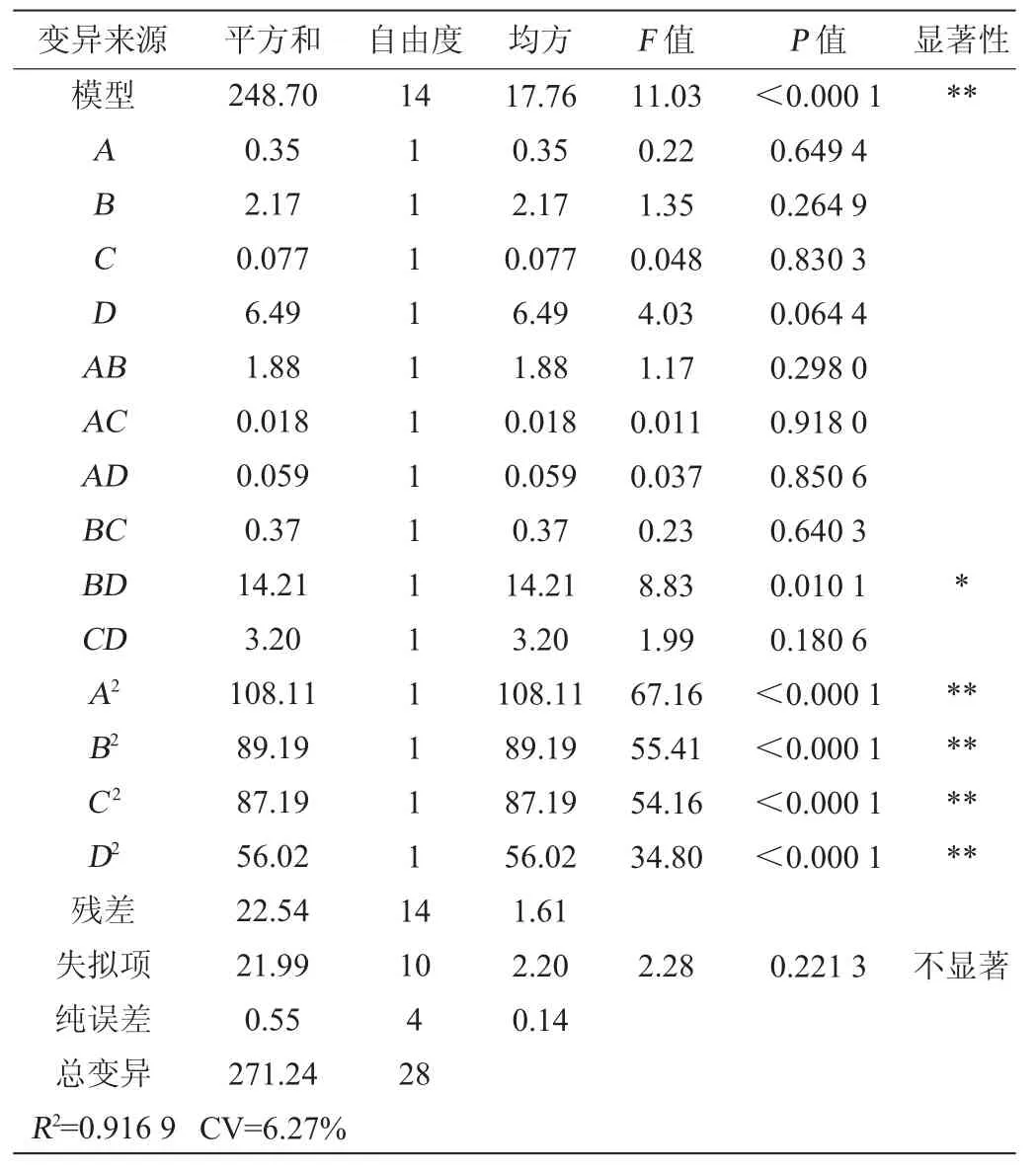
表3 多元回归模型方差分析Table 3 Variance analysis of multiple regression model

续表
由表3可知,失拟项P=0.221 3,说明相对于纯误差失拟不显著(P>0.05)。模型P=0.000 1说明模型极显著。获得模型线性回归系数R2=0.9169,说明91.69%响应值的变化是由独立变量决定,只有8.31%的总变异系数不能由该模型来解释。此外,模型的变异系数(coefficient of variation,CV)相对较低(6.27%),证明该试验值有较高的精密度及可靠性。综上所述,该模型拟合度符合数理统计学原则,诺丽果中黄酮提取的最佳工艺可以用此方程预测。根据F值的大小,得出黄酮成分提取率受各因素的影响次序:微波功率(D)>液料比(B)>乙醇体积分数(A)>微波提取时间(C)。
2.3.3 响应面分析
参照王燕等[24-26]的方法,用Design-Expert8.0.6软件绘制以黄酮提取率为响应值的各因子的响应曲面图,并研究其交互作用,发现乙醇体积分数和液料比、乙醇体积分数和提取时间、液料比和提取时间三组交互作用相对较弱;而乙醇体积分数和微波功率、提取时间和微波功率、液料比和微波功率三组交互作用较强,具体如图5所示。
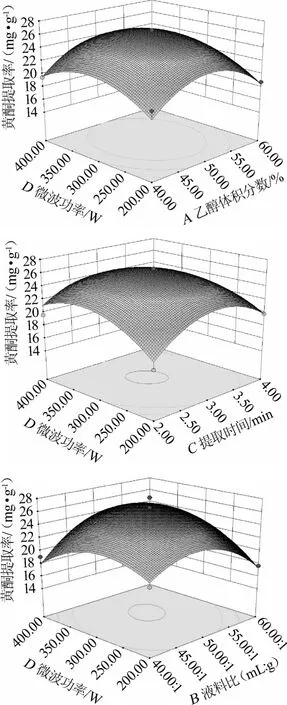
图5 乙醇体积分数、提取时间、液料比与微波功率交互作用对黄酮提取率影响的响应曲面与等高线Fig.5 Response surface plots and contour line of effects of interaction between ethanol concentration,extraction time,liquid-solid ratio and microwave power on flavonoids extraction rate
由图5可知,随着乙醇体积分数增大提取率也增大,且在乙醇体积分数为50%时提取率最大,超过50%后开始下降,微波功率呈先上升后下降的趋势。由其等高线图可以看出,等高线呈椭圆形,说明乙醇体积分数与微波功率的交互影响较为显著。随着提取时间的增加,提取率也呈增加趋势,且在3 min处达到最高值,而后逐渐下降,提取时间与微波功率对提取率的影响较大,表现为曲线较为陡峭。由等高线图可知,等高线呈椭圆的趋势显著,说明二者交互作用影响较为显著。液料比的影响趋势也相似,随着液料比的增大,提取率升高,在50∶1(mL∶g)处达到最高值,而后提取率开始降低,液料比与微波功率对诺丽果提取率的影响相对最大,表现为曲线更为陡峭。由等高线图可以看出,等高线为更扁的椭圆形,说明微波功率与液料比对诺丽果黄酮提取率交互作用相当显著。综合分析发现,液料比与微波功率的交互作用最为显著。
2.4 最优工艺及验证试验
对多元二次方程进行求解和分析,得出微波辅助法提取诺丽果中黄酮的最佳工艺条件为乙醇体积分数50%,微波辅助提取时间3min,溶剂和诺丽果的液料比50∶1(mL∶g),微波功率300 W,模型预测黄酮提取率为26.204 mg/g。检验优化模拟结果,确定最佳工艺条件为乙醇体积分数50%、微波提取时间3 min、液料比50∶1(mL∶g)、微波功率300 W,做5次平行样,计算平均值为25.981 mg/g,与模型预测值基本一致,说明所得模型可以用来预测诺丽果中黄酮提取率。
2.5 抗氧化试验结果
通过试验得出,诺丽果黄酮提取液质量浓度为8.00mg/mL时对DPPH自由基、·OH去除能力达到最大,分别为92.8%、82.8%,说明诺丽果提取物对DPPH自由基及·OH具备较好的去除能力。
3 结论
经Design-Expert8.0.6优化,检验确定最佳工艺条件为乙醇体积分数50%,微波辅助提取时间3 min,液料比50∶1(mL∶g),微波功率300 W,在此条件下,黄酮提取率平均值为25.981 mg/g。
诺丽果黄酮提取液质量浓度为8.00mg/mL时对DPPH自由基、·OH去除能力达到最大,分别为92.8%、82.8%,说明其抗氧化能力较强。
[1]林卫华,郑定仙,冯丁山,等.诺丽果粉食用安全性研究[J].中国热带医学,2011,11(12):1509-1511.
[2]刘树民,王 宇,张洪彩,等.诺丽果的化学成分研究[J].中草药,2012,43(11):2150-2153.
[3]李奕星,袁德保,郑晓燕,等.诺丽果汁的抗氧化性研究[J].热带作物学报,2013,34(8):1531-1534.
[4]朱耀华,杨建雄,代 斌.高粱红色素的体外抗氧化研究[J].陕西师范大学学报:自然科学版,2009,37(3):66-69.
[5]萨茹丽,木其尔,王翠芳,等.沙葱总黄酮提取工艺优化及其体外抗氧化、抗菌作用[J].食品科学,2014,35(24):1-8.
[6]吴海清,甄润英,何新益,等.萝卜叶黄酮的超声波辅助提取工艺及抗氧化活性研究[J].天津农学院学报,2017,24(2):63-66,71.
[7]巫宝霞,杨桂珍,温智幸,等.超声-微波提取蛤蒌中黄酮类化合物的工艺及成分初鉴[J].保鲜与加工,2016,16(5):67-73.
[8]李 娜,鲁晓翔.微波提取红花黄酮类化合物的研究[J].中国酿造,2010,29(7):105-109.
[9]张梦军,金建锋,李伯玉,等.微波辅助提取甘草黄酮的研究[J].中成药,2002,24(5):12-14.
[10]李 侠,邹基豪,王大为.响应面试验优化超声波-酶法提取绿豆皮黄酮类化合物工艺[J].食品科学,2017,38(8):206-212.
[11]袁茹楠,胡浩斌,韩舜禹,等.响应面法优化超声-微波提取甘草渣总黄酮工艺[J].中成药,2017,39(3):504-508.
[12]黄 菊,史小琴.响应面法优化超声辅助提取荞麦中芦丁的工艺[J].湖北农业科学,2016,55(20):5327-5331.
[13]韦学丰.分光光度法测定桉树叶中总黄酮的含量[J].中国酿造,2010,29(3):162-162.
[14]廉 琪,郑学芳,彭友舜,等.微波辅助提取芦笋粉中总黄酮的研究[J].中国酿造,2011,30(12):85-87.
[15]楚红英,李 瑜.菊花中总黄酮及铁含量的测定[J].江苏农业科学,2013,41(3):293-295.
[16]韩雪梅,许效群,王 缘,等.苦荞叶总黄酮提取纯化工艺研究[J].山西农业大学学报:自然科学版,2017,37(2):134-140.
[17]蒋益花.破铜钱总黄酮的提取工艺研究[J].生物质化学工程,2007,41(2):38-40.
[18]朱彩平,张艳霞,张 晓,等.石榴皮多酚提取方法研究进展[J].食品与发酵工业,2015,41(11):243-248.
[19]阳梅芳,曾新安,杨 星.沙田柚中不同部位黄酮类物质的分布及含量探讨[J].食品工业科技,2013,34(1):89-91,96.
[20]张亮亮,陈笳鸿,汪咏梅,等.海南蒲桃叶黄酮的提取及抗氧化性研究[J].生物质化学工程,2010,44(2):27-30.
[21]胡迎芬,丁皓玥,魏玉西,等.花生粕黄酮类物质的提取及抗氧化活性研究[J].中国油脂,2017,42(9):141-144.
[22]罗松明,张志清,向建军,等.小麦胚芽中黄酮类物质的超临界CO2萃取及其抗氧化作用[J].食品工业科技,2012,33(1):272-274.
[23]郑敏燕,魏永生,耿 薇,等.迎春叶黄酮的提取纯化及清除自由基活性研究[J].林产化学与工业,2009,29(6):47-51.
[24]王 燕,赖普辉.采用Box-Behnken Design优化玉米须总黄酮提取工艺[J].西部林业科学,2015,44(3):175-179.
[25]ZHONG Z,ZHENG H.Optimization for decolorization of azo dye acid green 20 by ultrasound and H2O2using response surface methodology[J].J Hazard Mater,2009,172(2):1388-1393.
[26]高晨哲,姜 帆,王艳菲,等.响应面法优化红薯美酒发酵工艺[J].中国酿造,2016,35(12):108-112.
