电针百会、神庭穴对缺血再灌注损伤大鼠学习记忆能力及海马CA1区嘌呤受体P2X7表达的影响①
2018-01-31黄佳宋长明杨敏光李建鸿黄盛柳维林陶静陈立典
黄佳,宋长明,杨敏光,李建鸿,黄盛,柳维林,陶静,2,3,陈立典,2,3,4
1.福建中医药大学康复医学院,福建福州市350122;2.福建省康复技术协同创新中心,福建福州市350122;3.康复医疗技术国家地方联合工程研究中心,福建福州市350122;4.国家中医药管理局中医康复研究中心,福建福州市350122
脑卒中是全球第二大致死病因及成人致残的首要原因。在一些发达国家,67.3%~80.5%的脑卒中归因为缺血性脑卒中[1-2]。认知功能障碍是学习记忆、言语、表达、理解、计算等能力的缺失。脑卒中后认知障碍发生率达47.3%[3],严重影响脑卒中患者日常生活,阻碍患者全面康复。临床研究表明,针刺可改善患者的认知功能[4]。本课题组通过动物实验和临床试验研究均证明电针百会、神庭穴在改善认知障碍方面有一定作用[5-8]。
海马是调节学习记忆的关键部位,CA1区神经元对结构蛋白损害和能量障碍特别敏感;脑缺血缺氧或炎症等损伤易引起海马CA1区神经元损伤及突触丢失,导致记忆障碍,特别是空间记忆受损[9-12]。
嘌呤受体与海马密切相关[13-14]。嘌呤受体可分为P1和P2两大类,P2受体的配基是嘌呤核苷酸。P2受体又分为两类:离子通道P2X受体和G蛋白偶联P2Y受体。P2X7受体在海马神经元及神经胶质细胞均有表达[15]。研究表明[16-18],脑卒中后,受损神经元和胶质细胞迅速释放ATP,激活胶质细胞P2X7受体;P2X7受体通过自身膜孔道结构或激活下游信号通路,促进炎症介质白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)和IL-6产生和释放;炎症介质进一步上调P2X7受体表达,并增加其对细胞外ATP的敏感性,从而加速炎症反应,促进神经元死亡。侧脑室注射P2X7受体特异性抑制剂后,能有效保护海马区神经元,改善脑缺血再灌注大鼠空间记忆能力[19-20]。
本研究观察脑缺血再灌注大鼠学习记忆能力及海马CA1区P2X7受体表达,探讨电针治疗认知功能障碍的机制。
1 材料与方法
1.1 实验动物
SPF清洁级雄性Sprague-Dawley大鼠42只,体质量230~260 g,购于上海斯莱克实验动物责任有限公司,生产许可证号SCXK(沪)2012-0002;由福建中医药大学实验动物中心饲养,许可证号SYXK(闽)2012-001。每笼5只,自由进食及饮水。
所有实验均遵照国际动物保护和使用指南的规定实施。
1.2 主要试剂和仪器
P2X7受体抗体(11144-1-AP):美国PROTEINTECH公司。 大鼠IL-1β酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(F15810)、大鼠TNF-α ELISA试剂盒(F16960):上海西唐生物科技有限公司。3600A线栓:广州佳灵生物技术有限公司。华佗牌G6805型电针仪:苏州医疗用品厂有限公司。Barnes迷宫:上海欣软信息科技有限公司。DMI4000B荧光倒置显微镜系统:德国LEICA公司。Motic Med 6.0数码医学图像分析系统、Image-lab图像分析系统:美国BIO-RAD LABORATORIES公司。
1.3 造模与分组
随机数字表法将大鼠分为假手术组(n=12)和手术组(n=30)。手术组参考Longa法[21]制备左侧大脑缺血再灌注动物模型。大鼠10%水合氯醛3 ml/kg腹腔注射麻醉,常规消毒颈部皮肤,颈正中切口,暴露左侧颈总动脉,向上分离并暴露左侧颈外动脉和颈内动脉;结扎颈总动脉和颈外动脉,用血管夹夹闭颈内动脉。在颈总动脉结扎处约3 mm处剪一小口,将线栓插入;撤去血管夹,缓慢推送线栓至大脑中动脉分支处,稍有阻力时停止,线栓距动脉分叉约18~20 mm;结扎颈内动脉固定线栓,清洗缝合创口。90 min后,缓慢抽出线栓,剪断体外多余线拴。
假手术组分离动脉,不予结扎和插线。
术中、术后注意保暖,置于25℃环境下苏醒。
动物苏醒后,按Longa评分判断模型是否成功。评分l~3分者入组实验。最终纳入24只大鼠,分为模型组、电针组各12只。
1.4 方法
造模成功后第2天,电针组采用自制捆绑法固定,参考《实验针灸学》[22]定位方法取百会、神庭。斜刺,深2 mm左右。接电针仪,疏密波,频率2/20 Hz,强度1~3 mA。每次30 min,每天1次,共7 d。假手术组和模型组同等条件抓取,不予任何治疗。
1.5 观察指标
1.5.1 神经行为学评分
造模后2 h和干预后1 d、3 d、7 d对各组大鼠行Longa评分。
1.5.2 Barnes迷宫测试
干预后3 d,采用Barnes迷宫测试大鼠空间记忆功能。迷宫由直径122 cm的圆形平台构成,四周分布20个洞口,洞口直径10 cm。逃避盒放在其中一个洞口的底部。检测前把大鼠置于逃避盒内30 s;风吹以及噪声等干扰刺激作为大鼠进入目标洞口的动机。实验时,大鼠置于圆形平台的中央起始盒内,电子跟踪设备记录其在300 s内找到正确洞口所用的时间(逃避潜伏期)和进入错误洞口的次数,共5 d。每次测试完毕后旋转圆形平台,并用70%酒精纱布擦拭清洗,以防通过嗅觉找到目标洞口。洞口位置保持不变。
1.5.3 免疫荧光检测
干预7 d后,各组取6只大鼠经腹腔静脉放血,前正中线剪开,心尖部及右心耳各剪开一个小口,用磨钝针头从心尖部插入心脏,进入颈动脉并固定,同时夹紧腹主动脉防止灌注液体进入下腔循环。用生理盐水300 ml快速冲洗,待流出血液呈较淡的粉红色停止。4%多聚甲醛缓慢灌注约400 ml,至大鼠前肢僵硬且轻微抽搐,头部坚硬停止。断头取脑,完整取出置4%多聚甲醛中常温固定,石蜡包埋,切片。
微波修复后,5%胎牛血清封闭,37℃孵育90 min。滴加P2X7受体一抗(1∶50),4℃冰箱孵育过夜;次日用PBS冲洗3次,每次5 min。滴加荧光二抗,37℃避光孵育90 min,PBS清洗3次,每次5 min。抗荧光淬灭处理及封片(含DAPI),风干后,立即用荧光倒置显微镜100倍下观察,Motic Med 6.0数码医学图像分析系统分析,记录平均光密度(optical density,OD)。
1.5.4 ELISA
干预7 d后,各组另6只大鼠腹主动脉放血,只灌注生理盐水,其他过程同上。冰上迅速取出大脑组织并用生理盐水冲洗干净,分离出左侧大脑海马CA1区,置于EP管内,迅速投入液氮罐中;保存于-80℃冰箱。
将海马CA1区组织称质量,加入10μl/mg蛋白酶抑制剂,充分研磨,4℃下3000 r/min离心20 min,取上清。按试剂盒说明书操作,酶标仪计算IL-1β、TNF-α含量。
1.6 统计学分析
采用SPSS 20.0软件进行统计分析。数据用(xˉ±s)表示。神经功能缺损评分不符合正态分布,采用非参数检验独立样本成对比较。逃避潜伏期、进入错误洞口次数、嘌呤受体P2X7平均OD值、IL-1β和TNF-α的含量均符合正态分布,采用单因素方差分析,两两比较,方差齐者用LSD法,方差不齐用Games Howell法。显著性水平α=0.05。
2 结果
2.1 神经行为学评分
假手术组无神经功能缺损;干预前,模型组和电针组间神经行为学评分无显著性差异(P>0.05);模型组和电针组Longa评分逐渐下降;干预后7 d,电针组较模型组降低(P<0.05)。见表1。

表1 各组Longa评分比较
2.2 Barnes迷宫测试
干预7 d后,与假手术组相比,模型组逃避潜伏期显著延长(P<0.001),进入错误洞口次数显著增多(P<0.001);与模型组相比,电针组逃避潜伏期显著缩短(P<0.001),进入错误洞口次数显著减少(P<0.001)。见表2。与假手术组相比,模型组大鼠轨迹分散于四周,杂乱;与模型组相比,电针组大鼠轨迹较集中,能较迅速找到目标洞口。见图1。
2.3 IL-1β、TNF-α表达
与假手术组相比,模型组大鼠IL-1β、TNF-α水平明显升高(P<0.01);与模型组相比,电针组IL-1β、TNF-α降低(P<0.05)。见表3。
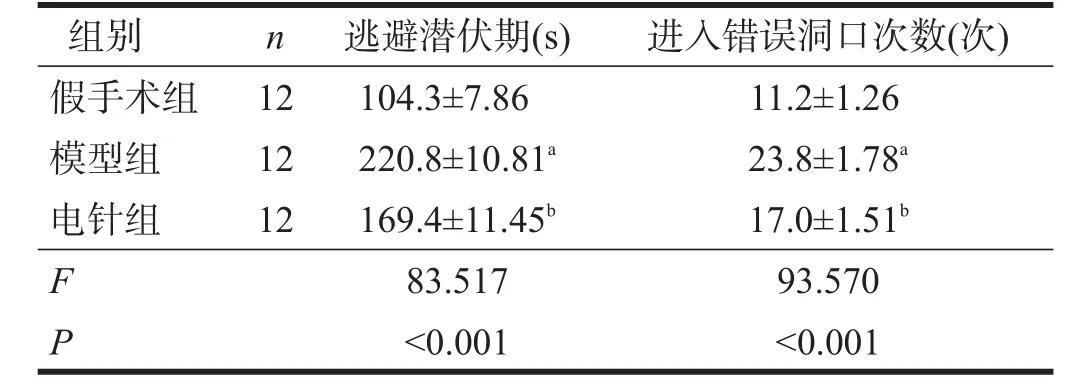
表2 各组Barnes迷宫测试结果比较
2.4 P2X7受体表达
假手术组P2X7受体平均光密度值显著低于模型组(P<0.001);与模型组相比,电针组P2X7受体表达明显减少(P<0.01)。见表3。模型组P2X7受体表达散乱,电针组表达较规整。见图2。
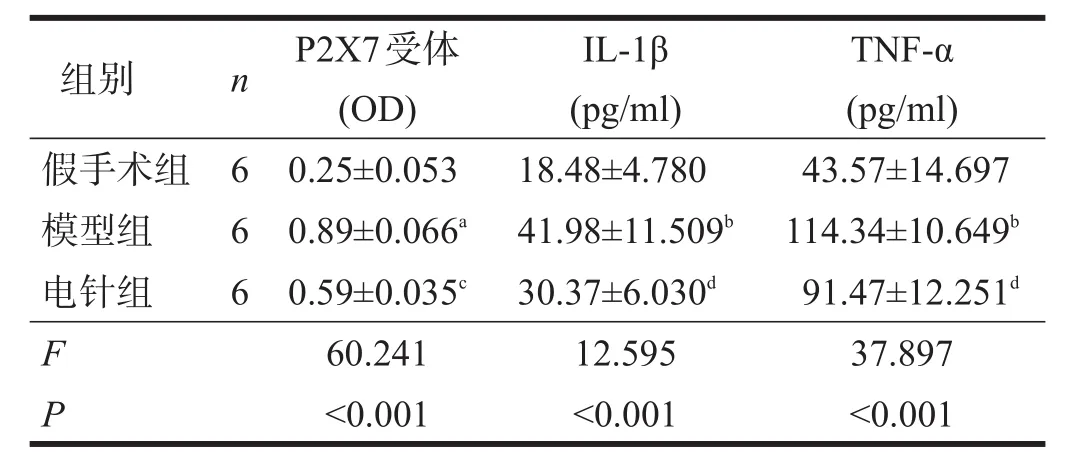
表3 各组大鼠海马CA1区P2X7受体、IL-1β和TNF-α表达
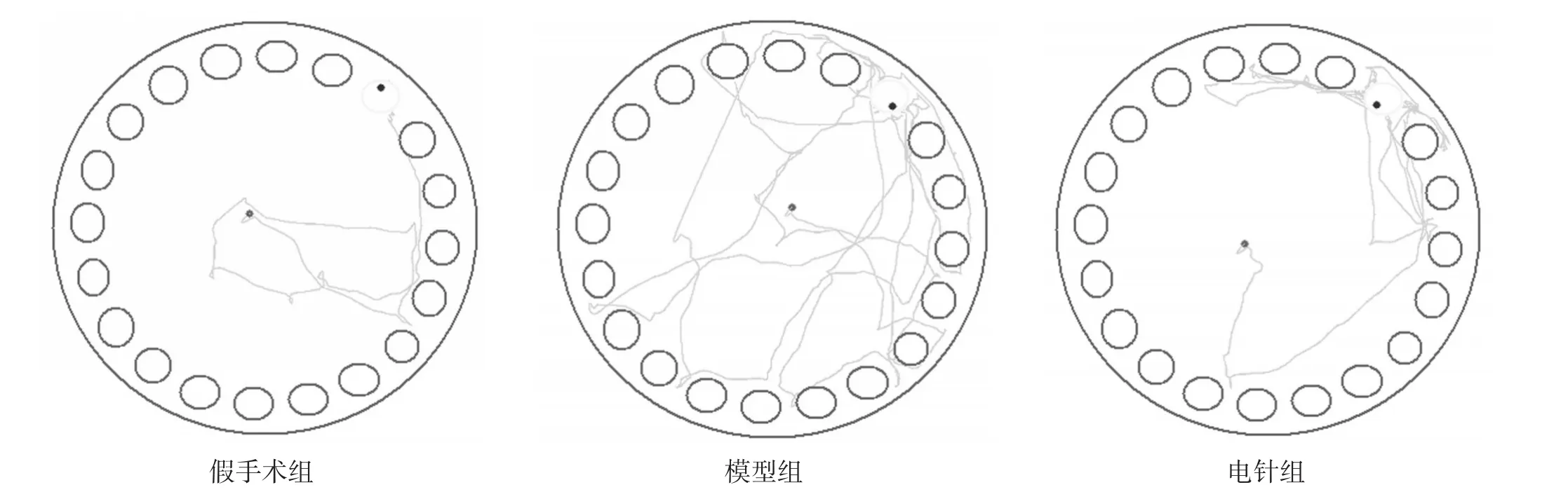
图1 干预7 d各组寻找目标洞口轨迹图

图2 干预7 d各组海马CA1区嘌呤受体P2X7表达(免疫荧光染色,100×)
3 讨论
脑卒中后认知功能障碍主要表现为记忆力减退、执行功能障碍、注意力障碍、判断力和抽象思维损害。督脉联络脑及脏腑,总督一身阳脉之气,与神志密切相关。督脉调畅,脑髓得以濡养,神机灵透,肢体活动自如;若督脉亏虚,髓海失充,则神明失用。百会为“三阳五会”,位居巅顶;头为诸阳之会,百脉之宗,百会穴则为各经脉气会聚之处。神庭是督脉、阳明经、足太阳交汇之穴,为神志所在,其功在神。针刺督脉穴位百会、神庭有醒脑开窍、安神定志、增强记忆之功。
针刺可以改善脑缺血再灌注大鼠的神经功能缺损症状。李梦瑶等[23]发现,电针能让局灶性脑缺血再灌注大鼠血中内源性内皮祖细胞含量增加,并能促进神经功能恢复。皮敏等[24]研究表明,电针督脉穴位能改善脑缺血再灌注大鼠的神经功能。梁超等[25]发现,不同变频组合电针头穴预处理能减轻脑缺血后大鼠神经功能损伤。本研究显示,电针百会、神庭穴能够有效缓解脑缺血再灌注大鼠的神经功能缺损症状。
针刺也能改善大鼠的认知功能障碍。蔡丽等[26]针刺百会、四神聪等穴,针刺组记忆功能显著提高。陈彬等[27]发现,针刺能改善大鼠学习记忆功能。
Barnes迷宫对动物应激性刺激较小,不需要食物剥夺和足底电击,既不需要像放射臂迷宫那样禁食,也不需要像水迷宫那样强应激,且能排除Morris水迷宫等测试中大鼠肢体运动功能障碍对实验的影响,有较高认可度。本研究显示,电针可以降低脑缺血再灌注大鼠逃避潜伏期,减少其进入错误洞口次数,改善大鼠学习记忆能力。
细胞外ATP激活P2X7受体促进IL-1β产生和释放,是一条公认的炎症相关通路。有研究表明[28],针刺对嘌呤受体有一定调控作用。电针治疗可下调脊髓嘌呤受体表达,减轻结肠免疫反应,减轻内脏痛觉敏感性[29-30]。Burnstock[28]发现,在中脑水管周围灰质区,电针对脊椎的镇痛效应与嘌呤受体活化密切相关;在脊髓背根神经元中,电针通过调控嘌呤受体,提高慢性神经性疼痛大鼠的痛阈。本研究表明,电针百会、神庭穴可有效抑制脑缺血再灌注大鼠P2X7受体表达。
本课题组前期研究表明,电针可能通过调控Toll样受体-4、核转录因子-κB信号通路,抑制缺血周围皮质区小胶质细胞的活化及炎性因子TNF-α、IL-1β、IL-6释放[5,31-32]。有研究显示[33-34],针刺百会、大椎7 d,也能有效抑制治疗脑缺血再灌注大鼠缺血皮质半暗带TNF-α表达,改善神经功能障碍。本研究发现,电针百会、神庭穴可有效抑制脑缺血再灌注大鼠炎性因子IL-1β、TNF-α表达。
综上所述,电针百会、神庭穴能够改善脑缺血再灌注大鼠的空间学习记忆能力,其机制可能与抑制嘌呤受体P2X7表达,降低炎性因子IL-1β、TNF-α水平,改善海马CA1区神经炎症反应有关。
[1]Mozaffarian D,Benjamin EJ,Go AS,et al.Executive Summary:Heart Disease and Stroke Statistics-2016 Update:a report from the American Heart Association[J].Circulation,2016,133(4):447-454.
[2]Murphy SL,Xu J,Kochanek KD,et al.Deaths:Final Data for 2013[J].Natl Vital Stat Rep,2016,64(2):1-119.
[3]Agnès J,Christine B,Olivier R,et al.Post-stroke cognitive im
pairment:high prevalence and determining factors in a cohort of mild stroke[J].JAlzheimers Dis,2014,40(4):1029-1038.
[4]Taylor RA,Sansing LH.Microglial responses after ischemic stroke and intracerebral hemorrhage[J].Clin Dev Immunol,2013,2013:746068.
[5]Feng X,Yang S,Liu J,et al.Electro-acupuncture ameliorates cognitive impairment through inhibition of NF-κB-mediated neuronal cell apoptosis in cerebral ischemia-reperfusion injured rats[J].Mol Med Rep,2013,7(5):1516-1522.
[6]宋长明,黄佳,林冰冰,等.电针百会、神庭穴对脑缺血再灌注大鼠学习记忆能力及海马CA1区突触超微结构的影响[J].中国康复理论与实践,2017,23(7):750-755.
[7]林志诚,杨珊莉,薛偕华,等.针刺百会穴改善脑卒中患者记忆力的中枢机制[J].中国康复理论与实践,2015,20(2):184-188.
[8]Jiang C,Yang S,Tao J,et al.Clinical Efficacy of acupuncture treatment in combination with RehaCom Cognitive Training for improving cognitive function in stroke:a 2×2 factorial design randomized controlled trial[J].J Am Med Dir Assoc,2016,17(12):1114-1122.
[9]Tort ABL,Komorowski RW,Manns JR,et al.Theta-gamma coupling increases during the learning of item-context associations [J].Proc Natl Acad Sci USA,2009,106(49):20942-20947.
[10]Nikonenko AG,Radenovic L,Andjus PR,et al.Structural features of ischemic damage in the hippocampus[J].Anat Rec,2009,292(12):1914-1921.
[11]Kerchner GA,Hess CP,Hammondrosenbluth KE,et al.Hippocampal CA1 apical neuropil atrophy in mild Alzheimer disease visualized with 7-T MRI(Podcast)[J].Neurology,2010,75(15):1381-1387.
[12]Kerchner GA,Deutsch GK,Zeineh M,et al.Hippocampal CA1 apical neuropil atrophy and memory performance in Alzheimer'sdisease[J].Neuroimage,2012,63(1):194-202.
[13]Pankratov YV,Lalo UV,Krishtal OA.Role for P2X receptors in long-term potentiation[J].J Neurosci,2002,22(19):8363-8369.
[14]Chin Y,Kishi M,Sekino M,et al.Involvement of glial P2Y1 receptors in cognitive deficit after focal cerebral stroke in a rodent model[J].JNeuroinflammation,2013,10(1):95.
[15]Illes P,Verkhratsky A.Purinergic neurone-glia signalling in cognitive-related pathologies[J].Neuropharmacology,2016,104:62-75.
[16]Amantea D,Micieli G,Tassorelli C,et al.Rational modulation of the innate immune system for neuroprotection in ischemic stroke[J].Front Neurosci,2015,9(12):2366-2378.
[17]Burnstock G.P2X ion channel receptors and inflammation[J].Purinergic Signal,2016,12(1):59-67.
[18]Deng Y,Guo XL,Yuan X,et al.P2X7 receptor antagonism attenuates the intermittent hypoxia-induced spatial deficits in a murine model of sleep apnea via inhibiting neuroinflammation and oxidative stress[J].Chin Med J(Engl),2015,128(16):2168-2175.
[19]Chu K,Yin B,Wang J,et al.Inhibition of P2X7 receptor ameliorates transient global cerebral ischemia/reperfusion injury via modulating inflammatory responses in the rat hippocampus[J].JNeuroinflammation,2012,9(1):150-159.
[20]Joana A,Alberto PS,Miroslav G,et al.P2X7 receptor blockade prevents ATP excitotoxicity in neurons and reduces brain damage after ischemia[J].Neurobiol Dis,2012,45(3):954-961.
[21]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[22]李忠仁.实验针灸学[M].北京:中国中医药出版社,2003.
[23]李梦瑶,李向荣,高琼珏,等.电针对局灶性脑缺血再灌注大鼠血中EPCs含量及其神经功能缺损程度的影响[J].中医药通报,2017,16(3):39-42.
[24]皮敏,陈鹏典,杨卓欣,等.电针督脉联合人脐血间充质干细胞移植对脑缺血大鼠神经功能缺损及细胞凋亡的影响[J].时珍国医国药,2014,25(2):492-495.
[25]梁超,姜涛,王静芝,等.不同变频组合电针预处理对急性脑缺血大鼠神经功能和脑皮质促红细胞生成素的影响[J].中国中医基础医学杂志,2017,23(5):686-688.
[26]蔡丽,刘毅,陆小青.针刺对卒中后抑郁大鼠空间学习记忆功能及海马CA3区脑源性神经营养因子的影响[J].上海针灸杂志,2016,35(4):462-465.
[27]陈彬,张志涛,骆健明,等.针刺治疗对缺血缺氧性脑病模型鼠学习与记忆能力的影响[J].中国医药,2014,9(8):1159-1163.
[28]Burnstock G.Purinergic signaling in acupuncture[J].Science,2014,346(6216):S23-S25.
[29]Weng ZJ,Wu LY,Zhou CL,et al.Effect of electro-acupuncture on P2X3 receptor regulation in the peripheral and central nervous systems of rats with visceral pain caused by irritable bowel syndrome[J].Purinergic Signal,2015,11(3):321-329.
[30]Guo X,Chen J,Yuan L,et al.Electro-acupuncture at He-Mu points reduces P2X4 receptor expression in visceral hypersensitivity[J].Neural Regen Res,2013,8(22):2069-2077.
[31]Liu W,Wang X,Zheng Y,et al.Electro-acupuncture inhibits inflammatory injury by targeting the miR-9-mediated NF-κB signaling pathway following ischemic stroke[J].Mol Med Rep,2016,13(2):1618-1626.
[32]Lan L,Tao J,Chen A,et al.Electro-acupunctureexerts anti-inflammatory effects in cerebral ischemia-reperfusion injured rats via suppression of the TLR4/NF-κB pathway[J].Int JMol Med,2013,31(1):75-80.
[33]Chen SH,Sun H,Xu H,et al.[Effects of acupuncture of"Baihui"(GV 20)and"Zusanli"(ST 36)on expression of cerebral IL-1beta and TNF-alpha proteins in cerebral ischemia reperfusion injury rats][J].[in Chinese].Zhen Ci Yan Jiu,2012,37(6):470-475.
[34]Cheng CY,Lin JG,Tang NY,et al.Electro-acupuncture-like stimulation at the Baihui(GV20)and Dazhui(GV14)acupoints protects rats against subacute-phase cerebral ischemia-reperfusion injuries by reducing S100B-mediated neurotoxicity[J].PLoSOne,2014,9(3):e91426.
