环磷酸腺苷效应元件结合蛋白/脑源性神经营养因子信号通路在调心方改善APP/PS1小鼠学习记忆中的作用①
2018-01-31王晓雯邓海燕王健徐颖
王晓雯,邓海燕,王健,徐颖
1.上海中医药大学,a.康复医学院;b.生理教研室,上海市201203
阿尔茨海默病(Alzheimer's disease,AD)是常发于老年人群的一种不可逆转的中枢神经退行性疾病。AD患病率随人口老龄化日益增加,目前,我国已有600~700万老年痴呆患者,其中60岁以上老年人口患病率为5%~10%,85岁以上老年人口患病率则高达20%~50%[1]。AD起病隐匿,早期出现近期记忆力的减退,随着病情的发展,患者的语言、计算、视空间和运动神经系统功能均有可能出现障碍,严重时可出现失语、妄想、错觉,严重影响老年人的社会能力与生活质量[2-3]。
盐酸多奈哌齐是治疗AD的常用药物,其临床疗效和安全性得到大量文献报道证实。盐酸多奈哌齐作为一种可逆性的乙酰胆碱酶抑制剂,能有效抑制乙酰胆碱水解,使得乙酰胆碱浓度增加,从而有效改善认知功能[4]。临床研究显示,调心方治疗AD有一定的疗效,尤其能改善认知功能障碍[5]。为进一步揭示其作用机理,本实验将观察各组小鼠海马环磷酸腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)/脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号通路的变化,探讨调心方改善APP/PS1双转基因AD小鼠学习记忆的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
SPF级雄性APP/PS1双转基因小鼠54只,初始体质量(25.22±1.71)g,3月龄;同月龄同品系同性别下的C57BL/6J小鼠18只,初始体质量(30.49±1.59)g。所有小鼠均购自南京大学模式动物研究所,许可证号SCXK(苏)2015-0001。实验前所有小鼠经适应性喂养1周,饲养于上海中医药大学实验动物中心,温度22~24℃,湿度60%。小鼠饲养及实验遵守本地实验动物管理委员会相关规定,均按照动物福利与伦理原则进行处理。
54只雄性APP/PS1双转基因小鼠按照随机数字表分为模型组、调心方组和多奈哌齐组,每组18只;同时以同月龄同性别同品系下18只C57BL/6J野生雄性小鼠为对照组。
1.1.2 实验试剂、药品与仪器
Trizol、随机引物、RNA酶抑制剂、First Strand cDNA synthesis Kit:美国INVITROGEN公司。RNA-free Water、QuantityNova SYBR Green PCR Kit:德国QIAGEN公司。TBE、6×loading buffer:上海威奥生物科技有限公司。RIPA、PMSF、BCA试剂盒、PBS缓冲液、SDS-PAGE凝胶配制试剂盒、5×loading buffer、SDS-PAGE电泳液、Western转膜液、彩色预染蛋白分子量标准(10~180 kD):上海碧云天生物技术公司。化学发光液:美国THERMO SCIENTIFIC公司。脱脂奶粉、BSA粉末、无水乙醇、NC膜:北京鼎国昌盛生物技术有限公司。BDNF、磷酸化CREB(p-CREB)(S133)、GAPDH多克隆抗体:英国ABCAM公司。CREB多克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L):美国CELL SIGNALING TECHNOLOGY公司。PCR引物由苏州金唯智生物科技有限公司合成。
Morris视频分析和跟踪系统:荷兰NETHERLANDS公司。组织匀浆器:北京鼎昊源公司。台式高速离心机、全波长酶标仪:美国THERMO公司。琼脂糖电泳、伯乐电泳设备:美国BIO-RAD公司。凝胶成像系统:上海天能科技有限公司。梯度PCR仪:美国LIFE公司。荧光定量PCR仪:瑞士ROCHE公司。
1.2 实验方法
1.2.1 给药
调心方采用配方颗粒,由党参2.25 g、桂枝0.42 g、石菖蒲0.83 g、远志0.38 g、龙骨0.5 g、甘草0.83 g、白芍0.5 g组成,江阴天江药业有限公司生产。使用前,用蒸馏水充分溶解、混匀。盐酸多奈哌齐片5 mg/片,批号H20030472,江苏豪森药业股份有限公司生产,使用前粉碎,蒸馏水溶解。
调心方组每天予调心方1.485 g/kg灌胃,多奈哌齐组予多奈哌齐0.083 mg/kg灌胃。对照组和模型组予等量生理盐水灌胃,给药体积10 ml/kg,每天1次,连续12周。在整个灌胃过程中共死亡9只小鼠,其中调心方组6只,多奈哌齐组3只。
1.2.2 Morris水迷宫测试
给药结束后第1天进行Morris水迷宫行为学测试。Morris水迷宫测试主要包括定位航行实验和空间探索实验。整个测试共持续6 d,其中定位航行实验持续5 d,空间探索实验在定位航行实验结束后开始,为期1 d[6]。
实验前1 d,将四组小鼠分别放入水中自由游泳,并且将小鼠放在手掌中,让它适应水迷宫的环境以及实验员的气息。
定位航行实验开始前,让小鼠在实验室里休息0.5 h,以减少小鼠的恐惧。平台低于水面1 cm,设在第2象限中间的位置。将小鼠面向池壁从第3象限1/2弧度处和第4象限1/2弧度处以半随机的方式放入水池中。每只小鼠60 s内找到平台,并在平台上保持5 s后记录终止,作为逃避潜伏期;未在60 s内找到平台的,记录时间为60 s,并且实验员需用小木棒引导小鼠找到平台,并让小鼠在平台上停留30 s。定位航行实验每天进行2个象限的训练程序。在一个象限完全结束后,休息10 min,再进行另一个象限的训练。
进行空间探索实验时,需撤去原平台,其余保持不变。选择第3象限为入水点,记录每只小鼠60 s内在各象限区域内停留的时间占总时间的百分比。
在Morris水迷宫行为学测试中,多奈哌齐组和模型组各有1只小鼠死亡。
各组随机选取10只小鼠进行Morris水迷宫行为学测试。
1.2.3 制备脑组织样本
Morris水迷宫行为学测试结束后第1天,各组随机取7只小鼠,使用20%水合氯醛8 ml/kg麻醉处死,断头取脑。在冰盒上迅速剥离海马,分别置于做好标记的EP管中,于-80℃液氮罐中储存。随后保存在冻层盒中,于-80℃冰箱中存储备用。
1.2.4 实时荧光定量聚合酶链反应(real-time quantitativepolymerasechain reaction,RT-qPCR)检测
从-80℃冰箱中各组随机取4只小鼠的海马组织,采用磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)作为内参基因,利用荧光定量PCR仪对目的基因BDNF和CREB进行定量检测。采用Trizol法提取总RNA,使用琼脂糖凝胶电泳检测总RNA的质量,将电泳凝胶块放在凝胶成像仪中拍照观察所提总RNA样品的完整性,并通过酶标仪检测总RNA 的浓度和纯度,确保 1.8<OD260/OD280<2.0。RNA纯度测定后,利用cDNA合成试剂盒将RNA 2 μg逆转录为cDNA。PCR扩增条件:95℃预变性2 min,执行一个循环;95℃5 s,60℃退火10 s,执行45个循环。循环结束后60~95℃缓慢升温,生成各基因的溶解曲线。通过BIO-RAD公司自带的PCR系统软件,观察扩增曲线,记录Ct值,采用2-△△Ct法进行相对定量。引物由NCBI Primer-blast设计,序列如下。
BDNF:上游 5′-GGT ATC CAA AGG CCA ACT GA-3′;下游5′-CTTATGAAT CGC CAG CCAAT-3′。
CREB:上游 5′-CAG ACA ACC AGC AGA GTG GA-3′,下游5'-GGGCTAATGTGGCAATCTGT-3′。
GADPH:上游5′-AGG TCG GTG TGA ACG GAT TTG-3′,下游 5′-TGTAGA CCA TGTAGT TGA GGT CA-3′。
1.2.5 Western blotting
从-80℃冰箱中各组取剩下3只小鼠的海马组织,按蛋白提取试剂盒上操作要求提取蛋白,使用BCA法测定各组蛋白溶液的浓度,使用RIPA将各组蛋白定容至等体积,浓度为1μg/μl,加适量5×上样缓冲液,混匀,煮沸10 min备用。10%~12%分离胶电泳分离目标蛋白并湿转到NC膜上。非磷酸化的目的蛋白选用5%脱脂奶粉,磷酸化的目的蛋白选用5%BSA溶液摇床室温封闭1 h,加入一抗:BDNF 1∶5000、p-CREB 1∶ 5000、 CREB 1∶ 3000、 GAPDH 1∶10000。摇床上4℃孵育过夜,加入辣根过氧化物酶标记山羊抗兔IgG(1∶3000),摇床室温孵育1 h,化学发光法曝光,Alpha View SA图像处理软件分析条带灰度。BDNF蛋白灰度与内参GAPDH蛋白灰度的比值作为BDNF蛋白的相对表达量,p-CREB蛋白灰度与CREB蛋白灰度的比值作为p-CREB蛋白的相对表达量。
1.3 统计学分析
采用SPSS 21.0统计软件进行分析。实验所得数据符合正态分布,均以(xˉ±s)表示,各组小鼠逃避潜伏期数据比较采用多组重复测量的方差分析[7]。单组小鼠连续5 d的逃避潜伏期数据比较采用单组重复测量的方差分析,在各个时间点内各组小鼠逃避潜伏期的数据比较采用完全随机设计多样本比较的秩和检验。RT-qPCR和Western boltting四组数据比较均采用单因素方差分析,用LSD检验各组间的两两比较。显著性水平ɑ=0.05。
2 结果
2.1 Morris水迷宫测试
在定位航行实验中,各组整体上分组效应(P<0.001)和时间效应(P<0.001)显著,时间和分组因素具有交互作用(P<0.05)。模型组连续5 d内逃避潜伏期无显著性变化(P>0.05),调心方组连续5 d内逃避潜伏期逐渐减少(P<0.05)。与对照组相比,模型组逃避潜伏期显著延长(P<0.001)。与模型组相比,调心方组逃避潜伏期显著减少(P<0.001)。见表1。
在空间探索实验中,模型组在原平台所在象限停留时间百分比较对照组显著减少(P<0.001)。与模型组比较,调心方组在原平台所在象限停留时间百分比增加(P<0.05)。见表2。
各组小鼠在目标象限的右边象限和相对象限停留时间百分比均无显著性差异(P>0.05)。各组小鼠在目标象限的左边象限有显著性差异(P<0.05);与正常组比较,模型组在左边象限停留时间百分比明显增加(P<0.01),调心方组和多奈哌齐组在左边象限停留时间百分比均无显著性差异(P>0.05)。见图1。

图1 各组小鼠在各象限停留时间百分比
2.2 CREB mRNA、BDNFmRNA表达
与对照组相比,模型组海马CREB mRNA、BDNF mRNA表达降低(P<0.05)。与模型组相比,调心方组海马CREB mRNA、BDNFmRNA表达均增加(P<0.05);多奈哌齐组海马CREB mRNA表达有增加的趋势,但无显著性差异(P>0.05),BDNF mRNA表达增加(P<0.05)。见表3。
2.3 p-CREB、BDNF蛋白表达
与对照组相比,模型组小鼠海马p-CREB、BDNF蛋白表达量均明显减少(P<0.01)。与模型组相比,调心方组海马p-CREB、BDNF蛋白表达量均明显增加(P<0.01);多奈哌齐组海马p-CREB、BDNF蛋白表达量均增加(P<0.05)。见表4、图2。

表1 各时点各组小鼠逃避潜伏期比较(s)

表2 各组小鼠在原平台所在象限停留的时间百分比(%)
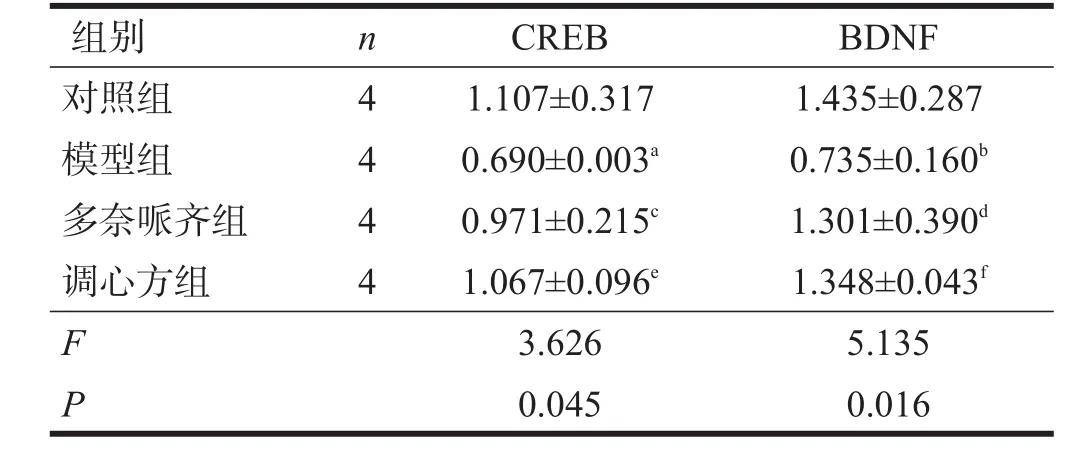
表3 各组海马CREB mRNA、BDNFmRNA表达比较(2-△△Ct)

表4 各组海马p-CREB、BDNF蛋白表达比较(相对表达量)

图2 各组海马p-CREB、BDNF蛋白表达(Western blotting)
3 讨论
根据AD发病特点和主要临床表现认知功能障碍,可以认为AD和中医“神”有密切关系。临床实践中发现,心气虚衰、气不生神,致神明失用为AD发生、发展主要病机之一;痰滞瘀阻,蒙蔽神窍,神机失灵是促进AD的重要因素。调心方由党参、石菖蒲、远志等组成。党参功擅补心气,安神增智为君;菖蒲安神益智,开窍为佐;远志通窍豁痰,增智为使。诸药配伍具有益心气化痰开窍之功效[5]。
Morris水迷宫是评估动物空间学习记忆的一种公认的方法[8]。它强迫实验动物游泳,并学习寻找隐藏在水面下方安全平台,目的是测试动物对空间位置感和方向感的学习记忆[9],包括定位航行与空间探索实验两个阶段。定位航行实验反映动物的空间学习能力,并建立空间参考记忆[10]。空间探索实验反映动物的空间记忆保持能力。逃避潜伏期和目标象限时间占总搜索时间百分比是最为常用且相对稳定的参数。
本研究显示,模型组训练后没有明显的学习趋势,没有对原平台位置形成明显的空间记忆;而随着训练时间的增加,调心方组有明显的学习趋势,并形成对原平台位置的记忆保持。
CREB是存在于真核生物细胞核内的组成性转录因子[11],是一种重要的核蛋白[12],与神经元的生长、损伤、再生,突触可塑性,学习记忆密切相关[13-14]。CREB发挥多种与学习记忆相关的基因转录调控作用均有赖于ser133位点的磷酸化[15]。CREB能参与细胞内多条信号通路传导途经,通过调节启动子中的环磷酸腺苷效应元件调节下游靶基因的转录[16]。p-CREB能促进CRE序列的转录,并调节位于其下游的大量与学习记忆相关的基因的转录,如钙/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)[17]、BDNF等[18],形成新的突触联系,进而形成海马区长时程记忆[19]。当CREB磷酸化水平受抑制时,无法启动和调控下游因子的转录,最终导致学习和记忆障碍[20]。
BDNF是在脑内合成,并分布于脑内多个部位的碱性蛋白质,以海马的水平最高[21]。它能够支持多种神经元生存、发育、分化及修复,促进突触可塑性,对形成长时程记忆有帮助[22]。BDNF是CREB的经典下游靶基因,其基因启动子区域含有CRE序列,受激活的CREB调控与转录。CREB磷酸化促进BDNF转录合成[23-24]。合成后的BDNF又可与其酪氨酸激酶B受体结合,激活PI3K/Akt、Ca2+/CaMK等通路,从而促进CREB激活[25]。BDNF mRNA表达上调,能形成上行传导的神经信号,使中枢神经产生动作电位,进一步影响CREB mRNA表达上调[26]。
综上所述,调心方可能通过调节CREB/BDNF的信号转导通路,上调CREB蛋白磷酸化和基因表达水平,促进BDNF表达,从而起到延缓和预防AD发展的作用。
[1]Trittschuh EH,Crane PK,Larson EB,et al.Effects of varying diagnostic criteria on prevalence of mild cognitive impairment in a community based sample[J].JAlzheimers Dis,2011,25(1):163-173.
[2]Mattsson N,Schott JM,Hardy J,et al.Selective vulnerability in neurodegeneration:insights from clinical variants of Alzheimer's disease[J].JNeurol Neurosurg Psychiatry,2016,87(9):1000-1004.
[3]Bauckneht M,Picco A,Nobili F,et al.Amyloid positron emission tomography and cognitive reserve[J].World J Radiol,2015,7(12):475-483.
[4]岳姣姣.盐酸多奈哌齐在阿尔茨海默病治疗中的应用研究[J].中国医药指南,2017,15(15):49-50.
[5]王健,林水森,周如倩,等.调心方治疗Alzheimer病的临床研究[J].北京中医药大学学报,2002,25(3):51-53.
[6]胡志红,闫君宝,杨东伟.游泳训练次数对大鼠Morris水迷宫成绩的影响[J].山西医科大学学报,2016,47(1):18-21.
[7]闫盼盼,闫国立,詹向红,等.Morris水迷宫实验设计的统计学方法探析[J].中华中医药学刊,2013,31(2):264-266.
[8]Singh S,Kaur H,Sandhir R.Fractal dimensions:A new paradigm to assess spatial memory and learning using Morris water maze[J].Behav Brain Res,2016,15(299):141-146.
[9]武海霞,吴志刚,刘红滨,等.Morris水迷宫实验在空间学习记忆研究中的应用[J].神经药理学报,2014,4(5):30-35.
[10]Fischer W,Bjorklund A,Chen K,et al.NGF improves spatial memory in aged rodents as a function of age[J].J Neurosci,1991,11(7):1889-1906.
[11]王怀颖,石少慧.环腺苷酸应答元件结合蛋白与学习记忆[J].生命的化学,2008,28(4):453-455.
[12]何萍,陈家欢,黄晓亮,等.慢性吗啡处理对大鼠交感神经节pCREB和CREB mRNA表达的影响[J].中国药理学通报,2013,29(2):238-241.
[13]Takemori H,Kajimura J,Okamoto M.TORC-SIK cascade regulates CREB activity through the basic leucine zipper domain[J].FEBSJ,2007(13):3202-3209.
[14]Li YF,Cheng YF,Huang Y,et al.Phosphodiesterase-4D knock-out and RNA interference-mediated knock-down enhance memory and increase hippocampal neurogenesis via increased cAMPsignaling[J].JNeurosci,2011,31(1):172-183.
[15]黄效东,杨新华,卢永辉.白藜芦醇通过抑制CREB磷酸化减轻癫痫发作并改善认知功能[J].实用医学杂志,2017,33(1):72-75.
[16]余汇,陈佳佳,曾冰倩,等.cAMP/CREB/BDNF信号通路在沃替西汀抗小鼠抑郁样行为中的作用[J].南方医科大学学报,2017,37(1):107-112.
[17]Zhu DY,Lau L,Liu SH,et al.Activation of cAMP-response-element-binding protein(CREB)after focal cerebral ischemia stimulates neurogenesis in the adult dentate gyrus[J].Proc Natl Acad Sci USA,2004,101(25):9453-9457.
[18]Deisseroth K,Bito H,Tsien RW.Signaling from synapse to nucleus:postsynaptic CREB phosphorylation during multiple forms of hippocampal synaptic plasticity[J].Neuron,1996,16(1):89-101.
[19]Hinoi E,Balcar VJ,Kuramoto N,et al.Nuclear transcription factors in the hippocampus[J].Prog Neurobiol,2002,68(2):145-165.
[20]Niu L,Zhou J,Huang Y,et al.db-Cyclic adenosine monophosphate promotes axon regeneration and motor function recovery in cerebral ischemia-reperfusion rats[J].Neurol India,2010,58(2):195-200.
[21]Aid T,Kazantseva A,Piirsoo M,et al.Mouse and rat BDNF gene structure and expression revisited[J].J Neurosci Res,2007,85(3):525-535.
[22]Leyhe T,Eschweiler GW,Stransky E,et al.Increase of BDNF serum concentration in lithium treated patients with early Alzheimer's disease[J].JAlzheimers Dis,2009,16(3):649-656.
[23]Mlyniec K,Budziszewska B,Holst BA,et al.GPR39(Zinc receptor)knockout mice exhibit depression-like behavior and CREB/BDNF Down Regulation in the hippocampus[J].Int J Neuropsychopharmacol,2014,18(3)pii:pyu002.
[24]Ge L,Liu L,Liu S,et al.Resveratrol abrogates lipopolysaccharide-induced depressive-like behavior,neuroinflammatory response,and CREB/BDNF signaling in mice[J].Eur J Pharmacol,2015,5(768):49-57.
[25]Ji Y,Pang PT,Feng L,et al.Cyclic AMPcontrols BDNF-induced TrkB phosphorylation and dendritic spine formation in mature hippocampal neurons[J].Nat Neurosci,2005,8(2):164-172.
[26]彭生,杨建平,张晓庆,等.磷酸二酯酶-4抑制剂Ro20-1724对氯胺酮麻醉后学习记忆及大鼠海马cAMP-PKA-CREBBDNF信号通路的影响[J].中华行为医学与脑科学杂志,2014,23(6):528-530.
