PD-1基因多态性与EOC易感性及预后的关系
2018-01-31,,,
, ,,
(山东省日照市中医医院妇科,山东 日照 276800)
卵巢癌具有易扩散浸润、早期无临床症状等特点,因此需要早诊断、早治疗。有研究发现卵巢癌中有绝大多数患者病理类型为卵巢上皮癌(epithelial ovarian cancer,EOC)[1]。目卵巢癌具有免疫原性已被越来越多的实验证明。近年发现与免疫逃逸有关的热点基因程序性细胞凋亡蛋白1(programmed apoptosis protein 1,PD-1)在肿瘤免疫逃逸中起到了重要作用。PD-1是一种分子量为50左右的Ⅰ型跨膜蛋白,可以与其配体程序性死亡受体-配体1结合后,显著抑制机体内T淋巴细胞的活性,进一步抑制身体内的免疫应答,从而协助肿瘤细胞,尤其是恶性肿瘤细胞出现“免疫逃逸”。PD-1基因多态性可造成不同个体间PD-1基因表达差异,进而影响蛋白表达,导致疾病的发生和发展。目前国内张会兰[2]对PD-1基因多态性与EOC的关系进行了相关报道,但是不同地区、不同环境下PD-1基因多态性与EOC关系有待进一步研究。本研究旨在探讨PD-1.1和PD-1.5单核苷酸多态(SNPs)与EOC患者发病风险及3年预后的关系。
1资料与方法
1.1一般临床资料
选取2009年4月至2012年5月就诊于山东省日照市中医医院的116例卵巢上皮癌患者,术中行快速冰冻切片,最终术后病理确诊为EOC的女性为本次研究卵巢癌组(Case组)。患者的年龄为23~73岁,平均年龄为(54.36±6.83)岁。其中确诊时年龄<50岁者42例(36.2%),≥50岁者74例(63.8%)。根据国际妇产科联盟(FIGO)的相关标准,对EOC患者行临床分期,其中Ⅰ~Ⅱ期患者有33例(28.4%),Ⅲ~Ⅳ期患者83例(71.6%);分化程度:高分化卵巢癌8例(6.9%),中分化79例(68.1%),低分化29例(25.0%)。116例患者中无失访病例,所有患者均随访至截止时间或者死亡。疾病复发指标为无疾病进展生存时间(progressives free survival,PFS),即手术切除病灶后复查时出现卵巢癌肿瘤标记物(CA125)升高、影像学检查异常、腹水等复发指征;评价生存预后的指标为总生存时间(over-all survival,OS),时间跨度为从手术切除病灶后至死亡或者随访截止时间。
另收集同期来本院体检正常的110例女性为健康对照组(Control组),其年龄在27~81岁,平均年龄(53.91±7.16)岁,其中年龄<50岁人员有38例(34.5%),≥50岁人员72例(65.5%)。Control组需排除卵巢出现病变患者,包含有健康体检者及输卵管积液、子宫脱垂等患者。
Case组和Control组的所有对象均在完全自愿的基础上参与本研究,并签订知情同意书。两组的平均年龄比较差异无统计学意义(P>0.05)。
1.2获取DNA样本
研究人员用含有EDTA+枸橼酸钠(0.85mL)的采血管在无菌操作下采取两组受试对象的外周血5mL,轻轻摇匀,并且置于-4℃冰箱保存备用,用基因组DNA快速提纯试剂盒(美国Promega生物试剂公司)提取DNA,保存于-40℃冰箱中备用。
1.3 PD-1基因SNP分型测序
实验中使用的引物由上海英骏生物科技有限公司设计提供,PD-1.1上游引物:GCCATCCACAAGGTGGAAGCT,下游引物:CTCAACCCCACTCCCATTCTG。PD-1.5上游引物:CACCCTGCCTGCTTCTCCTG,下游引物:GAGCAGA ̄CGGAGTATGCCACC。
采用RT-PCR法对所有受试对象行PD-1基因多态位点的基因型检测。PCR产物扩增反应所采用的实验条件为:95℃预变性1min,紧接94℃变性30s,而后64℃退火15s,进而72℃延伸25s,共计行35个循环后,最终在72℃下延伸2.5min。将所得到的PCR产物2μL及1μL引物序列,与10μL上样buffer(已混入Mark)混合,置于总体系为25μL,在含有2%琼脂糖凝胶上电泳,经95℃变性3min,并立即在冰水浴,获得终产物。根据ABI3100型测序分析仪对全部基因型进行测序。检测每个基因位点的准确性时,需要随机选取10%的PCR产物进行测序判断。具体电泳凝胶图见图1和图2。

注:通道1、4为AA基因;通道2为GG基因;通道3为AG基因。
图1 PD-1.1基因位点电泳图
Fig.1 Electrophorogram of different PD-1.1 genotypes

注:通道1、4为CC基因;通道2、3、5为CT基因;通道6为TT基因。
图2 PD-1.5基因位点电泳图
Fig.2 Electrophorogram of different PD-1.5 genotypes
1.4统计学方法
采用SPSS 17.0软件分析实验数据。采用Hardy-Weinberg平衡检验对两种PD-1基因分型及等位基因频率分布进行检验,采用行×列表的χ2检验卵巢上皮癌患者与健康者的等位基因和基因型频率分布,采用非条件Logistic回归分析PD-1.1、PD-1.5基因多态性与卵巢上皮癌发病的关系。采用Kaplan-Meier法分析PD-1基因中不同基因分型患者3年的生存情况,并采用Log-rank检验基因分型及等位基因之间的差异,采用Cox风险比例模型分析患者预后生存的相关基因分型及等位基因。以P<0.05为差异有统计学意义。
2结果
2.1两组的一般临床资料
研究结果显示,Control组在平均年龄、初潮年龄、孕次及产次与Case组比较差异均无统计学意义(均P>0.05),见表1。

表1 两组的一般临床资料比较结果[χ±S,n(%)]
2.2 PD-1.1和PD-1.5在不同组别中的分布
Case组PD-1.1基因型分布及等位基因频率与Control组比较差异均有统计学意义(均P<0.05);Case组PD-1.5基因型分布与Control组比较差异无统计学意义(P>0.05),而等位基因频率之间两组差异存在统计学意义(P<0.05),见表2。
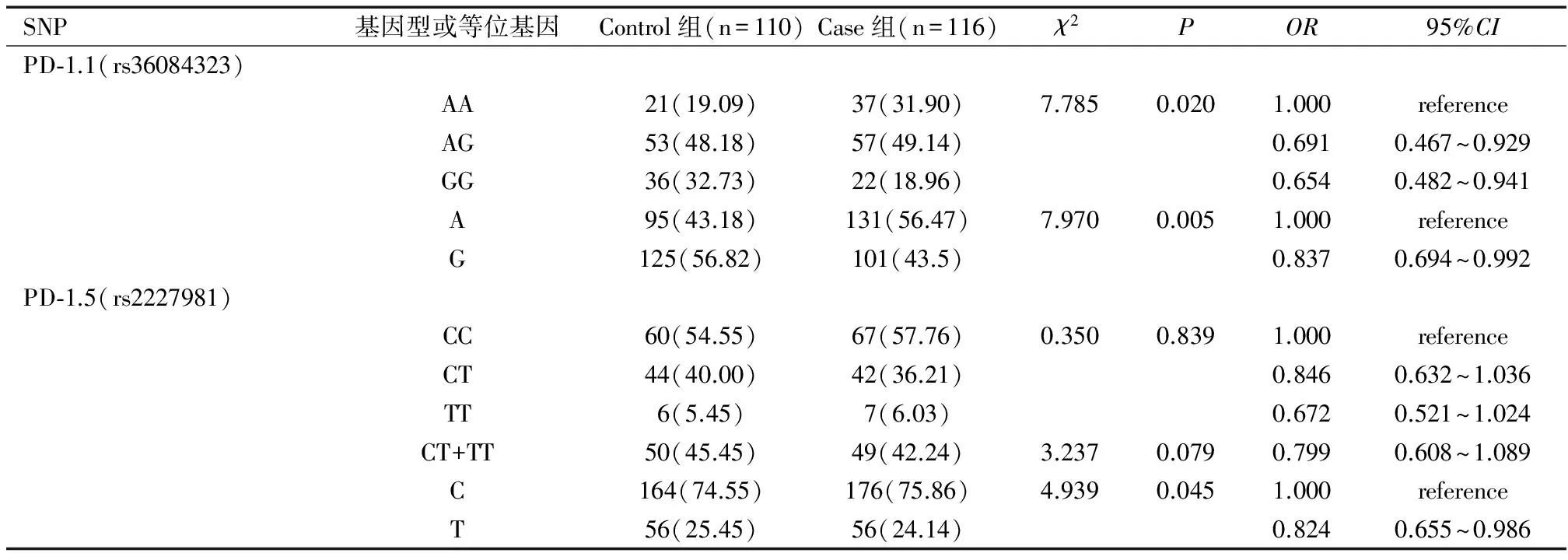
表2 PD-1.1和PD-1.5基因型及等位基因在不同组别中的分布比较结果[n(%)]
注:Reference表示参考。
2.3卵巢上皮癌患者临床相关因素与基因型的关系
PD-1.1基因分型与EOC患者临床分期和肿瘤分化程度有关系(均P<0.05);PD-1.5基因分型与EOC患者年龄、临床分期、分化程度和病理类型均无关联(均P>0.05),见表3。
表3 EOC患者临床相关因素与基因型的关系n(%)
Table 3 Correlation of clinical factors of EOC patients and genotypesn(%)
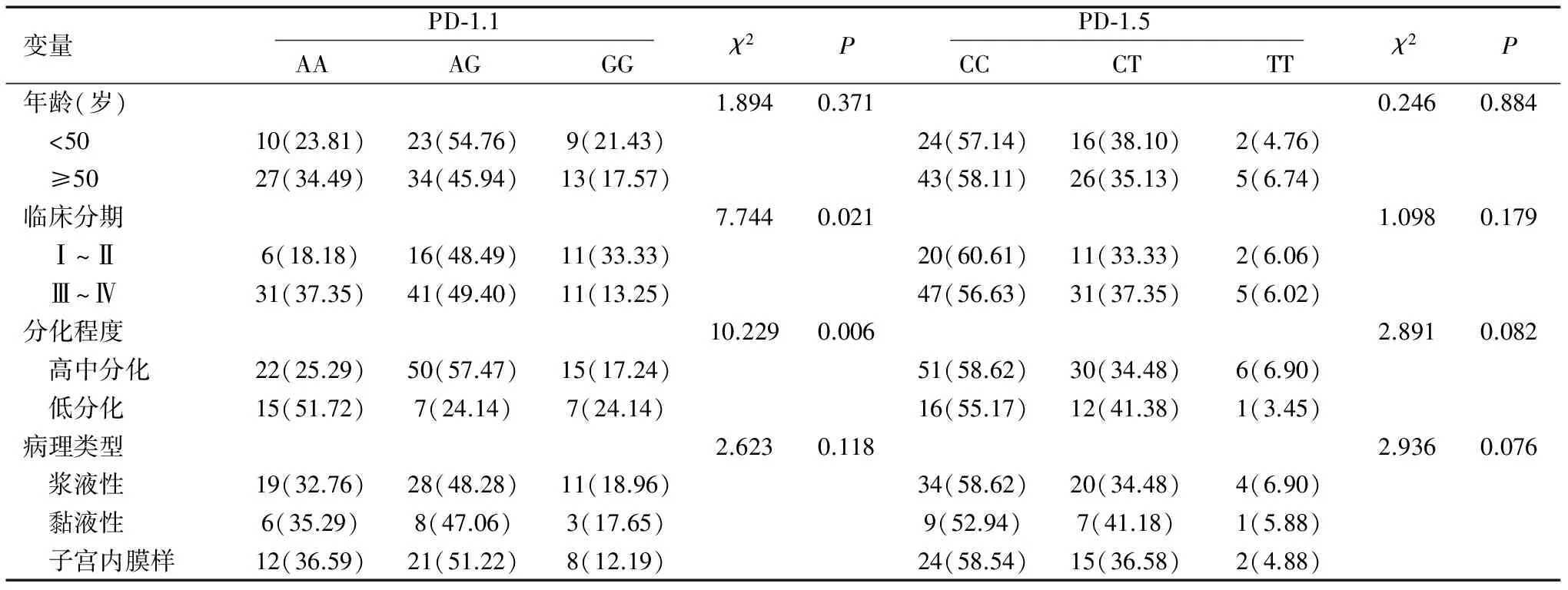
表3 EOC患者临床相关因素与基因型的关系n(%)
变量 PD⁃1.1 AAAGGGχ2P PD⁃1.5 CCCTTTχ2P年龄(岁)1.8940.3710.2460.884 <5010(23.81)23(54.76)9(21.43)24(57.14)16(38.10)2(4.76) ≥5027(34.49)34(45.94)13(17.57)43(58.11)26(35.13)5(6.74)临床分期7.7440.0211.0980.179 Ⅰ~Ⅱ6(18.18)16(48.49)11(33.33)20(60.61)11(33.33)2(6.06) Ⅲ~Ⅳ31(37.35)41(49.40)11(13.25)47(56.63)31(37.35)5(6.02)分化程度10.2290.0062.8910.082 高中分化22(25.29)50(57.47)15(17.24)51(58.62)30(34.48)6(6.90) 低分化15(51.72)7(24.14)7(24.14)16(55.17)12(41.38)1(3.45)病理类型2.6230.1182.9360.076 浆液性19(32.76)28(48.28)11(18.96)34(58.62)20(34.48)4(6.90) 黏液性6(35.29)8(47.06)3(17.65)9(52.94)7(41.18)1(5.88) 子宫内膜样12(36.59)21(51.22)8(12.19)24(58.54)15(36.58)2(4.88)
2.4基因多态性与术后3年和5年复发率的关系
PD-1.1基因AA型、AG型及GG型3年和5年复发率分别为70.27%、68.42%、36.36%和86.49%、80.70%、63.64%,三种基因型3年和5年的复发率差异均有统计学意义(均P<0.05);PD-1.5基因CC型、CT+TT型3年和5年的复发率分别为62.69%、63.27%和80.60%、77.55%,各基因分型在3年和5年的复发率差异均无统计学意义(均P>0.05),见表4。
表4 基因多态性与术后3年和5年复发率的关系 n(%)
Table 4 Relationship between gene polymorphism and 3-year and 5-year recurrence raten(%)
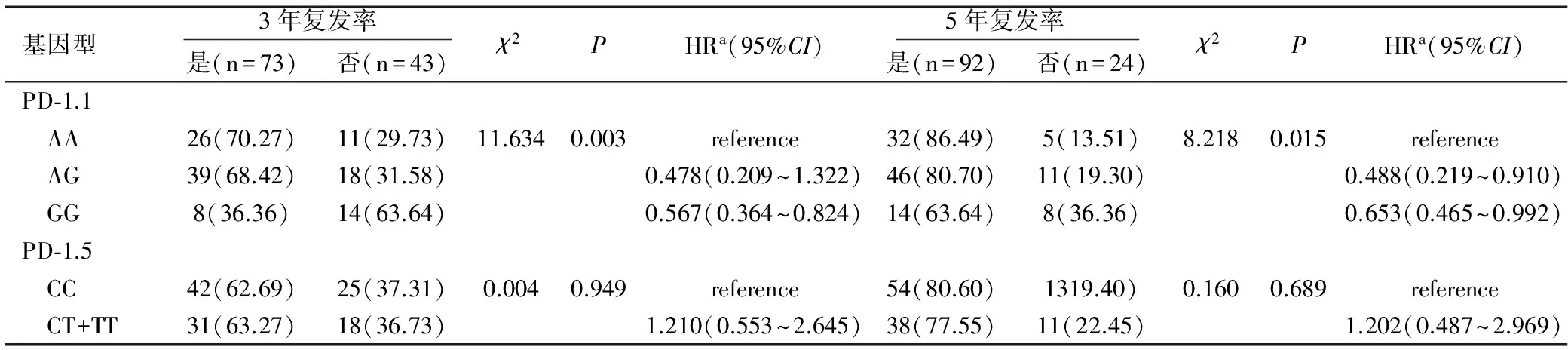
表4 基因多态性与术后3年和5年复发率的关系 n(%)
基因型 3年复发率 是(n=73)否(n=43)χ2PHRa(95%CI) 5年复发率 是(n=92)否(n=24)χ2PHRa(95%CI)PD⁃1.1 AA26(70.27)11(29.73)11.6340.003reference32(86.49)5(13.51)8.2180.015reference AG39(68.42)18(31.58)0.478(0.209~1.322)46(80.70)11(19.30)0.488(0.219~0.910) GG8(36.36)14(63.64)0.567(0.364~0.824)14(63.64)8(36.36)0.653(0.465~0.992)PD⁃1.5 CC42(62.69)25(37.31)0.0040.949reference54(80.60)1319.40)0.1600.689reference CT+TT31(63.27)18(36.73)1.210(0.553~2.645)38(77.55)11(22.45)1.202(0.487~2.969)
注:Reference表示参考,HRa表示危害比。
2.5基因多态性与术后3年和5年生存率的关系
PD-1.1基因AA型、AG型及GG型5年总生存率分别为18.92%、43.86%和54.55%,经Kaplan-Meier分析,其差异有统计学意义(P<0.05);PD-1.5基因CC、CT+TT基因型患者5年总生存率分别为38.81%和36.73%,经Kaplan-Meier分析,其差异无统计学意义(P>0.05),见表5、图3。
纠正Case组中患者的年龄、临床分期及初次手术后残存灶的大小,经Cox回归多因素分析结果显示,PD-1.1基因分型为卵巢上皮癌患者的5年复发率和死亡率的危险因素(HR=2.709,95%CI:1.127~4.892,P=0.004)。
表5基因多态性与术后3年和5年生存率的关系n(%)
Table 5 Relationship between gene polymorphism and postoperative 3-year and 5-year survival raten(%)

基因型 3年生存率 生存(n=59)死亡(n=57)χ2PHRa(95%CI) 5年生存率 生存(n=44)死亡(n=72)χ2PHRa(95%CI)PD⁃1.1AA17(45.95)20(54.05)4.2230.089reference7(18.92)30(81.08)9.1110.011reference AG27(47.37)30(52.63)0.531(0.124~0.822)25(43.86)32(56.14)0.628(0.234~0.983) GG15(63.64)7(36.36)0.467(0.264~0.724)12(54.55)10(45.45)0.573(0.365~0.916)PD⁃1.5V CC33(49.25)34(50.75)0.1640.685reference26(38.81)41(61.19)0.0520.820reference CT+TT26(53.06)23(46.94)1.165(0.557~2.435)18(36.73)31(63.27)1.092(0.510~2.337)
注:Reference表示参考,HRa表示危害比。
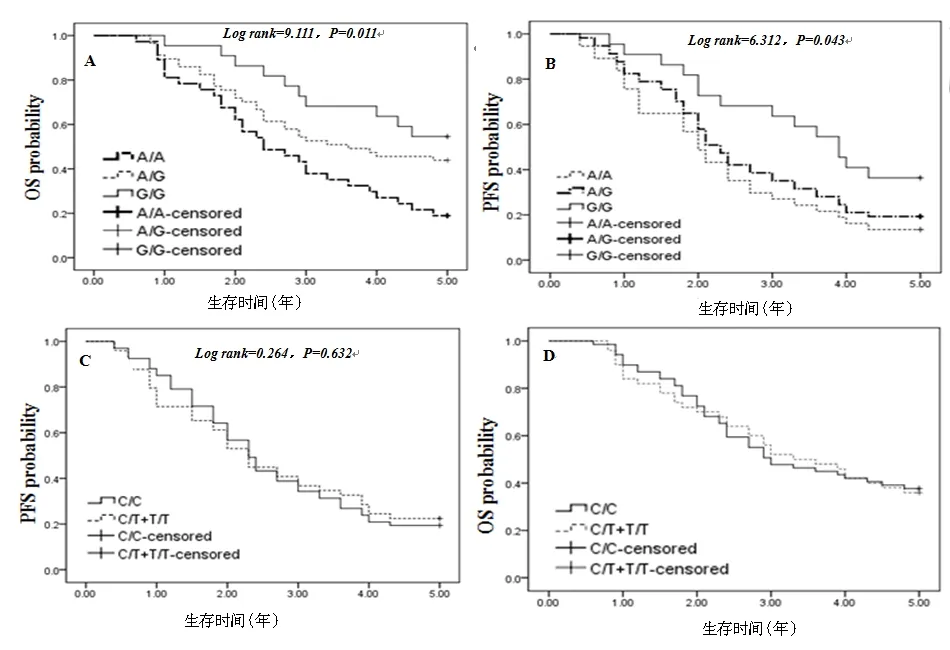
注:图A、B为PD-1.1基因,A为总生存率,B为疾病无进展生存率;图C、D为PD-1.5基因,C为总生存率,D为疾病无进展生存率。
图3 Kaplan-Meier法分析PD-1.1、PD-1.5不同基因位点5年内总生存、疾病无进展生存率
Fig.3 Analysis of 5-year overall survival rate and progression free survival rate of different gene loci in PD-1.1 and PD-1.5 by Kaplan-Meier method
3讨论
3.1 PD-1.1基因多态性与卵巢上皮癌发病的关系
PD-1作为CD28免疫球蛋白超家族中的一员,是近年来新发现的与恶性肿瘤细胞免疫逃逸有关的关键基因,其位于人染色体2q37.3上,能够编码某些跨膜糖蛋白,已经证实其在肿瘤免疫逃逸中起重要作用。以往国内外关于PD-1基因多态性与疾病关系的研究中发现PD-1.1多态性与不同疾病的发病风险关系不尽相同。有研究结果显示PD-1基因多态性与乳腺癌发病风险有关,并且GG型具有降低乳腺癌的发病风险,C等位基因具有增加乳腺癌发病风险[3]。一项国外研究显示,PD-1.1基因分型中的AA基因型人员发生类风湿性关节炎的可能性明显小于AG、GG型[4],同时有研究认为PD-1.1多态性与乙型肝炎的发病风险有关[5]。目前对于PD-1.1基因多态性与卵巢癌,尤其是卵巢上皮癌的发病风险的关系研究报道较少。本研究与张会兰[2]的研究报道不尽一致,其研究显示PD-1.1、PD-1.5基因多态性与卵巢上皮癌的发病,尤其术后复发及生存率之间无明显相关性,但本研究中却发现,卵巢上皮癌患者中等位基因A和G频率分布与对照组人员有显著性差异。本研究结果显示G等位基因携带者患卵巢上皮癌的风险是A基因携带者的0.837倍。进一步对所有患者进行随访发现,携带AA基因型的卵巢上皮癌患者术后复发率显著高于AG或GG基因型,而生存率低于AG、GG型。因此认为导致本研究与张会兰研究结果不相一致的原因可能有:①入选的卵巢上皮癌患者存在地域、环境差异,环境及地域等对基因型的分布存在一定的差异;②张会兰的研究在随访时出现较多的失访,因此认为在一定程度上可能会导致误差。此外需要指出的是,本研究与其研究均证实,卵巢上皮癌患者AA型比例较AG、GG型有显著性差异,而本研究在随访过程中未出现失访患者。
3.2 PD-1.5基因多态性与卵巢上皮癌的关系
关于PD-1.5基因位点与疾病相关的研究,目前发现CT+TT基因型相比于CC基因型能使非小细胞肺癌患者发病风险增高,C等位基因与非小细胞肺癌发病风险有关[6-7]。有研究发现,胃腺癌及胃溃疡患者体内CT基因型频率显著高于正常人[8-10]。
总之,对PD-1基因多态性与疾病的关系研究较多,包括乳腺癌、黑色素瘤等[11-14]。需要指出的是,在本研究中未发现Case组和Control组的CC、CT+TT基因型及等位基因频率分布差异存在统计学意义。因此认为PD-1.5多态位点的C和T基因可能与卵巢上皮癌发病无关。
3.3小结
目前关于PD-1.1和PD-1.5多态性与恶性肿瘤临床预后关系的研究较少。本研究结果表明卵巢上皮癌患者3年、5年的术后复发率及生存率与PD-1.1基因型频率分布有关,而与PD-1.5无关。综合以上分析,本研究结果可用于预测女性卵巢上皮癌的发病风险,辅助临床对卵巢上皮癌的早期诊断,同时对患者的预后治疗提供参考依据。通过早期诊断女性PD-1.1基因型分布,可为预防卵巢上皮癌提供依据。
[1]Mojtahedi Z, Mohmedi M, Rahimifar S,etal.Programmed death-1 gene polymorphism (PD-1.5 C/T) is associated with colon cancer[J].Gene,2012,508(2):229-232.
[2]张会兰.PD-1基因多态性与上皮性卵巢癌患者发病风险及临床预后关系的研究[D].石家庄:河北医科大学,2016:27-30.
[3]Sasaki H, Tatemaysu T, Okuda K,etal.PD-1 gene promoter polymorphisms correlate with a poor prognosis in non-small cell lung cancer[J].Mol Clin Oncol,2014,2(6):1035-1042.
[4]Liu C, Jiang J,Gao L,etal.A promoter region polymorphism in PDCD-1 gene is associated with risk of rheumatoid arthritis in the Han Chinese population of Southeastern China[J].Int J Genomics,2014,2014:247637.
[5]Wang L, Wang H, Chen H,etal.Serum levels of soluble programmed death ligand 1 predict treatment response and progression free survival in multiple myeloma[J].Oncotarget,2015,6(38):41228-41236.
[6]Savabkar S, Azimzadeh P, Chaleshi V,etal.Programmed death-1 gene polymorphism (PD-1.5 C/T) is associated with gastric cancer[J].Gastroenterol Hepatol Bed Bench,2013,6(4):178-182.
[7]Hamanishi J, Mandai M, Matsumura N,etal.PD-1/PD-L1 blockade in cancer treatment: perspectives and issues[J].Int J Clin Oncol,2016,21(3):462-473.
[8]Ceeraz S, Nowak E C, Noelle R J.B7 family checkpoint regulators in immune regulation and disease[J].Trends Immunol,2013,34(11):556-563.
[9]Yin L, Guo H, Zhao L,etal.The programmed death-1 gene polymorphism (PD-1.5 C/T) is associated with non-small cell lung cancer risk in a Chinese Han population[J].Int J Clin Exp Med,2014,7(12):5832-5836.
[10]赵沙,蒋涛,周彩存.抗PD-1/PD-L1免疫治疗疗效预测标志物在非小细胞肺癌中的研究进展[J].肿瘤,2016,36(7):823-828.
[11]Gettinger S N, Horn L, Gandhi L,etal.Overall survival and long-term safety of nivolumab (anti-programmed death 1 antibody, BMS-936558, ONO-4538) in patients with previously treated advanced non-small-cell lung cancer[J].J Clin Oncol,2015,33(18):2004-2012.
[12]王丽梅,王红,王树鹤,等.影响上皮性卵巢癌复发的临床因素分析[J].中国妇幼健康研究,2012,23(5):637-639.
[13]单莺,肖丽萍,杨晓宁,等.EGFR、MMP-9和AQP1在上皮性卵巢癌中的表达及临床意义[J].中国妇幼健康研究,2012,23(5):579-582.
[14]Hamid O, Robert C, Daud A,etal.Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma[J].N Engl J Med,2013,369(2):134-144.
