TACSTD2在卵巢高级别浆液性癌中的表达及意义
2018-01-31荣国华戴红英张菲菲张桂萍
相 丽,荣国华,戴红英,张菲菲,田 静,张桂萍
(1.青岛大学附属医院妇科,山东 青岛 266000;2.青岛市市立医院(集团)乳腺外科,山东 青岛 266077)
卵巢上皮性癌为女性生殖系统中致死率最高的疾病,其大部分组织学类型为高级别浆液性癌,发病时多为晚期,进展迅速,常伴盆腹腔转移和不良预后。因此,针对卵巢高级别浆液性癌的研究具有切实的临床意义。近年来,卵巢癌的起源研究取得了很大的进展。传统的卵巢表面上皮起源学说受到挑战,新的输卵管起源学说获得越来越多的证据支持,最新的世界卫生组织(WHO)分期和美国妇科肿瘤协会的卵巢癌预防方案中均纳入了卵巢高级别浆液性癌的输卵管起源理论。在本实验中,将采集卵巢高级别浆液性癌、输卵管上皮和卵巢上皮的组织标本,分析比较其组织学表型和基因表达谱的相似性和差异性,为卵巢高级别浆液性癌的输卵管起源学说提供证据支持;进而将通过光纤微珠芯片分析,筛选出可行的目的基因,并检测其在卵巢高级别浆液性癌和输卵管中的差异表达,揭示其与卵巢高级别浆液性癌“输卵管起源”发病机制的相关性。
1材料与方法
1.1材料来源
研究对象收集2015年3月至2016年10月于青岛大学附属医院妇科行手术切除的卵巢高级别浆液性癌新鲜组织标本及因子宫良性病变行全子宫+双附件切除术的输卵管、卵巢新鲜组织标本各36例用以进行组织学表达及基因谱分析研究。卵巢癌患者年龄39~67岁,中位年龄49.3岁;良性病变患者年龄47~65岁,中位年龄52岁。所有患者术前均已签署知情同意书。
主要试剂基因表达谱分析平台购自美国Illumina公司,实时定量聚合酶链反应(real time polymerase chain reaction,RT-PCR)试剂盒购自德国Qiagen公司,逆转录试剂盒及随机引物购自美国Promega公司,肿瘤关联钙信号转导因子2(tumor-associated calcium signal transducer 2,TACSTD2)抗体购自美国R&D公司,配对盒基因8(Paired Box Gene 8,PAX8)抗体购自美国Proteintech公司,二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色试剂盒购自中杉金桥公司。
1.2方法
1.2.1免疫组化
免疫组化及结果判定常规石蜡包埋组织切片,厚度约5μm。常规脱蜡、脱苯、抗原修复后,滴加一抗(PAX8,1:100),山羊血清封闭,滴加二抗,滴加高敏过氧化物酶,滴加新鲜配制的DAB溶液显微镜下控制显色程度,适时终止显色。每次染色均以已知PAX8阳性的输卵管上皮切片为阳性对照,用PBS代替一抗作为阴性对照。参照文献,大于10%的细胞核染色可判定PAX8阳性表达[1]。
1.2.2基因表达谱分析
从采集的卵巢高级别浆液性癌、输卵管上皮、卵巢表面上皮组织样本中随机挑选各4例,提取mRNA并纯化,通过IlluminahumanHT-12 v4 expression BeadChip平台进行基因表达谱分析,应用GenomeStudio软件对芯片数据进行归一化处理,并筛选出差异表达基因。
1.2.3实时定量聚合酶链反应
RT-PCR提取卵巢高级别浆液性癌和输卵管上皮组织的细胞总RNA,提纯并测定浓度,逆转录为cDNA。
根据BLAST软件设计引物:上游引物GCTTCCCTGT ̄TCTGATCCTATC;下游引物TCTTATACTCTACCCGAC ̄CTGC。将引物加入实时定量PCR反应体系,按照反应条件(42℃ 5min,95℃ 10s,58℃ 30s,40个循环)在Light Cycler 480上进行。
1.2.4蛋白印记
将卵巢高级别浆液性癌、输卵管上皮组织标本进行称重、粉碎、裂解。按BCA蛋白质定量法测定样品浓度,然后进行变性聚丙烯酰胺不连续凝胶电泳(sodium salt-Polyacrylamide gel electrophoresis,SDS-PAGE)。分别上样,电泳分离蛋白,浓缩胶80V,分离胶120V。然后将蛋白质转移到0.45μm孔径聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)。封闭过的膜加入一抗(TACSTD2,1:2 000)4℃孵育过夜,二抗孵育2h。ECL显影,上机检测。
1.3统计学方法
应用SPSS 18.0软件进行统计学分析,计量实验数据用均数±标准差(χ±S)表示,两组数据比较采用独立样本t检验,两组数据分布的概率比较采用卡方检验,P<0.05表示差异有统计学意义。
2结果
2.1卵巢高级别浆液性癌和输卵管上皮、卵巢上皮的组组织学表型相似性比较
PAX8目前被推荐用于区别苗勒氏管起源和非苗勒氏管起源肿瘤的可行分子标志物。免疫组化法检测显示:PAX8在卵巢高级别浆液性癌的阳性表达率为83.33%(30/36),在输卵管上皮中的阳性表达率为100.00%(36/36),在卵巢上皮中的阳性表达率为16.67%(6/36)。卵巢高级别浆液性癌和输卵管上皮之间的PAX8表达率比较,差异无统计学意义(χ2=2.180,P=0.140>0.05);而卵巢高级别浆液性癌和卵巢上皮的PAX8表达率比较,差异有统计学意义(χ2=10.670,P=0.001<0.05)。由此可见,相比较卵巢表面上皮,卵巢高级别浆液性癌和输卵管上皮之间更具有组织学表型上的相似性,见图1。
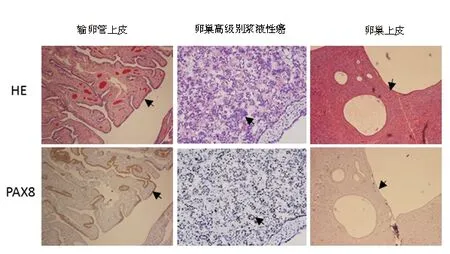
图1免疫组化法检测苗勒氏管起源标志物PAX8在输卵管上皮、卵巢高级别浆液性癌、卵巢上皮中的表达(×100)
Fig.1 Expression of PAX8 in fallopian tube epithelium, high-grade ovarian serous carcinoma, and ovarian epithelium detected by immunohistochemistry (×100)
2.2卵巢高级别浆液性癌、输卵管上皮、卵巢上皮的基因表达谱相似性比较
通过Illumina光纤微珠芯片平台进行卵巢高级别浆液性癌、输卵管上皮、卵巢表面上皮的基因表达谱比较,发现卵巢高级别浆液性癌和输卵管上皮被聚类到同一分支并且距离较近。提示相对于卵巢上皮,卵巢高级别浆液性癌和输卵管上皮更具有基因表达谱的相似性,见图2A。
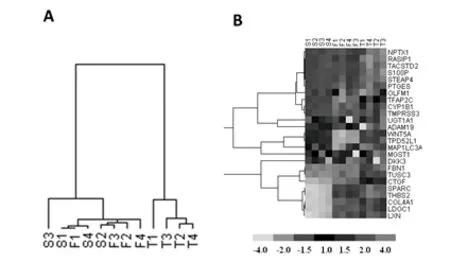
注:A为卵巢高级别浆液性癌和输卵管上皮被聚类到同一分支并且距离较近;B为相对于输卵管上皮,在卵巢高级别浆液性癌中差异表达的候选基因。
图2卵巢高级别浆液性癌、输卵管上皮、卵巢上皮的基因表达谱聚类分析
Fig.2 Clustering analysis of gene expression profile in high-grade ovarian serous carcinoma, fallopian tube and ovarian epithelium
2.3卵巢高级别浆液性癌和输卵管上皮之间的差异表达基因
数据分析显示:卵巢高级别浆液性癌和输卵管上皮之间存在2 412个差异表达基因,包括822个上调基因及1 590个下调基因。结合文献检索及综合评析,筛选出若干候选基因,其中差异表达显著并且与肿瘤关系密切的TACSTD2成为本次研究的目标,见图2B及表1。
表1相比较输卵管上皮,在卵巢高级别浆液性癌中差异表达的部分基因
Table 1 Different expressed genes in high-grade ovarian serous carcinoma compared with fallopian tube epithelium
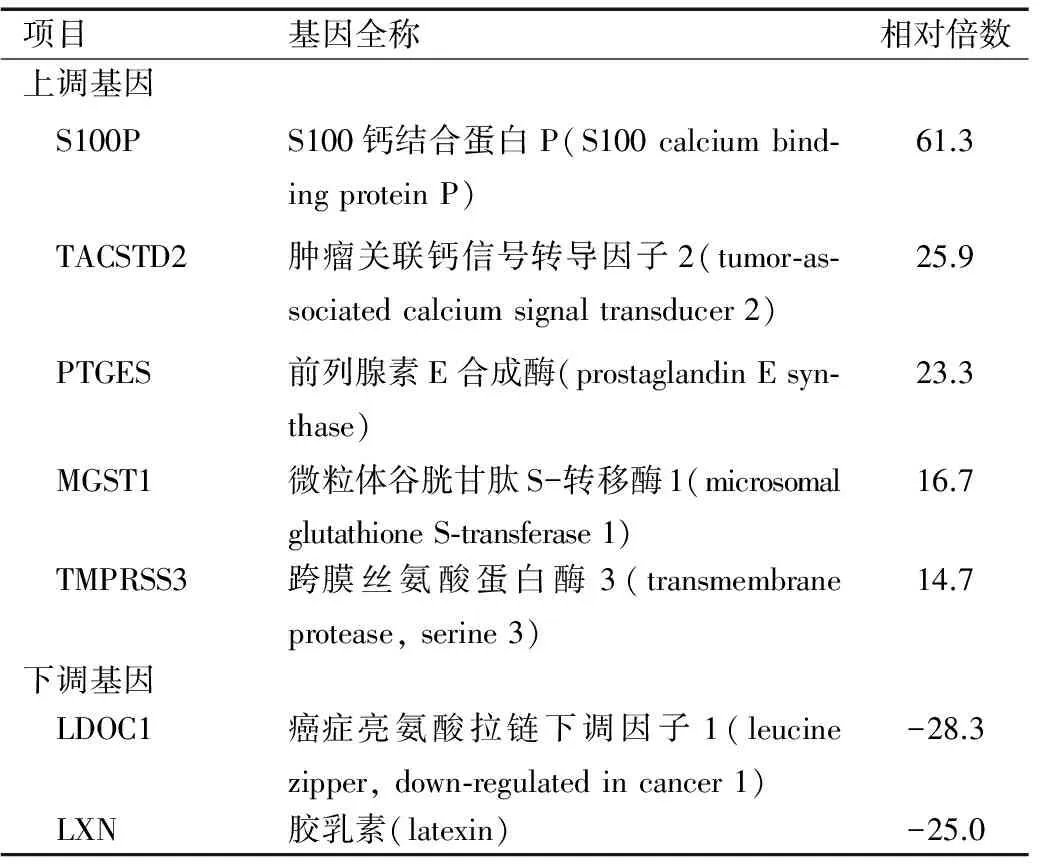
项目基因全称相对倍数上调基因 S100PS100钙结合蛋白P(S100calciumbind⁃ingproteinP)61.3 TACSTD2肿瘤关联钙信号转导因子2(tumor⁃as⁃sociatedcalciumsignaltransducer2)25.9 PTGES前列腺素E合成酶(prostaglandinEsyn⁃thase)23.3 MGST1微粒体谷胱甘肽S-转移酶1(microsomalglutathioneS⁃transferase1)16.7 TMPRSS3跨膜丝氨酸蛋白酶3(transmembraneprotease,serine3)14.7下调基因 LDOC1癌症亮氨酸拉链下调因子1(leucinezipper,down⁃regulatedincancer1)-28.3 LXN胶乳素(latexin)-25.0
2.4目的基因TACSTD2在卵巢高级别浆液性癌组织中的基因和蛋白表达
通过Real time PCR检测发现,相比较于输卵管上皮,TACSTD2在卵巢高级别浆液性癌中的基因表达升高,差异有统计学意义(t=-50.411,P=0.000<0.05)。通过Western blot检测发现,相比较于正常输卵管上皮,TACSTD2在卵巢高级别浆液性癌中的蛋白表达升高。见图3。

注:A为通过Real time PCR检测TACSTD2的基因表达,F是输卵管上皮,S是卵巢高级别浆液性癌;B为通过Western blot检测TACSTD2的蛋白表达,R1~R3是输卵管上皮,R4-R6是卵巢高级别浆液性癌。
图3 TACSTD2在卵巢高级别浆液性癌中的异常表达
Fig.3 Abnormal expression of TACSTD2 in high-grade ovarian serous carcinoma
3讨论
3.1卵巢癌的表面上皮起源理论缺陷
作为致死率最高的女性生殖系统肿瘤,卵巢癌约75%的组织学类型表现为高级别浆液性癌,发病时大多为晚期,进展迅速,常伴盆腹腔转移和不良预后[2]。因此,针对卵巢高级别浆液性癌的研究,具有切实的临床意义,一直推动研究者和临床医师对其起源和发病机制的探索。卵巢癌的起源具有争议性,传统的卵巢表面上皮起源理论认为卵巢癌起源于卵巢表面生发上皮。随着近十几年的研究进展,人们逐渐发现卵巢表面上皮起源理论本身存在的缺陷。首先,研究者没有找到卵巢表面上皮化生的直接证据,也一直未能在卵巢组织内发现卵巢癌的癌前病变。另外,卵巢上皮性癌和卵巢表面上皮在免疫表型上也存在差异。研究发现,间皮组织来源的分子标志物间皮素(calretinin)在卵巢表面上皮多呈阳性表达,而在卵巢上皮性癌中却完全不表达。而一些生物学印迹如人类同源盒基因A(human homeobox gene A,HOXA)、PAX8、配对盒基因2(paired box gene 2,PAX2)在卵巢上皮性癌中多呈过表达,但在卵巢表面上皮中不表达[3-4]。与之相一致,在本次研究中,通过免疫组化检测发现,苗勒氏管组织起源的分子标志物PAX8在输卵管表面上皮、卵巢高级别浆液性癌均多呈阳性表达,而在卵巢表面上皮中却多不表达,揭示输卵管上皮和卵巢高级别浆液性癌的组织学表型相似性。而卵巢高级别浆液性癌的苗勒氏管起源可能性与卵巢表面上皮的间皮组织起源的确是不相符合的。
3.2卵巢癌的输卵管起源学说进展
目前卵巢高级别浆液性癌的输卵管起源学说在国内外均获得很大进展。随着SEE-FIM Protocol规范应用,输卵管伞端病变的检出率大大增加。Piek等于2001年在BRCA+妇女预防性切除的输卵管标本中发现高级别浆液性癌以及原位癌病变,但在卵巢标本中却没有找到相关癌灶和癌前病变。Kindelberger等在2007年进一步发现,输卵管上皮内原位癌也表现出和卵巢高级别浆液性癌一致的特征性TP53突变。Crum等于2011年在输卵管上皮中发现了特征性的病理学形态改变并提出“p53 signatures”和“secretory cell outgrowths”的概念,推测其可能为浆液性癌的前驱病变。国内对卵巢癌的二元论模型和输卵管起源学说日渐重视,并分别在卵巢高级别和低级别浆液性癌的发病机制研究中有所发现[5]。最新的WHO分期纳入了卵巢高级别浆液性癌输卵管起源的理论[6]。另外,美国妇科肿瘤协会(Society of Gynecologic Oncology,SGO)也强调了输卵管起源在卵巢高级别浆液性癌诊治和预防中的重要性[7]。在本次研究中,通过Illumina光纤微珠芯片平台进行卵巢高级别浆液性癌、输卵管上皮、卵巢表面上皮的基因表达谱比较,发现卵巢高级别浆液性癌和输卵管上皮被聚类到同一分支并且距离较近。提示相对于卵巢上皮,卵巢高级别浆液性癌和输卵管上皮更具有基因表达谱的相似性。当然,这些数据仅为输卵管起源提供了支持性证据,并不能从根本上证明卵巢高级别浆液性癌和输卵管上皮的同源性。要彻底证实此理论,需大量研究,却可为临床带来革命性的影响。
3.3 TACSTD2的研究意义
基于目前国内外对输卵管起源理论的认可趋势,从卵巢高级别浆液性癌和输卵管上皮的差异表达基因入手以探索发病机制,应是可行之策。从本次芯片分析获取的数据中,结合文献检索及综合评析,差异表达显著并且与肿瘤关系密切的TACSTD2被筛选出来,成为具体分析的目的基因。TACSTD2基因即tumor-associated calcium signal transducer 2,又称Trop2、MlSl基因,全长1.8Kb,编码323个氨基酸。TACSTD2 蛋白是细胞表面有单个跨膜区域的磷酸化的糖蛋白,含有一个EGF样的重复区,一个甲状腺球蛋白样的重复区和一个跨膜区,羧基端有丝氨酸和酪氨酸的磷酸化位点和PIP2结合序列。近年来研究发现TACSTD2在多种上皮癌中高表达,而在正常上皮组织中表达很低或者不表达。TACSTD2的过表达可促进某些肿瘤细胞包括卵巢癌的增殖、浸润、侵袭等生物学行为;反之,沉默TACSTD2基因则可抑制肿瘤细胞的生长[8]。研究发现TACSTD2与多种调控因子有所关联,可能通过激活ERK/MAPK通路驱动NF-kB、cyclin D1等蛋白表达发挥作用[9-10]。本次研究证实,TACSTD2在卵巢高级别浆液性癌中呈高表达,而在输卵管上皮中呈低表达,差异有统计学意义,提示其与肿瘤发病机制的相关性。目前的研究尚表浅,下一步将着重分析TACSTD2在卵巢癌中的具体分子机制。
总之,本研究通过比较卵巢高级别浆液性癌、输卵管上皮和卵巢表面上皮的组织学表型及基因表达谱相似性,为卵巢癌的“输卵管起源”学说提供证据支持;并通过聚类分析筛选出差异基因TACSTD2,明确其在卵巢高级别浆液性癌中的异常表达,提示其与卵巢高级别浆液性癌“输卵管起源”发病机制的相关性。下一步将探讨阐释TACSTD2在肿瘤发生发展中的作用及具体分子机制,以期为临床诊断及预后指标提供可行的分子标志物选择。
[1]Heidarpour M, Tavanafar Z. Diagnostic utility of PAX8 in differentiation of mullerian from non-mullerian tumors[J]. Adv Biomed Res, 2014,3:96.
[2]Siegel R, Ma J, Zou Z,etal. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1):9-29.
[3]Quick C M, Ning G, Bijron J,etal. PAX2-null secretory cell outgrowths in the oviduct and their relationship to pelvic serous cancer[J]. Mod Pathol, 2012, 25(3):449-455.
[4]Mhawech-Fauceglia P, Wang D, Samrao D,etal. Pair Box 8 (PAX8) protein expression in high grade, late stage (stages III and IV) ovarian serous carcinoma[J]. Gynecol Oncol, 2012, 127(1):198-201.
[5]孔北华,ZHENG Wenxin.重视卵巢癌的二元论模型与卵巢外起源新说[J].中华妇产科杂志,2011,46(10):721-723.
[6]Meinhold-Heerlein I, Fotopoulou C, Harter P,etal.The new WHO classification of ovarian, fallopian tube, and primary peritoneal cancer and its clinical implications[J]. Arch Gynecol Obstet, 2016, 293(4):695-700.
[7]Walker J L, Powell C B, Chen L M,etal. Society of Gynecologic Oncology recommendations for the prevention of ovarian cancer[J]. Cancer, 2015, 121(13): 2108-2120.
[8]Lin H, Zhang H, Wang J,etal. A novel human Fab antibody for Trop2 inhibits breast cancer growth in vitro and in vivo[J]. Int J Cancer, 2014, 134(5):1239-1249.
[9]Trerotola M, Jernigan D L, Liu Q,etal. Trop-2 promotes prostate cancer metastasis by modulating β(1) integrin functions[J]. Cancer Res, 2013, 73(10):3155-3167.
[10]Guerra E, Trerotola M, Aloisi A L,etal. The Trop-2 signalling network in cancer growth[J].Oncogene, 2013, 32(12):1594-1600.
