鳀鱼粉、金枪鱼粉、鳕鱼排粉和酶解鳀鱼浆对黄颡鱼生长及健康的影响
2018-01-30吴代武王梦影周露阳高敏敏叶元土蔡春芳浦琴华
吴代武, 何 杰, 汪 冰, 王梦影, 周露阳,高敏敏, 叶元土*, 蔡春芳,吴 萍,浦琴华
(1.苏州大学基础医学与生物科学学院,江苏苏州 215123;2.浙江一星实业股份有限公司,浙江海盐 314300)
以海洋捕捞的非食用鱼、食用鱼加工副产物为原料生产的鱼粉,一直是养殖水产动物饲料的重要蛋白质原料。鱼粉的营养组成因原料的选择表现出较大的差异,不同的鱼种类、不同生长阶段蛋白质含量不同,以鱼头、内脏等水产品下脚料生产的鱼粉,其蛋白质和赖氨酸、甲硫氨酸含量低,“未知生长因子”含量少,促生产性能差(王中华,2006)。 金枪鱼(Thunnus)和鳕鱼(Gadus)是商品食用鱼的主要捕捞对象,加工过程产生的大量下脚料常被用来生产鱼粉。鳀鱼(Engraulis japonicus)是鳀属鱼类的统称,鳀属鱼类产量占世界水产品产量的10% ~20%(周明明,2010),捕捞后极易腐烂,鲜销困难,是制作鱼粉的优质原料。此外,鳀鱼、金枪鱼等红肌鱼类比白肌鱼类(鳕鱼等)可能含有更高的组胺等毒性因子(Vinci等,2002)。近几年,鱼粉资源愈加紧张,在维持养殖鱼类健康生长的前提下,降低饲料成本是实现水产养殖业可持续发展的基础保障。因此,研究不同质量的鱼粉对黄颡鱼生产性能的影响具有重要意义。
传统的鱼粉生产工艺中,原料鱼在蒸煮、烘干等生产环节经一定的高温处理,使肌胃糜烂素等有害成分含量升高(韩凌霜,2015)。将原料鱼酶解后直接用于水产饲料,避免了鱼粉生产的高温对油脂、蛋白质的不利影响,可以更好的保持原料新鲜度和特殊活性成分。
本研究以三种鱼粉(鳀鱼粉、金枪鱼粉、鳕鱼排粉)和酶解鳀鱼浆为试验材料,以黄颡鱼(Pelteobagrus fulvidraco)为研究对象,探讨酶解鱼浆和传统鱼粉对养殖鱼类生产性能、机体健康的影响,为配方饲料中鱼粉的选择提供科学依据。
1 材料与方法
1.1 试验饲料的制备 试验用鳀鱼粉来自荣成市海圣饲料有限公司,以东海海域捕捞的鳀鱼为主要原料生产;金枪鱼粉来自中粮饲料原料贸易公司,以非洲捕捞的小型金枪鱼为原料生产;鳕鱼鱼排粉来自浙江科盛饲料有限公司,以鳕鱼鱼排为原料生产;酶解鳀鱼浆是以荣成市海圣饲料有限公司提供的冰冻鳀为原料,在实验室条件下制备(吴代武等,2015)。鳀鱼粉、金枪鱼粉、鳕鱼鱼排粉、酶解鱼浆营养成分实测值见表1。
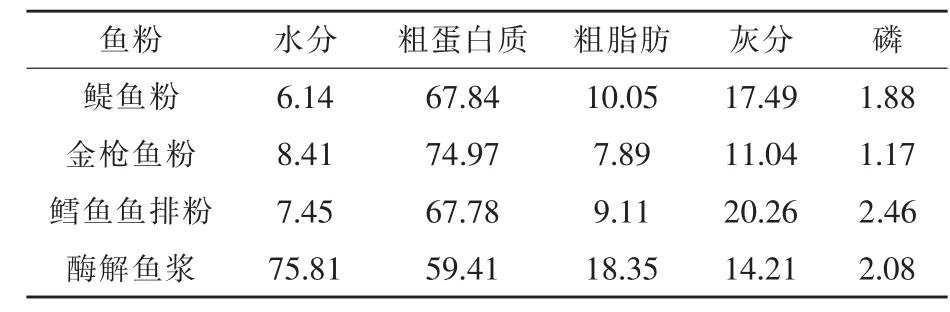
表1 鱼粉、酶解鱼浆营养成分组成(干物质)%
以实测的鳀鱼粉(FM)、金枪鱼粉(TFM)、鳕鱼鱼排粉(CFM)蛋白质含量为基础,按相同蛋白质计算其在试验饲料配方中用量(表2)。按照鱼粉蛋白质量的35%,在高植物蛋白饲料中添加酶解鱼浆(FPH)。共设计4组试验饲料,试验所用饲料配方及其营养成分实测值见表2。各组间蛋白质、脂肪、总磷、总能水平无显著差异。原料粉碎后过60目筛,混匀加适量水搅拌,制粒机加工成切成3~5 mm长的颗粒饲料,风干后置于-20℃密封保存。饲料氨基酸组成见表3,生物胺组成见表4。
1.2 试验鱼与养殖管理 养殖试验在浙江一星养殖基地池塘网箱中进行,在面积为40 m×60 m的池塘中设置试验网箱 (规格为1.0 m×1.5 m×1.5 m),以海盐县长山河为水源,池塘中设置1台1.5 kW的叶轮式增氧机,每天运行12 h。
选取浙江一星养殖基地池塘培育的1冬龄、规格整齐、健康,体重为(30.08±0.35)g 的黄颡鱼种240尾,随机分成4组,每组设3个重复(n=3),每网箱20尾,试验鱼网箱驯化适应两周后开始正式投喂。日投喂2次(07:00、16:00),日投喂量为鱼体重的3%~5%,每10 d估算1次鱼体增重量,调整投喂量。实际投喂60 d,养殖期间水温24.1~36.0℃,溶解氧浓度 >7.0 mg/L,pH 8.0~8.4,氨氮浓度<0.10 mg/L,亚硝酸盐浓度<0.005 mg/L,硫化物浓度<0.05 mg/L。
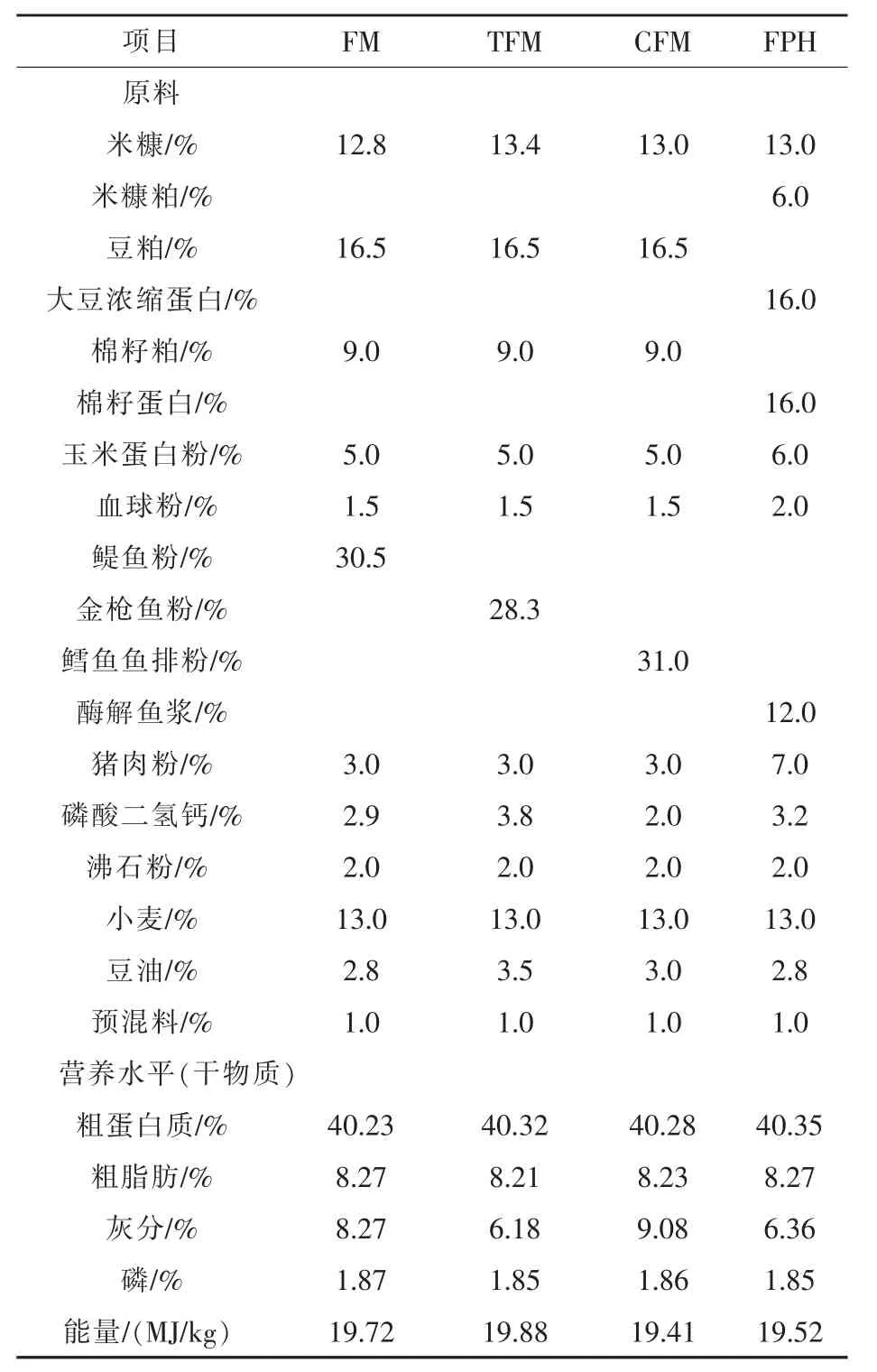
表2 试验饲料配方与营养水平
1.3 样品采集 正式试验前,从分组剩余的黄颡鱼中随机取6尾鱼,作为初始样本进行全鱼体成分分析。养殖结束时,停食24 h,对每个网箱黄颡鱼进行称重、计数,计算成活率、特定生长率。每网箱随机取3尾鱼保留全鱼样品,进行全鱼体成分测定。分析试验前后鱼体蛋白质、脂肪含量,计算蛋白质沉积率、脂肪沉积率。每网箱随机取6尾鱼测定体重、体长,解剖取内脏团、肝胰脏称重,用于计算肥满度、脏体比和肝体比。
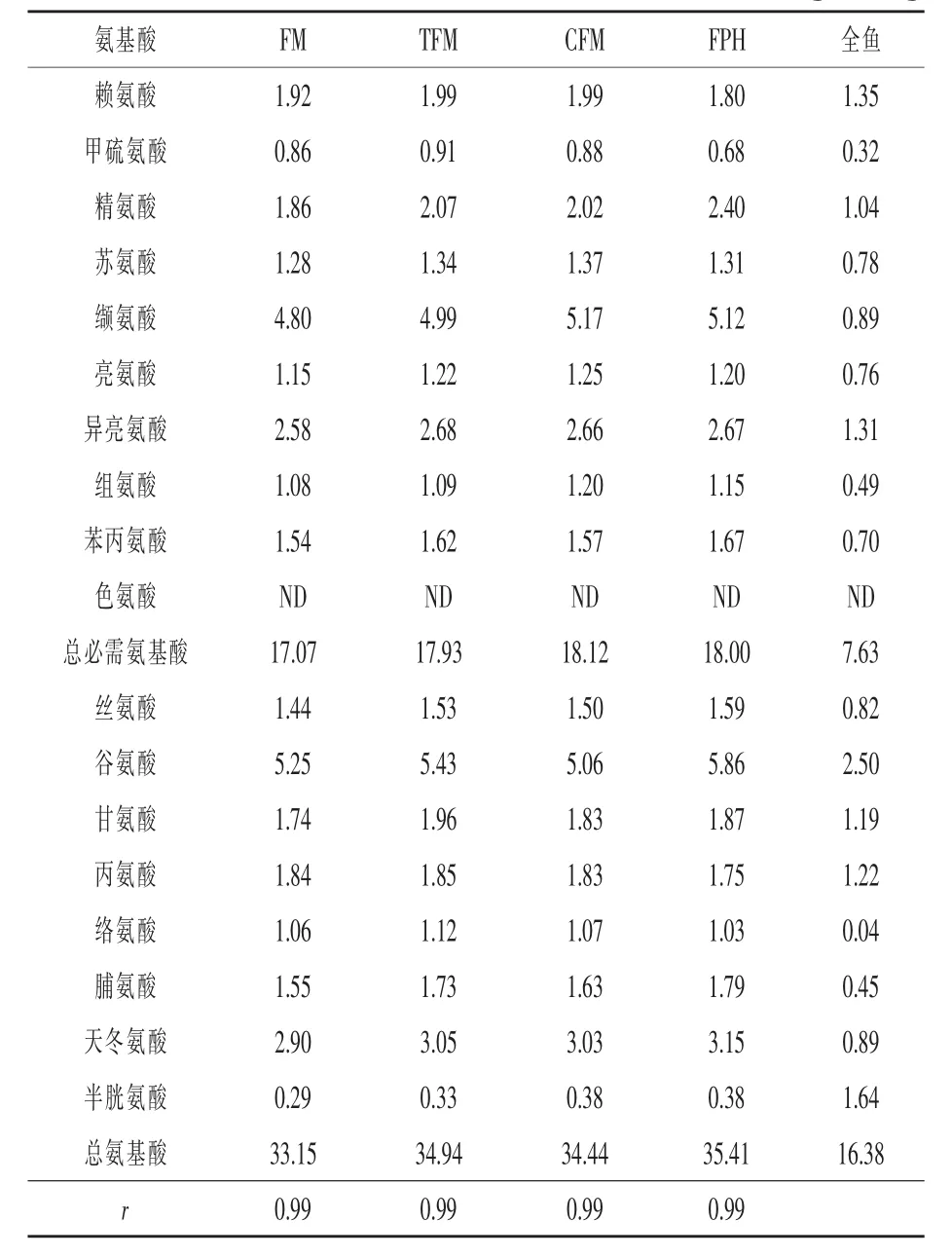
表3 试验饲料氨基酸组成(干物质)g/100g

表4 试验饲料生物胺组成(干物质)mg/kg
每网箱随机取3尾鱼,解剖取胃黏膜组织,鱼用生理盐水清洗,2.5%戊二醛固定,用于扫描电镜的样品制备,观察胃黏膜结构。
每个网箱随机取10尾鱼,以无菌的1 mL注射器自尾柄静脉采血,置于Eppendorf离心管中室温自然凝固3 h,3000 r/min、室温离心10 min,取上层血清混合,每个网箱作为1个样品,液氮速冻后于-50℃冰箱保存待测。血清生理生化指标采用雅培C800全自动生化分析仪测定。
1.4 分析方法 将保存的饲料和全鱼样品解冻,用粉碎机低温粉碎均匀,采用真空冷冻干燥方法测定水分;凯氏定氮法(GB 5009.5-2010)测定粗蛋白质含量;索氏抽提法(GB/T 14772-2008)测定粗脂肪含量;GB 5009.4-2010中方法测定粗灰分含量;能量采用XRY-1C型氧弹氏热量计测定;饲料、全鱼氨基酸的测定采用SYKAM S-433D氨基酸分析仪(吴代武等,2017)。
各试验组饲料中的生物胺含量由新希望六和测试中心分析检测,仪器Thermo Q-Exactive(配有ESI源),色谱柱Hypersil GOLD C18 100mm×2.1mm×3.0 μm,流动相为甲醇:0.1%甲酸水溶液,流速0.3 mL/min,柱温30℃。
1.5 计算方法
特定生长率(SGR)/(%/d)=(lnWt-lnWi)/t×100;
饲料系数(FCR)=Wa/(W1-W0);
蛋白质沉积率(PRR)/%=(P1-P0)/Wp×100;
脂肪沉积率(FRR)/%=(F1-F0)/WF×100;
肥满度(CF)/(%/cm3)=W/L3×100;
脏体比(HSI)/%=Wh/W×100;
肝体比(VSI)/%=Wv/W×100;
式中:Wt、Wi分别为终末均重,g;初始均重,g;t为饲养天数,d;W1、W0分别为终末总体质量,g;初始总体质量,g;Wa为投喂饲料总质量,g;P1、P0分别为终末体蛋白质质量,g;初始体蛋白质质量,g;Wp为蛋白质摄入总质量,g;F1、F0分别为终末体脂肪质量,g;初始体脂肪质量,g;WF为脂肪摄入总质量,g;W 为鱼体质量,g;Wv为鱼体内脏重质量,g;Wh为鱼体肝胰脏质量,g;L为鱼体长,cm。
1.6 数据处理 试验结果使用SPSS 18.0进行单因子方差分析,同时进行Duncan’s多重比较分析试验数据的差异显著性,结果以 “平均值±标准差”表示,以P<0.05为差异显著水平。
2 结果分析
2.1 不同来源鱼粉对黄颡鱼的生长和饲料效率的影响 养殖过程中各试验组黄颡鱼的成活率(SR)无显著差异(P > 0.05)(表 5)。以 SGR 表示黄颡鱼的生长速度,结果显示,FM组最高,其次为FPH组,TFM和CFM组比FM组低了11.4%、14.9%,但差异不显著(P>0.05)。对于饲料效率,各处理组的FCR差异不显著 (P>0.05),TFM和CFM组比FM组高了28.6%;饲料的PRR和FRR也无显著差异 (P>0.05),FM组黄颡鱼PRR和FRR最高。
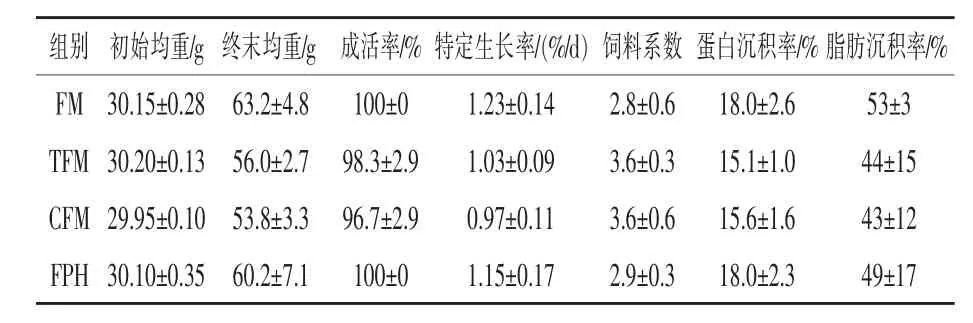
表5 不同来源鱼粉对试验黄颡鱼生长、饲料效率的影响(n=3)
各组鱼的体成分无显著差异(表6)。对于形体指标,CFM组 CF、VSI和 HSI均最高,HSI显著高于 TFM(P< 0.05)。

表6 不同来源鱼粉对黄颡鱼体成分和形体指标的影响(n=3)
2.2 不同来源鱼粉对黄颡鱼血清生理指标的影响黄颡鱼血清生理指标见表7,各组的谷草转氨酶(AST)和谷丙转氨酶(ALT)、总蛋白(LTP)、白蛋白(ALB)、葡萄糖(GLU)、高密度脂蛋白(HDL)水平无显著差异(P>0.05);而FPH组血清低密度脂蛋白(LDL)、胆固醇(CHOL)和甘油三酯(TG)比TFM组降低了42.0%、37.0%、35.0%,变化显著(P < 0.05)。
2.3 不同来源鱼粉对黄颡鱼胃黏膜组织形态的影响 CFM和FPH组胃部黏膜结构清晰,上皮细胞形态完整、排列紧密;而FM、TFM组胃部黏膜损伤严重,上皮细胞出现破损,FM上皮细胞完全损坏,没有基本的细胞形态。
3 讨论
鱼粉对养殖水产动物表现出特殊的营养作用,对养殖动物生长速度、饲料利用效率及鱼体生理机能的影响是评价鱼粉营养质量最综合的指标。原料质量的判别常以营养成分作为依据,而鱼粉的营养组成因原料的选择表现出较大的差异。饲料鱼粉蛋白质用量相同时,鳀鱼粉、鳕鱼鱼排粉的灰分含量高于金枪鱼粉,导致饲料中鱼源灰分含量也高于金枪鱼粉饲料。研究表明,鱼排粉(粗蛋白质55.74%,灰分22.65%)会降低凡纳滨对虾(Litopenaeus vannamei) 的生长 (程传龙,2010);Toppe等(2006)在饲料中添加鱼排粉,饲料中鱼源灰分含量为8.4%~18%时,大西洋鳕(Gadus morhua)的摄食率、特定生长率随灰分升高而增加;Li等(2004)用高灰分的鱼头粉替代25%鱼粉粗蛋白养殖美国红鱼(Sciaenops ocevatus),养殖效果无显著差异。本研究中,鱼粉饲料的黄颡鱼生长速度、饲料利用效率无显著差异,意味着黄颡鱼能在一定范围能有效利用高灰分鱼粉。在相同鱼粉蛋白质用量的条件下,鱼粉饲料氨基酸的平衡模式均与鱼体氨基酸模式接近(表3)。以冰冻鱼为原料制备的酶解鱼浆,其主要营养组成与鱼粉差异较大,但保全了原料鱼的主要组成物质,氨基酸的平衡性好,12%鱼浆(干物质)与30%的鱼粉在生产性能方面具有一定的等效性。
生物胺在鱼粉中的含量是评价鱼粉质量的重要指标。鳀鱼等红肌鱼类比白肌鱼类含更高的组氨酸(Suyama 和 Yoshizawa,1973),在一定条件下,组氨酸在微生物脱羧酶及尿酐酸酶作用下生成组胺(赵利等,2006),因此,红鱼粉中的组胺含量高于白鱼粉(周天政,2009;Vinci等,2002)。Opstvedt等 (2000)在饲料中添加腐胺(600 mg/kg)、尸胺(1600 mg/kg)、组胺(1600 mg/kg),大西洋鲑(Salmo salar L.)生长不受影响。Fairgrieve(1992)在饲料中添加0~2000 mg/kg组胺,或同时加入 500 mg/kg的腐胺、尸胺 (Fairgrieve等,1994),虹鳟 (Oncorhynchus mykiss)生长也不受影响。本研究中,试验鳀鱼粉饲料组胺为322 mg/kg,是金枪鱼粉饲料的6倍、鳕鱼鱼排粉饲料的75倍,尸胺、腐胺水平也远高于金枪鱼粉饲料,但黄颡鱼生长未受到鳀鱼粉高组胺的影响,与虹鳟(Fairgrieve,1994、1992)结果相似。 组胺所带来的毒性影响因子(肌胃糜烂素)可能会影响鱼体胃部肌肉收缩。研究表明,用组胺含量高的鱼粉投喂虹鳟时发现,其胃部产生了严重的生理病变(Fairgrieve 等,1994;Watanabe 等,1987)。 本研究中鳀鱼粉、金枪鱼粉组黄颡鱼胃部绒毛基础结构完整,但黏膜上皮细胞出现损伤,意味着高组胺的鱼粉有导致黄颡鱼胃肠道病理变化的风险。
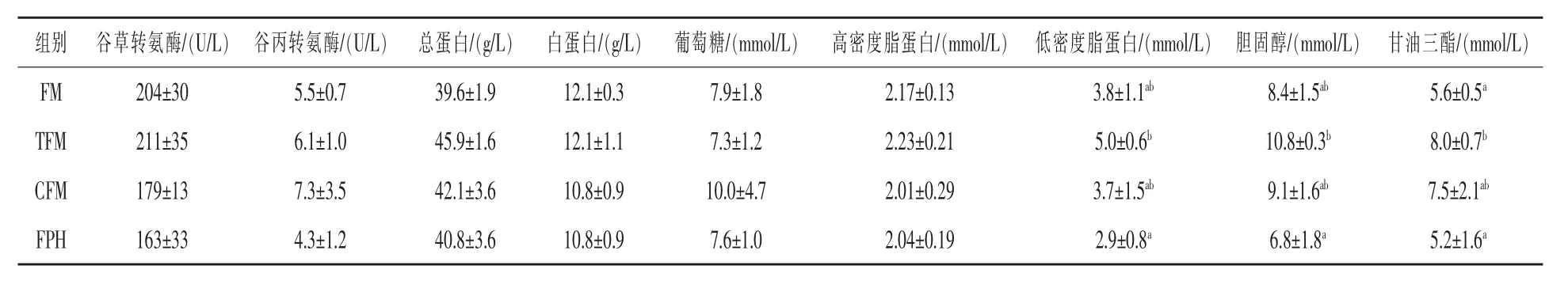
表7 不同来源鱼粉对黄颡鱼血清生理指标的影响
血清生理指标可以反映鱼类的营养代谢与健康状况。转氨酶是催化氨基转移的一类酶,是反映肝脏功能的指标。在正常情况下,血清转氨酶的活性保持在一个适当的范围内,当肝胰脏等组织受到损伤时,会导致大量的转氨酶释放到血液中,引起血清中转氨酶活性的升高。有研究发现,在饲料中添加大量的菜籽会造成肝脏的损伤,引起血清转氨酶活性显著升高(叶元土等,2005;马利等,2005),而本试验中高植物蛋白中添加鱼浆,两种转氨酶的活性与高鱼粉饲料差异不显著,表明鱼浆可以缓解植物蛋白对肝脏的损伤作用。血清蛋白含量也与机体健康、营养状况等密切相关(Yildirim等,2003),但研究表明鱼粉质量不影响黄颡鱼血清总蛋白水平(黄文文等,2015),与本研究结果相符。
胆固醇是脂质代谢的重要部分,主要在肝胰脏参与合成胆汁酸。高密度脂蛋白和低密度脂蛋白是胆固醇的主要运输者,高密度脂蛋白(HDL)的功能是将胆固醇由外周组织转运至肝胰脏进行代谢;而低密度脂蛋白(LDL)将其由肝胰脏向外周转运。酶解鱼浆组黄颡鱼血清LDL水平较低,导致血清中胆固醇和甘油三酯也随之降低,意味着减少饲料鱼粉用量,在高植物蛋白质中添加鱼浆,有利于胆固醇参与代谢。
4 结论
本研究中,高植物蛋白饲料中添加12%的鱼浆(干物质),其生长性能与30%鱼粉具有一定的等效性;鱼粉蛋白质用量相同时,黄颡鱼的生长速度和饲料利用效率不受鱼粉主要营养成分的影响,但饲料组胺水平较高时,黄颡鱼胃黏膜上皮细胞会出现损伤。
[1]程传龙.不同品质的鱼粉对凡纳滨对虾(Litopenaeus vannamei)的影响:[硕士学位论文][D].广东湛江:广东海洋大学,2010.
[2]韩凌霜.鱼粉中肌胃糜烂素的产生机理及影响研究:[硕士学位论文][D].广东广州:广东工业大学,2015.
[3]黄文文,李弋,周歧存.不同品质鱼粉对黄颡鱼幼鱼生长性能、饲料利用及肝脏抗氧化能力的影响 [J].动物营养学报,2015,27(12):3744 ~ 3753.
[4]马利,黄峰,吴建开,等.不同菜粕水平对草鱼生长、血清生化指标和毒素残留的影响[J].水产学报,2005,29(6):798 ~ 803.
[5]王中华.不同原料和加工方式对鱼粉质量的影响[J].江西饲料,2006,5:1 ~ 2.
[6]吴代武,税典章,蔡春芳,等.鳀鱼鱼浆的酶解过程与营养成分的变化[J].饲料工业,2015,36(24):25 ~ 30.
[7]吴代武,何杰,叶元土,等.饲料中鱼蛋白水解物对黄颡鱼生长、体成分和血清生理指标的影响[J].水产学报,2017,41(3):415~ 427.
[8]叶元土,蔡春芳,丁晓峰,等.在饲料中直接添加菜籽对草鱼生长的影响[J].饲料工业,2005,26(2):25 ~ 30.
[9]赵利,苏伟,刘建涛,等.水产品中生物胺的研究进展[J].水产学报,2006,30(2):272 ~ 276.
[10]周明明.鳀鱼酶解过程及其加工利用的初步研究:[硕士学位论文][D].山东青岛:中国海洋大学,2010.
[11]周天政.红鱼粉脱毒添加剂的初步研究:[硕士学位论文][D].江苏南京:南京农业大学,2009.
[12]Fairgrieve W T.Effects of dietary Hsitamine on fish meal protein quality to rainbow trout (Oncorhynchus mykiss)[D].Washington,University of Washington,1992.130 ~ 155.
[13]FairgrieveW T,MyersM S,HardyR W,etal.Gastric abnormalities in rainbow trout (Oncorhynchus mykiss) fed aminesupplemented diets or chicken gizzard-erosion-positive fish meal[J].Aquaculture,1994,127(2 ~ 3):219 ~ 232.
[14]Li P,Wang X X,Hardy R W,et al.Nutritional value of fisheries by-catch and by-product meals in the diet of red drum(Sciaenops ocellatus)[J].Aquaculture,2004,236(1 ~ 4):485 ~ 496.
[15]Opstvedt J,Mundheim H,Nygard E,et al.Reduced growth and feed consumption of Atlantic salmon (Salmo salar L.) fed fish meal made from stale fish is not due to increased content of biogenic amines[J].Aquaculture,2000,188(3 ~ 4):323 ~ 337.
[16]Suyama M,Yoshizawa Y.Free amino acid composition of the skeletal muscle of migratory fish[J].The Japanese Society of Fisheries Science,1973,39(12):1339 ~ 1343.
[17]Toppe J,Aksnes A,Hope B,et al.Inclusion of fish bone and crab by-products in diets for Atlantic cod,Gadus morhua[J].Aquaculture,2006,253(1 ~ 4):636 ~ 645.
[18]Vinci G,Antonelli M L.Biogenic amines:quality index of freshness in red and white meat[J].Food Control,2002,13(8):519 ~ 524.
[19]WatanabeT,TakeuchiT,Satoh S,etal.Effectofdietary histidine or histamine on growth and development of stomach erosion in rainbow trout[J].The Japanese Society of Fisheries Science,1987,53(7):1207 ~ 1214.
[20]Yildirim M,Lim C,Wan P J,et al.Growth performance and immune response of channel catfish (Ictalurus punctatus) fed diets containing graded levels of gossypol-acetic acid[J].Aquaculture,2003,219(1 ~ 4):751 ~ 768.
