外源信号物质MeJA诱导糖槭叶部营养物质含量的变化*
2018-01-30刘恒旭马晓乾
滑 莎 继 丹 刘 欣 刘恒旭 马晓乾
(黑龙江省森林保护研究所,哈尔滨 150081)
糖槭(Acer saccharum)是我国东北地区主要的绿化树种,极具观赏价值,但在园林绿化生产中,光肩星天牛对其危害比较严重,而普通的化学农药防治会对环境造成巨大的污染,因此急需环境友好型的防治措施。植物的抗性是植物在自然界长期适应周围环境的过程中,在受到生物因子或非生物因子侵扰时表现的一种自我防御的特性,从而实现自我保护的目的[1-3,14]。寄主植物中营养物质的情况是植食性昆虫寄主选择的物质基础,具有决定性的作用。寄主植物在受到病虫害侵入时,体内会产生多途径的代谢变化,从而形成诱导防御,如酚类物质、防御相关酶活性及营养物质的变化[4,15]。茉莉酸甲酯(MeJA)是植物体内和个体间传递的重要化学信号物质,在植物体内具有调节植物生长发育作用[5-10,16-17],同时还能作为信息素信号在植物与植食性昆虫间、植食性昆虫种间和种内传递[11-13]。
大量研究证明,利用外源信号物质茉莉酸类化合物可以诱导植物产生防御反应,从而增强植物抗性[16-19]。本研究通过对糖槭局部喷施茉莉酸甲酯(MeJA)后,测定其叶部营养物质含量变化情况,旨在揭示外源信号物质MeJA诱导糖槭叶部防御反应的差异,分析外源信号物质MeJA诱导对糖槭叶部蛋白质总量、可溶性糖及游离氨基酸含量的差异和变化,探究外源信号物质对糖槭营养物质的调节作用,并为危害糖槭的主要害虫与糖槭营养物质的相互依赖关系奠定基础。
1 材料与方法
1.1 试验材料
MeJA购自Sigma公司,蛋白质、可溶性糖及总氨基酸测定试剂盒均购于南京建成生物制剂公司。
1.2 试验方法
用16 L超纯水中含2 mL的丙酮水溶液,配制1 mM·L-1MeJA丙酮水溶液,2014年8月7日(晴天)上午11时,在黑龙江省哈尔滨市行道绿化带上随机选取4棵糖槭树,其中1棵作为对照(CK),要与其它3棵试验用树距离10 m以上,防止交互作用。选择朝阳一侧的树枝,其中3棵试验用树喷施MeJA丙酮水溶液进行诱导处理,CK喷施丙酮水溶液,分别在诱导处理 3、6、12、21、24、48 和 96 h 时采集标本,置入便携式冰箱带回室内,转入-40℃冰箱待用。测定前将采集糖槭树叶剪碎,称取0.100~0.900 g,移入研钵研磨成匀浆,后移入5mL离心管中,放置于-20℃冰箱保存,待测。
1.3 营养物质含量的测定
蛋白质、可溶性糖及游离氨基酸含量参照试剂盒上的方法进行测定。
1.4 数据统计及分析
利用SPSS22.0及Excel软件对所得试验数据进行统计和处理。
2 结果与分析
2.1 外源信号物质MeJA局部诱导糖槭叶部蛋白质含量时序的变化
通过局部喷施外源信号物质MeJA后,糖槭叶部蛋白质含量呈现增加的趋势,在不同时间内具有一定的差异性(图1)。糖槭叶部蛋白质含量在诱导处理3h时,与CK相比变化不明显;当诱导处理6 h时,含量为0.484 9 mg/mL,较CK的0.386 9 mg/mL有了明显的增加;诱导处理9 h时与诱导处理6 h时的含量水平基本一致;在诱导处理12 h时,含量为0.382 8 mg/mL,也明显高于CK的0.290 4 mg/mL;在诱导处理21 h时,含量为0.320 0 mg/mL,较CK的0.348 9 mg/mL有所降低;当诱导处理24 h时,含量为0.5317mg/mL,明显高于CK为0.295 4 mg/mL;诱导处理48 h和96 h时,也明显高于CK。局部喷施外源信号物质MeJA后,诱导处理24 h时,蛋白质含量变化最大,相较CK及其他试验诱导处理时间,蛋白质含量值最高;同时,不同时间点MeJA处理和CK蛋白质含量均表现出一定的波动性,这可能是由于采集时间、温度、湿度和光照等环境因子造成的,但从整个试验时间点的选取及所得到的数据可以看出,经MeJA处理后,在不同时间内,糖槭叶部蛋白质均不同程度的增加。
2.2 外源信号物质MeJA局部诱导糖槭叶部可溶性糖含量时序的变化
通过局部喷施外源信号物质MeJA后,在不同时间糖槭叶部可溶性糖含量较CK呈现出降低的现象,但每个试验时间点降低幅度具有一定的差异性(图2)。糖槭叶部可溶性糖含量在喷施MeJA诱导处理3h时,为4.8215mg/g,较CK的4.5084mg/g降低了0.3131mg/g;在诱导处理6h时,含量为3.9420mg/g,CK的为3.283 2 mg/g,降低了0.658 8 mg/g,降低比较明显;在诱导处理后9、21、24和48 h时,可溶性糖含量较CK降低都比较明显,分别降低1.8047mg/g、0.9200mg/g、1.3852mg/g和2.6694mg/g;在诱导处理后96 h时,MeJA处理与CK的可溶性糖含量基本接近。与CK相比较,在诱导处理48 h时,可溶性糖含量降低幅度最大;在整个试验的不同时间点,经MeJA处理的糖槭叶部可溶性糖含量具有一定的波动性,在诱导处理6 h时,含量最低,诱导处理12 h时最高,这种波动性与CK的波动性基本一致,但与CK相比较,可溶性糖含量降低的幅度在不同的时间点,表现出一定的差异性。

图1 外源信号物质MeJA诱导糖槭叶部蛋白质含量的时序变化
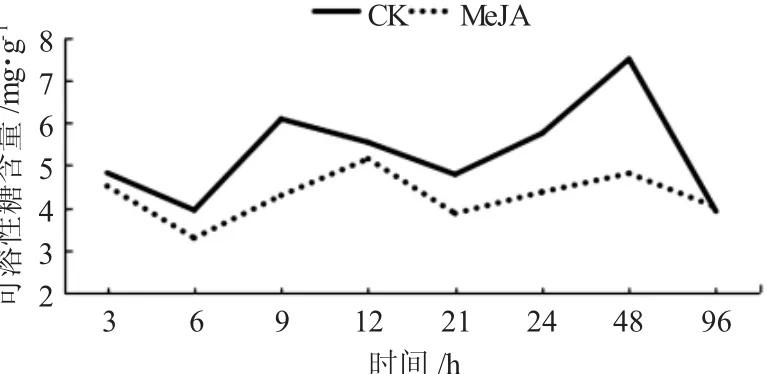
图2 外源信号物质MeJA诱导糖槭叶部可溶性糖含量的时序变化
2.3 外源信号物质MeJA局部诱导糖槭叶部氨基酸含量时序的变化
通过局部喷施外源信号物质MeJA后,在持续不同时间利用茚三酮试剂显色法测得糖槭叶部氨基酸含量,与CK相比较,表现出不同程度的增加,而这种增加在不同时间内具有一定差异(图3)。在喷施MeJA处理后,游离氨基酸含量与CK比较,在诱导处理3、21、48和96 h时增加很明显,且在诱导处理21 h时增加幅度最大;在诱导处理6 h和9 h时含量增加较明显,而在诱导处理12 h和24 h增加不明显。同时还可以看出,在选取的不同时间点获得的氨基酸含量呈现出一定的波动现象,而这种现象在MeJA处理及CK试验结果中都出现,且两者波动基本一致。
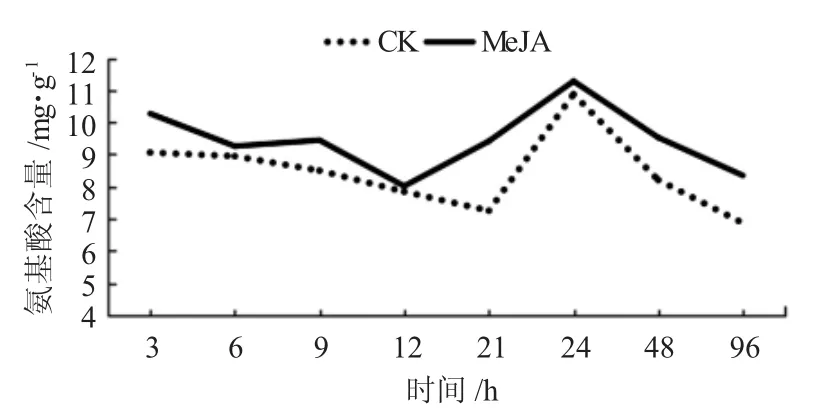
图3 外源信号物质MeJA诱导糖槭叶部氨基酸含量的时序变化
3 结论与讨论
MeJA是植物体内传递外界不利因素及启动消除这种不利因素的激素物质,在植物生长过程中,扮演着重要的作用。而诸多研究证实,植物在受到生物或非生物因子侵扰时,体内营养物质等也会呈现出一定的变化产生抗性[19-20,22],喷施外源信号物质MeJA和昆虫取食诱导寄主植物形成的抗性基本一致。在自然界中,植物主要是通过根际、气管和渗透调节体内营养物质等一系列的变化,从而来适应生境中带来的一系列不利因素,消弱或抑制对其生长发育的影响[22]。植食性昆虫对寄主植物的选择,其营养物质的差异及变化具有决定性作用,如余德亿等人通过研究证实,榕管蓟马的危害程度与榕树不同品种叶片营养物质含量关系十分密切[21]。该项研究结果也表明,局部喷施MeJA诱导了糖槭叶部营养物质发生了一定的变化,蛋白质和氨基酸含量均呈现出一定的增加现象,而可溶性糖含量呈现出降低的现象。这与Scott等[11]发现被危害的寄主植物蛋白质含量高于健康植物一致;也表明局部喷施MeJA诱导了糖槭叶部可溶性糖不同程度的降低[22]。通过外源信号物质诱导糖槭营养物质的变化情况,有助于揭示危害糖槭的主要害虫与糖槭营养物质间相互依赖的关系,从而通过探讨通过育种或者其他策略改变寄主营养物质组成,深入研究寄主植物营养物质的变化或营养物质的差异性对植食性昆虫取食的影响具有重要的实践意义及理论价值。
[1] Howe GA.Jasmonates as signals in the wound response[J].Jourrral ofPlant Growth Regulation,2004,23(3):223-237.
[2] Karban R,Baldwin IT.Induced Responses to herbivory[J].UniversityofChicagoPress Ltd.London,1997,187-191.
[3] Dicke M,Van Loon JJ.Multitrophic effects of herbivore-induced plant volatiles in an evolutionary context [J].Entomologia Experimentalis et Applicata,2000,97:237-249.
[4] War A R.,Sharma H C.Effect of jasmonic acid and salicylic acid induced resistance in groundnut on Helicoverpa armigera[J]..Physiological Entomology,2014,39(2):136-142.
[5] Preston CA,Laue q Baldwin IT.Methyl jasmonate is blowingin the wind,but can it act as a plant-plant airborne signal Biochem[J]..Syst Ecol,2001,29(10):1 007-1 023.
[6] Kautz S,Trisel J A,Ballhobrn D J.Jasmonic acid enhances plant cyanogenesis and resistance toherbovoryin limabean[J].Journal ofChemical Ecology,2014,40(11-12):1 186-1 196.
[7] Wasternack C.Action of jasmonates in plant stress reponses and development:applied aspect[J].Biotechnology Advances,2014,32(1):31-39.
[8] MartInez-EsplaA,ZapataPJ,CastilloS,etal.Preharvestapplication of methyl jasmonate(MeJA)in two plumcultivars.Improvement offruit growth and qualityattributes atharvest[J].Postharwest Biol.Tec.,,2014,98(3):98-105.
[9] Liao YC,Xu YH,Zhang Z,et al.Molecular cloning and sequence analysis of lipoxygenase (AsLOX1)gene in Aquilaria sinensis(Lour.)Gilg and its expression responding to MeJA and crush woundingtreatment[J].Plant Gene,2015,2(323):10-16.
[10] 孙晓玲,董文霞,蔡晓明,等.外用不同浓度茉莉酸甲酯诱导的茶树挥发物的种类和时序变化[J].应用昆虫学报,2016,53(3):499-506.
[11] Petty RL,Boppre M,Schneider D,et al.Identification and localization of volatile hairpencil components in male Amanris ochleabutterflies(Danaidae)[J].Experienria,1977,33(10):1 324-1 326.
[12] Hampel D,Mosandl A,Wust M.Induction of de novo volatile terpene biosynthesis via cytosolic and plastidial pathways by methyl jasmonate in foliage of Vitis vinifera[J].J.Agric.Food Chem.,2005,53(7):2 652-2 657.
[13] Hare JD.Variation in herbivore and methyl jasmonate-induced volatiles amonggenetic lines ofDatura wrightii[J]..J.Chem.Ecol.,2007,33(11):2 028-2 043.
[14] Kr ó l P,Igielski R,Pollmann S,et al.Priming of seeds with methyl jasmonate induced resistance to hemi-biotroph Fusarium oxyspornum f.sp.lycopersici in tomato via 12-oxo-phytodienoic acid,salicylicacid,andflavonolaccumulation[J].J.PlantPhysiol.,2015,179:122-132.
[15]Held D W,Boyd D.A newthrips threat[J].Ornamental Outlook,2005,14(7):14.
[16] Mantyla E,Blande JD,Klemola T.Does application of methyl jasmonate to birch mimic herbivory and attract insectivorous birds innature?[J].Arthropod-Plantinteractions,,2014,8(2):143-153.
[17] Nishida R,Baker TC,Roelofs WL.Hairpencil pheromone components of male oriental fruit moths,Grapholitha molesta[J].J.Chem.Ecol.,1982,8(6):947-959.
[18] Par é PW,Tumlinson JH.Plant volatile signals in response to herbivore feeding[J].Fla.Entomol.,1996,79(2):93-103.
[19] Petty RL,Boppré M,Schneider D,et al.Identification and localization ofvolatile hairpencil components in male Amauris ochlea butterflies (Danaidae)[J].Experientia,1977,33(10):
1 324-1 326.
[20] 曹宇,郅军锐,孔译贤.西花蓟马繁殖力与寄主营养物质的关系.应用昆虫学报,2011,48(3):524-529.
[21] 余德亿,姚锦爱,黄鹏,等.榕管蓟马危害与寄主叶片结构及营养物质的关系田.南京农业大学学报,2014,37(2):38-44。
[22] 马晓乾,赵红盈,邓勋,等.模拟昆虫取食后红皮云杉幼苗营养物质的时序变化.东北林业大学学报,2013,41(3):24-25,29.
