腹膜后恶性血管周上皮样细胞肿瘤1例
2018-01-30陈烟辉
陈烟辉
(中国人民解放军第180医院影像科,福建 泉州 362000)
女,64岁,左上肢麻木1个月入院。查体:生命体征平稳,心脏听诊正常。实验室检查:WBC计数正常,AFP稍高(7.03 ng/mL),CEA正常(1.15 ng/mL),CA125 90.5 ng/mL,神经特异性烯醇稍高(130.6 ng/mL)。CT检查:腹膜后可见不规则软组织肿块,大小5.0 cm×10.1 cm,界限欠清,密度不均,可见斑点、斑片钙化,CT值38~96 HU,增强扫描动脉期,病灶明显不均匀强化,CT值-114~89 HU,腹主动脉、下腔静脉被包绕。L2椎体骨质破坏,可见软组织影充填,右肾体积增大,密度不均,可见斑片状钙化,增强扫描呈明显不均匀强化,强化程度与腹膜后肿块一致。双侧肾上腺结节样软组织影,右侧较大者为5.6 cm×6.4 cm,呈不均匀强化,肝多发结节样软组织影,增强扫描呈“牛眼征”改变。双侧盆壁沿双侧髂内动脉走行区可见结节样软组织影,右侧较大者为3.9 cm×3.9 cm,呈不均匀强化(图1~6)。诊断:右肾细胞癌并肝、双肾上腺、腰椎、腹膜后及双侧盆壁淋巴结转移瘤。彩色多普勒超声引导下行左颈部淋巴结活检,采用巴德活检枪穿刺针,穿刺出2条长1.5 cm的组织,术中送检:“左颈部淋巴结穿刺活检标本”:恶性肿瘤伴坏死,结合组织学及免疫组化标记考虑恶性血管周上皮样细胞肿瘤。免疫组化:Melan-A(++),抗黑色素瘤特异性单抗(HMB-45)(+),CD56(++),Vimentin(局灶+),CKpan(弱+),pax-8(弱+),P16(+),Ki-67(30%),余 S100、SOX10、甲状腺转录因子(TTF-1)、CK7、CK20、CD117、P504S、雌激素受体(ER)、WT-1、CD10、Hepatocyte、CgA、Syn、α-Inhibin均阴性。病理诊断:考虑恶性血管周上皮样细胞肿瘤(图7)。
讨论:血管周上皮样细胞肿瘤是一种少见的由组织学和免疫表型上具有独特表现的血管周上皮样细胞构成的间叶组织源性肿瘤[1-10],大部分为良性,极少见恶性。 其家族肿瘤包括:血管平滑肌脂肪瘤、肺的透明细胞糖瘤、淋巴管平滑肌增生症、肝镰状韧带/圆韧带透明细胞肌黑色素细胞性肿瘤,以及发生于腹腔、盆腔、消化道、泌尿生殖道、周围软组织和皮肤等部位、不能归入上述几种特殊类型的一些透明细胞肿瘤。组织学上,肿瘤细胞主要由圆形和多角形上皮样细胞组成,排列成条索、巢状,局部可见肿瘤细胞围绕血管周围排列。本病特征是瘤细胞同时表达黑色素细胞标志和肌细胞标志。恶性血管周上皮样细胞肿瘤须符合下列 2项或以上标准:肿瘤直径>5 cm,呈浸润性生长,高的核分级和细胞密度,核分裂象≥1/50高倍视野,凝固性坏死,血管侵犯。良性血管周上皮样细胞肿瘤直径<5 cm,且无其他组织学异常。本病女性多见,多数缺乏临床症状。
本例腹膜后软组织肿块密度不均匀,可见钙化,大小5.0 cm×10.1 cm,包绕腹主动脉、下腔静脉生长,伴肝、双肾上腺、盆壁软组织及L2椎体转移,为恶性肿瘤。右肾体积增大,呈弥漫性侵犯,密度不均匀,可见钙化,增强扫描呈不均匀强化,强化程度与腹膜后肿块一致。
本病需与以下疾病鉴别:①原发性肾癌,一般较局限,即使肿瘤巨大,亦可见部分正常肾组织,以及肿瘤侵蚀肾组织的交界面,本例未见正常肾组织,与肾癌表现不一致。临床上肾癌常有腹痛、腹部包块、血尿等症状。恶性血管周上皮样细胞肿瘤临床上常无症状。本例因左上肢麻木1个月入院。②腹膜后纤维化,表现为位于肾门和腹主动脉分叉水平间的纤维斑块,以腹主动脉为中心,多位于其前方或两侧,背侧很少累及,多不向主动脉后方生长。恶性血管周上皮样细胞肿瘤则常包绕腹主动脉、下腔静脉生长,血管前后及两侧均有肿瘤生长。③腹腔间质瘤,多来源于腹膜或肠系膜,病灶大多为实性,可囊变,较局限,有明显边界,亦可多发,但很少包绕血管生长。
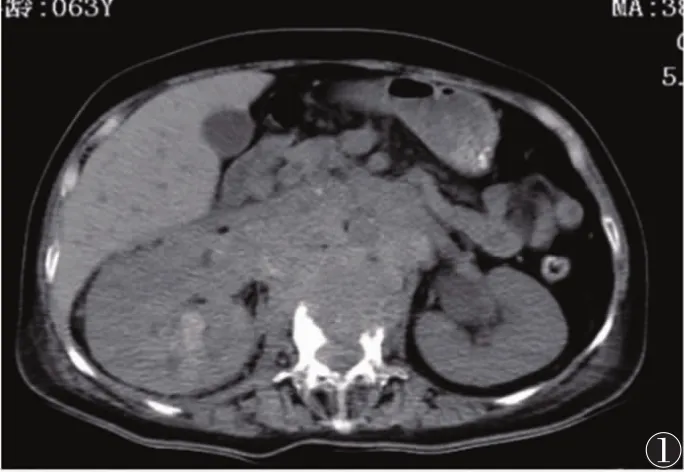
图1~7 女,64岁 图1 CT平扫示腹膜后不规则软组织肿块,密度不均匀,可见斑点、斑片状高密度影,界限不清。右肾增大,密度不均匀。L2椎体不规则骨质破坏
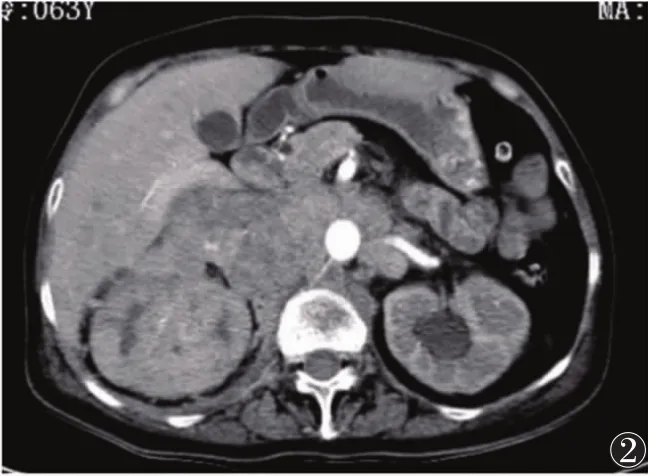
图2 CT增强扫描动脉期腹膜后软组织肿块及右肾不均匀强化
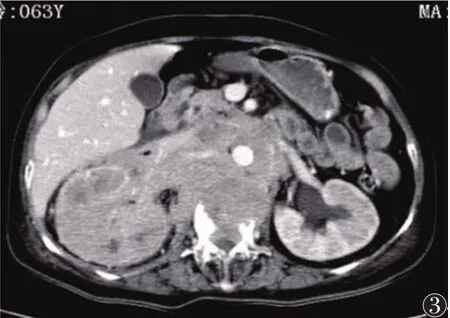
图3 静脉期腹膜后病灶包绕腹主动脉、下腔静脉、右肾动静脉
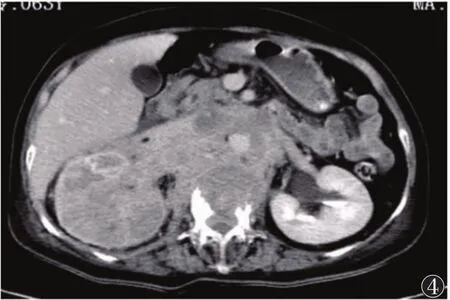
图4 延迟扫描病灶密度稍减低
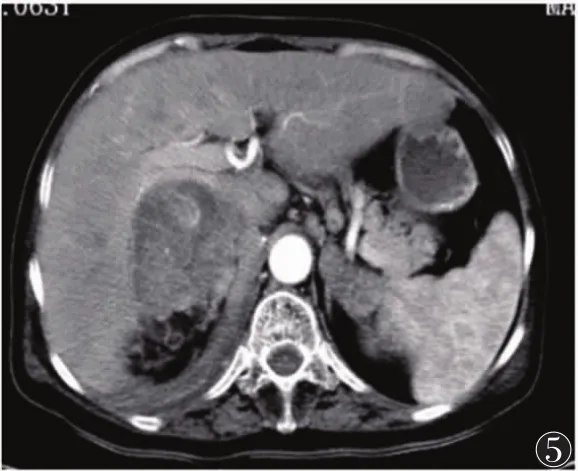
图5 肝左外叶结节样等低密度病灶,边界欠清,双肾上腺区结节样软组织肿块
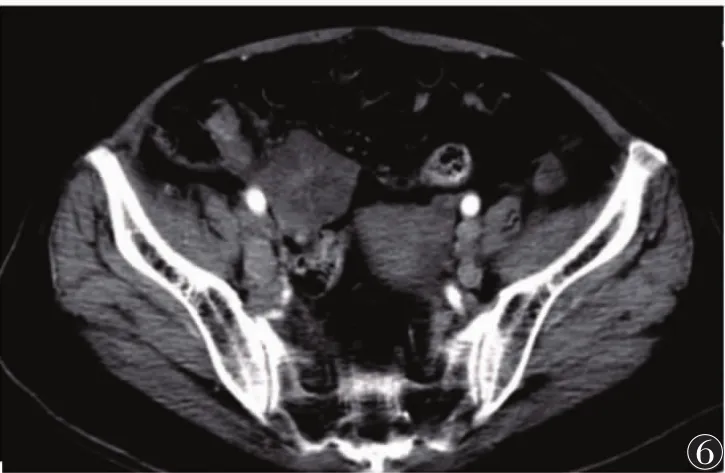
图6 双侧盆壁结节样软组织影
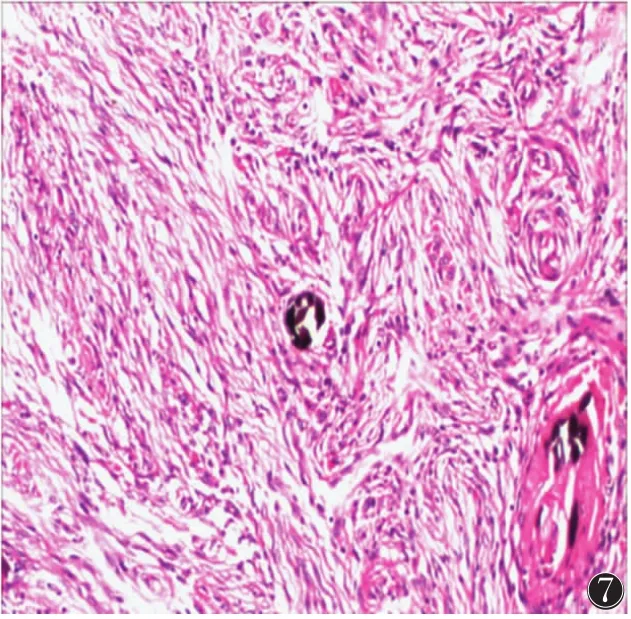
图7 病理检查示腹膜后恶性血管周上皮样细胞肿瘤(HE 10×10)
总之,腹膜后肿块,密度不均匀,可见斑点、斑片状钙化,包绕腹主动脉、下腔静脉生长,排除肾癌、腹膜后纤维化、腹腔间质瘤等,应考虑恶性血管周上皮样细胞肿瘤的诊断。
[1]蔡俊娜,施旻,王坚.肺特殊性血管周上皮样细胞肿瘤31例的病理学观察[J].中华病理学杂志,2011,40(4):241-243.
[2]Zamboni C,Pea M,Martignoni G,et al.Clear cell“sugar”tumor of the pancreas.A novel member of the family of lesions characterized by the presence of perivescular epithelioid cells[J].Am J Surg Pathol,1996,20:722-730.
[3]李燕,石怀银,韦立新.4例胃肠道血管周上皮样细胞肿瘤临床病理学分析[J].临床与实验病理学杂志,2009,25(1):58-61.
[4]Martignoni G,Pea M,Reghellin D,et al.PEComas:the past,the present and the future[J].Virchows Arch,2008,452:119-132.
[5]Gong QX,Fan QH.Neoplasms with perivascular epithelioid differentiation[J].Zhonghua Bing Li Xue Za Zhi,2010,39:205.
[6]Armah HB,Parwani AV.Perivascular epithelioid cell tumor[J]. Arch Pathol Lab Med,2009,133:648-654.
[7]Folpe AL,Mentzel T,Lhr HA,et al.Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin:a clinicopathologic study of 26 cases and review of the literature[J].Am J Surg Pathol,2005,29:1558-1575.
[8]Bonetti F,Martignoni G,Colato C,et al.Abdomnopelvic sarcoma of perivascular epithelioid cells.Report of four cases in young women.one with tuberous sclerosis[J].Mod Pathol,2001,14:563-568.
[9]Hornick JL,Fletcher CD.Sclerosing PEComa:clinicopathologic analysis of a distinctive variant with a predilection for the retroperitoneum[J].Am J Surg Pathol,2008,32:493-501.
[10]Italiano A,Delcambre C,Hostein I,et al.Treatment with the mTOR inhibitor temsirolimus in patients with malignant PEC-oma[J].Ann Oncol,2010,21:1135-1137.
