汽车尾气暴露对小鼠运动力竭时间的影响
2018-01-29樊磊曹继军张英杰刘颖张治然袭荣刚王晓波
樊磊,曹继军,张英杰,刘颖,张治然,袭荣刚,王晓波,*
1. 中国人民解放军第210医院药学部,大连 116021 2. 辽东学院,丹东 118001
随着经济的发展,环境污染已成为社会发展和人民健康水平提高的制约因素,特别是大气污染带来的健康问题已日益严峻。大气污染物成分复杂,随着汽车保有量的增加,汽车尾气污染已逐渐代替工业废气污染,成为我国城市大气污染的首要因素[1]。汽车尾气中的主要污染物为碳氢化合物、氮氧化合物、一氧化碳、二氧化硫、含铅化合物、苯并芘及固体颗粒物等[2]。据研究显示,在英国,每年由汽车尾气污染造成的死亡人数是车祸死亡人数的2倍以上[3],汽车尾气与心血管系统疾病,呼吸系统疾病,神经系统损伤以及生殖功能下降的相关性已得到越来越多的实验证实。严超等[4]通过气管滴注的方式将大鼠长期暴露于汽车尾气来源的可吸入颗粒物中,发现汽车尾气中的颗粒物可引起大鼠体重降低,肺脏及心脏组织结构受损,肝脏、脾脏及肾脏出现炎症反应。杨伟等[5]利用构建汽车尾气暴露装置,发现汽车尾气持续暴露可损伤雄性小鼠的生精组织及功能,且该作用与体内氧化水平改变有关。张遵真等[6]发现汽油机尾气可诱导A549细胞DNA氧化损伤,提示汽油机尾气具有明显的细胞毒性。虽然社会对汽车尾气的危害高度重视,但目前对汽车尾气致生物体损伤的研究报道较少,其原因主要是汽车尾气成分复杂,缺乏较为可靠的尾气染毒模型及评价指标,本课题组在构建汽车尾气动物整体染毒装置的基础上,通过研究汽车尾气暴露对小鼠运动力竭时间的影响,探讨汽车尾气对机体的损伤机制,以期为汽车尾气致生物体损伤的医学防治提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验动物及分组
SPF级昆明种小鼠24只,8~10周龄,体质量20~25 g,雌雄各半,购自辽宁省实验动物中心(合格证号:雄鼠211002300011604,雌鼠211002300011605)。将小鼠分笼饲养,环境温度20~25 ℃,相对湿度55%~65%,昼夜交替,适应性饲养一周后,按随机数字表法分为正常对照组,汽车尾气短时间暴露(4 h·d-1)组和汽车尾气长时间暴露(8 h·d-1)组,每组8只。
1.2 主要实验仪器与试剂
玻璃染毒柜,主要由尾气进气口、排风口、空气循环风扇、126型激光空气质量检测仪(北京博朗通医疗科技有限公司)和希玛AR8100氧浓度监测仪(香港希玛科技有限公司)组成。汽车尾气来源于丰田牌小汽车(型号Previa,行使里程80 000 km,排量2.4 L),使用92号乙醇无铅汽油(中国石油公司大连分公司)。YLS-10B转轮式疲劳仪(山东医学科学院),Antos2010酶标仪(郑州安图生物工程有限公司),正置显微镜(日本Olympus公司)。还原型谷胱甘肽(GSH)、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)测定试剂盒(南京建成生物工程研究所)。白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α) 酶联免疫吸附检测(ELISA)试剂盒(美国BioLegend公司)。
1.3 汽车尾气持续暴露条件的建立
将汽车怠速状态下排出的气体经软管通入染毒装置内(1.5 m ×1.5 m ×1.2 m ),根据预实验测得的装置内空气条件,每次通入尾气180 s后关闭发动机,暂停30 min后再次通入汽车尾气180 s。根据实验分组,每日将小鼠分别暴露于汽车尾气中 4 h和8 h,连续暴露30 d。在尾气暴露过程中监测装置内的O2浓度以及直径小于等于1.0 μm的颗粒物(PM1.0)、直径小于等于2.5 μm的颗粒物(PM2.5)和直径小于等于10 μm的颗粒物(PM10)浓度。
1.4 运动力竭时间的测定
在实验正式开始前,对小鼠进行转轮奔跑适应性训练,每次训练30 min(转轮条件设定:转速15 r·min-1,电击耐受时间5 s,刺激电流2 mA,难度系数按1~3逐渐增加)。连续训练10 d后将小鼠放入转轮式疲劳仪中进行运动力竭测试,测试条件为:转速20 r·min-1,电击耐受时间5 s,刺激电流2 mA,难度系数3;力竭状态设置标准:休息时间30 s·次-1,10 min内休息5次判定为力竭[7]。在汽车尾气暴露结束后1 d,依照上述条件再次测定受试小鼠的运动力竭时间。
1.5 血液红细胞参数和生化指标测定
在小鼠运动力竭测定结束后,立刻摘除眼球取血。由于小鼠血液量较少,采用血浆稀释液稀释100 μL血浆,用于红细胞和血红蛋白含量测定。另一份低速离心(1 000 g, 10 min)制备血清,用于谷胱甘肽(GSH)、丙二醛(MDA)和超氧化物歧化酶(SOD)含量测定。
1.6 肺泡灌洗液的收集及分析
取血结束后脱颈处死小鼠,暴露颈部气管,结扎气管远心端后剪开胸腔,暴露双侧肺脏,结扎一侧肺支气管,该侧肺用于组织病理检查取样;未结扎的一侧肺通过刺入主气管的24 G留置针灌入0.5 mL预冷的生理盐溶液,反复灌洗3~4次,收集支气管-肺泡灌洗液(BALF),1 200 g低温离心20 min,留取上清液, 采用ELISA方法检测上清中细胞因子IL-1β、IL-6和TNF-α水平。用1 mL含有1% BSA的PBS重悬BALF中的细胞沉淀,取10 μL重悬液进行细胞计数。余液再次离心后弃上清,将细胞沉淀涂片后用瑞氏法染色并进行细胞分类计数。
1.7 肺脏组织病理学观察
取未灌洗一侧肺脏,用10%福尔马林溶液固定,石蜡包埋。包埋蜡块用切片机制成4 μm组织切片,苏木精-伊红(HE)染色,在光学显微镜下观察肺组织的病理改变。
1.8 统计学方法
2 结果(Results)
2.1 汽车尾气染毒模型的构建
在预实验中,向染毒柜内连续通入汽车尾气6 min,可导致大部分小鼠死亡,死亡原因为一氧化碳中毒。将汽车尾气通入时间设定为180 s,小鼠出现较为明显的躁动,但再无死亡现象。故为了保证实验连续性和有效性,将每次尾气通入时间设定为180 s。在向装置内通入尾气180 s时关闭汽车发动机,测定装置内可吸入颗粒物PM1.0、PM2.5和PM10的值,同时测定氧浓度,结果如表1所示。根据测定结果,将通入尾气的时间间隔设置为30 min。
2.2 汽车尾气暴露对小鼠运动力竭时间的影响
在汽车尾气暴露前,首先检测各组小鼠的运动力竭时间,结果无显著差异。在连续30 d汽车尾气暴露结束后第2天,再次检测各组小鼠的运动力竭时间,结果如表2所示。与汽车尾气暴露前相比,汽车尾气可显著降低小鼠的运动力竭时间,其中8 h·d-1组小鼠的运动力竭时间较4 h·d-1组明显缩短(P<0.05)。与正常对照组相比,2个汽车尾气暴露组的运动力竭时间明显较短,其中8 h·d-1组小鼠的运动力竭时间最短。结果表明,汽车尾气暴露可明显影响小鼠的运动能力。

表1 汽车尾气通气结束后装置内PM和氧浓度值Table 1 The PM and oxygen concentration in the device after vehicle exhaust emission (± s, n=3)
注:PM是颗粒物,指空气中的固体或液体颗粒状物质。
Note: PM stands for particulate matter, a small discrete mass of solid or liquid matter that remains individually dispersed in air.
2.3 汽车尾气暴露对小鼠红细胞数和血红蛋白含量的影响
由表3可见,汽车尾气长时间暴露可引起小鼠红细胞数增高,其中8 h·d-1组血红蛋白浓度较正常对照组明显升高(P<0.05);而4 h·d-1组小鼠红细胞数和血红蛋白浓度较正常对照组无明显差异。
2.4 汽车尾气暴露对小鼠血清中GSH,MDA和SOD的影响
与正常对照组相比,汽车尾气暴露后小鼠血清中的抗氧化物质GSH和SOD含量均有不同程度降低,其中8 h·d-1组血清中抗氧化物质减少最为显著(P<0.05)。汽车尾气暴露可增加小鼠血清中脂质过氧化终产物MDA的含量(P<0.05)。结果见表4。
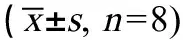
表2 汽车尾气暴露对小鼠运动力竭时间的影响Table 2 Effect of vehicle exhaust exposure on the running exhausting time of mice (±s, n=8)
注:aP<0.05 vs. 正常对照组;bP<0.05 vs. 短时间暴露组;cP<0.05 vs. 暴露前。
Note:aP<0.05 vs. Control group;bP<0.05 vs. Short time exposure group;cP<0.05 vs. Before exposure.
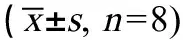
表3 汽车尾气暴露对小鼠红细胞计数和血红蛋白浓度的影响Table 3 Effect of vehicle exhaust exposure on RBC count and HGB of mice (±s, n=8)
注:aP<0.05 vs. 正常对照组;bP<0.05 vs. 短时间暴露组;RBC,红细胞计数;HGB,血红蛋白浓度。
Note:aP<0.05 vs. Control group;bP<0.05 vs. Short time exposure group; RBC, red blood cell; HGB, hemoglobin.

表4 汽车尾气暴露对小鼠血清中GSH、SOD活性和MDA含量的影响Table 4 Effect of vehicle exhaust exposure on GSH, SOD activities and MDA content in the serum of mice (± s, n=8)
注:aP<0.05 vs. 正常对照组;bP<0.05 vs. 短时间暴露组。
Note:aP<0.05 vs. Control group;bP<0.05 vs. Short time exposure group.
2.5 汽车尾气暴露对小鼠BALF中细胞因子浓度的影响
如表5所示,与正常对照组相比,汽车尾气暴露组BALF中的炎症性细胞因子IL-1β,IL-6和TNF-α的含量均有不同程度升高,其中8 h·d-1组细胞因子浓度升高最为显著(P<0.05)。
2.6 肺泡灌洗液中白细胞计数及分类比较
细胞涂片计数结果显示,8 h·d-1组肺泡灌洗液中的白细胞计数较正常对照组和4 h·d-1组明显升高(P<0.05)。其中,细胞涂片可见中性粒细胞百分比明显升高(P<0.05)。
2.7 小鼠肺脏组织形态学变化
通过对肺组织切片HE染色后观察可见,汽车尾气暴露组肺泡间隔较正常对照组增厚,肺支气管黏膜层中可见较多中性粒细胞和淋巴细胞浸润,管腔内有较多含中性粒细胞的黏液。结果如图1所示。
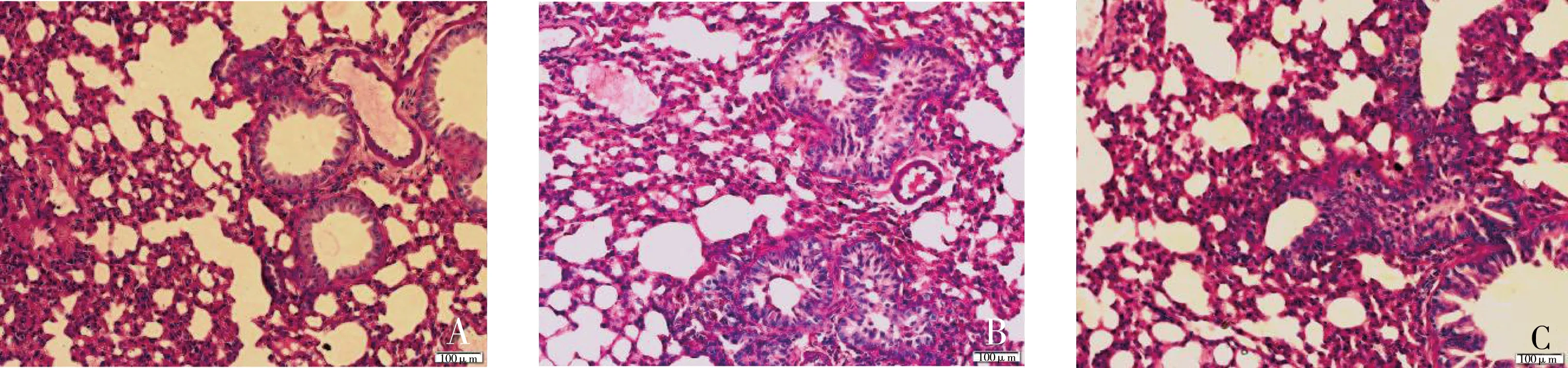
图1 汽车尾气暴露对小鼠肺组织结构的影响(HE, ×400)注:A,正常对照组;B,短时间暴露组;C,长时间暴露组;图中标尺为100 μm。Fig. 1 The effect of vehicle exhaust exposure on the structure of mice lung tissue (HE, ×400)Note: A, Control group; B, Short time exposure group; C, Long time exposure group; the scale bars are 100 μm.
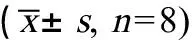
表5 汽车尾气暴露对小鼠BALF中炎症细胞因子水平的影响Table 5 Effect of vehicle exhaust exposure on inflammation cytokine in the BALF of mice (± s, n=8)
注:aP<0.05 vs. 正常对照组;bP<0.05 vs. 短时间暴露组。
Note:aP<0.05 vs. Control group;bP<0.05 vs. Short time exposure group.

表6 汽车尾气对小鼠BALF中白细胞总数和中性粒细胞百分比的影响Table 6 Effect of vehicle exhaust exposure on the WBC and percentage of neutrophilic granulocyte
注:aP<0.05 vs. 正常对照组;bP<0.05 vs. 短时间暴露组;WBC,白细胞计数。
Note:aP<0.05 vs. Control group;bP<0.05 vs. Short time exposure group; WBC, White blood cell.
3 讨论(Discussion)
随着汽车工业水平的提高,汽车尾气中有害物质的排放已得到较好的控制,但由于汽车保有量的剧增和人们对健康重视程度的增加,汽车尾气对健康的危害及其防治方法再次成为研究的热点。流行病学及基础研究结果均表明,长期暴露于汽车尾气中可对机体造成不可逆性的系统性损伤,主要累及呼吸系统[8]、心血管系统[9]和神经系统[10]。为进一步研究汽车尾气对机体的损伤机制,进而探索防治方法,本课题组建立了汽车尾气染毒装置。目前常用的空气污染物染毒实验方法主要包括:经气管或者咽后壁滴注收集的空气颗粒物[11]、将收集到的汽车尾气颗粒物通过超声波雾化的方法使动物吸入[8]、直接将动物暴露于污染物浓度较大的环境中[12]等方法,各种方法的实验周期和效果差异较大。通过预实验的探索和调整,本实验中采用的汽车尾气染毒装置可以较为真实稳定地模拟环境中的尾气条件,为实验的可重复性奠定了基础。
运动能力是机体功能的综合体现,运动力竭时间是反映动物运动能力的常用指标[13]。本实验发现,长时间暴露于汽车尾气环境中,小鼠的运动力竭时间与暴露前和与正常对照组相比均明显缩短,表明该汽车尾气染毒模型可在较短时间内对小鼠机能产生明显影响。为进一步探究汽车尾气暴露对小鼠机体的损伤机制,本研究对汽车尾气暴露后小鼠红细胞、肺脏和血清相关指标进行了检测。
汽车尾气成分复杂,主要包括多环芳烃、碳黑、氮氧化物、硝酸盐、二氧化硫、硫酸盐等。硫酸盐、硝酸盐和碳黑是构成PM2.5的主要成分,而PM2.5则是城市大气污染物中的主要成分[14]。大气中颗粒物直径是决定颗粒物健康威胁程度的主要因素,直径10 μm左右的颗粒物通常沉积在上呼吸道,2.5 μm以下的可深入到细支气管和肺泡[15]。细颗粒物进入肺泡后,可直接影响肺的通气功能,使机体处于缺氧状态。本实验发现,汽车尾气长时间暴露组小鼠的红细胞数和血红蛋白含量较正常组明显升高,可能与其持续处于慢性缺氧状态有关。
本研究还显示,汽车尾气暴露组小鼠BALF中炎症相关细胞因子IL-1β、IL-6和TNF-α水平均显著高于正常对照组,此结果与陈轶等[16]研究汽车尾气污染对小鼠血清炎症因子影响的结果相一致,长期暴露于汽车尾气环境中,可导致机体炎症因子水平显著升高,其机制可能与气态污染物损伤呼吸道黏膜上皮细胞[17],以及PM2.5上黏附的过渡金属刺激有关[15]。细胞因子IL-1β、IL-6和TNF-α均参与中性粒细胞的激活和黏附[18],在对BALF中细胞分析后发现,汽车尾气长时间暴露组BALF中的白细胞数以及中性粒细胞百分比较正常对照组明显升高,中性粒细胞由骨髓造血干细胞分化而来,在正常情况下,中性粒细胞主要存在于外周血中,当局部有病原体入侵时,中性粒细胞就会被招募到入侵部位杀伤病原体[19]。BALF中性粒细胞比例升高可能与汽车尾气造成呼吸道黏膜上皮细胞损伤进而引起病原菌入侵有关。同时,我们观察到8 h·d-1组小鼠肺脏组织结构发生了一定的病理改变,包括肺泡壁变厚,中性粒细胞及淋巴细胞浸润支气管黏膜层等,表明长时间的汽车尾气暴露可对肺脏组织结构产生损伤,小鼠运动力竭时间减少可能与其肺脏损伤有关。但我们也观察到:虽然4 h·d-1组小鼠运动力竭时间较正常组明显缩短,小鼠肺内的炎症水平与正常对照组相比并无明显差异,肺脏组织结构也无明显病理改变,表明汽车尾气造成的肺损伤不是影响小鼠运动能力的唯一因素。
机体持续处于氧化应激状态是大气颗粒物对机体造成损伤的机制之一,大气中的颗粒物通过肺进入机体后,可通过氧化应激产生大量的自由基对组织造成损伤,其中附着在颗粒物上的过渡金属在组织局部释放浓度较高的金属离子是自由基产生的主要因素[20];长时间运动后机体也可产生大量自由基,具体机制是长时间运动导致机体能量需求量增加,组织细胞有氧代谢率显著提高,需要红细胞提供大量氧分子,红细胞氧运输速率的增加导致氧自由基的产生几率显著增加[21],氧自由基与细胞膜上的多不饱和脂肪酸反应可形成具有细胞毒性的脂质过氧化物,MDA是膜脂过氧化最重要的产物之一,它的产生还能加剧细胞膜的损伤。本实验发现,汽车尾气暴露组小鼠血清中的MDA含量与正常对照组小鼠相比明显增加。分析原因可能是由于汽车尾气暴露导致体内氧自由基积累增多,随后的力竭运动导致体内的氧自由基产生量进一步增加,机体抗氧化能力由于之前尾气连续作用已不足以对抗新增加的氧自由基,从而导致小鼠体内氧化与抗氧化平衡被打破,运动能力显著下降。SOD和GSH是机体重要的抗氧化物质,在清除氧自由基中起关键作用,本实验发现汽车尾气暴露组小鼠体内的SOD和GSH量较正常对照组均明显减少,提示可能与氧自由基持续增多,进而导致抗氧化物质过量消耗有关。综上所述,汽车尾气可通过损伤肺脏功能和增加机体氧化应激压力对小鼠的运动功能产生影响。本研究中使用的汽车尾气染毒装置和染毒方法,为进一步深入研究创造了条件,利用小鼠运动力竭时间判断整体机能状况可作为实验性汽车尾气致机体损伤的评价指标。
[1] Wang J, Ho S S, Ma S, et al. Characterization of PM2.5 in Guangzhou, China: Uses of organic markers for supporting source apportionment [J]. Science of the Total Environment, 2016, 550: 961-971
[2] Keyte I J, Albinet A, Harrison R M. On-road traffic emissions of polycyclic aromatic hydrocarbons and their oxy- and nitro- derivative compounds measured in road tunnel environments [J]. Science of the Total Environment, 2016, 566-567: 1131-1142
[3] Yim Steve H L, Barrett Steven R H. Public health impacts of combustion emissions in the United Kingdom [J]. Environmental Science and Technology, 2012, 46(8): 4291-4296
[4] 严超, 曹希宁, 沈炼桔, 等. 汽车尾气来源PM 2.5长期暴露导致大鼠多器官损害[J]. 重庆医科大学学报, 2015, 40(6): 845-849
Yan C,Cao X N,Shen L J, et al. Long exposure to automobile exhaust source PM 2.5 leads to inflammatory injury of multiple organs in SD rats [J]. Journal of Chongqing Medical University, 2015, 40(6): 845-849 (in Chinese)
[5] 杨伟, 姚基伟, 丁杰, 等. 汽车尾气持续暴露致雄性小鼠生精功能损伤模型的建立和评估 [J]. 第三军医大学学报, 2015, 37(24): 2425-2427
Yang W,Yao J W, Ding J, et al. Mice model of impaired production in sperm induced by continuous exposure to automobile exhaust:Establishment and evaluation [J]. Journal of Third Military Medical University, 2015, 37(24): 2425-2427 (in Chinese)
[6] 张遵真, 吴媚, 张浩, 等. 汽油尾气对人肺腺癌 A549细胞的氧化损伤效应研究[J]. 生态毒理学报, 2006, 1(1): 25-29
Zhang Z Z, Wu M, Zhang H, et al. Oxidative damage induced by extract from gasoline-fueled vehicle emissions in human lung adenocarcinoma A549 cells [J]. Asian Journal of Ecotoxicology, 2006, 1(1): 25-29 (in Chinese)
[7] 王晓波, 袭荣刚, 姚文, 等. 耐力胶囊抗疲劳耐缺氧作用的实验研究[J]. 解放军药学学报, 2011, 27(2): 122-123, 127
Wang X B, Xi R G, Yao W, et al. The effect of NaiLi capsule on the antifatigue property and oxygen deficit-tolerance in mice [J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2011, 27(2): 122-123, 127 (in Chinese)
[8] Kim B G, Lee P H, Lee S H, et al. Long-term effects of diesel exhaust particles on airway inflammation and remodeling in a mouse model [J]. Allergy Asthma Immunology Research, 2016, 8(3): 246-256
[9] Kajbafzadeh M, Brauer M, Karlen B, et al. The impacts of traffic-related and woodsmoke particulate matter on measures of cardiovascular health: A HEPA filter intervention study [J]. Occupational and Environmental Medicine, 2015, 72(6): 394-400
[10] Kicinski M, Vermeir G, Van Larebeke N, et al. Neurobehavioral performance in adolescents is inversely associated with traffic exposure [J]. Environment International, 2015, 75: 136-143
[11] Li Q, Liu H, Alattar M, et al. The preferential accumulation of heavy metals in different tissues following frequent respiratory exposure to PM2.5in rats [J]. Scientific Reports, 2015, 5: 16936
[12] Aragon M J, Chrobak I, Brower J, et al. Inflammatory and vasoactive effects of serum following inhalation of varied complex mixtures [J]. Cardiovascular Toxicology, 2016, 16(2): 163-171
[13] 高丽杰, 杨丽君, 黄志强. 丹参总提物抗运动性疲劳作用研究[J]. 中国中医基础医学杂志, 2011, 17(9): 963-966
Gao L J, Yang L J, Huang Z Q. Effect of total extracts fromSalviamiltiorrhizaon sports fatigue[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2011, 17(9): 963-966 (in Chinese)
[14] Kang C M, Koutrakis P, Suh H H. Hourly measurements of fine particulate sulfate and carbon aerosols at the Harvard-U.S. Environmental Protection Agency Supersite in Boston [J]. Journal of the Air & Waste Management Association, 2010, 60(11): 1327-1334
[15] Wang G, Huang L, Gao S, et al. Measurements of PM10 and PM2.5 in urban area of Nanjing, China and the assessment of pulmonary deposition of particle mass [J]. Chemosphere, 2002, 48(7): 689-695
[16] 陈轶, 陈志斌, 詹鹃铭, 等. 地下停车场汽车尾气污染对小鼠血清炎症因子影响的研究[J]. 中国中西医结合急救杂志, 2013, 20(6): 353-354
Chen Y, Chen Z B, Zhan J M, et al. A study on effect of automobile exhaust pollutants in under ground parking area on serum inflammatory cytokines of mice [J]. Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care, 2013, 20(6): 353-354 (in Chinese)
[17] Risom L, Moller P, Loft S. Oxidative stress-induced DNA damage by particulate air pollution [J]. Mutation Research, 2005, 592(1-2): 119-137
[18] Villar A, Munoz X, Sanchez-Vidaurre S, et al. Bronchial inflammation in hypersensitivity pneumonitis after antigen-specific inhalation challenge [J]. Respirology, 2014, 19(6): 891-899
[19] Maugeri N, Manfredi A A. Tissue factor expressed by neutrophils: Another piece in the vascular inflammation puzzle [J]. Seminars in Thrombosis and Hemostasis, 2015, 41(7): 728-736
[20] Ghio A J, Devlin R B. Inflammatory lung injury after bronchial instillation of air pollution particles [J]. American Journal of Respiratory and Critical Care Medicine, 2001, 164(4): 704-708
[21] Strasser B, Geiger D, Schauer M, et al. Effects of exhaustive aerobic exercise on tryptophan-kynurenine metabolism in trained athletes [J]. PLoS One, 2016, 11(4): e0153617
