5种不同晶型的纳米二氧化钛对金属铜生物积累的影响
2018-01-29范文宏曾佩卢惠婷刘莹莹李晓敏
范文宏,曾佩,卢惠婷,刘莹莹,李晓敏
北京航空航天大学空间与环境学院, 北京 100191
二氧化钛纳米颗粒是目前使用最为广泛的纳米材料之一[1]。2006年,仅在美国就生产了4万t纳米二氧化钛(nTiO2)[2]。在生产、运输和应用过程中,这些纳米材料会进入环境,通过污(废水)排放、地表径流等方式[3],也不可避免地会进入水环境中,必然会对其中的水生生物产生影响[4-5]。
有文献指出,nTiO2本身毒性不大,对水生生物的半致死浓度大于100 mg·L-1 [6]。常见的nTiO2环境浓度为0.7~16 μg· L-1 [7]。但是进入水体的nTiO2会与水体中其他物质发生复杂反应[8],会影响其他污染物的环境行为和生态毒性。相关研究报道了nTiO2对重金属、有机污染物生物毒性的影响。Zhang等[9]研究发现nTiO2存在会增强鲤鱼体内镉(Cd2+)的生物蓄积。Zhu等[10]研究表明nTiO2会增强三丁基锡的水生生物毒性。重金属不但污染水环境,也严重威胁人类和水生生物的生存。目前,已有大量关于重金属离子对水生生物的毒性研究[11-12]。铜离子(Cu2+)是常见的重金属之一,然而,目前二氧化钛对铜的影响研究仍然较为缺乏。
研究表明,二氧化钛对金属毒性的影响与二氧化钛本身性质有关[13]。Hartmann等[14]研究不同粒径nTiO2与Cd2+对绿藻的联合毒性时发现,30 nm的nTiO2与Cd2+联合暴露对绿藻的毒性效应要大于Cd单独存在时。Rosenfeldt等[15]研究发现nTiO2对重金属银、砷、铜的毒性影响与nTiO2的表面性质有关。二氧化钛有3种自然晶型,其中应用最为广泛的是锐钛矿型和金红石型[16]。我们实验室制备了晶型百分比有序变化的nTiO2[6],研究了其对大型溞的急性毒性影响机制。
本实验研究了5种不同晶型nTiO2对铜的生物积累的影响,探索了 nTiO2的晶型对大型溞体内金属积累的影响机制,为纳米材料的生态环境风险安全评价提供参考依据。
1 材料与方法 (Material and methods)
1.1 nTiO2的制备与表征
nTiO2是实验室采用水热法(高温水解法)制备的锐钛矿、金红石2种材料,标记为A-S和R-S。不同比例的A-S和R-S经过物理方法均匀混合得到3种混合晶型,标记为M1、M2、M3,其中锐钛矿所占比例分别为80%、50%、20%,金红石所占比例分别为20%、50%、80%[6]。将5种nTiO2加入到超纯水(Millipore)中,震荡并在超声浴中超声30 min配制成nTiO2浓度为1 g·L-1的悬浮液,利用透射电子显微镜(TEM,JEM-2100F,日本)对5种nTiO2进行微观结构表征(图1),5种nTiO2的比表面积用BET方程计算得出[6]。
1.2 养殖用水和和暴露用水
养殖用水取自京密引水渠的颐和园段,定期监测水体中的TOC、pH值和金属元素。暴露用水采用简化的SM7配方水[17],其成分为CaCl2(293.8 mg·L-1)、 MgSO4(123.3 mg·L-1)、 K2HPO4(0.184 mg·L-1)、 KH2PO4(0.143 mg·L-1)、 NaNO3(0.274 mg·L-1)、 NaHCO3(64.8 mg·L-1)、 Na2SiO3(10 mg·L-1)、 H3BO3(0.715 mg·L-1) 和 KCl (5.8 mg·L-1),该配水的pH 值测得为 7.71±0.20。暴露之前利用SM7配方水将5种nTiO2悬浮液稀释到1 mg·L-1,并超声30 min以保持分散状态。
1.3 nTiO2对Cu2+的吸附实验
用SM7将 1 g·L-1Cu2+标准液稀释至Cu2+浓度为50 μg·L-1,加入适量1 g·L-1nTiO2悬浮液(5种材料各设3个平行样),使nTiO2溶液的浓度达到1 mg· L-1。将混合溶液放入25 ℃、100 r·min-1摇床中振荡,在吸附15、30、45、60、90、120、150、180、240、360 min 分别取4 mL样品,在12 000 ×g条件下离心10 min (在该高速离心下可以去除91.8%~95.0% nTiO2)[18], 分别取2 mL上清液于5 mL离心管中,加入 20 μL HNO3, 用ICP-MS测Cu2+浓度。nTiO2对Cu2+的吸附量可以通过吸附开始和吸附平衡后溶液中Cu2+浓度之差计算得到。
1.4 水生生物的培养与暴露
大型溞(Daphniamagna)为本实验室连续培养10年以上的单克隆品系,每只大型溞培养在至少10 mL过滤后的京密水中,培养温度为 23.5 ℃,光照周期为亮:暗=16 h:8 h,光照强度7 000 lux,每天喂食莱茵衣藻 (Chlamydomonasreinhardtii),每2天换一次水。正式实验之前,对6~24 h 的幼溞进行敏感性实验,重铬酸钾的24 h半数致死浓度(24 h-EC50) 在 0.5~2 mg·L-1范围内为满足毒性实验标准,方可用于正式实验(24 h-EC50为 0.75 mg·L-1)。实验前将出生14 d的大型溞放在SM7配方水中约2 h,以去除其肠道内食物的残留,同时适应新的实验环境。
大型溞的暴露在500 mL大烧杯内进行,分别放入健康的14 d大型溞各50 只,Cu2+浓度为50 μg·L-1,5种nTiO2的暴露浓度均为1 mg·L-1,分别进行有无nTiO2条件下的暴露,设3个平行样。暴露采用静态法,实验期间不换水,暴露时间均为48 h,暴露期间不取样。暴露结束后,从存活的大型溞中选择10只用于测定铜积累量和钛积累量,用超纯水冲洗3次,放入离心管中,在80 ℃下烘干至恒重,测量干重,将干燥恒重后的样品转移到消解管中,加入1 mL浓HNO3,消解至溶液澄清透明。加入1 mL硫酸和硫酸铵溶液,用适量2% HNO3溶液定容至10 mL,用ICP-MS测定样品中Cu和Ti的浓度,根据干重,计算大型溞体内铜和钛的积累量,用μg·g-1dry wt干重表示。
1.5 数据处理
运用SPSS 20.0统计软件,利用One-way Anova分析各种指标与对照组的差异显著性。P<0.05,则认为2个不同处理组之间存在显著性差异。
2 结果 (Results)
2.1 nTiO2的表征
图1为水中5种nTiO2的TEM图,可以看出5种TiO2都为纳米级材料,且都在水中发生了团聚作用。5种nTiO2(A-S、M1、M2、M3、R-S)的比表面积分别为32.2、45.3、38.4、36.6、32.4 m2·g-1[6]。
2.2 nTiO2对Cu2+的吸附
5种不同晶型nTiO2材料对水体中Cu2+的吸附如图2所示。根据上清液中Cu2+浓度的降低来确定nTiO2对Cu2+的吸附作用,可以看出,TiO2对水体中Cu2+的吸附过程很快,吸附30 min后就达到了吸附平衡,不同晶型nTiO2对Cu2+的吸附能力不同,nTiO2吸附Cu的能力大小:A-S > R-S > M2 > M3 >M1。锐钛矿吸附的Cu量最高,这可能与锐钛矿晶型的空间结构有关。相对于正交的金红石晶型,锐钛矿的八面体有严重的扭曲,进而导致其电子-空穴分离能力变强,含有较多的缺陷,包括一个表面羟基和一个化学吸附的水[19]。nTiO2的表面羟基可以和Cu2+发生交换作用从而吸附铜,因此A-S能更强地吸附Cu2+。
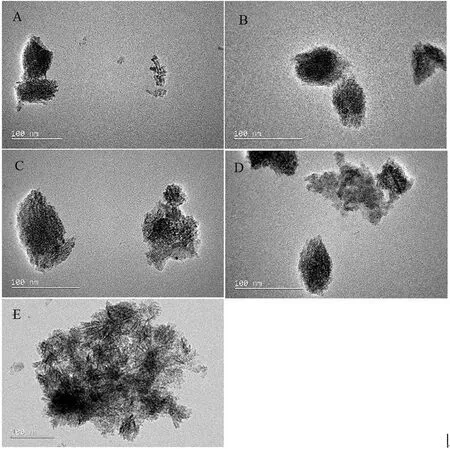
图1 5种nTiO2的TEM图注: (A) A-S, Anatase nTiO2; (B) M1, Anatase: Rutile=4:1 nTiO2; (C) M2, Anatase: Rutile=1:1 nTiO2; (D) M3, Anatase: Rutile=1:4 nTiO2, and (E) R-S, Rutile nTiO2.Fig. 1 TEM images of the morphological structure of the five nTiO2Note: (A) A-S, Anatase nTiO2; (B) M1, Anatase: Rutile=4:1 nTiO2; (C) M2, Anatase: Rutile=1:1 nTiO2; (D) M3, Anatase: Rutile=1:4 nTiO2, and (E) R-S, Rutile nTiO2.
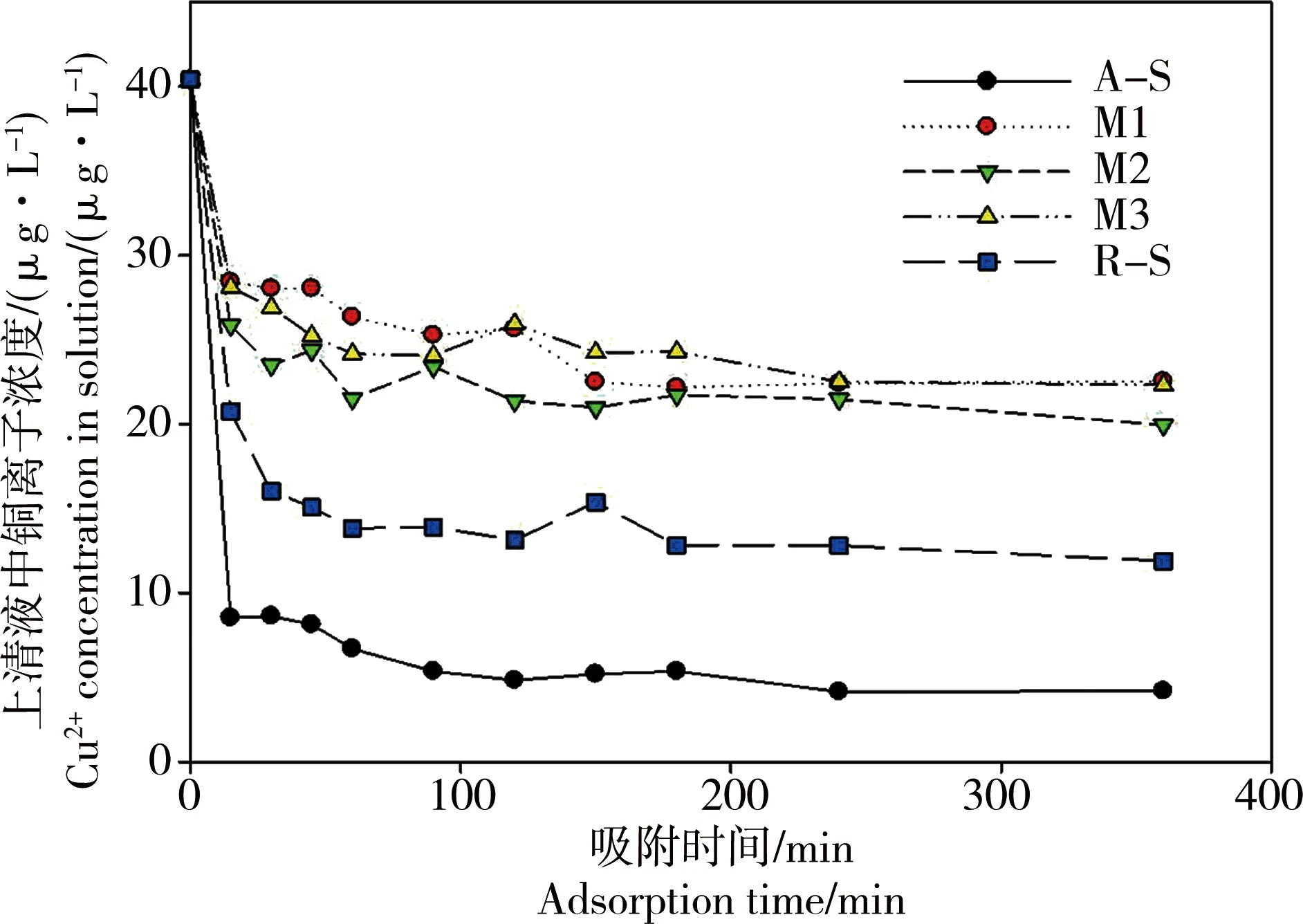
图2 5种不同晶型nTiO2材料对水体中Cu2+的吸附Fig. 2 Adsorption of Cu2+ onto TiO2 nanoparticles with different crystal forms
2.3 大型溞体内的金属积累
图3是大型溞暴露48 h后体内的Ti积累量和Cu积累量。图3(a)中,大型溞在仅含nTiO2的暴露液中具有较高的钛积累量,其中nTiO2摄入量最高的为A-S,相对于其他4种nTiO2,A-S可能更易进入或者聚集在大型溞体内。加入铜后nTiO2溶液中大型溞体内钛积累量显著降低。Rosenfeldt等[15]在研究nTiO2对砷的生物影响时也发现了类似的结果,并指出大型溞体内积累降低的原因是nTiO2对 As 的快速吸附以及聚集沉降等过程。类似的,本实验中Cu2+的加入可能加剧了nTiO2的团聚,以至于大型溞不能有效摄取这些nTiO2颗粒。图3(b)中,与单独铜暴露相比,M1和M2这2种nTiO2的存在使大型溞体内Cu积累量显著降低,这可能是由于受到金属铜积累影响后,大型溞的摄食速率降低,从而减少了对nTiO2颗粒的摄食。其他3种晶型nTiO2的存在对铜积累没有显著影响。
3 讨论 (Discussion)
3.1 大型溞体内的金属铜积累影响机制
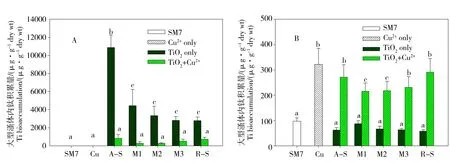
图3 大型溞体内Ti积累量(A)和Cu积累量(B)注:数据为平均值±标准方差(n=3),不同字母(a、b、c)代表组间具有显著差异。Fig. 3 The accumulation of Ti (A) and Cu (B)Note: the data were mean ± standard deviation (n = 3), different letters (a, b, c) represent significant differences between groups.

图4 nTiO2和Cu共存时大型溞体内铜积累量与nTiO2对Cu吸附量的相关关系(A);大型溞体内铜积累量与钛积累量的相关关系(B)Fig. 4 The relationship between Cu accumulation and Cu adsorption on nTiO2 in the coexistence of nTiO2 and Cu (A); the correlation between the Cu accumulation and Ti accumulation in D. magna (B)
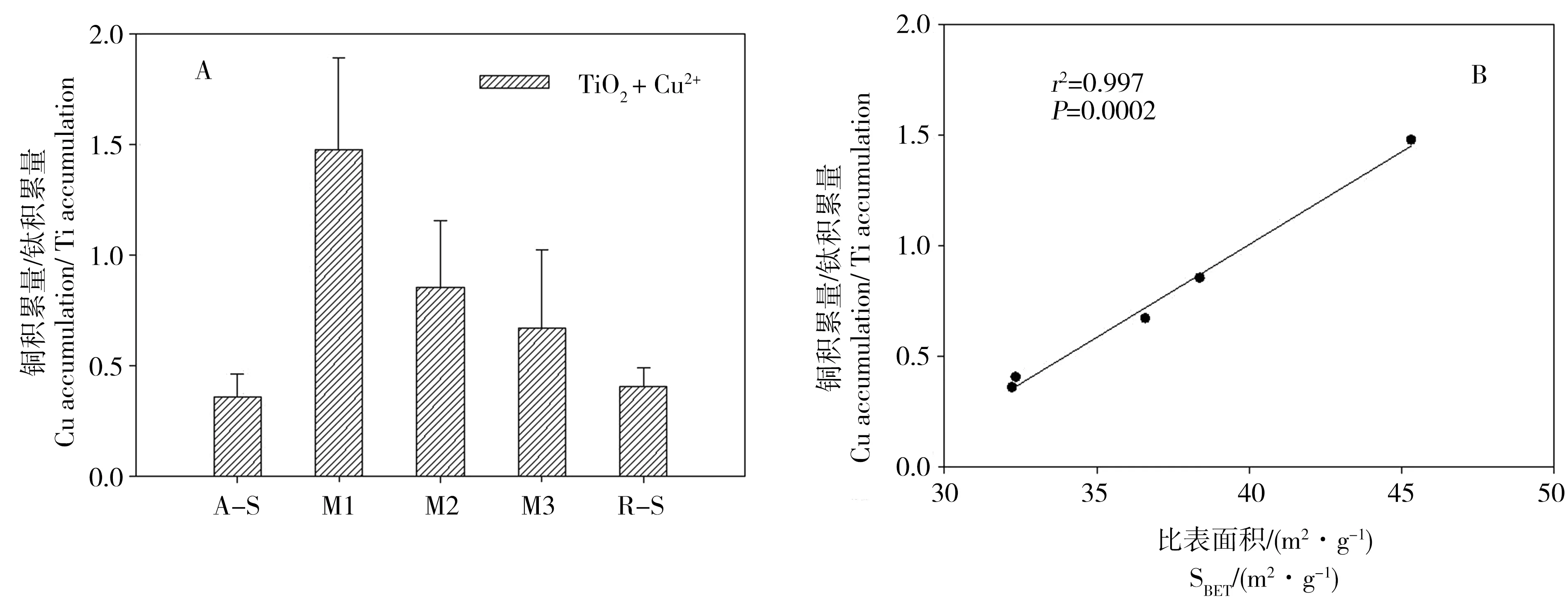
图5 大型溞体内单位钛积累量的铜积累量(A) ; nTiO2和Cu共存时大型溞体内单位钛积累量的铜积累量与nTiO2比表面积的相关关系(B) Fig. 5 Cu accumulation in unit Ti accumulation in D. magna (A); the relationship between Cu accumulation in unit Ti accumulation and of SBET of nTiO2 in the coexistence of nTiO2 and Cu (B)
为了深入研究大型溞体内金属的积累机制,我们分析了大型溞体内的金属积累量和二氧化钛对铜吸附量的关系,结果如图4所示。图4 (A)中大型溞体内 Cu积累量和吸附在nTiO2上的Cu量存在正相关关系(r=0.82,P< 0.1),即随着nTiO2吸附的Cu量增加,大型溞体内 Cu积累量也增加。这说明金属铜的积累和纳米材料对金属铜的吸附作用密切相关。大型溞体内金属铜的来源主要有2种,一个是自由离子铜,一个是纳米材料吸附的铜。当Cu与nTiO2共存时,nTiO2能吸附Cu2+,导致自由Cu2+浓度降低,降低Cu的生物积累。另一方面,大型溞能吞食吸附了Cu的nTiO2颗粒,这会增加Cu的生物积累。这两方面的原因都能导致大型溞不但能吸收水中的溶解性金属铜,同时也使一部分nTiO2结合的金属进入到生物体内[20]。
进一步分析了大型溞体内 Ti积累量和Cu积累量的关系,图4 (B)中发现二者之间存在显著的负相关关系 (r=0.68,P< 0.05),即Ti积累量越高,Cu积累量越低。这说明大型溞体内的Cu积累量不完全来源于nTiO2的吸附。类似地,Fan等[21]在研究中也发现nTiO2降低了Cu积累,并指出共存体系中nTiO2使大型溞体内Cu积累量显著降低的原因可能是纳米颗粒主要积累在大型溞的肠道内,阻碍铜的吸收,也可能对大型溞的肠道造成损伤,降低肠道细胞的功能。因此,nTiO2与铜共存时大型溞的体内钛积累可能会阻碍铜的生物积累。
3.2 不同晶型nTiO2对铜积累的影响
为了进一步比较不同晶型nTiO2对铜的影响,进行了归一化处理,计算了单位钛积累量引起的铜积累量,结果如图5所示,从图中可以看出5种nTiO2中单位钛积累量的铜积累量最高的是M1,其次为M2、M3、R-S,A-S最低。大型溞体内金属铜积累量的来源主要有自由离子铜和纳米材料吸附的铜2种。单位钛积累量一致时,大型溞体内的铜积累量是由于自由Cu2+在体内的富集,M1的单位钛积累量的铜积累量最高,原因可能是M1在大型溞体内积累对自由Cu2+进入大型溞的阻碍能力最小。
为探讨原因我们分析了单位钛积累量的铜积累量与5种nTiO2比表面积之间的关系,发现二者之间存在显著的正相关关系。类似的,Rosenfeldt等[22]在研究中发现nTiO2会减小Cu的毒性,可能是由于nTiO2比表面积和结构引起nTiO2对Cu的吸附以及聚集沉降作用。Ni等[23]在研究时也发现氧化石墨烯存在条件下减少了铜的积累量,并指出原因可能是氧化石墨烯表面含氧基团丰富,因而对重金属离子的吸附能力较强,并且氧化石墨烯较易发生团聚作用,因而降低了大型溞体内的铜富集量。因此,本实验中nTiO2的比表面积越大,nTiO2的表面含氧基团越多,nTiO2的羟基自由基(·OH)越易形成,从而nTiO2越易吸附铜离子,因此单位钛积累量的铜积累量越高。因此,5种不同晶型nTiO2对铜的水生生物毒积累降低的主要原因,是受到5种nTiO2比表面积的影响,而比表面积这种材料性质的差异主要是由于不同比例的锐钛矿和金红石的晶型结构差异导致的。
[1] Wiesenthal A, Hunter L, Wang S, et al. Nanoparticles: Small and mighty [J]. International Journal of Dermatology, 2011, 50(3): 247-254
[2] Robichaud C O, Uyar A E, Darby M R, et al. Estimates of upper bounds and trends in nano-TiO2production as a basis for exposure assessment [J]. Environmental Science and Technology, 2009, 43: 4227-4233
[3] 林道辉, 冀静, 田小利, 等. 纳米材料的环境行为与生物毒性[J]. 科学通报, 2009, 54(23): 3590-3604
[4] Zhang R, Bai Y, Zhang B, et al. The potential health risk of titania nanoparticles [J]. Journal of Hazardous Materials, 2012, 211: 404-413
[5] Baker T J, Tyler C R, Galloway T S. Impacts of metal and metal oxide nanoparticles on marine organisms [J]. Environmental Pollution, 2014, 186: 257-271
[6] Lu H, Fan W, Dong H, et al. Dependence of the irradiation conditions and crystalline phases of TiO2nanoparticles on their toxicity toDaphniamagna[J]. Environmental Science: Nano, 2017, 4: 406-414
[7] Mueller N C, Nowack B. Exposure modeling of engineered nanoparticles in the environment [J]. Environmental Science and Technology, 2008, 42(12): 4447-4453
[8] David B W, Robert A H, Carol F, et al. Development of a base set of toxicity tests using ultra fine TiO2particles as a component of nanoparticle risk management [J]. Toxicology Letters, 2007, 171: 99-110
[9] Zhang X Z, Sun H W, Zhang Z Y, et al. Enhanced bioaccumulation of cadmium in carp in the presence of titanium dioxide nanoparticles [J]. Chemosphere, 2007, 67: 160-166
[10] Zhu X S, Zhou J, Cai Z H. TiO2nanoparticles in the marine environment: Impact on the toxicity of tributyltin to abalone embryosHaliotisdiversicolorsupertexta[J]. Environmental Science and Technology, 2011, 45: 3753-3758
[11] Zhang X Z, Sun H W, Zhang Z Y, et al. Enhanced bioaccumulation of cadmium in carp in the presence of titanium dioxide nanoparticles [J]. Chemosphere, 2007, 67: 160-166
[12] Sun H W, Zhang X Z, Zhang Z Y, et al. Influence of titanium dioxide nanoparticles on speciation and bioavailability of arsenite [J]. Environmental Pollution, 2009, 157(4): 1165-1170
[13] Johnston H J, Hutchison G R, Christensen F M, et al. Identification of the mechanisms that drive the toxicity of TiO2particulates: The contribution of physicochemical characteristics [J]. Particle and Fibre Toxicology, 2009, 6(1): 1-27
[14] Hartmann N B, Von der K F, Hofmann T, et al. Algal testing of titanium dioxide nanoparticles - testing considerations, inhibitory effects and modification of cadmium bioavailability [J]. Toxicology, 2010, 269(2-3): 190-197
[15] Rosenfeldt R R, Seitz F, Schulz R, et al. Heavy metal uptake and toxicity in the presence of titanium dioxide nanoparticles: A factorial approach usingDaphniamagna[J]. Environmental Science and Technology, 2014, 48(12): 6965-6972
[16] Reyes-Coronado D, Rodríguez-Gattorno G, Espinosa-Pesqueira M E, et al. Phase-pure TiO2nanoparticles: Anatase, brookite and rutile [J]. Nanotechnology, 2008, 19(14): 145605
[17] Organization for Economic Cooperation and Development.Daphniamagnareproduction test. OECD Guideline 211 [S]. Paris: OECD, 2012
[18] Tan C, Fan W H, Wang W X. Role of titanium dioxide nanoparticles in the elevated uptake and retention of cadmium and zinc inDaphniamagna[J]. Environmental Science and Technology, 2012, 46(1): 469-476
[19] Stone A T, Torrents A, Smolen J, et al. Adsorption of organic compounds possessing ligand donor groups at the oxide/water interface [J]. Environmental Science and Technology, 2002, 36(5): 895-909
[20] Fan W, Cui M, Liu H, et al. Nano-TiO2enhances the toxicity of copper in natural water toDaphniamagna[J]. Environmental Pollution, 2011, 159(3): 729-734
[21] Fan W, Peng R, Li X, et al. Effect of titanium dioxide nanoparticles on copper toxicity toDaphniamagnain water: Role of organic matter [J]. Water Research, 2016, 105: 129-137
[22] Rosenfeldt R R, Seitz F, Senn L, et al. Nanosized titanium dioxide reduces copper toxicity—The role of organic material and the crystalline phase [J]. Environmental Scienceand Technology, 2015, 49(3): 1815-1822
[23] 倪凌峰, 李轶, 郭燕飞. 氧化石墨烯存在下铜离子对大型溞的毒性研究[J]. 生态毒理学报, 2016, 11(5): 71-78
Ni L F, Li Y, Guo Y F. Toxicity of copper ions onDaphniamagnain the presence of graphene oxide [J]. Asian Journal of Ecotoxicology, 2016, 11(5): 71-78 (in Chinese)
