污水再生处理工艺中卡马西平的去除过程模拟及其生态风险评价
2018-01-29李抒苡孙傅李丹曾思育杜鹏飞何苗
李抒苡,孙傅, *,李丹,曾思育,杜鹏飞,#,何苗
1. 清华大学环境学院,北京 100084 2. 复旦大学环境科学与工程系,上海 200433
近20年来,随着医药业、洗护业、畜牧和水产养殖业的发展,人和动物所用处方药及生物制剂、诊断试剂、芳香剂、日光遮蔽剂等药品和个人护理用品(pharmaceuticals and personal care products, PPCPs)对生态系统的潜在危害日益受到广泛关注[1- 2]。卡马西平是一种常见的精神性疾病药物,临床用于缓解和治疗癫痫发作、三叉神经痛和咽舌神经痛发作、狂躁和抑郁症以及中枢性部分性尿崩症等[3]。据估算,全球卡马西平的年消费量为1 014 t,而人体服用的卡马西平约有28%通过尿液和粪便直接排出体外[4]。但是,传统的污水二级处理工艺对卡马西平的去除作用甚微[2, 4],因此污水处理厂成为环境中卡马西平的重要来源[5]。Ternes[6]在德国30座污水处理厂出水中检测到卡马西平,且其在90%污水厂出水中浓度达3.7 μg ·L-1。我国学者在北京、上海、重庆、无锡、邯郸、邢台等地的污水处理厂二级出水中发现卡马西平浓度在ng~μg范围,最高可达8.75 μg ·L-1[7-13]。卡马西平进入环境后亦较难降解,广泛存在于地表水、地下水和土壤中,因此其常被用作PPCPs污染的指示化合物[14-17]。众多研究表明,水体中残留的卡马西平会对细菌、藻类、无脊椎动物、鱼类等造成不利影响,并可能改变水生生物群落结构及生态系统平衡[18-21]。
为了应对水资源短缺、改善水环境质量,污水再生利用在全球发展迅速,深度处理工艺对卡马西平等PPCPs的去除效果也成为重要研究主题。例如,Mitchell等[22]对污水厂二级出水进行超滤处理,发现超滤对卡马西平几乎没有去除作用;Zhou等[23]研究臭氧氧化、超声波臭氧氧化和光催化臭氧氧化3种工艺对卡马西平的去除,发现超声波臭氧氧化的去除效果最佳,达14.8%;Soufan等[24]基于反应动力学研究氯消毒对卡马西平的去除,发现卡马西平的去除效果甚微,其半衰期约为52~69 d。现有研究主要以污水再生处理工艺的单个单元为对象,考察卡马西平的去除,缺少对完整再生处理工艺链的集成研究[25-27]。同时,目前针对卡马西平去除效果和机理的研究大多基于实验室或小试实验数据,其结果在实际规模处理工艺的适用性尚有待检验。此外,现有研究以卡马西平的去除效果及机理研究为主,缺少对污水再生处理工艺的模拟研究,因而难以突破观测数据的局限,无法满足生态风险评价和管理的需求。
本研究以北京清河再生水厂为例,研究卡马西平在“超滤—臭氧氧化—氯消毒”处理工艺中的去除特性并建立相应的机理模型,同时基于再生水处理工艺模型的蒙特卡洛模拟和基于北京市本地物种的物种敏感度分布(species sensitivity distribution, SSD)模型,评价再生水用于补给地表水体时卡马西平产生的生态风险。
1 研究方法(Methods)
1.1 研究案例与数据来源
清河再生水厂一期工程的处理规模为8万 m3·d-1,采用“超滤—臭氧氧化—氯消毒”处理工艺。其中,超滤工艺采用ZeeWeed-1000中空纤维膜,膜材料为聚偏氟乙烯,孔径为0.02 μm,物理反冲洗周期为30~40 min;臭氧氧化工艺中臭氧投加量为3.5~5.0 mg·L-1,停留时间为25 min;氯消毒工艺中次氯酸钠投加量为7~10 mg·L-1,停留时间为4 h。
2015年1月对该处理工艺进水以及超滤、臭氧氧化和氯消毒工艺出水进行了6次现场监测,监测指标包括卡马西平、总有机碳(total organic carbon, TOC)、氨氮、余氯等。其中,卡马西平浓度测定[28]采用超高效液相色谱-质谱联用(Ultra-Performance Liquid-Chromatography Tandem Mass Spectrometry,UHPLC-MS/MS)进行分析。测定仪器为Agilent 6430型高效液相色谱串联三重四级杆质谱。色谱柱型号为Agilent ZORBAX SB-C18 HD,2.1 mm×50 mm×1.8 μm。液相流动相A相为乙腈+0.1%乙酸,B相为DI+0.1 %乙酸,柱温箱温度为30 ℃,流速为0.25 mL·min-1。质谱参数为:干燥器流量10 L·min-1,雾化器压力45 psi,高纯氮压力为18 mTorr,气体温度为375 ℃,毛细管电压4 000 V。具体方法如下:取1 000 mL水样经0.45 μm滤膜过滤后,加入1 mL 5%乙二胺四乙酸二钠溶液(5% EDTANa2),并用甲酸酸化至pH 3.0,加入同位素内标至50 ng·L-1。HLB小柱在用10 mL甲醇活化后依次用5 mL酸化的甲醇(0.1%甲酸的甲醇溶液)和10 mL超纯水平衡,随后过滤水样,控制流速为10 mL·min-1。过滤结束后用10 mL 5%甲醇溶液淋洗以去除HLB柱子残留杂质,并通入氮气5 min使柱子完全干燥。最后,依次用5 mL甲醇和5 mL碱化的甲醇(含0.1%氨水的甲醇溶液)洗脱HLB柱子。洗脱液用氮气吹干后,用5%甲醇水溶液定容至1.0 mL,-20 ℃保存后用UHPLC-MS/MS分析。卡马西平最低检出限为1 ng·L-1。所有试剂均购于Sigma公司。TOC浓度用TOC-V CPH分析仪根据“水质 总有机碳的测定 燃烧氧化—非分散红外吸收法”(HJ 501—2009)测定。氨氮和余氯浓度测定仪器为DR5000紫外可见分光光度计,氨氮浓度根据“水质 氨氮的测定 纳氏试剂分光光度法”(HJ 535—2009)测定,余氯浓度则根据“水质 游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺分光光度法”(HJ 586—2010)测定。
1.2 模型概化
卡马西平分子较小,在再生水处理中难以被超滤膜截留,同时超滤膜结垢将进一步降低其去除效率,因此超滤工艺对卡马西平的去除率较低[22]。清河再生水厂的现场监测数据也表明超滤工艺对卡马西平几乎没有去除作用(见2.1节),因此本研究仅模拟臭氧氧化和氯消毒2个工艺中卡马西平的去除过程。
1.2.1 臭氧氧化模型概化
臭氧对有机物的氧化作用分为臭氧直接氧化和羟基自由基间接氧化,而在实际的污水处理和再生水厂的工况下,羟基自由基的浓度常常较小或难以测量[25]。因此,模型假设臭氧对污水中卡马西平等组分的氧化去除均是直接氧化作用。同时,模型认为臭氧与卡马西平、TOC和氨氮的反应均是二级反应[25],与污水中其他组分的反应为一级反应,反应速率方程如式(1)~(4)所示。
(1)
(2)

(3)
-zNH3-NkNH3-NCO3CNH3-N-krestCO3
(4)
式中,CCAR、CO3、CTOC和CNH3-N分别表示卡马西平、臭氧、TOC和氨氮浓度,mg ·L-1;t表示停留时间,s;kCAR、kTOC和kNH3-N分别表示臭氧与卡马西平、TOC和氨氮反应的二级反应速率常数,L·mg-1·s-1;krest表示臭氧参与其他反应过程的一级反应速率常数,s-1;zCAR、zTOC和zNH3-N分别表示臭氧与卡马西平、TOC和氨氮反应的化学计量系数。
1.2.2 氯消毒模型概化
参照文献[29]对氯消毒模型的概化方法,建立氯与卡马西平、TOC、氨氮等组分的反应速率方程如式(5)~(8)所示。
(5)
(6)
(7)
CHOClCTOC-z′NH3-Nk′NH3-NCHOClCNH3-N-k′restCHOCl
(8)
式中,CCAR、CHOCl、CTOC和CNH3-N分别表示卡马西平、余氯、TOC和氨氮的浓度,mg ·L-1;t表示停留时间,s;k′CAR、k′TOC和k′NH3-N分别表示余氯与卡马西平、TOC和氨氮反应的二级反应速率常数,L·mg-1·s-1;k′rest表示余氯参与其他反应过程的一级反应速率常数,s-1;z′CAR、z′TOC和z′NH3-N分别表示余氯与卡马西平、TOC和氨氮反应的化学计量系数。
1.3 模型参数率定
臭氧氧化模型和氯消毒模型分别含7个待识别参数。考虑到实际再生水厂处理工艺中水质变化的影响因素复杂,受控实验条件下获得的模型参数取值不完全适用,因此本研究采用基于拉丁超立方采样的Hornberger-Spear-Young算法识别模型参数,具体步骤见文献[30]。臭氧氧化模型和氯消毒模型的采样次数均为50 000次。获得可接受参数集和不可接受参数集后,进一步对每个模型参数开展区域灵敏度分析,利用Kolmogorov-Smirnov(K-S)检验判断其可接受和不可接受2个参数集是否服从相同概率分布。当二者在统计意义上具有显著差异时,认为该参数是灵敏参数,否则即为不灵敏参数[30]。
1.4 生态风险评价
本研究采用SSD方法评价再生水厂出水中卡马西平对受补给水体的生态风险。为了构建反映研究区域物种特征的SSD模型,参考文献[31]的方法,在美国环境保护署(EPA)的ECOTOX数据库(http://www.epa.gov/ecotox/)中查询北京市及其周边区域存在的430个物种的卡马西平毒性数据。利用获取的毒性数据构建SSD模型时,为了考察不同模型选择对生态风险评价结果的影响,本研究亦选择文献[31]中正态分布、对数正态分布、Logistic分布、对数Logistic分布、Weibull分布、Burr III型分布和Gumbel分布等7种常用模型拟合毒性数据,并利用K-S检验的P值、曲线拟合的相关系数r值以及模拟值和实测值的均方根误差等判断SSD模型与毒性数据的吻合程度。
在生态风险评价中,为了考虑暴露浓度的不确定性,本研究利用上述再生水厂处理工艺模型开展蒙特卡洛模拟,模拟再生水厂进水中卡马西平浓度对出水浓度的影响。再生水厂进水中的卡马西平浓度参考文献[7-13]中报道的国内污水处理厂二级出水的浓度,设定取值范围为0~0.8 μg ·L-1,且认为其服从均匀分布。在每次模拟中,再生水厂进水中卡马西平浓度按上述取值范围和概率分布随机取值,各处理工艺单元的运行参数按实际运行状况取一固定值,模型参数则在可接受参数集合中随机取得,由此模拟得到出水浓度的一次模拟值。经100 000次拉丁超立方采样和蒙特卡洛模拟,可以得到再生水厂出水中卡马西平浓度的概率分布。
利用SSD模型和再生水出厂水中卡马西平暴露浓度的概率分布作图,将横坐标取为一系列暴露浓度水平下受影响物种的比例,纵坐标取为暴露浓度分布中超过相应浓度水平的概率,可以得到联合概率曲线(Joint Probability Curve, JPC)。根据JPC与两坐标轴构成区域的面积,可以计算总体风险的期望值(Expected Total Risk, ETR)[31]。
2 结果(Results)
2.1 再生水处理工艺中卡马西平的去除特征
再生水厂进水及各处理工艺出水中卡马西平浓度的统计特征如表1所示。进水(即二沉出水)中卡马西平的浓度在0.0697~0.1210 μg ·L-1之间波动,与文献中邢台某污水处理厂二沉出水的监测结果(0.02~0.51 μg ·L-1)相近[7]。超滤工艺出水中卡马西平浓度均值略高于进水,因此其对卡马西平几乎没有去除效果,这与文献[22]的结论相符。臭氧氧化工艺对卡马西平的平均去除率为23.4%,与文献报道的14.8%~20%的范围接近[1, 23, 32]。氯消毒工艺对卡马西平的平均去除率为9.3%,也与文献报道的5.3%~30%的范围接近[33-35]。
2.2 模型参数识别
2.2.1 臭氧氧化模型
臭氧氧化模型参数识别共获得可接受参数7 526组,占采样总数的15.1%。为了评价模型的模拟效果,在可接受参数中选取使得模拟值和实测值相对误差的绝对值之和最小的一组参数作为代表,其对臭氧氧化工艺出水中卡马西平、TOC和氨氮的模拟结果如图1所示。从图中可以看出,本研究建立的臭氧氧化模型的模拟效果总体较好。其中,出水中卡马西平浓度模拟值与实测值相对误差的绝对值为9.7%~24.6%,平均为12.5%;TOC模拟值与实测值相对误差的绝对值为1.0%~35.3%,平均为16.9%;氨氮模拟值与实测值相对误差的绝对值为0.7%~10.6%,平均为3.9%。

表1 再生水厂进水及各处理工艺出水中卡马西平浓度的统计特征Table 1 Statistical characteristics of carbamazepine concentrations in the influent and effluent of each treatment process of the wastewater reclamation plant

图1 臭氧氧化模型模拟结果Fig. 1 Simulation results of the ozonation model
臭氧氧化模型的7个参数中,除krest之外的6个参数均为灵敏参数,可以被较好地识别。以标准差衡量,6个灵敏参数的可接受参数集的不确定性较初始取值范围下降了1.2%~27.5%,并且参数越灵敏,其不确定性下降比例越高。这说明,臭氧氧化模型中灵敏度高的参数得到了较好的识别,因此该模型的模拟结果具有较高的可靠性。从识别得到的参数取值看,kCAR、kTOC和kNH3-N可接受参数集概率分布的峰值分别出现在0~0.1 L·mg-1·s-1、0.7~0.9 L·mg-1·s-1和0~0.1 L·mg-1·s-1,与文献报道值1.27 L·mg-1·s-1[36]、3.20 L·mg-1·s-1[37]和0.002 L·mg-1·s-1[37],总体处于可比水平。
2.2.2 氯消毒模型
氯消毒模型参数识别共获得可接受参数8 800组,占采样总数的17.6%。在可接受参数中选取使得模拟值和实测值相对误差的绝对值之和最小的一组参数作为代表,其对氯消毒工艺出水中卡马西平、TOC和氨氮的模拟结果如图2所示。从图中可以看出,本研究建立的氯消毒模型的模拟效果总体较好。其中,出水中卡马西平浓度模拟值与实测值相对误差的绝对值为0.8%~32.3%,平均为9.1%;TOC模拟值与实测值相对误差的绝对值为2.9%~30.0%,平均为10.1%;氨氮模拟值与实测值相对误差的绝对值为3.7%~7.5%,平均为5.9%。由于本研究未能获取到采样时刻氯的实际投加量,均取为8.5 mg·L-1,因此余氯的模拟效果略差,其模拟值与实测值相对误差的绝对值为2.8%~86.9%,平均为38.0%。
氯消毒模型的7个参数中,k′NH3-N、z′NH3-N和k′rest为灵敏参数,可以被较好地识别。以标准差衡量,3个灵敏参数的可接受参数集的不确定性较初始取值范围下降了4.5%~63.6%,并且参数越灵敏,其不确定性下降比例越高。从识别得到的参数取值看,k′NH3-N可接受参数集概率分布的峰值出现在5×10-6L·mg-1·s-1,在数量级上远低于与文献报道值0.22~118 L·mg-1·s-1[38-39]。由于氯与氨氮的反应可分为快速反应和慢速反应阶段,2个阶段的反应速率相差可高达105倍[39]。本研究中k′NH3-N实际上相当于整个接触时间内的平均反应速率常数,因此更加接近氯与氨氮慢速反应阶段的反应速率。k′rest可接受参数集概率分布的峰值出现在3×10-4s-1,与文献报道值5×10-5~0.02 s-1[39]处于可比水平。k’CAR和k′TOC不可识别,这可能与氯消毒工艺对卡马西平和TOC的去除作用较弱有关。

图2 氯消毒模型模拟结果Fig. 2 Simulation results of the chlorination model
2.3 生态风险评价
2.3.1 SSD模型
本研究从EPA的ECOTOX数据库中共获得了卡马西平对北京市6个物种的全部毒性效应终点的最大无效应浓度值(no-observed-effect concentration, NOEC),包括:虹鳟(Oncorhynchusmykiss)、圆形盘肠溞(Chydorussphaericus)、鲤鱼(Cyprinuscarpio)、大型溞(Daphniamagna)、水螅(Hydravulgaris)和青鳉(Oryziaslatipes)。虹鳟是6个物种中对卡马西平最敏感的,其NOEC值最低的毒性效应终点为对过氧化氢酶的影响;圆形盘肠溞只有一个可用的NOEC值,其毒性效应终点为对种群个体数的影响;鲤鱼、大型溞、水螅和青鳉NOEC值最低的毒性效应终点分别为对细胞增殖、生长长度、形态和游泳行为的影响。
卡马西平对上述6个物种的毒性数据以及7种SSD模型对这些数据的拟合结果如图3所示。7种SSD模型K-S检验的P值均大于0.05,且曲线拟合的相关系数r值均不小于0.9,它们总体上能够较好地模拟北京市6个物种对卡马西平毒性的响应关系。进一步对比7种模型可以发现,正态分布、Logistic分布和Gumbel分布模型在卡马西平浓度低于500 μg·L-1时累积概率已接近1,过高估计了卡马西平的毒性效应;正态分布、Weibull分布和Burr III型分布的均方根误差是7种模型中最大的;对数正态分布、Logistic分布、对数Logistic分布和Gumbel分布模型的r值不小于0.95。综上,选取r值较高、均方根误差最小的对数正态分布和对数Logistic分布开展后续分析。
本研究还利用ECOTOX数据库提供的全体45个物种的卡马西平毒性数据开展7个SSD模型的拟合分析,结果发现Burr III型分布的拟合效果最好,该曲线亦列于图3中。从图中可以看出,虽然本研究从ECOTOX数据库中仅获取到北京市6个物种的卡马西平毒性数据,但它们具有足够的代表性,其SSD曲线与基于全体45个物种的SSD曲线具有较好的一致性,因此由此得到的分析结果具有较高的可信度。

图3 基于北京市物种及ECOTOX数据库中全体物种的卡马西平SSD模型Fig. 3 SSDs models based on Beijing native species and all available species in the ECOTOX database
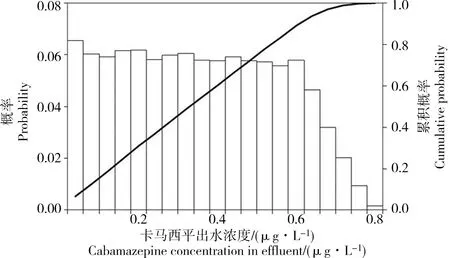
图4 再生水厂出水中卡马西平浓度的蒙特卡洛模拟结果Fig. 4 Monte Carlo simulation results for carbamazepine concentration in the effluent of the wastewater reclamation plant

图5 再生水厂出水中卡马西平的联合概率曲线Fig. 5 Joint Probability Curve (JPC) of carbamazepine in the effluent of the wastewater reclamation plant
2.3.2 JPC曲线
利用臭氧氧化和氯消毒模型开展蒙特卡洛模拟,得到再生水厂出水中卡马西平的浓度分布如图4所示。由图4中出水卡马西平浓度的累积概率曲线和图3中模拟效果较好的对数正态分布和对数Logistic分布曲线绘制JPC,结果如图5所示。按对数正态分布模型计算得到再生水厂出水中卡马西平的ETR为7.4%,按对数Logistic分布模型计算得到的ETR为8.5%。
3 讨论(Discussion)
3.1 再生水处理工艺模型模拟效果评估
本研究建立的臭氧氧化和氯消毒机理模型能较好模拟再生水处理工艺对卡马西平的去除过程,模型对卡马西平、TOC、氨氮等指标的模拟误差总体上低于20%。模型参数区域灵敏度分析结果表明,臭氧氧化和氯消毒模型的灵敏参数均可以被较好地识别,且识别后参数的不确定性显著下降,这些都有利于增加模拟结果的可靠性。但是,由于数据量的局限,氯消毒模型中卡马西平与余氯的反应速率尚难以识别,需要未来积累数据,进一步深入研究,从而完善模型。
3.2 SSD模型选择对生态风险评价的影响
本研究比较了7种SSD模型对卡马西平毒性数据的拟合效果,综合考虑K-S检验的P值、曲线拟合的相关系数r值和均方根误差等结果,最终采用对数正态分布和对数Logistic分布2种SSD模型开展生态风险评价。利用2种SSD模型计算得到的ETR值比较接近,降低了生态风险评价结果的不确定性。因此,在开展生态风险评价时考虑SSD模型选择的不确定性,可以避免根据经验或参照类似研究选择单一SSD模型可能导致的评价结果偏差。同时,综合多个模拟效果较好的SSD模型的生态风险评价结果,则可以更好地掌握评价结果的不确定性,有助于生态风险管理决策。
3.3 再生水补给地表水体的生态风险管理
考虑生态风险评价中SSD模型选择的不确定性,清河再生水厂出水补给地表水体造成的生态风险期望值约为8%,即约有8%的水生生物物种将会受不利影响。如以国际上常用的保护95%物种作为生态风险管理目标,则有必要通过降低再生水处理工艺进水中卡马西平浓度以及优化处理工艺运行等措施进一步降低出水的卡马西平浓度。本研究评估了进水浓度对生态风险的影响,未来可利用臭氧氧化模型和氯消毒模型进一步评价处理工艺运行参数对生态风险的影响,为处理工艺的优化和调控提供决策依据。
[1] Espejo A, Aguinaco A, Amat A M, et al. Some ozone advanced oxidation processes to improve the biological removal of selected pharmaceutical contaminants from urban wastewater [J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances and Environmental Engineering, 2014, 49(4): 410-421
[2] Andreozzi R, Marotta R, Pinto G, et al. Carbamazepine in water: Persistence in the environment, ozonation treatment and preliminary assessment on algal toxicity [J]. Water Research, 2002, 36(1): 2869-2877
[3] 张娟, 代朝猛, 周雪飞, 等. 水体中卡马西平的污染特征与赋存现状研究[J]. 给水排水, 2012(6): 120-124
Zhang J, Dai C M, Zhou X F, et al. Study on the pollution characteristics and occurrence of carbamazepine in water body [J]. Water and Wastewater Engineering, 2012(6): 120-124 (in Chinese)
[4] Zhang Y, Gei En S, Gal C. Carbamazepine and diclofenac: Removal in wastewater treatment plants and occurrence in water bodies [J]. Chemosphere, 2008, 73(8): 1151-1161
[5] 安婧, 周启星. 药品及个人护理用品(PPCPs)的污染来源、环境残留及生态毒性[J]. 生态学杂志, 2009(9):1878-1890
An J, Zhou Q X. Pollution sources, environmental residues and ecological toxicity of pharmaceuticals and personal care products (PPCPs): A review [J]. Chinese Journal of Ecology, 2009(9): 1878-1890 (in Chinese)
[6] Ternes T A. Occurrence of drugs in German sewage treatment plants and rivers [J]. Water Research, 1998, 32(11): 3245-3260
[7] 王钊. 药物活性物质在污水处理厂的分布与控制技术研究[D]. 邯郸: 河北工程大学, 2015: 32-33
Wang Z. The distribution and control technology of PhACs in wastewater treatment process [D]. Handan: Hebei University of Engineering, 2015: 32-33 (in Chinese)
[8] 徐维海, 张干, 邹世春, 等. 典型抗生素类药物在城市污水处理厂中的含量水平及其行为特征[J]. 环境科学, 2007(8): 1779-1783
Xu W H, Zhang G, Zou S C, et al. Occurrence, distribution and rate of antibiotics in sewage treatment plants [J]. Environmental Science, 2007(8): 1779-1783 (in Chinese)
[9] 严清. 典型PhACs在城市水系统中的迁移分布规律及其在人工湿地中的去除研究[D]. 重庆: 重庆大学, 2014: 107-110
Yan Q. Transportation and distribution of typical pharmaceutical active compounds in the water system of city and their removal in constructed wetland system (CWS) [D]. Chongqing: Chongqing University, 2014: 107-110 (in Chinese)
[10] 盛灵慧, 陈红瑞, 霍英斌, 等. 液相色谱串联质谱同位素稀释法测定污水中卡马西平[J]. 中国测试, 2015(5): 46-49
Sheng L H, Chen H R, Huo Y B, et al. An isotope dilution liquid chromatography-tandem mass spectrometry method for determination of carbamazepine in wastewater [J]. China Measurement and Test, 2015(5): 46-49 (in Chinese)
[11] 胡金龙. 典型PPCPs在污水处理厂中的迁移转化规律研究[D]. 上海: 东华大学, 2014: 47-48
Hu J L. Occurrence and removal of typical pharmaceuticals and personal care products (PPCPs) in a wastewater treatment plant [D]. Shanghai: Donghua University, 2014:47-48 (in Chinese)
[12] 袁圣柳. 典型精神病药物在污水处理厂的存在与去除[D]. 兰州: 兰州大学, 2012: 48-52
Yuan S L. Occurrence and remove of typical psychiatric pharmaceuticals in wastewater treatment plants [D]. Lanzhou: Lanzhou University, 2012: 48-52 (in Chinese)
[13] 丁紫荣, 贺德春, 万大娟, 等. 中型污水处理厂中药物和个人护理品的分布与去除[J]. 环境工程学报, 2015(3): 1247-1252
Ding Z R, He D C, Wan D J, et al. Occurrence and removal of pharmaceuticals and personal care production by medium-sized sewage treatment plants [J]. Chinese Journal of Environmental Engineering, 2015(3): 1247-1252 (in Chinese)
[14] Clara M, Strenn B, Kreuzinger N. Carbamazepine as a possible anthropogenic marker in the aquatic environment: Investigations on the behaviour of carbamazepine in wastewater treatment and during groundwater infiltration [J]. Water Research, 2004, 38(4): 947-954
[15] Bernot M J, Becker J C, Doll J, et al. A national reconnaissance of trace organic compounds (TOCs) in United States lotic ecosystems [J]. Science of the Total Environment, 2016, 572: 422-433
[16] Wolf L, Zwiener C, Zemann M. Tracking artificial sweeteners and pharmaceuticals introduced into urban groundwater by leaking sewer networks [J]. Science of the Total Environment, 2012, 430: 8-19
[17] Dalkmann P, Siebe C, Amelung W, et al. Does long-term irrigation with untreated wastewater accelerate the dissipation of pharmaceuticals in soil? [J]. Environmental Science & Technology, 2014, 48(9): 4963-4970
[18] Ferrari B, Paxeus N, Lo Giudice R, et al. Ecotoxicological impact of pharmaceuticals found in treated wastewaters: Study of carbamazepine, clofibric acid, and diclofenac [J]. Ecotoxicology and Environmental Safety, 2003, 56(3):359-370
[19] Cleuvers M. Aquatic ecotoxicity of pharmaceuticals including the assessment of combination effects [J]. Toxicology Letters, 2003, 142(3): 185-194
[20] Fent K, Weston A A, Caminada D. Ecotoxicology of human pharmaceuticals [J]. Aquatic Toxicology, 2006, 78(2): 122-159
[21] Jarvis A L, Bernot M J, Bernot R J. The effects of the psychiatric drug carbamazepine on freshwater invertebrate communities and ecosystem dynamics [J]. Science of the Total Environment, 2014, 496: 461-470
[22] Mitchell S M, Ullman J L. Removal of phosphorus, BOD, and pharmaceuticals by rapid rate sand filtration and ultrafiltration systems [J]. Journal of Environmental Engineering, 2016, 142(6): 600-611
[23] Zhou H, Liu J, Xia H, et al. Removal and reduction of selected organic micro-pollutants in effluent sewage by the ozone-based oxidation processes [J]. Chemical Engineering Journal, 2015, 269: 245-254
[24] Soufan M, Deborde M, Delmont A, et al. Aqueous chlorination of carbamazepine: Kinetic study and transformation product identification [J]. Water Research, 2013, 47(14): 5076-5087
[25] Zimmermann S G, Wittenwiler M, Hollender J, et al. Kinetic assessment and modeling of an ozonation step for full-scale municipal wastewater treatment: Micropollutant oxidation, by-product formation and disinfection [J]. Water Research, 2011, 45(2): 605-617
[26] Adams C, Wang Y, Loftin K, et al. Removal of antibiotics from surface and distilled water in conventional water treatment processes [J]. Journal of Environmental Engineering-ASCE, 2002, 128(3): 253-260
[27] 姜蕾, 谢丽, 周琪, 等. 水处理中微量抗生素去除的研究及进展[J]. 中国给水排水, 2010, 18: 18-22
Jiang L, Xie L, Zhou Q, et al. Research and progress in removal of trace antibiotics from sewage and drinking water [J]. China Water and Wastewater, 2010, 18: 18-22 (in Chinese)
[28] Hampel D, York E R, Allen L H. Ultra-performance liquid chromatography tandem mass-spectrometry (UPLC-MS/MS) for the rapid, simultaneous analysis of thiamin, riboflavin, flavin adenine dinucleotide, nicotinamide and pyridoxal in human milk [J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2012, 903: 7-13
[29] 孙傅, 陈吉宁, 佟庆远, 等. 给水处理厂预氯化工艺概率机理模型研究[J]. 环境科学, 2006(4): 665-668
Sun F, Chen J N, Tong Q Y, et al. Developing a statistical conceptual model for pre-chlorination process in waterworks [J]. Environmental Science, 2006(4): 665-668 (in Chinese)
[30] 邓义祥, 陈吉宁, 杜鹏飞. HSY算法在水质模型参数识别中的应用探讨[J]. 上海环境科学, 2002(8): 497-500
Deng Y X, Chen J N, Du P F. Approach on application of HSY algorithm to parameter identification of water quality model [J]. Shanghai Environmental Sciences, 2002(8): 497-500 (in Chinese)
[31] 王铜, 孙傅, 曾思育, 等. 北京市污水处理厂出水中雌二醇的概率生态风险评价[J]. 生态毒理学报, 2015, 10(1): 271-280
Wang T, Sun F, Zeng S Y, et al. Probabilistic ecological risk assessment of estradiol in the effluents of wastewater treatment plants in Beijing [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 271-280 (in Chinese)
[32] Rosal R, Rodríguez A, Perdigón-Melón J A, et al. Occurrence of emerging pollutants in urban wastewater and their removal through biological treatment followed by ozonation [J]. Water Research, 2010, 44(2): 578-588
[33] Stamatis N K, Konstantinou I K. Occurrence and removal of emerging pharmaceutical, personal care compounds and caffeine tracer in municipal sewage treatment plant in Western Greece [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2013, 48: 800-813
[34] Yang B, Kookana R S, Williams M, et al. Removal of carbamazepine in aqueous solutions through solar photolysis of free available chlorine [J]. Water Research, 2016, 100: 413-420
[35] Okuda T, Kobayashi Y, Nagao R, et al. Removal efficiency of 66 pharmaceuticals during wastewater treatment process in Japan [J]. Water Science and Technology, 2008, 57(1): 65-71
[36] Huber M M, Gobel A, Joss A, et al. Oxidation of pharmaceuticals during ozonation of municipal wastewater effluents: A pilot study [J]. Environmental Science and Technology, 2005, 39(11): 4290-4299
[37] Hoigne J, Bader H. Ozonation of water - kinetics of oxidation of ammonia by ozone and hydroxyl radicals [J]. Environmental Science and Technology, 1978, 12(1): 79-84
[38] Deborde M, von Gunten U. Reactions of chlorine with inorganic and organic compounds during water treatment - Kinetics and mechanisms: A critical review [J]. Water Research, 2008, 42(1-2): 13-51
[39] Haas C N, Karra S B. Kinetics of wastewater chlorine demand exertion [J]. Journal Water Pollution Control Federation, 1984, 56(2): 170-173
