纳米零价铁在环境中的毒性研究进展
2018-01-29夏泽阳刘爱荣
夏泽阳,刘爱荣
污染控制及资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092
纳米零价铁(nZVI)技术早在1997年就作为有效的脱卤反应还原剂被应用到环境中。实验表明,nZVI对于环境中多种卤化物,如卤代烷烃、卤代烯烃、卤代芳香烃和有机氯农药等难降解的有机污染物可有效脱除卤素[1-5],同时提高其可生化性,上述反应主要应用的是nZVI的还原性能。研究发现,由于nZVI具有核-壳结构,即核心为立方结构的单质铁,表面包裹一层铁氧化物,兼具还原和吸附的性能[6],也可高效去除污染水体中的重金属[7-10]和无机阴离子污染物。此外,将nZVI进行修饰后,将进一步改善其性能,提高对污染物的去除效能[11-12]。nZVI技术对于污染物的治理和修复已经成为环境领域的一个研究热点,有望在未来助力解决众多环境难题。
目前在原位修复中nZVI的应用是最有前景的技术之一[13-16],这是由于nZVI具有以下4个优点[17]:(1)nZVI颗粒小、比表面积大,其胶体能够轻易地注入并在其他修复材料难以到达的土壤含水层[18]中起作用,从而能够与污染物直接反应;(2)nZVI在地下水层与污染物反应不仅快速,而且可以长时间保持反应活性;(3)和其他修复材料相比,nZVI的投加对环境产生的危害更小;(4)nZVI技术经济实用且操作简单。世界范围内有关nZVI在地下水的原位修复研究已经蓬勃展开,在全球已经有100多处试点[19]。
然而,由于nZVI性质非常活泼,易产生铁离子和铁氧化物释放到环境中,会对生物体乃至生态系统产生难以预测且严重的毒性影响[20],毒性效应已经引起了世界范围内专家学者的强烈关注。目前大部分研究都集中在nZVI对微生物的毒性上。但也有学者研究发现,nZVI也会对大麦[21]、蚯蚓[22]和鱼类[23-24]等生物体产生作用,进一步的观测还发现nZVI甚至会使环境中的理化性质[25-27]发生变化。因此可以看出,nZVI在环境中的毒性作用范围是非常广泛的,在大规模应用nZVI之前,务必要对其毒性的影响进行全面的评估。本文会从nZVI在环境中毒性效应、毒性产生机制和毒性影响因素等方面进行综述。
1 nZVI在环境中的毒性效应(The toxic effect of nZVI in environment)
近些年来,nZVI生态效应受到越来越多的关注,学者们研究其对自然界中多种生物体和大环境的作用,基本明确了在试验对象上的毒性效应。虽然目前大部分的研究成果都是在实验条件下获得的,而在实际应用中,环境因素复杂且多变,nZVI毒性效应会受到这些因素的影响,但实验结果仍具有很好的指导意义。现将近年来国内外学者对nZVI毒性研究成果总结如下。
(1)王学等[28]分别用不同浓度的nZVI悬浮液与大肠杆菌接触,发现大肠杆菌的生长受到了抑制,且对数期缩短,稳定期延长。nZVI的浓度越高,大肠杆菌对数期缩短和稳定期延长的趋势就越明显,并且nZVI会使氧自由基在大肠杆菌细胞内大量积累。TEM图片表明,大肠杆菌周围吸附了一些nZVI颗粒,且细胞表面变得模糊并出现破损,细胞膜也呈现出凹陷。Shin等[29]研究发现即使在nZVI浓度高达1 g·L-1时,也只对脱氮细菌产生微弱的毒性。而在nZVI浓度较低时,甚至会增强脱氮细菌的反硝化作用并刺激细菌生长。一般来说,低温条件不利于脱氮细菌对硝酸盐的还原,但在nZVI存在时,即使设定体系温度为12 ℃,硝酸盐的完全还原也只用了很短的时间,并且nZVI的加入能长期使脱氮细菌保持较强反应活性。
(2)Yehia等[22]先将nZVI使用羧甲基纤维素(CMC)稳定处理后得到CMC-nZVI,然后把蚯蚓在含有不同浓度CMC-nZVI的土壤中培养,研究发现蚯蚓的回避行为、单体重量变化和死亡率只有在CMC-nZVI浓度超过500 mg·kg-1时才能明显观察到。浓度提升至750 mg·kg-1时,蚯蚓死亡率可达100%。但在CMC-nZVI浓度为100 mg·kg-1时,蚯蚓的繁殖就会受到影响。Liang等[30]在含有不同浓度nZVI的土壤中培养蚯蚓,测定十溴联苯醚在蚯蚓体内的吸附量和nZVI对其毒性影响。和对照组相比,加入高浓度nZVI的实验组中蚯蚓的生长和呼吸作用受到了明显抑制,蚯蚓体内间质组织被严重损伤,蚯蚓对十溴联苯醚的吸附量大幅度降低,并且蚯蚓代谢十溴联苯醚的产物也发生了变化。
(3)Ma等[31]把宽叶香蒲和杨树幼苗在不同浓度的nZVI悬浮液中培养,观察结果显示nZVI在低于200 mg·L-1时会增进宽叶香蒲和杨树幼苗的生长,但高于此浓度时,2种植物均会出现生长减慢、单体重量减轻和叶子变黄等症状。Hjorth等[32]使用白萝卜和黑麦草测试nZVI的毒性,发现在nZVI浓度低于100 mg·L-1时,2种植物的根部生长均未受到任何影响,但当nZVI浓度达到1 g·L-1时,2种植物的根部生长显著减慢,继续提升浓度至10 g·L-1时,根部生长均完全停止。
(4)Kunmar等[33]将以嗜酸氧化亚铁硫杆菌和杆菌属细菌为优势菌种的微生物群落接触nZVI 130 d后,发现优势菌种被梭菌属细菌取代,这说明nZVI会对微生物群落产生长期的影响。Fajardo等[34]报道称在砂质黏壤土中nZVI会增加培养体系中α-变形菌门的数量,同时降低β-和γ-变形杆菌的数量。但Fajardo等[35]在另一篇报道中称在铅污染的土壤中,nZVI会使β-变形杆菌数量上升,ε-变形杆菌的数量降低。Ludovica等[36]在富含沙子的壤质土中观察到,nZVI会同时使α-变形杆菌和β-变形杆菌的数量降低。
除此之外,nZVI在自然界中的毒性研究还包括nZVI对病毒、蓝藻和自然环境等方面的影响。从已有的研究结果中可以发现,nZVI对生物体除了负面作用以外,在某些条件下也会促进部分生物的生长和增强其代谢功能[34-36]。而相同条件下的重复实验所得的实验结果有时不完全相同,这说明nZVI毒性在环境中极易受到外界条件的干扰,尤其是nZVI对微生物群落的影响中,不同的土壤质地条件下微生物数量变化趋势不一,可以推断土壤质地是影响nZVI毒性的一个重要因素。在自然条件下需要考虑的条件繁多易变,仍需要在未来逐一针对主要的可变条件进行研究。目前研究对象较为单一,多为微生物,需要扩大研究范围,并且研究的指标应该尽可能地包含生物体在nZVI影响下主要的行为特征,而不是从个别指标着眼。
2 nZVI毒性产生机理(Mechanisms for toxicity of nZVI)
目前,nZVI的致毒机制尚未完全弄清,但学者们总结出可能的几种作用机制分别为氧化损伤、铁离子释放和基因损伤等。
2.1 氧化损伤
Nel等[37]提出活性氧生成和氧化应激反应是纳米材料引起生物毒性的主要方式。由于纳米材料尺寸小、比表面积大、颗粒表面电子供体和受体活动位点多,所以能轻易地与分子氧(O2)发生作用,形成活性氧(ROS)[28],ROS主要包括O2、O2-、H2O2和·OH等,nZVI反应产生过量ROS[37]的相关方程式如下[38]:
2Fe(0)+O2+2H2O→2Fe2++4OH-
Fe(0)+O2+2H+→Fe2++H2O2
Fe(0)+H2O2+2H+→Fe2++H2
Fe2++O2→Fe3++O2-
Fe2++O2-+2H+→Fe3++H2O2
Fe2++H2O2→oxidant
这类过量的活性氧不能及时被细胞内的抗氧化防御体系清除,因此会在细胞中大量积累,导致细胞内氧化和抗氧化状态失衡,发生氧化应激反应,进而致使脂类、蛋白质和核酸等大分子变性,损害细胞的结构并最终造成细胞死亡[39]。同时nZVI也会降低细胞内超氧化物歧化酶(SOD)的活性,而SOD是一种特异性酶,可以维持细胞氧化和抗氧化体系的平衡,其活性的降低预示着细胞内自由基的产生增加,这也会进一步加剧氧化损伤[40]。王学等[28]研究发现在抗氧化剂中nZVI对大肠杆菌的毒性降低。Krittanut等[41]将野生大肠杆菌菌株和缺少抗氧化基因的大肠杆菌诱变菌株分别接触nZVI,结果发现诱变菌株更易受到损伤,从而证实了氧化损伤是nZVI的毒性机制之一。
2.2 铁离子的释放
在细胞接触到nZVI的初始阶段,nZVI会快速氧化,导致以Fe0为核心的nZVI会在外层被铁氧化物包裹。一旦接触外界环境,纳米颗粒的外部氧化物层的厚度就会快速增加[42]。不断释放出Fe2+和Fe3+。微量的铁离子是生物体的生长不可或缺的,但是当铁离子过量时,就会对生物体产生危害。释放铁离子的反应会一直持续到零价铁核心被完全氧化为止,相关方程式如下[19]:
Fe0+2H2O→Fe2++H2+2OH-
2Fe0+2H2O+O2→2Fe2++4OH-
4Fe2++4H++O2→4Fe3++4H2O
通常情况下,Fe2+相对于Fe3+,前者会在nZVI表面优先释放出来。而nZVI的强还原性会使细胞膜的渗透性降低,有利于铁离子进入细胞内与H2O2反应生成过量的ROS,造成氧化应激和随后的细胞死亡[43]。Fe2+和Fe3+在细胞内参与Fenton反应的方程式如下[44]:
Fe2++H2O2→Fe3++OH·+OH-
Fe3++3H2O2→Fe2++OOH-+H+→Fe2++2H++2O2-
Fe2++H2O2→FeO2++H2O
Fe2+和Fe3+在环境中会不可避免地逐渐转变为铁氧化物,Qiu等[45]将nZVI与发光细菌接触36 d后,观察到nZVI甚至不再对发光细菌产生毒性,这表明nZVI的毒性会随着时间的推移而减小。证实了离子在初期的释放是nZVI表现出毒性的原因之一,但随后铁离子的不断转化使其毒性逐渐降低。
2.3 基因损伤
随着纳米材料在工程领域中的应用日益增多,人们也越来越关注nZVI在基因水平上的影响。葛春梅等[46]的研究称纳米材料可使贝类DNA结构、免疫相关基因转录水平和相关蛋白质表达改变。Barmo等[47]证实纳米材料可降低紫贻贝抗氧化和免疫相关基因的转录。Neenu等[48]发现纳米材料造成的基因影响包括染色体分裂、DNA链断裂、点突变和基因表达谱的改变。Neenu进一步指出,纳米材料还会导致机体癌变甚至使后代基因出现畸变。McCarthy等[49]评估了纳米材料在牡蛎的鳃和肝部分的毒性,发现肝对纳米材料更敏感,其总蛋白质水平增加得更高,更容易受到损伤和产生代谢障碍,证明了纳米材料在同种生物的不同器官上毒性的表现具有差异性。纳米材料产生的基因损伤需要在分子水平上讨论,而这种分子毒性具备慢性和难以观测性,要想全面评估纳米材料对环境中生物的基因损伤,需对接触到纳米材料的生物进行长期观测,但目前这方面的数据较少,并且学者们也没有对nZVI造成的基因损伤形成统一认识,因此也难以判断nZVI在基因层面上影响程度的轻重,还需要继续在研究中获知。
实际上,nZVI的致毒机制可能并不唯一,可能由多种机制共同作用。除了以上提到的3点,致毒机制也有可能是由于nZVI具有纳米尺寸,会拥有一些与常规材料完全不同的性质,如结合到生物大分子上,干扰其正常的生理功能,nZVI自身及其氧化物阻塞细胞膜上的各种离子通道,阻碍细胞对营养物质的摄取和排泄物的排放[38]。甚至也有可能是nZVI具有较强的吸附性,会主动吸附环境中有毒有害物质如重金属As3+、Hg2+和Pb2+等,进一步和这些重金属协同表现出毒性[50-52]。为了确定毒性机制,还需要综合考虑环境因素和nZVI自身的性质。
3 影响nZVI毒性的因素(Factors influencing nZVI toxicity)
3.1 nZVI的合成方法和条件
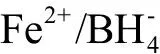
3.2 nZVI氧化
在有氧环境中,nZVI只需2 h就会氧化,2 d就会完全氧化。而在缺氧环境中,nZVI的保鲜期可达数月之久[56]。但在实际使用中,几乎不可能做到完全无氧,因此nZVI毒性的表现大多数时候都是氧化后的行为,有必要全面评测nZVI在氧化前后以及不同氧化时期的毒性。nZVI投加到环境中后,会逐渐氧化生成磁赤铁矿(γ-Fe2O3)、磁铁矿(Fe3O4)、针铁矿(α-FeOOH)和纤铁矿(γ-FeOOH)[57],生成氧化物的类型和速率主要和环境中溶氧量含量有关[58],反应方程式如下[56]:
2Fe2++3H2O→γFe2O3
6Fe2++O2+6H2O→2Fe3O4
γ-FeOOH→α-FeOOH
4Fe++O2+6H2O→4γ-FeOOH
4Fe3O4+O2+6H2O→12γ-FeOOH
Zhou等[59]发现nZVI毒性随着氧化程度的加深而减小,完全氧化的nZVI并未让大肠杆菌产生任何失活。Wang等[60]发现新鲜的和老化2周的nZVI均未对水稻种子的发芽率有明显影响,低浓度的nZVI老化2周后未产生任何毒性,但高浓度的nZVI在老化2周后会严重抑制种子的生长,且老化2周和4周的nZVI对种子生长的抑制并无明显不同。Diao等[44]通过实验证实即使在FeOOH浓度达到10 g·L-1时,仍未对萤光假单胞菌造成毒性。Azam等[61]发现在γ-Fe2O3浓度仅为65 mg·L-1时,枯草杆菌的生长就会大大减缓。Auffan等[61]发现nZVI氧化后的产物Fe3O4对大肠杆菌具有毒性。Jiang等[62]证实Fe3O4甚至会促进副球菌的反硝化作用。氧化后的nZVI对生物的作用取决于生物种类、氧化物种类和浓度,而且对于同种生物的多个观测指标,nZVI对其影响也有可能是不同的,促进某些指标的同时也会抑制某些指标。
3.3 nZVI投加量和接触时间
一般来说nZVI毒性随着投加量的增大而增加,但也有实验表明在nZVI与微生物接触2 h后,低浓度的nZVI毒性更大,接触时间进一步延长至24 h,则只有低浓度的nZVI呈现毒性[63],这和nZVI自身特性有关,因为nZVI颗粒的聚集速度随着浓度的提高而加快,聚集成的大颗粒聚合体会从悬浮液中沉降下来,导致nZVI毒性降低,而低浓度的nZVI聚集作用相对较弱,可以在较长时间内保持毒性[64]。An等[65]发现施氏假单胞菌在与nZVI接触的初始阶段其生长会受到抑制,而后生长会逐渐恢复正常。Saccà等[66]证实假单胞菌与nZVI接触10 min后,nZVI毒性会渐渐减小。可能是由于随着时间延长,nZVI会聚合沉降或者逐渐氧化,从而降低了nZVI毒性。
3.4 nZVI的改性处理
由于nZVI的高活性和其颗粒之间的磁性引力,nZVI极易发生团聚和氧化现象,影响处理污染物的效率,一般在使用时都会对nZVI进行改性处理。Dong等[67]在被CMC改性的nZVI中培养大肠杆菌,发现改性大幅度降低了nZVI毒性,大肠杆菌的细胞膜不仅没有破碎,反而保持完好。Kirschling等[68]的研究表明聚天冬氨酸修饰nZVI后,nZVI会对微生物生长起到促进作用。王菁娇等[69]研究了几种常用类型的nZVI对大肠杆菌的毒性效应,通过大肠杆菌的耐受性实验发现,负载型nZVI的毒性最小,包覆型nZVI毒性次之,进一步研究发现,空间位阻效应是负载型和包覆型毒性减小的主要原因,原理是nZVI表面的改性材料起到了物理阻碍的作用,阻止了nZVI与细胞的直接接触。
Cirtiu等[70]分别用CMC、藻酸双酯钠(PSS)、聚丙烯酸(PAA)和聚丙烯酰胺(PAM)这4种聚合物稳定剂稳定处理nZVI,当采用前期稳定处理时,发现处理后nZVI的平均颗粒粒径大小关系是:PAA-nZVI (189 nm) >PSS-nZVI (182 nm)>PAM-nZVI (101 nm)>CMC-nZVI (82 nm)。而当采用后期稳定处理时,所得的改性nZVI平均粒径均在51.8~56.9 nm之间。粒径越大意味着nZVI在环境中更加稳定,粒径越小,nZVI就越易再次团聚,不利于表现出毒性。因此改性材料和改性方式的选择是改性处理影响nZVI毒性的重要因素。
3.5 其他因素
实际上,nZVI的毒性也会受到其他环境中常见因素的影响。Temsah等[21]在溶液、沙土和黏土中测试nZVI对种子萌发率的作用,发现在黏土中萌发率受到的影响最大,沙土次之,黏土最小。Chen等[71]研究在腐殖酸中nZVI对大肠杆菌的影响,结果发现腐殖酸能大大降低nZVI毒性,TEM显示腐殖酸会分别吸附在nZVI和大肠杆菌的表面,阻碍二者的直接接触。Dong等[67]研究发现Ca2+会对nZVI毒性效应展现出双重作用。一方面Ca2+会促进nZVI的聚集和沉降,减弱毒性;另一方面,Ca2+有助于nZVI在细胞表面的吸附,增强毒性,2种作用的相对强弱取决于Ca2+的浓度。除此之外,由于环境中的温度、pH和其他共存离子等因素会影响nZVI的演变,因此演变过后nZVI的物理化学性质都会发生很大变化,所以完全有可能也会改变其毒性。
4 讨论(Discussion)
nZVI作为一种新兴的环境修复材料,其对环境的负面效应需要重点关注。但nZVI在环境中的毒性效应和影响因素较为复杂,目前的表征手段又非常有限,因此我们对其认知还处在初级阶段。现阶段有关nZVI的毒性效应研究才刚刚起步,并未太多进行实际环境的研究。而且已有的多数研究都是针对微生物,对其他物种毒性效应的探索还远远不够,无法进行整体的类比和归纳,未来还需要从以下方面加强相关研究。
(1)nZVI与环境中其他物质的联动作用。nZVI在环境中有时并不是孤立地在起作用,会受到其他物质的影响,如改性物质和环境中阴阳离子等,相互作用的结果可能是加强nZVI毒性,也有可能是减弱其毒性,加强这方面的研究有利于确定nZVI在实际环境中的表现。
(2)nZVI在环境中的演变规律。nZVI由于自身的特殊性质,从进入环境开始,就会发生一系列改变结构和性质的演变,其中nZVI的氧化就是演变的一种形式,演变的同时其毒性也会随之改变。研究影响演变的条件和演变过程应该是未来研究的一个重点。
(3)nZVI在实际环境中的毒性效应。目前的研究中考虑到的环境条件较为单一,nZVI在实际环境中会受到各种复杂条件的影响,如有机质、土壤质地、水分、矿物质、溶解氧等,而这些条件中有很多还是处在动态变化中,因此nZVI的实际毒性效应具有很大的不确定性。
(4)nZVI毒性的表征手段。现阶段的研究大多只是表征了nZVI对生物体的某些常规指标产生的影响,难以全面描述nZVI的毒性效应。未来还需拓展表征范围,如研究生物体内酶活性和后代遗传性状等内在变化,深入探索nZVI对于生物体细胞内以及基因上的影响效能。
(5)nZVI毒性的时间效应。nZVI投加到环境中后毒性的产生可能是长期和慢性的过程,在某些条件下,短期内的毒性效应可能并不明显,因此需要加强nZVI对生态环境毒性效应的长期和大尺度研究。
(6)nZVI的毒性机制。尽管目前对于毒性机制已经有较多假设,但是确切的机制还不清楚,是否存在其他的机制还需要进一步研究,研究时须同时将环境因素、受试生物和nZVI自身特性等因素纳入考虑之中。
[1] Muftikian R, Fernando Q, Korte N. A method for the rapid dechlorination of low molecular weight chlorinated hydrocarbons in water [J]. Water Research, 1995, 29(10): 2434-2439
[2] Singh S P, Bose P, Guha S, et al. Impact of addition of amendments on the degradation of DDT and its residues partitioned on soil [J]. Chemosphere, 2013, 92(7): 811-820
[3] Lundin L, Molto J, Fullana A. Low temperature thermal degradation of PCDD/Fs in soil using nanosized particles of zerovalent iron and CaO [J]. Chemosphere, 2013, 91(6): 740-744
[4] Song H, Carraway E R. Reduction of chlorinated ethanes by nanosized zero-valent iron: Kinetics, pathways, and effects of reaction conditions [J]. Environmental Science & Technology, 2005, 39(16): 6237-6245
[5] Barnes R J, Riba O, Gardner M N, et al. Inhibition of biological TCE and sulphate reduction in the presence of iron nanoparticles [J]. Chemosphere, 2010, 80(5): 554-562
[6] Li X Q, Zhang W X. Iron nanoparticles: The core-shell structure and unique properties for Ni(II) sequestration [J]. Langmuir, 2006, 22(10): 4638-4642
[7] Li X Q, Zhang W X. Sequestration of metal cations with zerovalent iron nanoparticles—A study with high resolution X-ray photoelectron spectroscopy (HR-XPS) [J]. Journal of Physical Chemistry C, 2007, 111(19): 6939-6946
[8] Jing C, Landsberger S, Li Y L. The application of illite supported nanoscale zero valent iron for the treatment of uranium contaminated groundwater [J]. Journal of Environmental Radioactivity, 2017, 175: 1-6
[9] Zhang W X. Nanoscale iron particles for environmental remediation: An overview [J]. Journal of Nanoparticle Research, 2003, 5(3-4): 323-332
[10] Kanel S R, Greneche J M, Choi H. Arsenic(V) removal from groundwater using nano scale zero-valent iron as a colloidal reactive barrier material [J]. Environmental Science & Technology, 2006, 40(6): 2045-2050
[11] Dong H R, Deng J M, Xie Y K, et al. Stabilization of nanoscale zero-valent iron (nZVI) with modified biochar for Cr(VI) removal from aqueous solution [J]. Journal of Hazardous Materials, 2017, 332: 79-86
[12] Dong H R, He Q, Zeng G M, et al. Chromate removal by surface-modified nanoscale zero-valent iron: Effect of different surface coatings and water chemistry [J]. Journal of Colloid and Interface Science, 2016, 471: 7-13
[13] Pettibone J M, Louie S M. Research highlights: Improved understanding of ecological impacts resulting from nanomaterial-basedinsituremediation. [J]. Environmental Science-Nano, 2016, 3(2): 236-239
[14] Karn B, Kuiken T, Otto M. Nanotechnology andinsituremediation: A review of the benefits and potential risks [J]. Ciencia and Saude Coletiva, 2011, 16(1): 165-178
[15] Su H J, Fang Z Q, Tsang P E, et al. Stabilisation of nanoscale zero-valent iron with biochar for enhanced transport andin-situremediation of hexavalent chromiuminsitu[J]. Environmental Pollution, 2016, 214: 94-100
[16] Ahn J Y, Kim C, Kim H S, et al. Effects of oxidants oninsitutreatment of a DNAPL source by nanoscale zero-valent iron: A field study [J]. Water Research, 2016, 107: 57-65
[17] Zhao X, Liu W, Cai Z Q, et al. An overview of preparation and applications of stabilized zero-valent iron nanoparticles for soil and groundwater remediation [J]. Water Research, 2016, 100: 245-266
[18] Jia H Z, Song C Y, Li H. Research progress of ground water treatment technology of nano-scale zero valent iron [J]. Chemical Industry and Engineering Progress, 2009, 28(11): 2028-2034
[19] Lefevre E, Bossa N, Wiesner M R, et al. A review of the environmental implications ofinsituremediation by nanoscale zero valent iron (nZVI): Behavior, transport and impacts on microbial communities [J]. Science of the Total Environment, 2016, 565: 889-901
[20] Chaithawiwat K, Vangnai A, McEvoy J M, et al. Impact of nanoscale zero valent iron on bacteria is growth phase dependent [J]. Chemosphere, 2016, 144: 352-359
[21] EI-Temsah Y S, Joner E J. Impact of the Fe and Ag nanoparticles on seed germination and differences in bio-availability during exposure in aqueous suspension and soil [J]. Environmental Toxicology, 2012, 27(1): 42-49
[22] El-Temsah Y S, Joner E J. Ecotoxicological effects on earthworms of fresh and aged nano-sized zero-valent iron (nZVI) in soil [J]. Chemosphere, 2012, 89(1): 76-82
[23] Chen P J, Su C H, Tseng C Y, et al. Toxicity assessments of nanoscale zerovalent iron and its oxidation products in medaka (Oryziaslatipes) fish [J]. Marine Pollution Bulletin, 2011, 63(5-12): 339-346
[24] 张章, 唐天乐, 唐文浩. 人工纳米材料对斑马鱼生态毒理效应研究进展[J]. 生态毒理学报, 2016,11(5): 14-23
Zhang Z, Tang T L, Tang W H. Research progress in ecotoxicological effects of engineered nanomaterials [J]. Asian Journal of Ecotoxicology, 2016, 11(5): 14-23 (in Chinese)
[25] Tilston E L, Collins C D, Mitchell G R, et al. Nanoscale zerovalent iron alters soil bacterial community structure and inhibits chloroaromatic biodegradation potential in Aroclor 1242-contaminated soil [J]. Environmental Pollution, 2013, 173: 38-46
[26] Cullen L G, Tilston E L, Mitchell G R, et al. Assessing the impact of nano- and micro-scale zerovalent iron particles on soil microbial activities: Particle reactivity interferes with assay conditions and interpretation of genuine microbial effects [J]. Chemosphere, 2011, 82(11): 1675-1682
[27] Barnes R J, van der Gast C J, Riba O, et al. The impact of zero-valent iron nanoparticles on a river water bacterial community [J]. Journal of Hazardous Materials, 2010, 184(1-3): 73-80
[28] 王学, 李勇超, 李铁龙, 等. 零价纳米铁对大肠杆菌的毒性效应[J]. 生态毒理学报, 2012, 7(1): 49-56
Wang X, Li Y C, Li T L, et al. Toxicity effects of nano-Fe0 onEscherichiacoli[J]. Asian Journal of Ecotoxicology, 2012, 7(1): 49-56 (in Chinese)
[29] Shin K H, Cha D K. Microbial reduction of nitrate in the presence of nanoscale zero-valent iron [J]. Chemosphere, 2008, 72(2): 257-262
[30] Liang J, Xia X, Zaman W Q, et al. Bioaccumulation and toxic effects of decabromodiphenyl ether in the presence of nanoscale zero-valent iron in an earthworm soil system [J]. Chemosphere, 2017, 169: 78-88
[31] Ma X, Gurung A, Deng Y. Phytotoxicity and uptake of nanoscale zero-valent iron (nZVI) by two plant species [J]. Science of the Total Environment, 2013, 443: 844-849
[32] Hjorth R, Coutris C, Nguyen N H A, et al. Ecotoxicity testing and environmental risk assessment of iron nanomaterials for sub-surface remediation—Recommendations from the FP7 project NanoRem [J]. Chemosphere, 2017, 182: 525-531
[33] Kumar N, Omoregie E O, Rose J, et al. Inhibition of sulfate reducing bacteria in aquifer sediment by iron nanoparticles [J]. Water Research, 2014, 51: 64-72
[34] Fajardo C, Ortiz L T, Rodriguez-Membibre M L, et al. Assessing the impact of zero-valent iron (ZVI) nanotechnology on soil microbial structure and functionality: A molecular approach [J]. Chemosphere, 2012, 86(8): 802-808
[35] Fajardo C, Gil-Diaz M, Costa G, et al. Residual impact of aged nZVI on heavy metal-polluted soils [J]. Science of the Total Environment, 2015, 535: 79-84
[36] Ludovica S M, Fajardo C, Martinez-Gomariz M, et al. Molecular stress responses to nano-sized zero-valent iron (nZVI) particles in the soil bacteriumPseudomonasstutzeri[J]. Plos One, 2014, 9(2): e89677
[37] Nel A, Xia T, Madler L, et al. Toxic potential of materials at the nanolevel [J]. Science, 2006, 311(5761): 622-627
[38] 葛兴彬, 王振虹, 郭楚奇, 等. 纳米零价铁的生态毒性效应研究进展[J]. 生态毒理学报, 2015, 10(3): 25-27
Ge X B, Wang Z H, Guo C Q, et al. Review of the ecotoxicity of nanoscale zero-valent iron [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 25-27 (in Chinese)
[39] Gillissen A, Scharling B, Jaworska M, et al. Oxidant scavenger function of ambroxolinvitro: A comparison with N-acetylcysteine [J]. Research in Experimental Medicine, 1997, 196(6): 389-398
[40] Xiong D, Fang T, Chen X, et al. Oxidative stress effects and damage of nanoscale TiO2and ZnO on zebrafish [J]. Chinese Journal of Environmental Science, 2010, 31(5): 1320-1327
[41] Chaithawiwat K, Vangnai A, McEvoy J M, et al. Role of oxidative stress in inactivation ofEscherichiacoliBW25113 by nanoscale zero-valent iron [J]. Science of the Total Environment, 2016, 565: 857-862
[42] Crane R A, Scott T B. Nanoscale zero-valent iron: Future prospects for an emerging water treatment technology [J]. Journal of Hazardous Materials, 2012, 211: 112-125
[43] Adeleye A S, Keller A A, Miller R J, et al. Persistence of commercial nanoscaled zero-valent iron (nZVI) and by-products [J]. Journal of Nanoparticle Research, 2013, 15(1): 18-24
[44] Diao M, Yao M. Use of zero-valent iron nanoparticles in inactivating microbes [J]. Water Research, 2009, 43(20): 5243-5251
[45] Qiu X Q, Fang Z Q, Yan X M, et al. Chemical stability and toxicity of nanoscale zero-valent iron in the remediation of chromium-contaminated watershed [J]. Chemical Engineering Journal, 2013, 220: 61-66
[46] 葛春梅, 黄茜枝, 林道辉, 等. 人工纳米材料对贝类生态毒理效应的研究进展[J]. 生态毒理学报, 2015, 10(4): 1-16
Ge C M, Huang X Z, Lin D H, et al. Research progress in ecotoxic effects of manufactured nanomaterials on shellfish [J]. Asian Journal of Ecotoxicology, 2015, 10(4): 1-16(in Chinese)
[47] Barmo C, Ciacci C, Canonico B, et al.Invivoeffects of n-TiO2on digestive gland and immune function of the marine bivalveMytilusgalloprovincialis[J]. Aquatic Toxicology, 2013, 132: 9-18
[48] Singh N, Manshian B, Jenkins G J S, et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials [J]. Biomaterials, 2009, 30(23-24): 3891-3914
[49] McCarthy M P, Carroll D L, Ringwood A H. Tissue specific responses of oysters,Crassostreavirginica, to silver nanoparticles [J]. Aquatic Toxicology, 2013, 138: 123-128
[50] Amiri M J, Abedi-Koupai J, Eslamian S. Adsorption of Hg(II) and Pb(II) ions by nanoscale zero valent iron supported on ostrich bone ash in a fixed-bed column system [J]. Water Science and Technology, 2017, 76(3): 671-682
[51] Pojananukij N, Wantala K, Neramittagapong S, et al. Improvement of As(III) removal with diatomite overlay nanoscale zero-valent iron (nZVI-D): Adsorption isotherm and adsorption kinetic studies [J]. Water Science and Technology-Water Supply, 2017, 17(1): 212-220
[52] Liu P, Luo H, Fang W. As(Ⅲ) removal by nanoscale zero valent iron-graphene/silica nanocomposites [J]. Chinese Journal of Environmental Engineering, 2016, 10(7): 3607-3615
[53] Han Y L, Yang M D Y, Zhang W X, et al. Optimizing synthesis conditions of nanoscale zero-valent iron (nZVI) through aqueous reactivity assessment [J]. Frontiers of Environmental Science and Engineering, 2015, 9(5): 813-822
[54] Hwang Y H, Kim D G, Shin H S. Effects of synthesis conditions on the characteristics and reactivity of nano scale zero valent iron [J]. Applied Catalysis B-Environmental, 2011, 105(1-2): 144-150
[55] Barreto-Rodrigues M, Silveira J, Zazo J A, et al. Synthesis, characterization and application of nanoscale zero-valent iron in the degradation of the azo dye Disperse Red 1 [J]. Journal of Environmental Chemical Engineering, 2017, 5(1): 628-634
[56] Liu A R, Liu J, Pan B C, et al. Formation of lepidocrocite (gamma-FeOOH) from oxidation of nanoscale zero-valent iron (nZVI) in oxygenated water [J]. RSC Advances, 2014, 4(101): 57377-57382
[57] Li Z, Greden K, Alvarez P J J, et al. Adsorbed polymer and NOM limits adhesion and toxicity of nano scale zerovalent iron toE.coli[J]. Environmental Science & Technology, 2010, 44(9): 3462-3467
[58] Jiang D, Hu X, Wang R, et al. Oxidation of nanoscale zero-valent iron under sufficient and limited dissolved oxygen: Influences on aggregation behaviors [J]. Chemosphere, 2015, 122: 8-13
[59] Zhou L, Thanh T L, Gong J, et al. Carboxymethyl cellulose coating decreases toxicity and oxidizing capacity of nanoscale zerovalent iron [J]. Chemosphere, 2014, 104: 155-161
[60] Wang J, Fang Z Q, Cheng W, et al. Ageing decreases the phytotoxicity of zero-valent iron nanoparticles in soil cultivated withOryzasativa[J]. Ecotoxicology, 2016, 25(6): 1202-1210
[61] Azam A, Ahmed A S, Oves M, et al. Antimicrobial activity of metal oxide nanoparticles against Gram-positive and Gram-negative bacteria: A comparative study [J]. International Journal of Nanomedicine, 2012, 7: 6003-6009
[62] Jiang C, Liu Y, Chen Z, et al. Impact of iron-based nanoparticles on microbial denitrification byParacoccussp. strain YF1 [J]. Aquatic Toxicology, 2013, 142: 329-335
[63] Thao T L, Murugesan K, Kim E J, et al. Effects of inorganic nanoparticles on viability and catabolic activities ofAgrobacteriumsp PH-08 during biodegradation of dibenzofuran [J]. Biodegradation, 2014, 25(5): 655-668
[64] Phenrat T, Saleh N, Sirk K, et al. Aggregation and sedimentation of aqueous nanoscale zerovalent iron dispersions [J]. Environmental Science & Technology, 2007, 41(1): 284-290
[65] An Y, Li T L, Jin Z H, et al. Effect of bimetallic and polymer-coated Fe nanoparticles on biological denitrification [J]. Bioresource Technology, 2010, 101(24): 9825-9828
[67] Dong H R, Xie Y K, Zeng G M, et al. The dual effects of carboxymethyl cellulose on the colloidal stability and toxicity of nanoscale zero-valent iron [J]. Chemosphere, 2016, 144: 1682-1689
[68] Kirschling T L, Gregory K B, Minkley E G, Jr., et al. Impact of nanoscale zero valent iron on geochemistry and microbial populations in trichloroethylene contaminated aquifer materials [J]. Environmental Science & Technology, 2010, 44(9): 3474-3480
[69] 王菁姣, 陈家玮. 不同种类纳米零价铁的毒性比较研究[J]. 现代地质, 2012, 26(5): 926-931
Wang J J, Chen J W. Comparison study on toxicity of different nanoscale zero-valent iron [J]. Geoscience, 2012, 26(5): 926-931 (in Chinese)
[70] Cirtiu C M, Raychoudhury T, Ghoshal S, et al. Systematic comparison of the size, surface characteristics and colloidal stability of zero valent iron nanoparticles pre- and post-grafted with common polymers [J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2011, 390(1-3): 95-104
[71] Chen J, Xiu Z, Lowry G V, et al. Effect of natural organic matter on toxicity and reactivity of nano-scale zero-valent iron [J]. Water Research, 2011, 45(5): 1995-2001
