老化玉米秸秆生物炭对碱性农田土壤氨氧化作用的影响
2018-01-29王朝旭陈绍荣张峰崔建国李红艳
王朝旭*,陈绍荣,张峰,崔建国,李红艳
1. 太原理工大学环境科学与工程学院,山西 晋中 030600;2. 山西省市政工程研究生教育创新中心,山西 晋中 030600
生物炭是生物质材料在缺氧环境中高温热解产生的难熔的、稳定的富碳物质(Lehmann et al.,2009)。近年来,生物炭备受关注,将其施入土壤可以达到固碳(Woolf et al.,2010)、改良土壤(Spokas et al.,2012)和农业增产(Atkinson et al.,2010)的目的。
氮素是作物生长必需的营养元素,也是农业生产可持续发展的根本要素。生物炭的农田施用对土壤氨氧化作用、氨氧化细菌(Ammonia Oxidizing Bacteria,AOB)数量和无机氮含量的影响将直接决定氮肥的生物有效性。一些研究表明,生物炭可以促进土壤氨氧化作用(Nelissen et al.,2012;王晓辉等,2013;Song et al.,2014;He et al.,2016a);然而也有研究表明,生物炭对土壤氨氧化作用没有影响(Deluca et al.,2006;Cheng et al.,2012);甚至有研究发现,生物炭对土壤氨氧化作用和AOB数量有抑制作用(Wang et al.,2015)。究其原因,主要由于生物炭制备材料、温度、土壤类型和酸碱性等不同。同时,目前相关研究多以新鲜生物炭为对象,而忽略老化生物炭对土壤氨氧化作用的影响。
生物炭施入农田之前,暴露在空气中,可使外层碳环氧化;施入农田后,与土壤、微生物和植物根系发生相互作用,也会引起生物炭氧化(Joseph et al.,2010)。Cheng et al.(2008)研究了11种不同生物炭,在不同气候和土壤等自然条件下的氧化反应,发现年平均温度对生物炭氧化的影响比土壤因素(pH、黏土含量等)更显著。苗微(2014)对稻壳生物炭进行了冻融循环老化研究,通过测定生物炭表面的O/C值,表明生物炭发生了氧化作用,且氧化速率较高,氧化程度明显。生物炭发生氧化(老化)是生物炭农田施用过程中普遍存在的现象。
本研究以玉米秸秆为原料,自制新鲜生物炭,并模拟其自然老化、高温老化和冻融循环老化过程,制备老化生物炭。在分析新鲜和老化玉米秸秆生物炭基本特性的基础上,采用室内静态土壤培养实验,探究新鲜和老化玉米秸秆生物炭对黄土高原碱性农田土壤氨氧化速率、AOB数量、无机氮含量和pH的影响,以期探明新鲜和老化生物炭施入农田后,对土壤氨氧化作用的影响,为生物炭在黄土高原地区的农业工程应用提供理论借鉴。
1 材料与方法
1.1 土壤
实验所用土壤采自山西农业大学校内试验田表层(0~20 cm),该区域位于黄土高原东南边缘,土壤类型为褐土。剔除植物根等杂质后,将土壤风干,然后过筛(2 mm),密封保存备用。土壤pH为(8.14±0.02),属碱性土壤;有机质含量为(55.3±1.05) g∙kg-1分 别 为 (37.5±1.08)、 (26.8±0.50)和 (0.40±0.03)mg∙kg-1。
1.2 生物炭
1.2.1 新鲜生物炭的制备
以农业废弃生物质玉米秸秆为原料制备生物炭。玉米秸秆采集后,将杂质去除,50 ℃烘干,粉碎后备用。将预制的玉米秸秆粉末置于管式电阻炉(SK-G10123K,天津中环实验电炉)中,升温前预先通入高纯氮气20 min(流速150 mL∙min-1),以形成无氧环境;然后以 5 ℃∙min-1的升温速率升温至 400 ℃,恒温 2 h。将生物炭冷却至室温(25±2) ℃后过筛(2 mm),便得新鲜玉米秸秆生物炭(生物炭产率38.8%)。
1.2.2 生物炭的老化处理
采用自然老化、高温老化和冻融循环老化3种方式制备老化生物炭。将新鲜玉米秸秆生物炭置于敞口容器中,在老化培养过程中采用称重法保持其重量含水率为77.7%,避光培养50 d。自然老化和高温老化分别在(25±2) ℃(室温)和50 ℃条件下(LRH-150型生化培养箱,上海一恒)进行。冻融循环老化每天采用5 h(-18 ℃,BC-86A型冰箱,合肥美菱)+19 h(25±2 ℃,室温)模式进行培养。培养结束后,将生物炭置于阴凉干燥处自然风干,便得自然老化、高温老化和冻融循环老化玉米秸秆生物炭。
1.2.3 玉米秸秆粉末和生物炭的特性表征
玉米秸秆粉末和生物炭的pH采用pH计测定(炭水比1∶15,Mettler Toledo Delta 320);酸(碱)性含氧官能团数量采用Boehm滴定法测定(Zhang et al.,2011);比表面积、总孔容和平均孔径采用N2吸附BET法测定(Quadrasorb SI,美国康塔)。
1.3 室内培养实验
采用室内静态土壤培养实验,研究玉米秸秆粉末及以其为原料制得的生物炭对碱性农田土壤氨氧化作用的影响。将玉米秸秆粉末和玉米秸秆生物炭(包括新鲜生物炭、自然老化生物炭、高温老化生物炭和冻融循环老化生物炭)与土壤充分混匀(质量比为2%),并等量装入敞口塑料瓶中(400 g土壤+8 g生物炭或秸秆粉末);同时设置不加生物炭的原状土(未灭菌)和灭菌土(原状土121 ℃灭菌30 min)作为对照处理。培养实验共设置7个处理,每个处理4次重复,共28个培养瓶。
首先向培养瓶中加入40 mL蒸馏水,并与土壤充分混匀,预先在室温(25±2) ℃条件下避光培养7 d。预培养结束后,向土壤中均匀喷洒21.3 mL 0.1 mol∙L-1(NH4)2SO4溶液(149.1 mg∙kg-1,大田用量约300 kg∙hm-2,以氮素计),并与土壤充分混匀,同时补充蒸馏水调整土壤重量含水率为18.5%。在室温(25±2) ℃条件下继续避光培养85 d。培养过程中用聚乙烯膜封住瓶口,并用针刺若干小孔,保证通气。同时,每天采用称重法补充土壤水分散失量。将培养瓶内土壤混匀后,分别于第0、1、3、5、7、11、15、22、29、36、43、50、57、71、85 天从每个培养瓶中随机采集30 g土壤样品,将土样置于4 ℃下保存备用,并在24 h内测定其氨氧化速率、AOB数量、无机氮含量和pH。
1.4 氨氧化速率的测定
氨氧化速率的测定采用Kurola et al.(2005)提出的氯酸钾抑制法。称取2.5 g新鲜土壤分别置于5个相同的50 mL具塞锥形瓶中,加入10 mL磷酸盐缓冲剂[NaCl,8.0 g∙L-1;KCl,0.2 g∙L-1;Na2HPO4,0.2 g∙L-1;NaH2PO4,0.2 g∙L-1;pH,7.4;(NH4)2SO4,1 mmol∙L-1;KClO3,10 mmol∙L-1];然后在恒温(25±1) ℃条件下振荡(170 r·min-1),0.5 h 后取出第 1 个锥形瓶,加入 2.5 mL KCl(2 mol∙L-1)溶液,振荡过滤后(0.45 μm 滤膜),测定滤液中含量(国家环境保护总局,2002)271-274;于 1.5、2.5、4.5和6.5 h后分别取出1个锥形瓶,重复上述操作并测定滤液含量。以每小时每克干土中物质的量的增加速率来表示氨氧化速率(nmol∙g-1∙h-1)。
1.5 氨氧化细菌数量的测定
AOB数量的测定采用稀释平板法(林先贵,2010)。AOB培养基配制方法如下:CaCO3,5.0 g;(NH4)2SO4,2.0 g;K2HPO4,0.75 g;NaH2PO4,0.25 g;MgSO4·7H2O,0.03 g;MnSO4·4H2O,0.01 g;NaCl,2.0 g;H2O,1000 mL;pH,7.1;琼脂,0.017 g·mL-1。
称取3.0 g新鲜土壤置于150 mL无菌锥形瓶中,用无菌水定容至30 mL,然后在恒温(25±1) ℃条件下振荡10 min(170 r·min-1),以形成均匀土壤悬液。在超净工作台中,取1 mL土壤悬液加入装有9 mL无菌水的试管中,混匀便得稀释梯度为10-1的溶液;用相同的方法,将上一浓度梯度的溶液进行稀释,可得稀释梯度为10-2的溶液。然后,用接种棒将不同稀释梯度的溶液(0.05 mL)分别均匀涂布在预制的平板表面,各3次重复。最后,将所有平板倒置于生化培养箱(LRH-150,上海一恒)中,在30 ℃条件下避光培养3 d,用肉眼数出每个平板上的菌落数。采用如下公式计算土样中 AOB的数量NAOB。
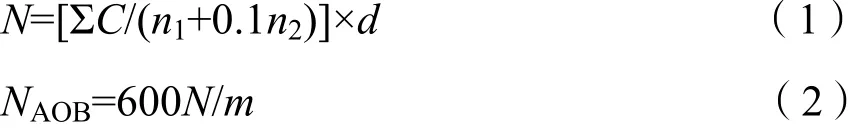
式中,N为0.05 mL土壤悬液中AOB的数量;
ΣC为10-1稀释梯度和10-2稀释梯度,共6个平板上的菌落数之和;n1为10-1稀释梯度的平板数,3;n2为10-2稀释梯度的平板数,3;d为稀释倍数,10;600为30 mL和0.05 mL之间的比值;m为制备土壤悬液所用土壤干重(g);AOB数量以每克干土中AOB的个体数计算(g-1)。
1.6 无机氮含量和pH的测定
称取5.0 g土壤样品置于250 mL锥形瓶中,然后加入 50 mL KCl溶液(2 mol∙L-1),在恒温(25±1) ℃条件下振荡 1 h(170 r·min-1)。上清液经0.45 μm滤膜过滤后,于4 ℃下保存备用;采用比色法测定其含量(国家环境保护总局,2002)258-285。土壤样品的pH采用pH计测定(土水比1∶2.5,Mettler Toledo Delta 320)(鲁如坤,2000)。
运用Origin 8.5制图;Statistica 6.0进行方差分析和多重比较(One-way ANOVA)。
2 结果
2.1 玉米秸秆粉末、新鲜和老化玉米秸秆生物炭的基本特性
不同外源添加材料对土壤氨氧化作用的影响,与其基本理化特性密切相关。玉米秸秆粉末400 ℃热解制成生物炭后,其 pH增大4,可见生物质材料的炭化过程是一个碱性增强的过程。与新鲜玉米秸秆生物炭相比,自然老化玉米秸秆生物炭的 pH降低0.30,羧基数量增加0.031 mmol∙g-1,酸性含氧官能团数量减少 0.005 mmol∙g-1,但差异并不显著(P<0.05);高温老化和冻融循环老化玉米秸秆生物炭的pH分别降低0.50和0.99,羧基数量分别增加0.236 mmol∙g-1和 0.376 mmol∙g-1,酸性含氧官能团数量分别增加 0.200 mmol∙g-1和 0.305 mmol∙g-1,且差异显著(P<0.05)。玉米秸秆粉末炭化后,其比表面积增大了 2.36倍(由 0.720 m2∙g-1增至 2.42 m2∙g-1);与新鲜玉米秸秆生物炭相比,自然老化、高温老化和冻融循环老化玉米秸秆生物炭的比表面积分别增大了 3.43、2.19和 0.99 m2∙g-1(表 1)。
2.2 玉米秸秆粉末和生物炭对土壤氨氧化速率的影响
为探明玉米秸秆粉末和生物炭对碱性农田土壤氨氧化作用的影响,开展为期85 d的室内静态土壤培养实验。结果表明,所有处理的氨氧化速率均随培养时间延长呈增大趋势。第 11天之后,同一采样时间点,原状土添加不同材料后的氨氧化速率(玉米秸秆粉末 69.3~104.0 nmol∙g-1∙h-1;新鲜生物炭91.6~113.0 nmol∙g-1∙h-1;自然老化生物炭 95.4~ 138.1 nmol∙g-1∙h-1; 高 温 老 化 生 物 炭 112.6~152.0 nmol∙g-1∙h-1; 冻 融 循 环老 化 生 物 炭 137.8~167.8 nmol∙g-1∙h-1) 均 显 著 高 于 原 状 土 ( 64.2~91.7 nmol∙g-1∙h-1);且添加不同材料的各处理氨氧化速率呈如下趋势:冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭、玉米秸秆粉末。第7天之前,培养体系处于初期培养阶段,但添加老化生物炭的各处理氨氧化速率仍呈如下趋势:冻融循环老化生物炭>高温老化生物炭>自然老化生物炭。另外,无菌土处理的氨氧化速率(0.495~28.4 nmol∙g-1∙h-1)显著低于其他处理,表明土壤的氨氧化作用主要源自微生物氧化(图1)。
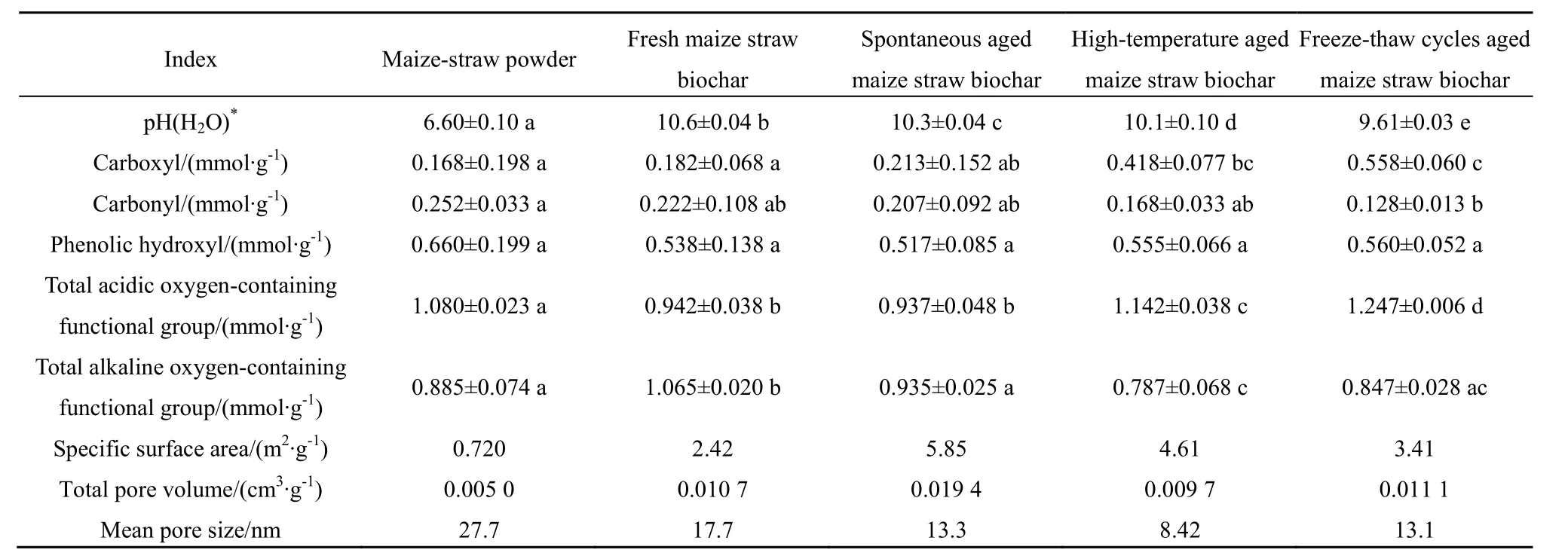
表1 玉米秸秆粉末、新鲜和老化玉米秸秆生物炭的基本特性Table 1 Physicochemical properties of the maize-straw powder, fresh and aged maize straw-derived biochars
2.3 玉米秸秆粉末和生物炭对土壤氨氧化细菌数量的影响
氨氧化细菌(AOB)作为土壤氨氧化作用的主要参与者,其数量可以较直观反映不同添加材料对土壤氨氧化作用的影响。经过85 d的室内培养后,原状土、原状土+玉米秸秆粉末、原状土+新鲜生物炭、原状土+自然老化生物炭、原状土+高温老化生物炭、原状土+冻融循环老化生物炭处理土壤的AOB数量分别是初始状态的2.09、2.80、2.63、2.42、3.17和3.08倍。第11天之后,同一采样时间点,添加老化生物炭的各处理 AOB数量(自然老化生物炭 3.16×105~6.65×105g-1;高温老化生 物炭3.55×105~7.06×105g-1; 冻 融 循 环 老 化 生 物 炭3.35×105~8.01×105g-1)均显著高于其他处理(玉米秸秆粉末 2.94×105~5.87×105g-1;新鲜生 物炭2.32×105~5.19×105g-1),呈如下趋势:冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭、玉米秸秆粉末。第 7天之前,各处理间AOB数量差异并不明显;值得注意的是,添加冻融循环老化生物炭土壤的AOB数量最高(2.60×105~3.93×105g-1)。无菌土处理土壤的AOB数量随培养时间延长呈增加趋势(0~2.11×105g-1),但显著低于其他处理(图2)。
2.4 玉米秸秆粉末和生物炭对土壤无机氮含量的影响
铵态氮(NH4+-N)作为AOB的底物,而硝态氮(NO3--N)和亚硝态氮(NO2--N)作为氨氧化过程的产物,其相对含量可以间接反映土壤氨氧化作用的强度。在整个培养过程中,各处理土壤NH4+-N含量随培养时间延长呈降低趋势,尤其在第 43天之前,NH4+-N含量降低明显。经过85 d的室内培养后,原状土、原状土+玉米秸秆粉末、原状土+新鲜生物炭、原状土+自然老化生物炭、原状土+高温老化生物炭、原状土+冻融循环老化生物炭处理土壤NH4+-N含量分别降低97.4、58.3、94.2、111.0、117.2和127.7 mg∙kg-1。第5天之后,同一采样时间点,添加老化生物炭的各处理土壤NH4+-N含量(自然老化生物炭60.1~139.1 mg∙kg-1;高温老化生物炭57.2~128.8 mg∙kg-1; 冻 融 循 环 老 化 生 物 炭48.7~119.5 mg∙kg-1)明显低于其他处理(玉米秸秆粉末 102.2~150.4 mg∙kg-1;新鲜生物炭 79.1~155.2 mg∙kg-1)(图 3)。
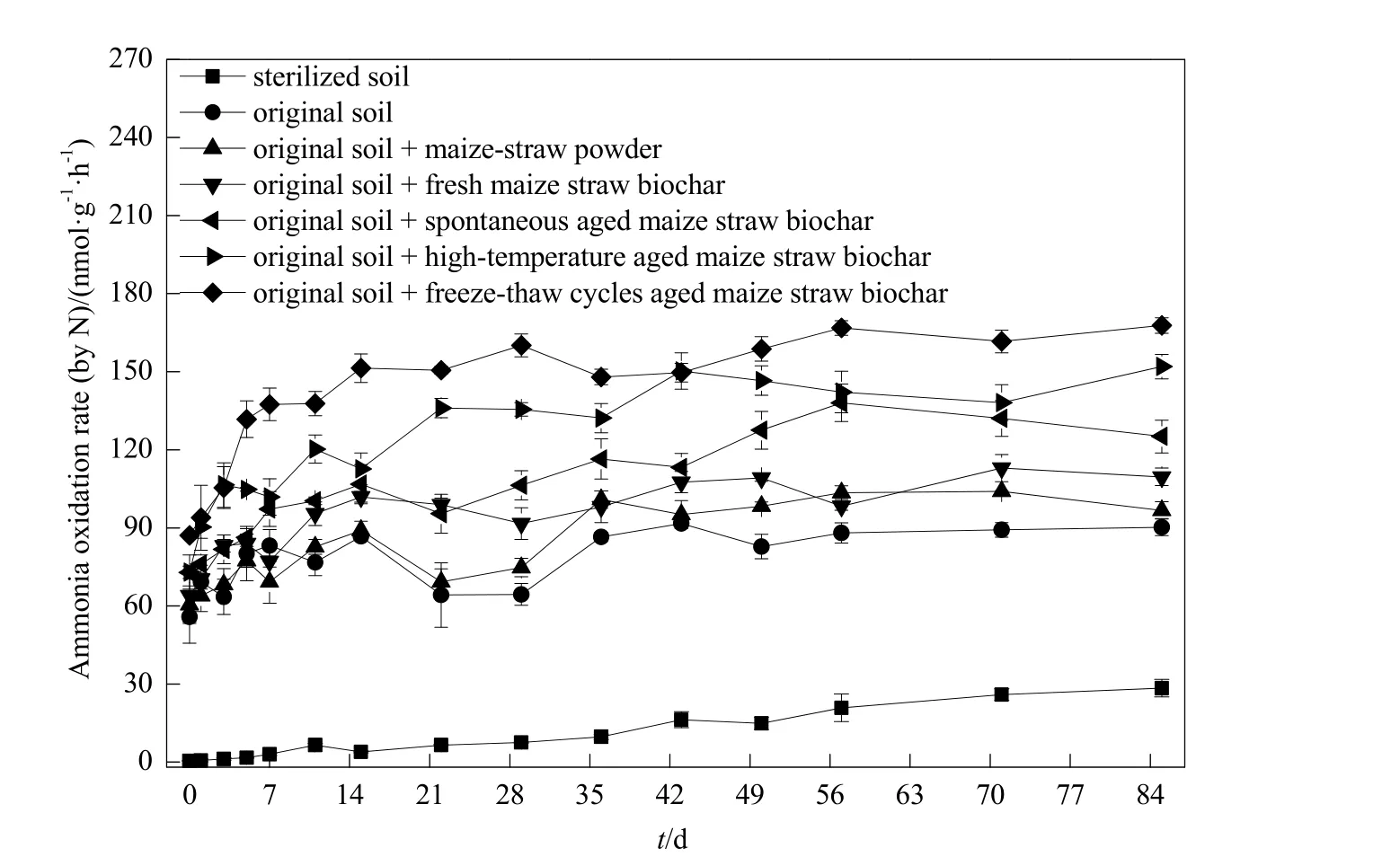
图1 不同处理条件下土壤氨氧化速率的动态变化Fig. 1 The dynamic change of ammonia oxidation rate of the soil amended with different materials n=4. The same below
在整个培养过程中,各处理土壤 NO3--N、含量呈增加趋势。第11天之后,同一采样时间点,添加不同材料的各处理土壤含量与氨氧化速率和 AOB数量呈相同趋势:冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭、玉米秸秆粉末。整个培养过程中,除第7、36天外,同一采样时间点,添加冻融循环老化生物炭处理土壤的含量最高。经过85 d室内培养后,原状土、原状土+玉米秸秆粉末、原状土+新鲜生物炭、原状土+自然老化生物炭、原状土+高温老化生物炭、原状土+冻融循环老化生物炭处理土壤N含量分别增加27.9、40.3、54.0、56.6、78.3 和 88.6 mg∙kg-1;含量分别增加 9.08、10.9、11.8、15.3、13.0和 18.6 mg∙kg-1(图4、图5)。

图2 不同处理条件下土壤氨氧化细菌数量的动态变化Fig. 2 The dynamic change of ammonia-oxidizing bacteria amount of the soil amended with different materials
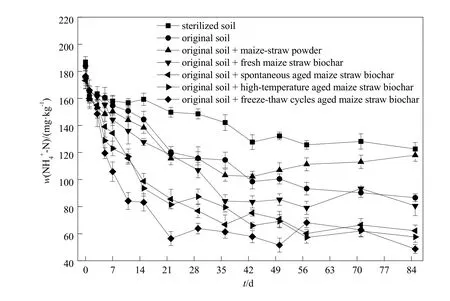
图3 不同处理条件下土壤NH4+-N含量的动态变化Fig. 3 The dynamic change of NH4+-N content of the soil amended with different materials
2.5 玉米秸秆粉末和生物炭对土壤pH的影响
pH是反映添加材料酸碱性,以及土壤氨氧化作用强度的综合指标。在85 d的培养过程中,同一采样时间点,原状土处理的 pH(8.10~8.20)均低于无菌土(8.21~8.36),此现象可能由氨氧化作用所致,氨氧化过程是消耗碱度的过程。从第3天开始,添加冻融循环老化生物炭处理土壤的 pH(8.17~8.40)均低于添加新鲜玉米秸秆生物炭处理(8.20~8.48),一方面由于冻融循环老化生物炭对土壤氨氧化作用具有较强的促进作用,另一方面由于其自身pH较低(冻融循环老化生物炭9.61±0.03;新鲜玉米秸秆生物炭10.6±0.04)。另外,添加玉米秸秆粉末处理土壤的 pH(8.13~8.34)亦显著低于添加新鲜玉米秸秆生物炭处理,主要是由于玉米秸秆粉末自身pH较低 (6.60±0.10)。因此,培养体系pH的动态变化是添加材料酸碱性与土壤氨氧化过程综合作用的结果(图6)。
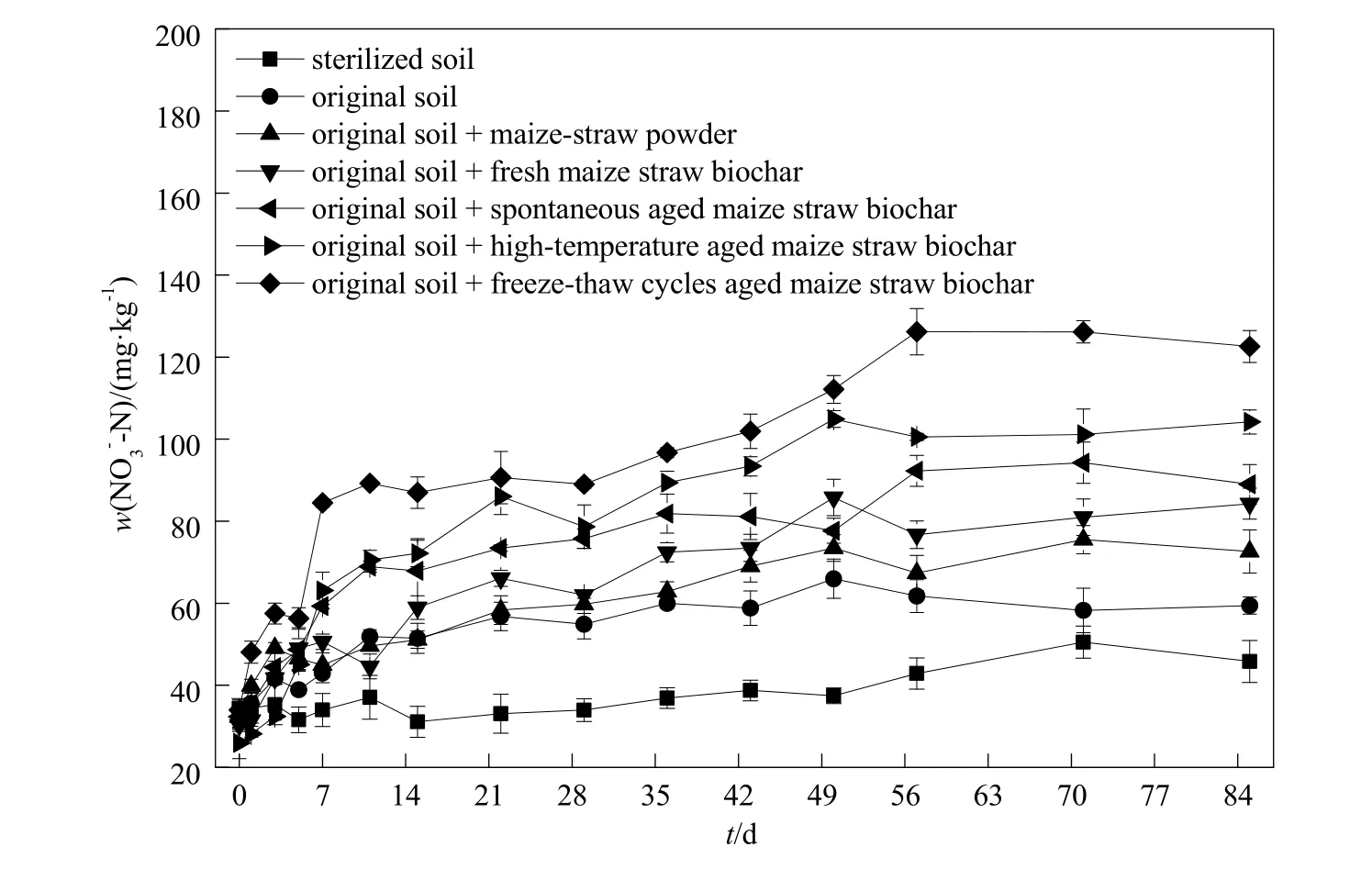
图4 不同处理条件下土壤N含量的动态变化Fig. 4 The dynamic change of content of the soil amended with different materials
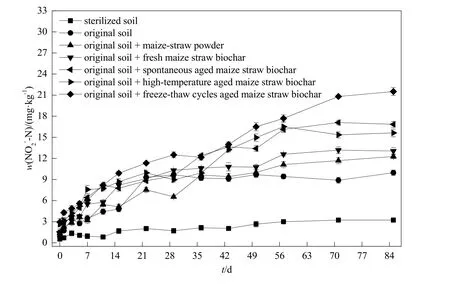
图5 不同处理条件下土壤含量的动态变化Fig. 5 The dynamic change ofcontent of the soil amended with different materials
3 讨论
3.1 不同老化过程对玉米秸秆生物炭基本特性的影响
新鲜玉米秸秆生物炭经自然老化、高温老化和冻融循环老化后,pH均有不同程度降低,其原因一方面可能与老化过程使生物炭中的碱性物质(如碳酸盐、氢氧化物等)溶解有关(Yao et al.,2010);另一方面与老化过程使生物炭表面的羧基和酸性含氧官能团数量增加有关。这与LeCroy et al(.2013)研究结果一致,其将苹果木锯木屑生物炭施入土壤,进行4周温室盆栽老化后,发现其表面的酸性含氧官能团数量增加;Yao et al.(2010)研究也表明,污泥生物炭在300 h的老化作用后,其表面的羧基数量增加。
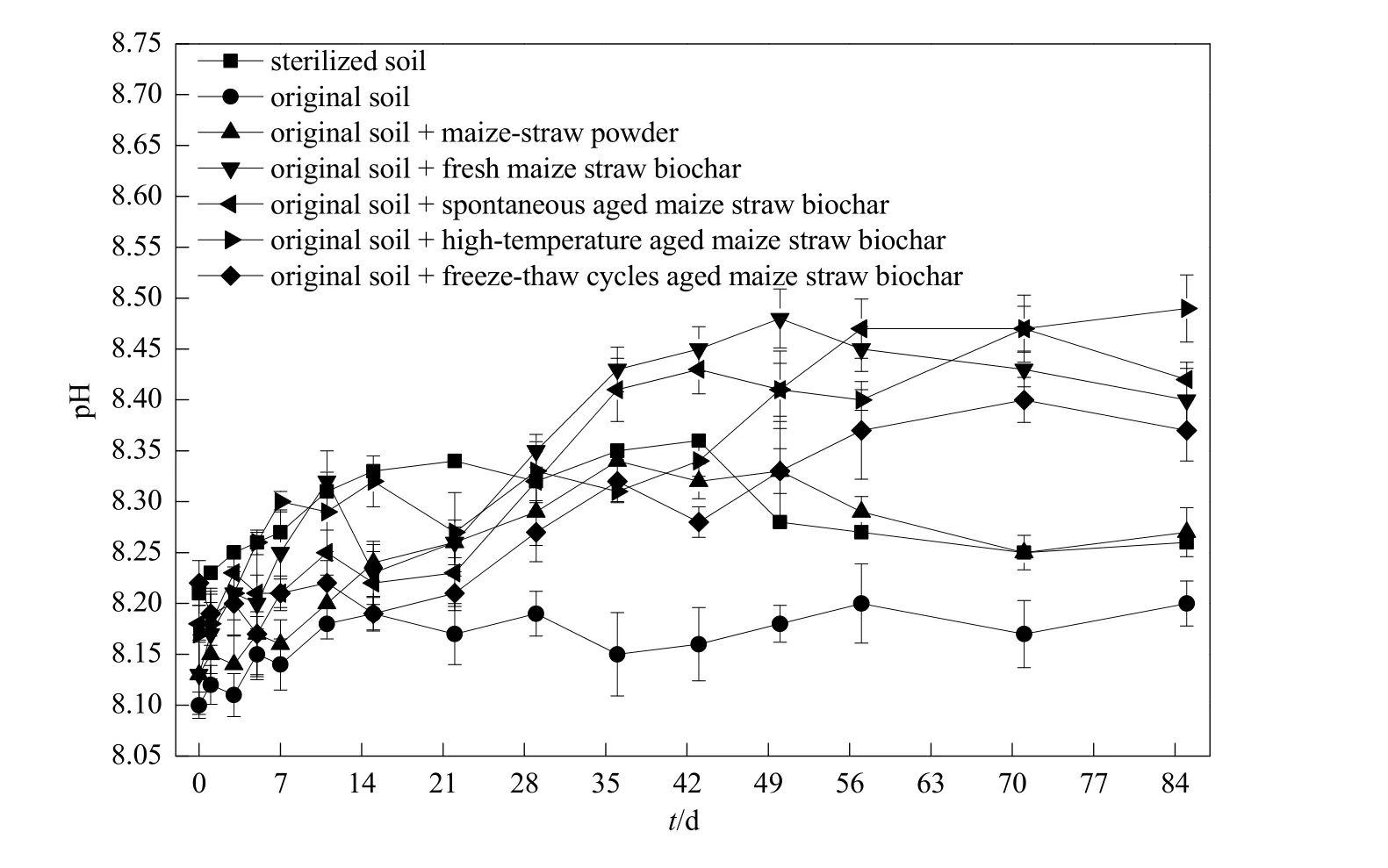
图6 不同处理条件下土壤pH的动态变化Fig. 6 The pH dynamic change of the soil amended with different materials
与自然老化玉米秸秆生物炭相比,高温老化和冻融循环老化玉米秸秆生物炭的pH较低,而羧基和酸性含氧官能团数量较高,这与生物炭的氧化程度有关。自然老化生物炭的氧化程度较低,而高温老化和冻融循环老化过程中,都存在外界因素加速其氧化,氧化程度较高(苗微,2014)。生物炭氧化程度越高,其表面酸性含氧官能团数量越多,pH值越低(Cheng et al.,2009)。鞠文亮等(2017)研究也表明,冻融循环人工强化生物炭老化方式,可以促进生物炭表面的氧化反应,增加生物炭表面的酸性含氧官能团数量,进而降低生物炭的 pH。陈昱等(2016)采用不同方式老化浮萍生物炭,发现由于自然老化生物炭的氧化程度较低,其主要官能团未发生没有显著变化;而高温老化使浮萍生物炭表面的羟基转化为羧基,导致羧基数量增加。
本研究中,自然老化、高温老化和冻融循环老化均使玉米秸秆生物炭的比表面积有不同程度增加,这与苗微(2014)的研究结果一致。在其研究中,稻壳生物炭经过约250 d冻融循环老化后,比表面积极显著高于新鲜生物炭。将坚果壳生物炭施入土壤中进行自然老化,老化过程使生物炭表面有机物消除,微孔数增加,微孔结构逐渐发育,1年后其比表面积从0.095增至69.8 m2∙g-1;老化2年后由于生物炭孔隙被有机物和无机物溶解沉淀堵塞,比表面积有所减小,但依然高于新鲜生物炭(5.79 m2∙g-1)(Trigo et al.,2014)。
3.2 老化生物炭对土壤氨氧化作用的影响
本研究发现,高温老化和冻融循环老化玉米秸秆生物炭表面的羧基和酸性含氧官能团数量均显著(P<0.05)高于新鲜玉米秸秆生物炭。生物炭老化导致其表面酸性含氧官能团数量增加,能够增强生物炭对的吸附作用(Asada et al.,2006;Singh et al.,2010;Esfandbod et al.,2017)。汪艳如等(2017)研究发现,冻融循环老化使450 ℃和600 ℃热解条件下制备的牦牛粪生物炭吸附量比老化前分别显著提高 13.1%和12.4%。在森林、草地以及农田中的研究表明,土壤含量对氨氧化作用有直接控制作用(Booth et al.,2005)。因此,我们推测,正是由于老化生物炭具有更强的吸附富集能力,才提高了氮素的微生物可利用性,从而更显著促进了土壤氨氧化作用。
生物炭的非生物氧化过程在其表面形成含氧基团,增加了生物炭的负电荷量和阳离子交换量,促进其表面多羧酸化合物的形成,降低了生物炭的芳香化程度,从而增强其微生物可利用性(伍孟雄等,2015),促进氨氧化细菌(AOB)的生长。这也是自然老化、高温老化和冻融循环老化生物炭更显著促进土壤氨氧化作用的原因。
本研究表明,自然老化、高温老化和冻融循环老化玉米秸秆生物炭的比表面积均高于新鲜玉米秸秆生物炭。陈昱等(2016)通过扫描电镜也发现,浮萍生物炭自然老化、高温老化和冻融循环老化后,其表面微孔结构更为明显。因此,老化生物炭为吸附更多AOB生长所需底物提供了可能;同时,老化生物炭大量孔洞有利于氧气填充,从而提高AOB 的活性(He et al.,2016b)。
4 结论
老化作用使玉米秸秆生物炭的pH降低,表面羧基和酸性含氧官能团数量增加,比表面积增大。与玉米秸秆粉末和新鲜玉米秸秆生物炭相比,自然老化、高温老化和冻融循环老化玉米秸秆生物炭均促进了碱性农田土壤的氨氧化作用,其促进程度表现为冻融循环老化生物炭>高温老化生物炭>自然老化生物炭。本研究农田土壤的氨氧化作用主要源自微生物氧化。
ASADA T, OHKUBO T, KAWATA K, et al. 2006. Ammonia adsorption on bamboo charcoal with acid treatment [J]. Journal of Health Science,52(5): 585-589.
ATKINSON C J, FITZGERALD J D, HIPPS N A. 2010. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils: a review [J]. Plant and Soil, 337(1):1-18.
BOOTH M S, STARK J M, RASTETTER E. 2005. Controls on nitrogen cycling in terrestrial ecosystems: a synthetic analysis of literature data[J]. Ecological Monographs, 75(2): 139-157.
CHENG C, LEHMANN J. 2009. Ageing of black carbon along a temperature gradient [J]. Chemosphere, 75(8): 1021-1027.
CHENG C, LEHMANN J, ENGELHARD M H. 2008. Natural oxidation of black carbon in soils: Changes in molecular form and surface charge along a climosequence [J]. Geochimica et Cosmochimica Acta, 72(6):1598-1610.
CHENG Y, CAI Z C, CHANG S X, et al. 2012. Wheat straw and its biochar have contrasting effects on inorganic N retention and N2O production in a cultivated Black Chernozem [J]. Biology and Fertility of Soils,48(8): 941-946.
DELUCA T H, MACKENZIE M D, GUNDALE M J, et al. 2006.Wildfire-produced charcoal directly influences nitrogen cycling in ponderosa pine forests [J]. Soil Science Society of America Journal,70(2): 448-453.
ESFANDBOD M, PHILLIPS I R, MILLER B, et al. 2017. Aged acidic biochar increases nitrogen retention and decreases ammonia volatilization in alkaline bauxite residue sand [J]. Ecological Engineering, 98: 157-165.
HE L, LIU Y, ZHAO J, et al. 2016a. Comparison of straw-biochar-mediated changes in nitrification and ammonia oxidizers in agricultural oxisols and cambosols [J]. Biology and Fertility of Soils, 52: 137-149.
HE L, ZHAO X, WANG S, et al. 2016b. The effects of rice-straw biochar addition on nitrification activity and nitrous oxide emissions in two Oxisols [J]. Soil & Tillage Research, 164: 52-62.
JOSEPH S D, CAMPS-ARBESTAIN M, LIN Y, et al. 2010. An investigation into the reactions of biochar in soil [J]. Australian Journal of Soil Research, 48(6-7): 501-515.
KUROLA J, SALKINOJA-SALONEN M, AARNIO T, et al. 2005. Activity,diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil [J]. FEMS Microbiology Letters,250(1): 33-38.
LECROY C, MASIELLO C A, RUDGERS J A, et al. 2013. Nitrogen,biochar, and mycorrhizae: Alteration of the symbiosis and oxidation of the char surface [J]. Soil Biology & Biochemistry, 58: 248-254.
LEHMANN J, JOSEPH S. 2009. Biochar for environmental management:science and technology (second edition) [M]. London: Earthscan Publications Ltd: 1-12.
NELISSEN V, RUTTING T, HUYGENS D, et al. 2012. Maize biochars accelerate short-term soil nitrogen dynamics in a loamy sand soil [J].Soil Biology & Biochemistry, 55: 20-27.
SINGH B P, HATTON B J, SINGH B, et al. 2010. Influence of biochars on nitrous oxide emission and nitrogen leaching from two contrasting soils[J]. Journal of Environmental Quality, 39(4): 1224-1235.
SONG Y, ZHANG X, MA B, et al. 2014. Biochar addition affected the dynamics of ammonia oxidizers and nitrification in microcosms of a coastal alkaline soil [J]. Biology and Fertility of Soils, 50(2): 321-332.SPOKAS K A, CANTRELL K B, NOVAK J M, et al. 2012. Biochar: a synthesis of its agronomic impact beyond carbon sequestration [J].Journal of Environmental Quality, 41(4): 973-989.
TRIGO C, SPOKAS K A, COX L, et al. 2014. Influence of soil biochar aging on sorption of the herbicides MCPA, nicosulfuron,terbuthylazine, indaziflam, and fluoroethyldiaminotriazine [J]. Journal of Agricultural and Food Chemistry, 62(45): 10855-10860.
WANG Z Y, ZONG H Y, ZHENG H, et al. 2015. Reduced nitrification and abundance of ammonia-oxidizing bacteria in acidic soil amended with biochar [J]. Chemosphere, 138: 576-583.
WOOLF D, AMONETTE J E, STREET-PERROTT F A, et al. 2010.Sustainable biochar to mitigate global climate change [J]. Nature Communications, DOI: 10.1038/ncomms1053.
YAO F X, ARBESTAIN M C, VIRGEL S, et al. 2010. Simulated geochemical weathering of a mineral ash-rich biochar in a modified Soxhlet reactor [J]. Chemosphere, 80(7): 724-732.
ZHANG G, ZHANG Q, SUN K, et al. 2011. Sorption of simazine to corn straw biochars prepared at different pyrolytic temperatures [J].Environmental Pollution, 159(10): 2594-2601.
王晓辉, 郭光霞, 郑瑞伦, 等. 2013. 生物炭对设施退化土壤氮相关功能微生物群落丰度的影响[J]. 土壤学报, 50(3): 624-631.
伍孟雄, 杨敏, 孙雪,等. 2015. 生物质炭生物与非生物氧化特性研究进展[J]. 生态学报, 35(9): 2810-2818.
汪艳如, 侯杰发, 郭建华, 等. 2017. 冻融循环对牦牛粪生物炭吸附氨氮的影响[J]. 农业环境科学学报, 36(3): 566-573.
林先贵. 2010. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社:32-52.
苗微. 2014. 生物炭陈化对土壤养分和水稻生长的影响[D]. 沈阳: 沈阳农业大学: 31-53.
国家环境保护总局. 2002. 水和废水监测分析方法 [M]. 第 4版. 北京:中国环境科学出版社.
鞠文亮, 荆延德. 2017. 陈化处理对棉花秸秆生物炭理化性质的影响[J].环境科学学报, 37(10): 3853-3861.
陈昱, 梁媛, 郑章琪, 等. 2016. 浮萍生物炭的老化作用对其性质及对Cd (II) 吸附的影响[J]. 环境工程, 34(10): 60-64.
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社:12-13.
