生物炭基钼肥对土壤无机氮形态转化的影响
2018-01-29黄永东杜应琼陈永坚管颐雯邓腾灏博李蕾吴志超柳勇
黄永东,杜应琼*,陈永坚,管颐雯,邓腾灏博,李蕾,吴志超,柳勇
1. 广东省农业科学院农产品公共监测中心//农业部农产品质量安全检测与评价重点实验室,广东 广州 510640;2. 广东省生态环境技术研究所//广东省农业环境综合治理重点实验室,广东 广州 510650
氮是植物生长不可或缺的营养元素,直接影响植物的生长发育和形态建成。铵态氮和硝态氮作为植物从土壤中吸收的无机氮的主要形态,对植物的形态学特征以及生理代谢过程具有显著的影响。不同植物对铵态氮和硝态氮需求有较大差异(邢瑶等,2015)。生物炭是近年来农林等领域研究的热点,研究表明生物炭通过影响土壤理化性质直接或间接地影响土壤氮的硝化作用(何飞飞等,2014;Cayuela et al.,2013)、铵态氮和硝态氮的固持(Mandal et al.,2016;Clough et al.,2013;Haider et al.,2016),从而影响土壤中氮的形态。然而,目前有关不同生物炭对土壤中铵态氮和硝态氮的综合影响还末见报道。探明施入不同生物炭对土壤铵态氮和硝态氮的变化,对指导生产实践中根据作物对铵态氮和硝态氮需求有针对性地施肥,对有效提高作物产量和降低作物(特别是叶类蔬菜)体内的硝酸盐含量有重要意义。
另外,钼作为硝酸还原本酶的重要组成成分,对作物特别是旱地作物的氮代谢具有重要影响。同时考虑广东作为中国两大缺钼区之一,其大面积的强酸性土壤会使直接施入土壤中的钼失活而难以被作物吸收(刘铮等,1990;广东省土壤普查办公室,1993),而生物炭具有提高土壤钼的活性(Johansson et al.,2016)和缓释作用(Yao et al.,2011;Takaya et al.,2016),因此本研究将钼与生物炭结合制备成生物炭基钼肥,一方面研究其对土壤氮形态的影响,为生物炭基钼肥与不同氮肥的合理施用提供依据,另一方面为后期研究生物炭基钼肥对土壤有效钼含量、作物钼吸收及对植物体内氮代谢的影响提供基础资料。
1 材料与方法
1.1 试验材料
(1)生物炭基钼肥:根据广东省主要作物种类与性质筛选出8种代表性的废弃物,制备成谷壳炭基钼肥(RHB)、甘蔗渣炭基钼肥(BB)、花生壳炭基钼肥(PSB)、水稻秸秆炭基钼肥(RSB)、玉米秸秆炭基钼肥(CSB)、花生秸秆炭基钼肥(PB)、水葫芦炭基钼肥(WHB)、丝瓜藤炭基钼肥(LB)。原料谷壳采自茂名化州市,甘蔗渣和花生壳采自茂名市电白区,水稻秸秆采自广东省农业科学院大丰试验基地,玉米秸秆、丝瓜藤和花生秸秆采自广东省农业科学院钟落潭试验基地,水葫芦采自韶关市丹霞山锦江水库。生物质破碎后置于真空箱式气氛炉内,抽真空后充入氮气作为保护气体,以 10 ℃·min-1的升温速度升至 600 ℃后恒温炭化2 h,冷却后取出,粉碎过筛(0.85 mm孔径)得到生物炭。8种生物炭的基本理化性质见表 1。钼酸铵与生物炭按质量比 1∶200000振荡吸附平衡48 h,自然晾干后得到生物炭基钼肥(杜应琼等,2015)。
(2)供试土壤:采自广东省清远市佛冈县石角镇(23°52'N,113°29'E)的典型赤红壤,土样晾干后过10 mm孔筛,充分混匀后备用,其基本理化性质见表2。
1.2 试验设计
采用模拟常温条件培养土壤。共 10个处理,分别为对照(CK)、钼基施(MO)、水葫芦炭基钼肥(WHB)、水稻秸秆炭基钼肥(RSB)、谷壳炭基钼肥(RHB)、玉米秸秆炭基钼肥(CSB)、甘蔗渣炭基钼肥(BB)、丝瓜藤炭基钼肥(LB)、花生壳炭基钼肥(PSB)、花生秸秆炭基钼肥(PB),各处理3个重复。生物炭的施用量为60.0 g∙kg-1(即1 kg土壤施加60.0 g生物炭,下同),钼基施和8种生物炭基钼肥处理中的钼施用量(以钼酸铵计)均为0.3 mg∙kg-1。称取250 g土壤置于1 L塑料桶中,加入一定量NH4Cl溶液或 NaNO3溶液,使外加或N质量分数达到450 mg∙kg-1。加蒸馏水使土壤含水量达到70%最大持水量,混合均匀后于(25±1) ℃下培养,期间每隔2~3 d用称重法补充水分以维持70%最大持水量。分别在第0、1、2、4、8、18、30、42、54、66、78、93、108 天取新鲜土样(0天为拌土后立即取样),测试土壤中N、N的含量和pH。添加铵态氮实验用于分析土壤pH、铵态氮的动态变化以及硝化作用,添加硝态氮实验用于分析土壤pH和硝态氮的动态变化。
1.3 测定方法
土壤有机质采用硫酸-重铬酸钾氧化-硫酸亚铁滴定法测定(任意等,2006);阳离子交换量(CEC)采用乙酸钙交换-氢氧化钠滴定法测定(张万儒等,1999);全氮含量采用凯氏蒸馏-定氮仪法测定(辛景树等,2012);最大持水量采用环刀法测定(王艳丽,2016);pH采用水土比2.5∶1浸提-酸度计法测定(王敏等,2007);有效磷含量采用氟化铵-盐酸浸提-钼锑抗比色法测定(辛景树等,2014);速效钾含量采用乙酸铵浸提-电感耦合等离子发射光谱法测定(蕉如珍等,2015);土壤NH4+-N和NO3—N含量采用0.01 mol∙L-1氯化钙浸提-流动注射分析仪测定(朱强等,2012)。
生物炭:C和 N采用元素分析仪(德国ELEMENTAR元素分析仪vario micro)测定;灰分于高温电炉(800±20) ℃条件下灼烧2 h后称重(邓先伦等,1999);钙、镁、钠含量采用全消解-电感耦合等离子体质谱法测定(江苏省环境监测中心,2016);pH、速效钾和有效磷等测定方法参照土壤的测定。

表1 生物炭的基本理化性质Table 1 Basic physical and chemical properties of biochars

表2 供试土壤基本理化性质Table 2 Basic physical and chemical properties of soil
1.4 数据处理方法
试验数据采用 Excel计算和作图,采用 SPSS统计软件进行多重比较、相关性分析和非线性回归。铵态氮和硝态氮固持量的计算:原始土壤和生物炭基钼肥中的铵态氮和硝态氮含量相对于外源添加的氮含量(450 mg∙kg-1)可以忽略,因此,固持量由所测土壤可提取态氮含量除以外源添加的氮含量计算所得。铵态氮的硝化率由培养结束时硝态氮的含量除以培养一天时的铵态氮含量得出。多重比较采用Duncan法,显著性水平为0.05。相关性分析采用Pearson相关系数,双侧检验显著性,显著性水平0.05为显著相关,0.01为极显著相关。硝化作用的非线性回归参照董江水(2007)的方法,Logistic方程表达式为N=Np/(1+Ce-rt),先估算参数Np(取距离最大观测值不远的渐近值),根据实测值计算参数C和r,将Np、C、r和方程表达式填入SPSS统计软件 Nonlinear Regression,拟合得出Logistic曲线指数模型,并计算最大累积速率、达到最大累积的时间、延滞期和最大硝化潜势。
2 结果与分析
2.1 添加铵态氮和生物炭基钼肥对土壤pH的影响
生物炭基钼肥显著提高了土壤 pH。不同生物炭基钼肥对土壤pH的提高幅度和变化趋势存在较大差异。如图1所示,在整个培养期内,CK和MO处理之间土壤pH几乎没有差异,表明单施钼肥对土壤pH值没有影响,由于铵态氮水解可使pH下降,CK和MO处理pH由原土壤的4.47降到4.10。而施生物炭基钼肥后,土壤pH值均显著提高。BB、RHB和PSB处理土壤pH在一天内迅速提高,分别比CK提高了0.37、0.57和1.20,之后分别在4.50、4.60、5.45附近轻微波动。相对于CK,RSB、PB、CSB和WHB、LB处理土壤pH均在一天内大幅度提高,分别比CK提高了2.77、3.28、3.85、3.54和3.78。30天后RSB、CSB和PB处理土壤pH开始加速下降,至第93天时趋于平稳,此时各处理土壤pH和第30天时比较,分别下降了1.41、2.06和1.38。WHB处理土壤pH从第54天才开始下降,至培养结束时仅下降0.70。LB处理在整个培养周期内土壤pH在7.9左右小幅波动。
不同生物炭基钼肥刚加入土壤时,土壤pH值存在显著差异,可能是由于各生物炭盐基离子含量不同造成的,一般而言,盐基离子含量越高,土壤pH值越大,反之则越低(赵静等,2009)。RHB、BB和PSB生物炭盐基离子(K、Na、Ca、Mg)含量低于其他生物炭,所以其加入土壤后土壤pH的提高幅度较低。
2.2 添加铵态氮和生物炭基钼肥对土壤铵态氮的影响
外源添加的铵态氮,因在土壤中发生固持、硝化等反应而发生含量变化。如图2所示,施入土壤中的可提取铵态氮含量在一天内迅速降低,其余部分被土壤吸附固持。以培养一天计算固持量,CK和MO处理固持的铵态氮分别为31.0%、30.6%,二者间无显著差异;生物炭基钼肥处理铵态氮固持量为34.1%~42.7%,比CK增加了10%~38%,说明生物炭基钼肥极大地提高了土壤固持铵态氮量。此后,CK、MO、RHB、BB和PSB处理土壤铵态氮含量维持在此附近上下波动;RSB处理土壤铵态氮含量在第2~30天内波动微弱,30~108 d缓慢降低至132 mg∙kg-1,可能是由于土壤pH降低导致硝化作用减弱(侯雪燕,2014);CSB、WHB和PB处理土壤铵态氮含量在18 d后迅速降低,在93 d时已几乎全部转化;LB处理土壤铵态氮转化几乎一开始就启动,在54 d时已几乎全部转化。由此表明,不同生物炭基钼肥对土壤中铵态氮转化的影响差异巨大。
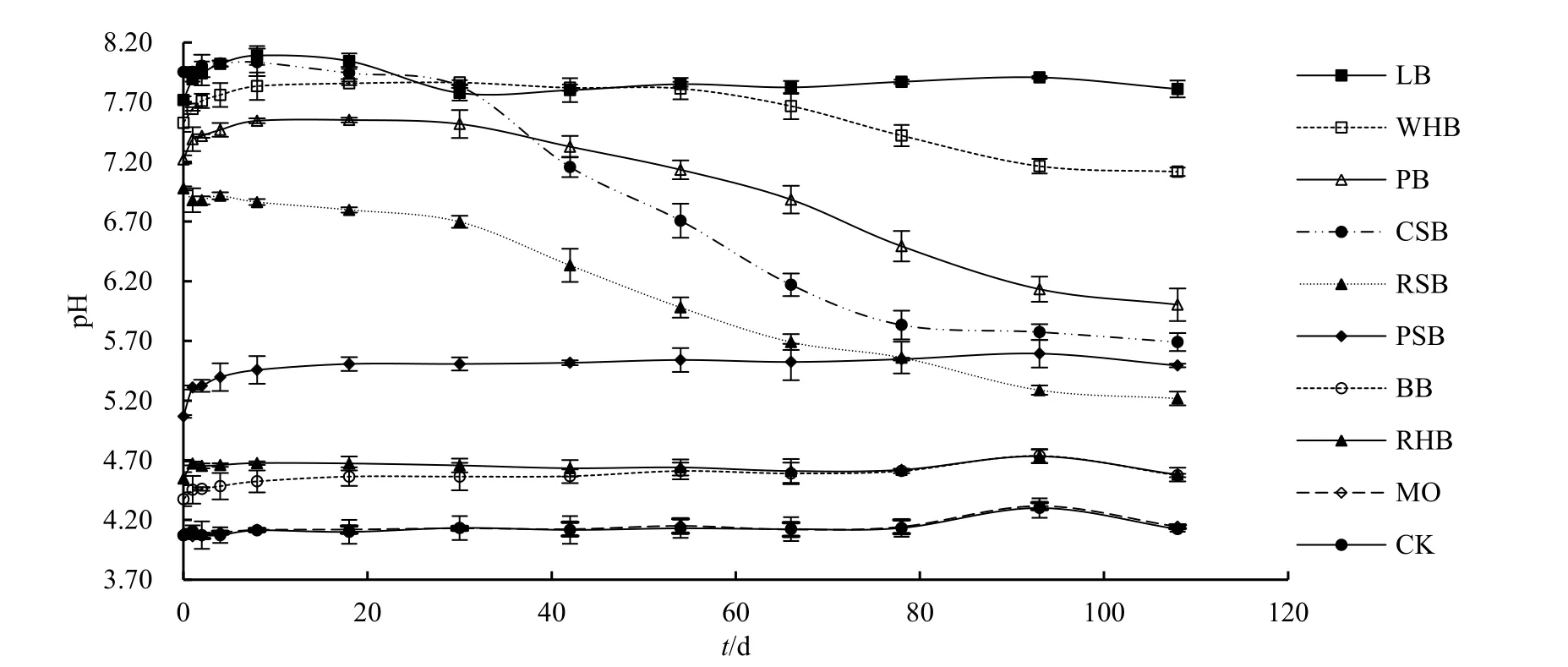
图1 添加铵态氮和生物炭基钼肥土壤pH的动态变化Fig. 1 Dynamic changes of soil pH after applying -N andbiochar-based molybdenum

图2 添加铵态氮和生物炭基钼肥土壤铵态氮的动态变化Fig. 2 Dynamic changes of soil-N after applying -N andbiochar-based molybdenum
2.3 生物炭基钼肥对土壤硝化作用的影响
施入土壤中的生物炭基钼肥通过影响土壤的pH值而影响土壤中铵态氮的硝化速率。如图 3所示,在整个土壤培养过程中,CK、MO、RHB、BB、PSB处理土壤硝态氮的含量维持在很低的范围内,硝化作用不显著。其他处理土壤硝态氮的含量呈升高趋势,其中LB处理土壤硝态氮的含量在第9天开始升高,在30 d达到200 mg∙kg-1后开始出现小幅下降,到58 d后又开始出现上升趋势,培养结束时土壤硝态氮的含量显著高于其他处理。RSB、WHB、PB、CSB处理土壤硝态氮的含量均在35 d后出现升高趋势,硝化速率存在差异,但在培养结束时硝态氮含量差异不显著。结合土壤铵态氮含量分析,RSB硝化率近50%,LB、WHB、PB、CSB硝化率近 100%。相关性分析表明,培养结束时土壤硝态氮含量与pH呈极显著正相关。
氨氧化细菌的数量是硝化作用的限速因素,生物炭基钼肥可能通过影响土壤pH进而影响氨氧化细菌的生长(Song et al.,2014)。如表3所示,LB、CSB、PB、WHB、RSB 5种处理土壤硝态氮的含量变化符合 Logistic曲线(P<0.05),相关系数 RS2在0.958~0.996之间。根据Logistic指数模型,硝化作用最大累积速率从大到小依次为 LB、WHB、CSB、PB、RSB。LB处理在第17天(延滞期)开始出现硝化作用,19 d(达到最大累积的时间)最大累积量为200.7 mg∙kg-1(最大硝化潜势);WHB处理在第40天开始出现硝化作用,52 d达最大累积量166.7 mg∙kg-1;CSB处理在第28天开始出现硝化作用,51 d达最大累积量168.8 mg∙kg-1;PB处理在第47天开始出现硝化作用,76 d达最大累积量193.8 mg∙kg-1;RSB处理在第43天开始出现硝化作用,70 d达最大累积量138.7 mg∙kg-1。

图3 添加铵态氮和生物炭基钼肥土壤硝态氮的动态变化Fig. 3 Dynamic changes of soi-N after applying-N andbiochar-based molybdenum
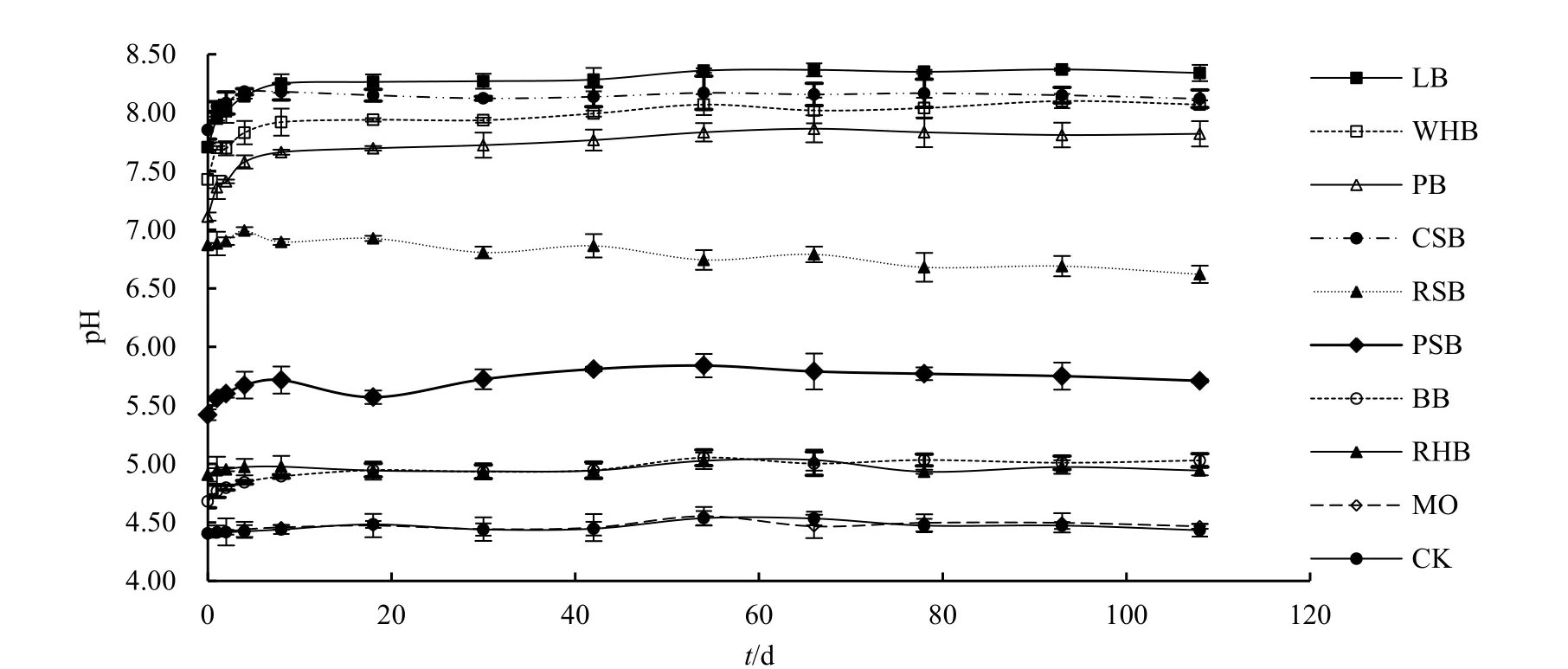
图4 添加硝态氮和生物炭基钼肥土壤pH的动态变化Fig. 4 Dynamic changes of soil pH after applying N and biochar-based molybdenum
2.4 添加硝态氮和生物炭基钼肥对土壤pH的影响
在添加硝态氮的实验中,CK和MO处理土壤pH在整个培养期内基本在接近初始土壤pH(图4)的 4.40~4.55之间波动。而生物炭基钼肥处理土壤pH则快速升高,培养1 d后PSB、BB和RHB的硝态氮处理土壤pH显著高于铵态氮处理,而WHB、RSB、CSB、LB和PB处理在两者间差异不显著,由此表明,将土壤pH提高到中性或碱性的生物炭基钼肥处理,铵态氮短期内对pH几乎没有影响。在培养的中后期,各处理pH均较为稳定,可能是由于硝态氮等盐基离子变化微弱所致。
2.5 添加硝态氮和生物炭基钼肥对土壤硝态氮的影响

图5 添加硝态氮和生物炭基钼肥土壤硝态氮含量的动态变化Fig. 5 Dynamic changes of soil -N after applying -N and biochar-based molybdenum
如图5所示,硝态氮添加到土壤后其可提取态氮含量在2 d内迅速降低,说明土壤对硝态氮的固持效果明显。以培养两天计算固持率,CK处理中土壤对硝态氮的固持率为36.0%;而生物炭基钼肥处理中硝态氮固持率为 40%~47%;所有生物炭基钼肥处理中,RHB和PSB对硝态氮的固持效果最强,达47%。各处理的硝态氮含量在108 d培养周期内缓慢波动。当培养结束后,CK、RHB、RSB、PB和WHB处理硝态氮含量与培养2 d相比显著降低,降幅为7%~12%,而MO、BB、CSB、LB、PSB处理硝态氮含量与培养2 d相比差异不显著,不同处理产生的差异可能与土壤反硝化作用有关(Cayuela et al.,2013;Case et al.,2015)。结果表明,生物炭基钼肥有促进土壤固持硝态氮的作用。
3 讨论
3.1 生物炭对土壤铵态氮和硝态氮固持作用的影响
生物炭基钼肥可以显著促进土壤对铵态氮和硝态氮的固持作用。这主要是由于生物炭具有较大的比表面积和较强的吸附性(Kanthle et al.,2016;Karhu et al.,2011)。生物炭对铵态氮的吸附可能与酸性官能团(酚羟基和羧基)和磷酸铵镁复合物的形成有关(Cui et al.,2016);而生物炭对硝态氮的吸附则以物理吸附作用为主(Jassal et al.,2015)。此外,生物炭对土壤pH及CEC的提高也可显著促进氮在土壤中的固持(Hollister et al.,2013)。
3.2 生物炭基钼肥对土壤中铵态氮的转化的影响
生物炭基钼肥对土壤中铵态氮的转化具有重要影响。生物炭的施加可改变土壤pH及有机质含量等理化性质,从而直接或间接地影响土壤微生物的硝化速率(Ball et al.,2010)。其中,土壤pH值是影响硝化作用的主要因素(Nicol et al.,2008)。因此,能够显著提高土壤pH的生物炭基钼肥(丝瓜藤炭基钼肥、水葫芦炭基钼肥、玉米秸秆炭基钼肥、水稻秸秆炭基钼肥、花生秸秆炭基钼肥)处理中铵态氮向硝态氮的转化速率明显强于其他处理。
由此可见,生物炭基钼肥对土壤pH值的调节作用是影响土壤无机氮固持和转化的重要因素。一般而言,生物炭的盐基离子含量越高,其对土壤pH的调升作用就越强(赵静等,2009)。本实验选取的甘蔗渣炭基钼肥、花生壳炭基钼肥和谷壳炭基钼肥的盐基离子(钾、钠、钙和镁)含量远低于其他生物炭基钼肥,故其对土壤pH及硝化作用的提升幅度较低。
4 结论
(1)生物炭基钼肥可以显著促进土壤对铵态氮和硝态氮的固持作用。8种生物炭基钼肥可使土壤对铵态氮的起始固持量增加10%~38%,硝态氮的起始固持量增加12%~30%。铵态氮和硝态氮在土壤中的固持主要于生物炭施入土壤后2 d内完成。
(2)本试验条件下,因甘蔗渣炭基钼肥、花生壳炭基钼肥和谷壳炭基钼肥盐基离子含量低,施入土壤后土壤pH仅提高了0.5~1个单位,而铵态氮的添加使土壤pH大幅下降,导致土壤硝化作用不显著,铵态氮在整个培养期内几乎不转化成硝态氮。其他5种生物炭基钼肥的施用可使土壤pH提高2.8~3.8单位,此时添加的铵态氮对土壤pH几乎没有影响,故硝化作用显著。其中,水稻秸秆炭基钼肥处理硝化率近50%,丝瓜藤炭基钼肥、水葫芦炭基钼肥、玉米秸秆炭基钼肥、花生秸秆炭基钼肥处理硝化率近 100%;培养结束时,土壤硝态氮含量与pH呈极显著正相关,说明生物炭基钼肥提高土壤pH是它影响土壤硝化速率的重要因素。硝化作用最大累积速率从大到小依次为丝瓜藤炭基钼肥、水葫芦炭基钼肥、玉米秸秆炭基钼肥、花生秸秆炭基钼肥、水稻秸秆炭基钼肥。
BALL P N, MACKENZIE M D, DELUCA T H, et al. 2010. Wildfire and charcoal enhance nitrification and ammonium-oxidizing bacterial abundance in dry montane forest soils [J]. Journal of Environmental Quality, 39(4): 1243-1253.
CASE S D C, MCNAMARA N P, REAY D S, et al. 2015. Biochar suppresses N2O emissions while maintaining N availability in a sandy loam soil [J]. Soil Biology and Biochemistry, 81: 178-185.
CAYUELA M L, SÁNCHEZMONEDERO M A, ROIG A, et al. 2013.Biochar and denitrification in soils: when, how much and why does biochar reduce N2O emissions? [J]. Scientific Reports, 3(7446): 1732.CLOUGH T J, CONDRON L M, KAMMANN C, et al. 2013. A review of biochar and soil nitrogen dynamics [J]. Agronomy, 3(2): 275-293.
CUI X, HAO H, ZHANG C, et al. 2016. Capacity and mechanisms of ammonium and cadmium sorption on different wetland-plant derived biochars [J]. Science of the Total Environment, 539: 566-575.
DELUCA T H, MACKENZIE M D, GUNDALE M J, et al. 2006.Wildfire-produced charcoal directly influences nitrogen cycling in ponderosa pine forests [J]. Soil Science Society of America Journal,70(2): 448-453.
HAIDER G, STEFFENS D, MÜLLER C, et al. 2016. Standard extraction methods may underestimate nitrate stocks captured by field-aged biochar [J]. Journal of Environmental Quality, 45(4): 1196-1204.
HOLLISTER C C, BISOGNI J J, LEHMANN J. 2013. Ammonium, nitrate,and phosphate sorption to and solute leaching from biochars prepared from corn stover (L.) and oak wood (spp.) [J]. Journal of Environmental Quality, 42(1): 137-144.
JASSAL R S, JOHNSON M S, MOLODOVSKAYA M, et al. 2015.Nitrogen enrichment potential of biochar in relation to pyrolysis temperature and feedstock quality [J]. Journal of Environmental Management, 152: 140-144.
JOHANSSON C L, PAUL N A, DE NYS R, et al. 2016. Simultaneous biosorption of selenium, arsenic and molybdenum with modified algal-based biochars [J]. Journal of Environmental Management, 165:117-123.
KANTHLE A K, LENKA N K, LENKA S, et al. 2016. Biochar impact on nitrate leaching as influenced by native soil organic carbon in an Inceptisol of central India [J]. Soil and Tillage Research, 157: 65-72.
KARHU K, MATTILA T, BERGSTRÖM I, et al. 2011. Biochar addition toagricultural soil increased CH4uptake and water holding capacity-Results from a short-term pilot field study [J]. Agriculture Ecosystemsand Environment, 140(1): 309-313.
MANDAL S, THANGARAJAN R, BOLAN N S, et al. 2016.Biochar-induced concomitant decrease in ammonia volatilization and increase in nitrogen use efficiency by wheat [J]. Chemosphere, 142:120-127.
NICOL G W, LEININGER S, SCHLEPER C, et al. 2008. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria [J]. Environmental Microbiology, 10(11): 2966-2978.
SONG Y, ZHANG X, MA B, et al. 2014. Biochar addition affected the dynamics of ammonia oxidizers and nitrification in microcosms of a coastal alkaline soil [J]. Biology and Fertility of Soils, 50(2): 321-332.TAKAYA C A, FLETCHER L A, SINGH S, et al. 2016. Phosphate and ammonium sorption capacity of biochar and hydrochar from different wastes [J]. Chemosphere, 145: 518-527.
YAO Y, GAO B, INYANG M, et al. 2011. Removal of phosphate from aqueous solution by biochar derived from anaerobically digested sugar beet tailings [J]. Journal of Hazardous Materials, 190(1): 501-507.
ZHAO X, WANG S, XING G. 2014. Nitrification, acidification, and nitrogen leaching from subtropical cropland soils as affected by rice straw-based biochar: laboratory incubation and column leaching studies [J]. Journal of Soils and Sediments, 14(3): 471-482.
邓先伦, 龚建平, 陈君珍. 1999. GB/T 17664—1999, 木炭和木炭试验方法[S].
董江水. 2007. 应用SPSS软件拟合Logistic曲线研究[J]. 金陵科技学院学报, 23(1):21-24.
杜应琼, 王富华, 陈永坚, 等. 2015. 一种降低蔬菜硝酸盐含量的生物炭基钼肥: 中国, 104725151A[P]. 2015-06-24.
高喜凤, 陈晓媛, 刘敬松, 等. 2016. 电感耦合等离子体质谱法及发射光谱法测定食品中钼[J]. 食品与药品, 18(5): 344-347.
广东省土壤普查办公室. 1993. 广东土壤[M]. 北京: 科学出版社: 412.
何飞飞, 梁运姗, 吴爱平, 等. 2014. 不同生物炭用量对酸性菜地土硝化作用的影响[J]. 环境科学学报, 34(9): 2376-2383.
侯雪燕. 2014. 土壤pH对硝化作用和氨氧化微生物群落结构的影响[D].重庆: 西南大学: 37-55.
江苏省环境监测中心. 2016. HJ 781—2016, 固体废物 22种金属元素的测定电感耦合等离子体发射光谱法[S].
蕉如珍, 董玉红, 孙启武. 2015. LY/T 1234—2015, 森林土壤钾的测定[S].
刘铮, 朱其清, 徐俊祥, 等. 1990. 中国土壤中钼的含量与分布规律[J].环境科学学报, 10(2): 132-137.
任意, 辛景树, 田有国, 等. 2006. NY/T 土壤检测第6部分: 土壤有机质的测定[S].
王敏, 南春波, 王占华, 等. 2007. NY/T 1377—2007, 土壤pH的测定[S].
王艳丽. 2016. 环刀法测定土壤田间持水量实验结果分析[J]. 地下水,38(3): 55-57.
辛景树, 郑磊, 马常宝, 等. 2012. NY/T 1121.24—2012, 土壤检测第24部分: 土壤全氮的测定自动定氮仪法[S].
辛景树, 郑磊, 钟杭, 等. 2014. NY/T 1121.7—2014, 土壤检测第7部分:土壤有效磷的测定[S].
邢瑶, 马兴华. 2015. 氮素形态对植物生长影响的研究进展[J]. 中国农业科技导报, 17(2): 109-117.
邢英, 李心清, 王兵, 等. 2011. 生物炭对黄壤中氮淋溶影响: 室内土柱模拟[J]. 生态学杂志, 30(11): 2483-2488.
张万儒, 杨光滢, 屠星南, 等. 1999. LY/T 1243—1999, 森林土壤阳离子交换量的测定[S].
赵静, 沈向, 李欣, 等. 2009. 梨园土壤 pH值与其有效养分相关性分析[J]. 北方园艺, (11): 5-8.
朱强, 马丽, 马强, 等. 2012. 不同浸提剂以及保存方法对土壤矿质氮测定的影响[J]. 中国生态农业学报, 20(2): 138-143.
