亚抑菌浓度哌拉西林/他唑巴坦对大肠埃希菌生物膜形成能力的影响
2018-01-29宋洁,洪海,冯伟,熊玮
宋 洁,洪 海,冯 伟,熊 玮
(1.第三军医大学西南医院老年科,重庆 400038;2.第三军医大学西南医院预防保健科,重庆 400038;3.北京总后勤部郑常庄干休所卫生所,北京 100141;4.第三军医大学西南医院药剂科,重庆 400038)
抗菌药物是临床抗感染治疗的常用药物。在治疗过程中,抗菌药物血药浓度会有部分时间低于最低抑菌浓度而处于亚抑菌浓度(sub-minimal inhibitory concentration,亚-MIC)状态,这是抗菌药物治疗过程中不可避免的情况。研究表明亚-MIC抗菌药物能够影响细菌的毒力、生物膜和运动性[1-3]。哌拉西林属于半合成的广谱青霉素类抗生素,可治疗敏感细菌引起的感染。哌拉西林与他唑巴坦联合可用于治疗对哌拉西林耐药而对哌拉西林/他唑巴坦敏感的产β-内酰胺酶细菌引起的中、重度感染。有研究报道亚-MIC哌拉西林可以导致大肠埃希菌形态改变而产生丝状体[4],然而关于亚-MIC哌拉西林/他唑巴坦对大肠埃希菌生物膜形成能力的影响尚未见报道。因此,本研究以大肠埃希菌临床菌株为研究对象,观察亚-MIC哌拉西林/他唑巴坦对大肠埃希菌生物膜形成、黏附性和运动性的影响,为临床抗感染治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1菌株来源 大肠埃希菌临床株(E156-E160)及药敏质控菌株ATCC25922保存于第三军医大学西南医院药剂科。
1.1.2试剂和仪器 哌拉西林/他唑巴坦(piperacillin/tazobactam,PTZ)、结晶紫购自美国Sigma公司;MH培养基购自北京陆桥生物技术有限公司;血琼脂平板购自重庆庞通公司;胰蛋白胨、酵母提取物购自英国Oxoid公司;氯化钠购自升博生物制品公司;冰醋酸购自重庆川东化工有限公司。Multiskan型酶标仪购自美国Thermo Fisher Scientific公司。
1.2方法
1.2.1大肠埃希菌最低抑菌浓度(MIC)的检测 大肠埃希菌MIC检测采用微量肉汤稀释法。大肠埃希菌划线接种于血琼脂平板,37 ℃孵育18 h。挑取细菌少许单菌落于4 mL无菌生理盐水稀释校正至0.5个麦氏比浊单位(1.5×108CFU/mL),然后再用水解酪蛋白(MH)肉汤稀释100倍。PTZ用MH肉汤倍比稀释至11个浓度梯度(0.25~256.00 μg/mL)。然后在96孔板中每孔加入100 μL稀释菌液和100 μL系列浓度PTZ。96孔板放入37 ℃孵箱培养24 h。细菌MIC值为能够抑制细菌生长的最低药物浓度,结果参照美国临床和实验室标准协会(CLSI,2014)标准进行判读。
1.2.2亚-MIC PTZ对大肠埃希菌生物膜形成能力的影响 生物膜形成能力的检测采用96孔板结晶紫染色法[5]。大肠埃希菌划线接种于血琼脂平板,37 ℃恒温培养18 h。挑取单菌落于10 mL LB肉汤,37 ℃、180 r/min恒温振荡培养18 h。过夜培养物用LB肉汤稀释1 000倍。PTZ组每孔加入100 μL菌液和100 μL PTZ,使药物终浓度为1/4 MIC;空白对照组每孔加入100 μL菌液和100 μL LB肉汤。每组设置3个复孔,37 ℃恒温培养24 h。轻轻吸出孔中的浮游菌,磷酸盐缓冲液(PBS)冲洗2次,通风阴凉处倒置晾干。然后在每孔中加入200 μL 1 %结晶紫溶液,染色10 min,自来水冲洗3次,通风阴凉处再次倒置自然晾干。最后每孔加入100 μL 30 %冰醋酸溶液,使用酶标仪在590 nm处测定吸光度值。
1.2.3亚-MIC PTZ对大肠埃希菌黏附性的影响 黏附能力检测采用菌落平板计数法[6]。将大肠埃希菌过夜培养物用LB肉汤稀释1 000倍。实验分为空白对照组和PTZ处理组。PTZ处理组在激光共聚焦显微镜专用细胞培养皿中加入1 mL菌液和1 mL PTZ,使其药物终浓度为1/4 MIC。空白对照组加入1 mL菌液和1 mL LB培养基。37 ℃培养4 h后,用无菌的PBS缓冲液轻轻冲洗2次以去除浮游菌。然后在培养皿中加入适量的PBS缓冲液超声10 min,使黏附细胞脱落下来。最后将细胞悬浮液用无菌生理盐水稀释至适当的倍数后,取100 μL稀释菌液加在LB固体培养基上并涂布均匀,37 ℃培养24 h后计算细菌数量。每个标本设置3个平行组,实验重复3次。
1.2.4亚-MIC PTZ对大肠埃希菌运动性的影响 通过泳动运动检测亚-MIC PTZ对大肠埃希菌运动性的影响[7]。将大肠埃希菌过夜培养物稀释校正至3个麦氏比浊单位(9×108CFU/mL),取5 μL稀释菌液加在不含和含有1/4 MIC PTZ的半固体培养基(1%胰蛋白胨,0.5%氯化钠,0.3%琼脂,pH 7.1~7.3)表面。37 ℃培养6 h后观察细菌菌落直径大小。每个标本设置3个平行组,试验重复3次。
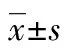
2 结 果
2.1PTZ对大肠埃希菌的MIC结果 PTZ对大肠埃希菌E156-E160的MIC结果分别为4、16、128、32、1 μg/mL。由于1/2 MIC抗菌药物对细菌生长有影响,因此,后续研究均采用1/4 MIC PTZ进行实验。
2.2亚-MIC PTZ对大肠埃希菌生物膜形成能力的影响 与空白对照组相比,PTZ能显著降低大肠埃希菌E156-E160生物膜的形成能力,其P值分别为0.003、0.022、0.022、0.006和0.025,见图1。

a:P<0.01;b:P<0.05
图1亚-MIC PTZ对大肠埃希菌生物膜形成能力的影响
2.3亚-MIC PTZ对大肠埃希菌黏附性的影响 与空白对照组相比,亚-MIC PTZ对5株大肠埃希菌E156-E160的黏附性均有显著抑制作用,其P值分别为0.002、0.016、0.004、0.003和0.003。PTZ处理组大肠埃希菌黏附细胞数减低比例为28.1%~43.0%,见图2。
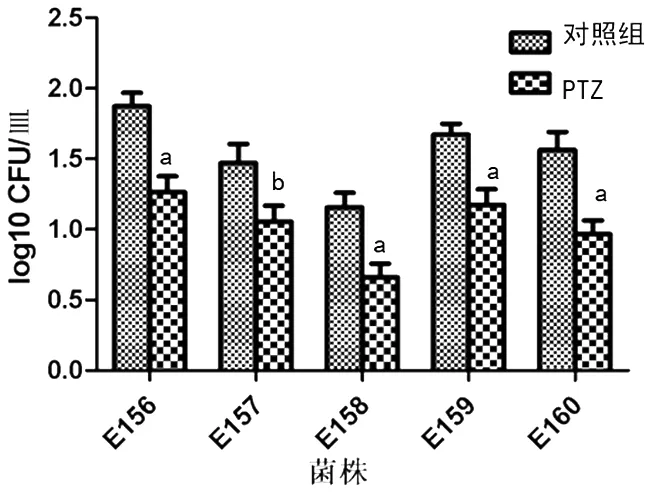
a:P<0.01;bP<0.05
图2亚-MIC PTZ对大肠埃希菌黏附性的影响
2.4亚-MIC PTZ对大肠埃希菌运动性的影响 与空白对照组相比,PTZ处理组细菌在半固体培养基上的菌落直径明显变小,其P值分别为0.025、0.005、0.001、0.042和0.017,提示PTZ能显著降低细菌的运动性,见图3。
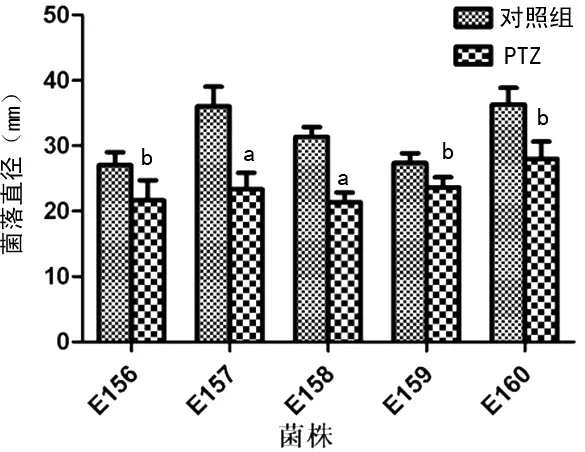
a:P<0.01;b:P<0.05
图3亚-MIC PTZ对大肠埃希菌运动性的影响
3 讨 论
大肠埃希菌是临床常见致病菌,容易在感染过程中形成生物膜,而生物膜形成是多重耐药大肠埃希菌耐药性获得和传播的重要机制。由于亚-MIC在临床抗感染过程中是不可避免的,因此研究亚-MIC抗菌药物对细菌生物膜形成能力的调控具有重要的临床意义。本研究结果显示亚-MIC PTZ对大肠埃希菌生物膜形成具有显著的抑制作用。有研究表明亚-MIC PTZ对铜绿假单胞菌和具核梭杆菌生物膜形成均有抑制作用[8-9],这与本研究结果相类似。大肠埃希菌生物膜形成的过程包括初始黏附和生物膜的形成,黏附能力是生物膜形成的重要影响因素[10-11]。结果显示亚-MIC PTZ在抑制生物膜形成的同时可以抑制大肠埃希菌的黏附性,提示PTZ可通过抑制大肠埃希菌的黏附性而抑制其生物膜的形成。
鞭毛是大肠埃希菌的运动器官,其所介导的运动性在细菌最初的表面黏附和后期生物膜的形成中都具有重要的作用[12-13]。有研究表明鞭毛和运动缺陷的铜绿假单胞菌突变株其生物膜形成能力降低[14]。WOOD等[15]研究报道运动性强的大肠埃希菌生物膜形成能力显著高于运动性弱的细菌。HORII等[16]报道亚-MIC头孢他啶通过运动性影响铜绿假单胞菌及奇异变形杆菌黏附及生物膜形成。本研究显示亚-MIC PTZ能够显著抑制大肠埃希菌的泳动运动,与其他研究报道一致[17],结果提示亚-MIC PTZ可能通过抑制细菌运动性来抑制细菌生物膜的形成。本研究表明亚-MIC PTZ可能通过抑制大肠埃希菌的黏附性和运动性从而抑制其生物膜的形成,但是其具体机制有待于进一步研究。
[2]KAPLAN J B,JABBOURI S,SADOVSKAYA I.Extracellular DNA-dependent biofilm formation by Staphylococcus epidermidis RP62A in response to subminimal inhibitory concentrations of antibiotics[J].Res Microbiol,2011,162(5):535-541.
[3]TCHOUAFFI-NANA F,BALLARD T E,CARY C H,et al.Nitazoxanide inhibits biofilm formation by Staphylococcus epidermidis by blocking accumulation on surfaces[J].Antimicrob Agents Chemother,2010,54(7):2767-2774.
[4]IIDA K,HIRATA S,NAKAMUTA S,et al.Inhibition of cell division of Escherichia coli by a new synthetic penicillin,piperacillin[J].Antimicrob Agents Chemother,1978,14(2):257-266.
[5]SHI H Q,SUN F J,CHEN J H,et al.Opposite effects of cefoperazone and ceftazidime on S-ribosylhomocysteine lyase/autoinducer-2 quorum sensing and biofilm formation by an Escherichia coli clinical isolate[J].Mol Med Rep,2014,10(5):2334-2340.
[6]XU Z G,GAO Y,HE J G,et al.Effects of azithromycin on Pseudomonas aeruginosa isolates from catheter-associated urinary tract infection[J].Exp Ther Med,2015,9(2):569-572.
[7]ASADISHAD B,HIDALGO G,TUFENKJI N.Pomegranate materials inhibit flagellin gene expression and flagellar-propelled motility of uropathogenic Escherichia coli strain CFT073[J].FEMS Microbiol Lett,2012,334(2):87-94.
[8]FONSECA A P,EXTREMINA C,FONSECA A F,et al.Effect of subinhibitory concentration of piperacillin/tazobactam on Pseudomonas aeruginosa[J].J Med Microbiol,2004,53(Pt 9):903-910.
[9]DE SOUZA FILHO J A,DINIZ C G,BARBOSA N B,et al.Morphological,biochemical,physiological and molecular aspects of the response of Fusobacterium nucleatum exposed to subinhibitory concentrations of antimicrobials[J].Anaerobe,2012,18(6):566-575.
[10]SILVESTRO E M,NAKANO V,ARANA-CHAVEZ V E,et al.Effects of subinhibitory concentrations of clindamycin on the morphological,biochemical and genetic characteristics of Bacteroides fragilis[J].FEMS Microbiol Lett,2006,257(2):189-194.
[11]VAN DER PLAS M J,JUKEMA G N,WAI S W,et al.Maggot excretions/secretions are differentially effective against biofilms of Staphylococcus aureus and pseudomonas aeruginosa[J].J Antimicrob Chemother,2008,61(1):117-122.
[12]EVANS K L,KANNAN S,LI GANG,et al.Eliminating a set of four penicillin binding proteins triggers the Rcs phosphorelay and Cpx stress responses in Escherichia coli[J].J Bacteriol,2013,195(19):4415-4424.
[13]LEMON K P,HIGGINS D E,KOLTER R.Flagellar motility is critical for Listeria monocytogenes biofilm formation[J].J Bacteriol,2007,189(12):4418-4424.
[14]O′TOOLE G A,KOLTER R.Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development[J].Mol Microbiol,1998,30(2):295-304.
[15]WOOD T K,GONZLEZ BARRIOS A F,HERZBERG M,et al.Motility influences biofilm architecture in Escherichia coli[J].Appl Microbiol Biotechnol,2006,72(2):361-367.
[16]HORII T,MORITA M,MURAMATSU H,et al.Effects of mupirocin at subinhibitory concentrations on flagella formation in Pseudomonas aeruginosa and Proteus mirabilis[J].J Antimicrob Chemother,2003,51(5):1175-1179.
[17]FONSECA A P,SOUSA J C.Effect of antibiotic-induced morphological changes on surface properties,motility and adhesion of nosocomial Pseudomonas aeruginosa strains under different physiological states[J].J Appl Microbiol,2007,103(5):1828-1837.
