大鼠压疮局部不同温度治疗对PI3K/Akt/GSK3β信号通路的影响*
2018-01-29王晴白燕平邢凤梅汪凤兰张小丽
王晴,白燕平,邢凤梅,汪凤兰,张小丽
(华北理工大学 护理与康复学院,河北 唐山 063000)
压疮又称压力性溃疡,常见于老年患者及长期卧床患者,是临床上困扰医护人员的难题之一。压疮的发生会增加患者痛苦,拖延治疗进程,甚至会继发感染致全身衰竭而危及患者的生命[1]。因此,探索压疮防治的有效方法是国内外医学领域的热点。目前,关于临床压疮防治中局部温度如何干预,日益引起人们的重视。对压疮防治的传统做法,多采用局部热疗,但近年有研究显示[2],局部温度升高可能会加重压疮损伤,而降低局部温度对压疮的治疗具有良好效果。在压疮的防治过程中,究竟采用哪种温度更有效,尚未形成定论。当前,缺血/再灌注损伤已成为压疮形成的最重要机制[3]。有研究表明[4],肌肉组织细胞凋亡是压疮的发生、发展过程中的关键因素,而磷脂酰肌醇3-激酶(phosphatidylinositol-3-OH kinase,PI3K)/蛋白激酶 B(protein kinase B,Akt)/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)通路是调控细胞增殖、分化、凋亡的重要途径,在压疮缺血再灌注损伤中起保护作用。本实验通过在大鼠压疮局部分别实施高温、低温干预,观察PI3K/Akt/GSK3β信号通路的表达情况,探讨不同局部温度对压疮的治疗效果,为压疮的临床防治提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物体重250~300 g的SPF级雄性健康成年SD大鼠40只,由华北理工大学实验动物中心提供。在恒温(18~24℃)、恒湿(45%~50%)、明暗交替各12 h的条件下饲养。
1.1.2 主要试剂和仪器兔源Akt、p-Akt单克隆抗体,兔源GSK3β、p-GSK3β单克隆抗体及兔源β-actin单克隆抗体(购自美国Cell Signaling Technology);FITC荧光素标记羊抗兔IgG(H+L)(美国KPL公司)。TUNEL试剂盒(美国Chemicon公司),电泳仪及电转仪(北京六一仪器厂),酶标仪(美国Thermo Scientific公司),压疮装置(唐山鼓风机器械制造厂),自制恒温箱。
1.2 方法
1.2.1 动物造模装置①大鼠压疮装置。根据姜丽萍、蔡福满等[5]的方法设计压疮装置。该装置主要结构为固定支架、施压柱(其头端为圆形底面,半径为0.5 cm)和泡沫板。在造模过程中大鼠受压的部位和压强需保持不变,已知施压柱头端底面面积一定,通过在上端增减砝码便能达到受压部位所需压强;②恒温箱。该装置主要由泡沫箱、温度计构成,泡沫箱顶端设置通风孔,可使箱内空气和外界空气相通(见图1)。通过预先在泡沫箱内放入冰袋或热水袋来调节箱内温度,使其达到预期温度Δt。对大鼠进行温度干预时,将其受压部位放入箱内,可根据温度计的变化随时打开通风孔对箱内温度进行微调,将箱内温度保持在Δt±1℃。

图1 造模示意图
1.2.2 大鼠压疮模型的复制按照蔡福满等[5]的方法复制大鼠压疮缺血再灌注损伤模型。用腹腔注射10%水合氯醛(0.3 ml/100 g)麻醉大鼠,侧卧位固定,将两侧大腿股薄肌处的毛剪去,暴露皮肤,在该部位施加170 mmHg(22.47 kPa)的压力。造模需要进行5个循环,每个循环包括施压2 h,放松0.5 h。造模过程中,将试验环境温度保持在22℃,期间要保证大鼠的麻醉状态,按需补充麻药。
1.2.3 实验分组及处理方法将40只SPF级成年雄性SD大鼠随机分为假手术组(Sham组)、常温IRI组(NTI)、低温IRI组(LTI)和高温IRI组(HTI)4组,每组各10只,处理方法如下:①Sham组(10只):只麻醉,不处理;②NTI组(10只):麻醉后,在常温(22℃)下施加5个缺血再灌注循环;③LTI组(10例):将常温22℃设为Δt,干预温度=Δt-10℃=12℃。大鼠麻醉后施加5个缺血再灌注循环,每个循环的缺血阶段(1 h)在22℃下实施,再灌注阶段(0.5 h)需将其受压部位放入温度设为12℃的恒温箱中;④HTI组(10只):将常温设为Δt,干预温度=Δt+10℃=32℃。大鼠麻醉后施加5个缺血再灌注循环,每个循环的缺血阶段(1 h)在22℃下实施,再灌注阶段(0.5 h)需将其受压部位放入温度设为32℃的恒温箱中;本实验中的温度设置参考BERNARD等[6]的实验方法,但在其基础上做了些许变动。
1.2.4 检测方法在实验终点于冰上切取各组大鼠受压中心部位肌肉组织,用4℃生理盐水洗去血液,用滤纸吸干水分,切取大小为0.5 cm×0.5 cm×0.5 cm的组织放在4%多聚甲醛中固定,用于制备常规石蜡切片,进行组织形态学观察、细胞凋亡的检测以及免疫荧光检测;另取500 mg组织放在-80℃冰箱冷冻保存备用,用于Western blot检测。①HE染色检测大鼠骨骼肌的病理变化。取适量肌肉组织,用4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,切片。烤片,脱蜡,苏木素、伊红染色,中性树胶封片。镜下观察并采集图像;②Western blot检测大鼠骨骼肌Akt、p-Akt和GSK3β、p-GSK3β蛋白的表达水平。取适量肌肉组织提蛋白,分装、加热变性。制备SDS-PAGE凝胶,蛋白上样,电泳,转膜,用5%脱脂牛奶封闭。加一抗,4 ℃过夜。次日用TBST洗膜后加入二抗,37℃孵育1~2 h。用TBST再次洗膜,显色,用Image J软件分析各组蛋白条带灰度值;③TUNEL检测大鼠骨骼肌细胞的凋亡情况。取适量肌肉组织,用4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,切片。烤片,脱蜡后,按照试剂盒说明书进行操作,中性树胶封片。光镜下观察染色结果并拍照计数,其阳性表现为细胞核固缩成棕褐色;④免疫荧光检测大鼠骨骼肌的p-Akt与p-GSK3β表达水平。取适量肌肉组织,用4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,切片。烤片,脱蜡,柠檬酸钠热修复,加3% H2O2灭活内源性酶,血清封闭,加一抗,4℃湿盒过夜。次日加荧光素标记二抗,37℃暗湿盒0.5 h,DAPI染核,甘油磷酸缓冲液封片,在荧光显微镜下观察。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用单因素方差分析,用LSD-t法进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果
HE染色结果显示,Sham组肌纤维排列紧密,间隙较小,骨骼肌横纹清晰,无炎症细胞浸润;NTI组肌纤维排列紊乱,间质增宽,出现断裂、溶解,亦有炎症细胞浸润;HTI组较NTI组损伤严重,大量肌纤维溶解、断裂,空泡变性,炎症细胞浸润增多;LTI组较NTI组损伤减轻,肌纤维排列较整齐,发生的断裂、溶解较少,炎症细胞浸润亦较少(见图2)。

图2 各组骨骼肌病理变化 (HE×200)
2.2 各组肌肉组织Akt、Gsk3β的磷酸化水平
与Sham组比较,NTI组Akt、GSK3β的磷酸化水平下降(P<0.05);与NTI组比较,HTI组的磷酸化水平进一步降低(P<0.05),而LTI组有所上升(P<0.05)。见表 1 和图 3。
2.3 免疫荧光结果
免疫荧光结果显示,Sham组可见大量p-Akt和p-GSK3β的荧光表达(主要集中在细胞膜和细胞质中),NTI组这两种因子的表达量均下降。与NTI组比较,HTI组两者的荧光表达量进一步下降,而在LTI组表达有所增加(见图4、5)。
表1 各组肌肉组织Akt及GSK3β磷酸化水平(n =5,±s)
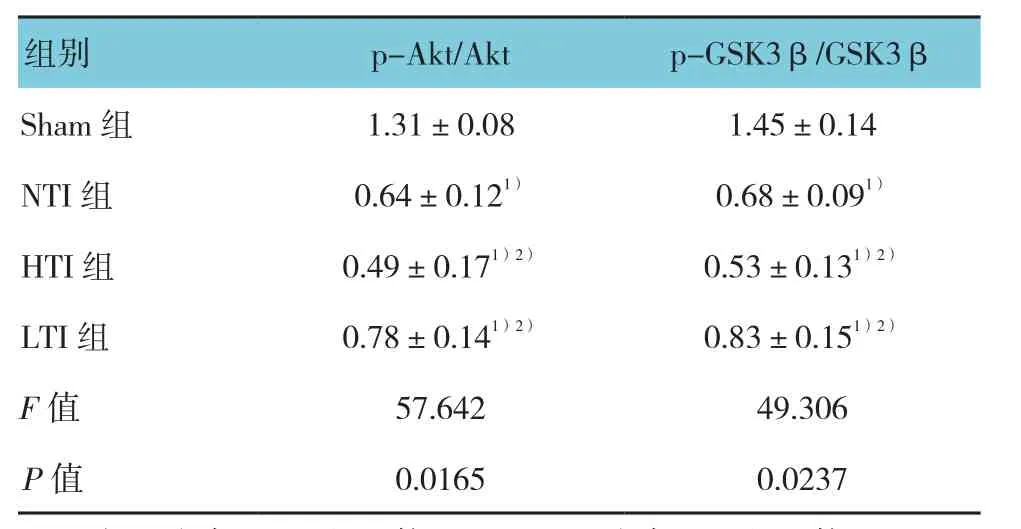
表1 各组肌肉组织Akt及GSK3β磷酸化水平(n =5,±s)
注:1)与Sham组比较,P <0.05;2)与NTI组比较,P <0.05
?
表2 TUNEL检测各组肌肉组织凋亡细胞数量(n =5,±s)
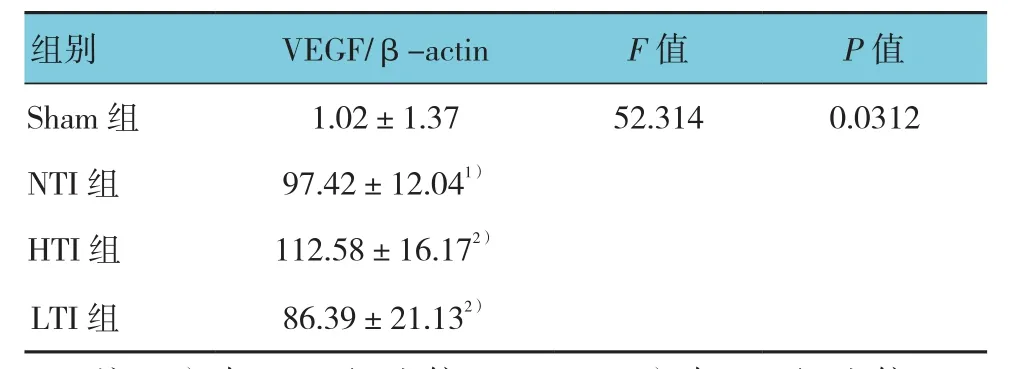
表2 TUNEL检测各组肌肉组织凋亡细胞数量(n =5,±s)
注:1)与 Sham 组比较,P <0.05;2)与 NTI组比较,P <0.05
?

图3 各组肌肉组织总的Akt、GSK3β及其磷酸化水平

图4 各组肌肉组织p-Akt的表达 (免疫荧光×200)

图5 各组肌肉组织p-GSK3β的表达 (免疫荧光×200)
2.4 TUNEL染色结果
TUNEL染色结果显示,Sham组阳性染色细胞核仅有少数,NTI组阳性细胞核数增加。与NTI组比较,凋亡细胞数在HTI组进一步增加,而在LTI组有所减少(见表4和图6)。

图6 各组骨骼肌细胞凋亡情况 (TUNEL×200)
3 讨论
压疮的形成是多种因素共同作用的结果,而缺血再灌注损伤被认为是压疮形成最主要的机制[3]。研究表明,与皮肤组织比较,肌肉组织由于存在更丰富的血管对缺血再灌注损伤更为敏感,因而深部组织损伤(DTI)在压疮发展中起关键作用。因此本实验在研究压疮损伤时以肌肉组织为中心。研究发现[4],压疮的发生与肌细胞凋亡密切相关,肌肉组织因受缺血缺氧等刺激而诱发骨骼肌细胞凋亡,是压疮病理发展的根源。PI3K/Akt/GSK3β通路是介导凋亡发生的重要途径,在压疮形成进展中起保护作用。
过去在临床防治压疮中多应用热疗,认为受压部位温度升高可促进局部血液循环,提高细胞功能从而减少组织损伤[7]。护理教材中也曾写到[8]:Ⅱ期压疮应以红外线照射疮面,Ⅲ期压疮用鹅颈灯照射。但近年有研究报导[2]:受压区域温度升高会增加局部组织的代谢需氧量,进而增加压疮的发生率。相反,降低温度可通过减少局部组织代谢需氧量,抑制损伤后炎症因子扩散和中性粒细胞浸润等来减轻缺血再灌注损伤[6]。近年来,临床上陆续有研究显示[9-11],在防治压疮时设法降低局部温度具有良好效果。目前相关压疮温度干预的研究大多是临床方面的研究,鲜有通过基础实验获得的理论支持。
本实验HE和TUNEL结果显示,NTI组骨骼肌严重损伤,出现大量凋亡细胞,说明造模成功。而LTI组与NTI组相比骨骼肌损伤有所减轻,凋亡细胞减少,说明局部温度降低可减轻压疮缺血再灌注损伤,这与BERNARD等[6]的研究结果一致。HTI组与NTI组相比损伤加重,凋亡细胞增多,说明升高局部温度会加重压疮组织的损伤。
PI3K/Akt/GSK3β信号通路作为细胞内重要的生命传导通路,参与多项细胞生理活动,并介导多种外界刺激信号诱导细胞存活、生长、分化及凋亡等过程,它的激活表现为相关靶点的磷酸化,磷酸化水平越高,发挥的抗细胞凋亡作用越强,对缺血灌注损伤的保护作用就越强[12]。PI3K由磷脂酰肌醇的肌醇环上的碳原子磷酸化形成,是细胞内重要转导信号分子之一。PI3K激活后与下游的直接靶点Akt发生相互作用,使其被激活并产生磷酸化,而磷酸化Akt具有促细胞生存、抗细胞调亡的作用[13]。GSK3β是Akt下游的一种活性激酶,可引起线粒体膜通透性转换孔开放,使线粒体出现功能障碍加剧细胞损伤;促进Caspase-3激活以及细胞色素C释放,诱导细胞凋亡。磷酸化Akt可促进GSK3β产生磷酸化,使其生物活性显著降低,即磷酸化GSK3β的是非活性状态,可减少线粒体通透性转换孔的开放,抑制Caspase-3激活以及细胞色素C释放,从而抑制凋亡,减轻细胞损伤[14]。
Western blot和免疫荧光结果显示,和Sham组比较,NTI组Akt和GSK3β的磷酸化水平降低,说明压疮损伤可通过抑制PI3K/Akt/GSK3β通路中Akt和GSK3β的磷酸化水平而引起骨骼肌细胞损伤和凋亡;局部经高温干预后,压疮组织中这两种因子的磷酸化水平在NTI组的基础上进一步下降,组织损伤程度加重;经低温干预后,局部组织中Akt和GSK3β的磷酸化水平较NTI组有所上升,细胞损伤和凋亡和凋亡也有所减轻。
综上所述,局部高温可能通过抑制PI3K/Akt/GSK3β通路中Akt和GSK3β的磷酸化水平而促进细胞凋亡的发生,进而加重大鼠压疮损伤;与之相反,局部低温可能通过提高Akt和GSK3β的磷酸化水平而减轻大鼠压疮损伤。因此,在对压疮的临床防治过程中,可能不宜使用热干预方法,使用冷干预可能会有良好效果。
[1]TANNEN A, DASSEN T, HALFENS R. Differences in prevalence of pressure ulcers between the Netherlands and Germanyassociations between risk, prevention and occurrence of pressure ulcers in hospitals and nursing homes[J]. J Clin Nurs, 2009,18(10): 1511-1512.
[2]JAN YIH-KUEN, LIAO FUYUAN, RICE, et al. Using reactive hyperemia to assess the efficacy of local cooling on reducing sacral skin ischemia under surface pressure in people with rehabilitation[J]. Archives of Physical Medicine and Rehabilitation,2013, 94(10): 1982-1989.
[3]KENDALL A C, WHATMORE J L, HARRIES L W, et al. Changes in inflammatory gene expression induced by hyperbaric oxygen treatment in human endothelial cells under chronic wound conditions[J]. Exp Cell Res, 2012, 318(3): 207-216.
[4]崔飞飞, 张菊芳, 吴海英, 等. PI3K/Akt/GSK3β信号通路及内质网应激蛋白在大鼠难免性压疮形成中表达变化[J]. 温州医科大报, 2014(8): 555-560.
[5] 蔡福满, 姜丽萍, 杨晔琴, 等. 褥疮不完全性缺血再灌注损伤简易模型的建立[J]. 中国病理生理杂志, 2009, 25(4): 830-832.
[6] BERNARD LEEA, SIRIBHINYA BENYAJATIA, JEFFREY A, et al. Effect of local cooling on pro-inflammatory cytokines and bloodinflammatoryow of the skin under surface pressure in rats: feasibility study[J].Journal of Tissue Viability, 2014, 23(2): 69-77.
[7]孙晓娟, 左玉芝. 自制六神祛腐汤联合红外线照射治疗Ⅱ期及Ⅲ期压疮的疗效观察[J]. 护理研究, 2011(36): 3380-3381.
[8]殷磊. 护理学基础[M]. 北京: 人民卫生出版社, 2002: 221.
[9]曹燕, 钱丹, 蔡亚萍, 等. 医用降温贴对重症监护室病人压疮的预防作用[J]. 护理研究, 2015(9): 1120-1121.
[10]王莉, 曾俊, 刘娟, 等. 低温碘伏治疗手术体位致压疮效果观察[J]. 护理学杂志, 2014(4): 47-48.
[11]YI-TING TZEN, DAVID M, PATRICIA E, et al. Effectiveness of local cooling for enhancing tissue ischemia tolerance in people with spinal cord injury[J]. Journal of Spinal Cord Medicine, 2013,36(4): 357-364.
[12]ISHII H, KAMIKAWA S, HIROHATA S, et al. Eosinophil cationic protein shows survival effection H9c2 cardiac myoblast cells with enhanced phosphorylation of ERK and Akt/GSK-3beta under oxidative stress[J]. Acta Med Okayama, 2015, 69 (3): 145-153.
[13]WU Q L, SHEN T, MA H, et al. Sufentanil postconditioning protects the myocardium from ischemia-reperfusion via PI3K/Akt- GSK-3 beta pathway[J]. J Surg Res, 2012, 178(2): 563-570.
[14]CHEN L, WEI X B, HOU Y F, et al. Tetramethylpyrazine analogue CXC195 protects against cerebral ischemia/reperfusioninduced apoptosis through PI3K/Akt/GSK3 beta pathway in rats[J]. Neurochemistry International, 2014(66): 27-32.
