阿霉素白蛋白纳米粒冻干条件的初步筛选
2018-01-29马永鸿管冠男康爽明李文攀胡海洋陈大为
马永鸿,管冠男,康爽明,李文攀,张 洁,胡海洋,陈大为*
阿霉素白蛋白纳米粒冻干条件的初步筛选
马永鸿,管冠男,康爽明,李文攀,张 洁,胡海洋,陈大为*
(沈阳药科大学 药学院, 辽宁 沈阳 110016)
对阿霉素白蛋白纳米粒的冻干工艺和冻干保护剂进行初步筛选。本文作者对预冻、干燥过程中的各工艺因素进行考察,同时,以冻干制剂的外观、再水化的难易程度、水化后粒径为指标,以不加任何保护剂的DOX-BSA-NP为对照,对单一冻干保护剂和冻干保护剂的联合使用进行考察。确定最终的冻干工艺为:将-75 ℃预冻10 h的样品迅速转移至冷阱温度降至-20 ℃的冻干机,进行一次干燥,持续时间为12 h;而后进入二次干燥阶段,持续时间为2 h。筛选出的最优冻干保护剂为:甘露醇质量浓度为50 g∙L-1,海藻糖质量浓度为50 g∙L-1。通过对冻干制剂的外观、再水化的难易程度、水化后粒径的考察可以初步筛选出阿霉素白蛋白纳米粒的冻干条件。
药剂学;白蛋白纳米粒;冻干保护剂;阿霉素
阿霉素(doxorubicin, DOX)是一种抗肿瘤抗生素,对急性白血病、淋巴瘤、乳腺癌、肺癌及多种其他实体肿瘤均有杀灭作用。但其严重的心脏毒性及脊髓抑制等不良反应,极大地限制了阿霉素广泛应用于临床的抗肿瘤治疗。目前,减小阿霉素毒性的主要方法是应用药物载体,改变其生物分布,减少它在全身特别是心脏组织中的分布,提高其在局部肿瘤部位中的含量。白蛋白材料具有安全无毒、无免疫原性、可生物降解、生物相容性好等特点。而且,与其他胶体载体系统如脂质体相比,白蛋白纳米粒具有更好的存储稳定性和更高的亲水性药物的负载能力,并且释药性能的可控性更好,是一种理想的药物载体[1]。
目前制备白蛋白纳米粒(BSA-NP)的方法主要有以下几种:乳化固化法、去溶剂化法、pH-凝聚法、快速膨胀超临界溶液法,本文作者选用去溶剂化法制备阿霉素白蛋白纳米粒(DOX-BSA-NP)。而制备得到的纳米粒实质上是一个多相体系,在存放过程中可能会发生药物的析出和粒径的增长,因此物理化学稳定性始终是纳米粒制剂研究的一个重要问题,尤其是静脉给药的制剂,对微粒污染和毒性有更高的要求。为了获得更长期的物理化学稳定性,可将纳米粒分散液冷冻干燥、蒸发干燥或喷雾干燥后转变为固体制剂。根据实验条件本文作者选择了冷冻干燥法将BSA-NP分散液制备成冻干粉针剂,主要对影响冻干纳米粒质量的冻干保护剂进行了优化。
真空冷冻干燥技术,简称冻干,又称升华干燥,是将含水物料预先冻结,然后使之在真空状态下升华的一种方法。经冷冻干燥的物品,原有的生物、化学特性基本保持不变,易于长期保存,加水后能基本恢复到冻干前的形态,并且能保持其原有的生化特性。针对部分生化药物的化学、物理、生物的不稳定性,冻干已被实践证明是一种非常有效的手段。
1 仪器与材料
FA-1104电子天平(上海民桥精密科学仪器有限公司),DF-101S集热式恒温加热磁力搅拌器(巩义英峪予华仪器厂),JM-1200EX透射电镜(日本电子公司),Delsa 440SX zeta电位测定仪(美国Beckman Coulter公司),Nicomp-380粒度测定仪(美国Particle Sizing Systems公司),DRC-1000REC冻干机(日本Rikakikai公司),MDF-192低温冰箱(日本Sanyo公司)。
阿霉素(大连美伦生物技术有限公司),牛血清白蛋白(美国Sigma公司),无水乙醇、戊二醛、甘露醇、海藻糖、蔗糖、乳糖、葡萄糖(分析纯,天津博迪化工有限公司),磷酸二氢钠(广东汕头西陇化工厂),磷酸氢二钠(西陇化工股份有限公司)。
2 方法与结果
2.1 阿霉素白蛋白纳米粒的制备
室温下,称取BSA 100 mg溶于4 mL磷酸盐缓冲液中(pH=8,10 mmol∙L-1),溶解后加入阿霉素1 mg,在1 000 r·min-1磁力搅拌下将无水乙醇以1 mL∙min-1滴入,待出现浑浊时,停止加入。滴加戊二醛溶液15 mL,搅拌4 h。旋蒸除去无水乙醇,4×104r∙min-1低温超速离心1 h,移除上清,再加入同体积的磷酸盐缓冲液,超声至溶解即得DOX-BSA-NP分散液。
2.2 阿霉素白蛋白纳米粒的表征
阿霉素白蛋白纳米粒的形态采用负染法用透射电子显微镜(transmission electron microscopy,TEM)进行观察,结果见图1。结果显示,白蛋白纳米粒为球形实心粒子,表面圆整,粒径分布比较均匀。

Fig. 1 Transmission electron micrographs of DOX-BSA-NP
采用Nicomp-380粒度测定仪测定DOX-BSA-NP的粒径,结果见图2。由结果可知,DOX-BSA-NP的平均粒径为192.3 nm,多分散系数(P.I.)为0.113。
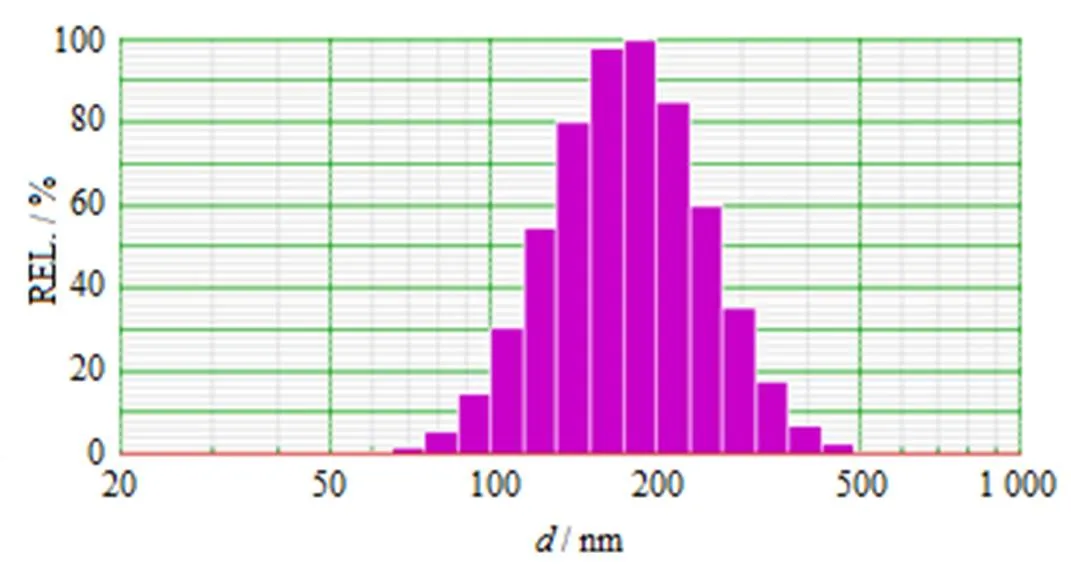
Fig. 2 Particle diameter of DOX-BSA-NP by Gaussian distribution
测定DOX-BSA-NP的电位,结果见图3。纳米粒的电位与纳米粒体系的稳定性密切相关,通常电位在±20 mV以上时,由于粒子之间的静电排斥作用,粒子间不会发生聚集现象。由图3可知,纳米粒表面带负电荷,电位为-27.8 mV,表明该制剂为物理稳定体系。
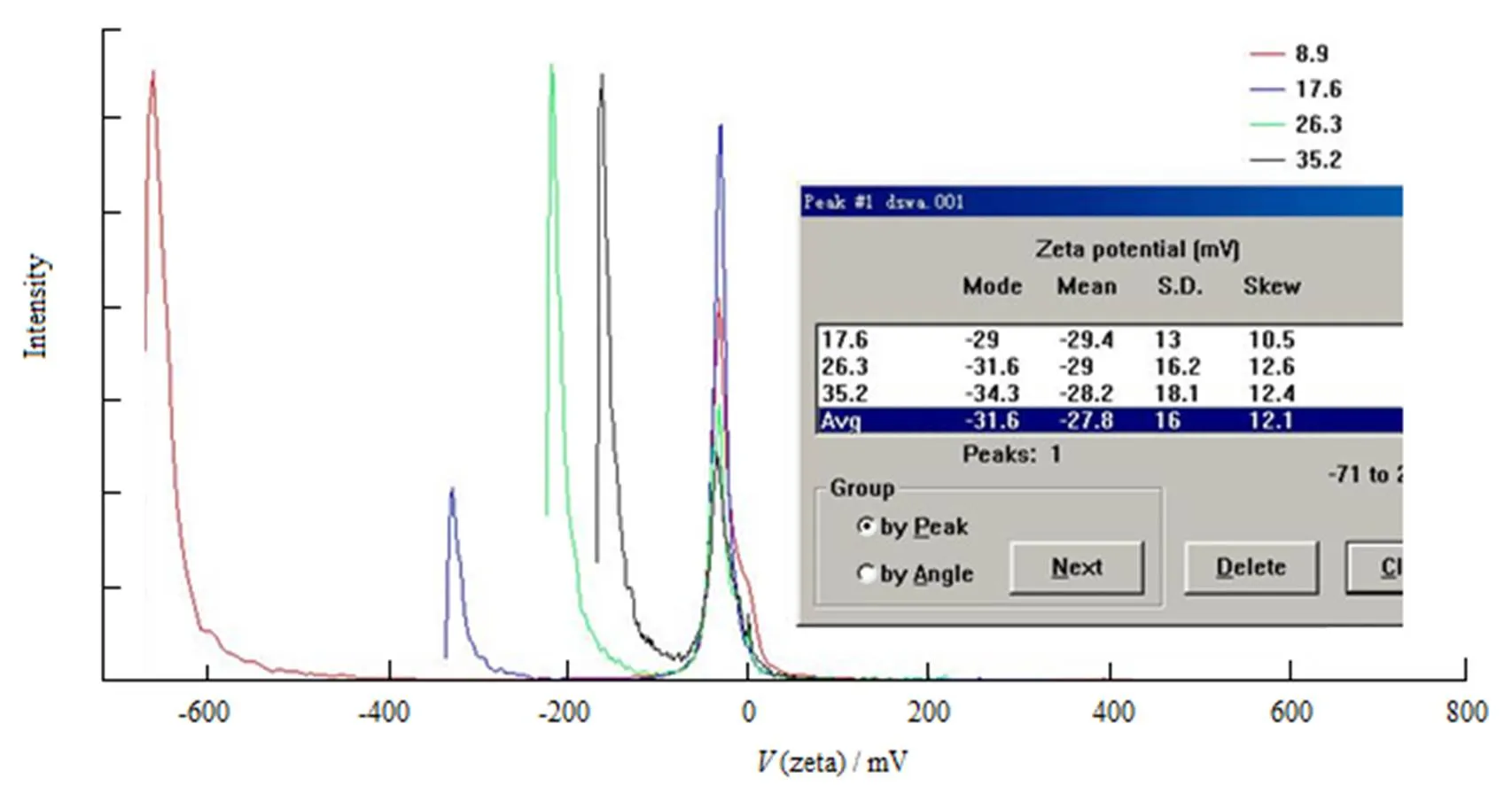
Fig. 3 The zeta potential analysis of DOX-BSA-NP
2.3 冷冻干燥工艺考察
药品冷冻干燥过程需要以下三个重要阶段[2-3],即预冻、升华干燥和二次干燥。预冻就是将制剂温度降低到冰点以下,使制剂中的水固化,防止干燥时出现起泡等现象发生;升华干燥为药品预冻时水分所形成的冰晶在真空条件下通过吸热而升华;二次干燥为升华干燥结束后,药品中还残余一部分结晶水,以及吸附于固体物质晶格间隙或以氢键方式结合在一些极性基团上的结合水,这部分结合水吸附能高,必须提供足够的能量(足够的真空度和温度)才能将其解析出来。这三个阶段中每个阶段的控制都会影响最终产品的质量。因此,本文作者对以上三个阶段分别进行了考察以期得到的最终冻干药品是干燥多孔的块状固体,可在室温下长期贮存。
2.3.1 预冻
预冻的目的是为了固定产品,以便在一定的真空度下进行升华。如果产品没有冻实,则药品可能没有完全冻结,在抽真空升华时会膨胀起泡;如果产品温度冻得过低,则又增加不必要的能量消耗。因此预冻之前应该确定三个因素:一是预冻的速度,二是预冻的最低温度,三是预冻的时间。
2.3.1.1 预冻速度
预冻速度分为:低温慢冻和低温快冻。低温慢冻降温速度慢,冰晶粗大,呈六角对称型,生长速度慢,有利于提高冻干效率,但产品水化速度较慢。低温快冻快速降温,形成的冰晶细小、生长速度快,呈树枝不规则型或球型,并且冰晶升华后能形成致密的网状结构,可以支撑本身的质量而不塌陷,且细微冰晶表面积大,能够与水化介质充分接触,重新分散的速度较快。根据实验室的条件,低温快冻后得到的冻干产品表面相对平整,水化速度较快,加水后能迅速分散,外观接近于冻干前样品,因此选择低温快速预冻。
2.3.1.2 预冻最低温度和预冻时间
冻干制品升华前,必须冻结到一定温度,这个温度应设在制品的共晶点以下10~20 ℃左右,如不经过预冻直接抽真空,当压力降到一定程度时,液体就会被抽出,这种情况也叫蒸发,这种蒸汽叫做不饱和蒸汽。如果制品冻结不实而抽真空,液体中的气体迅速逸出而引起“沸腾”的现象。制品如在“沸腾”中冻结,有部分可能逸出瓶外,引起药物损失或使制品表面凹凸不平。实验中,分别考察了预冻温度-20 ℃和-75 ℃及预冻时间10 h和24 h对产品质量的影响。结果显示,预冻温度-75 ℃、预冻时间10 h和24 h所得样品成型性好、外观饱满;而预冻温度-20℃,预冻时间10 h和24 h均出现萎缩、喷瓶等现象,说明样品没有完全冻实。任何制品在冻干过程中,冻结是最基础的,如果冻结不好,那么升温干燥过程就会受到影响。因此,确定的预冻温度为-75 ℃、预冻时间为10 h。
2.3.2 干燥
干燥分为升华干燥(一次干燥)和解析干燥(二次干燥)两个阶段。升华干燥:热量从搁板通过玻璃瓶传送转换到冻结冰晶体内,并传导至制品的表面;冰晶体升华过程产生的水蒸气通过制品枝状孔隙(已干燥层通道)跑到制品表面;从制品表面出来的水蒸气进入真空冷凝器(水份捕集器,即冷阱);水蒸气在真空冷凝器中凝结成冰。升华干燥阶段除去绝大部分水分。为了达到良好干燥状态,必须进行解析干燥(二次干燥),目的是进一步去除制品中残留的水份,这部分残留水份包括结晶水和吸附于固体物质晶格间隙中或以氢键方式结合在一些极性基团上的结合水,这部分结合水吸附能高,必须提供足够的能量(包括足够的高温和足够的真空度)才能将其解吸出来。药品水份含量质量分数以低于或接近于2%较为理想,一般制品的水份质量分数不应超过3%。二次干燥所需的时间由制品中水份的残留量来决定。二次干燥过程中,在确保制品热力学稳定性的条件下,应尽量提高产品的温度,降低冻干箱的真空度,以缩短二次干燥的时间。
通过实验确定干燥过程为:将-75 ℃预冻10 h的样品迅速转移至冷阱温度降至-20 ℃的冻干机搁板上,盖上真空罩,开启真空泵开关,进行升华干燥(一次干燥),持续时间为12 h;而后进入解析干燥(二次干燥)阶段,持续时间为2 h。
2.4 冻干保护剂的选择
2.4.1 单一冻干保护剂的筛选
以冻干制剂的外观、再水化的难易程度、水化后粒径为指标,以不加任何保护剂的DOX-BSA-NP作为对照,分别考察等渗浓度的乳糖、海藻糖、甘露醇、蔗糖和葡萄糖对DOX-BSA-NP的保护效果,评价指标如下:
外观:以表面光洁平整、饱满、粉饼状记为佳(-);表面平整、饱满、略有针晶记为(+);饱满、针晶状、略有皱缩记为(++);塌陷、脱离瓶壁、硬壳记为(+++)。
再分散效果(复溶效果):取各冻干产品,加注射用水2.0 mL,轻轻振摇后,溶液不分层,无沉淀,无药物结晶,水化后透光性与冻干前相似记为(-);溶液不分层,无沉淀,无药物结晶,水化后透光性与冻干前澄明度有所下降,略带乳光记为(+);不分层,无沉淀,无药物结晶,水化后不透明记为(++);分层,有不可逆沉淀,水化后完全不透明、记为(+++)。结果见图4和表1。
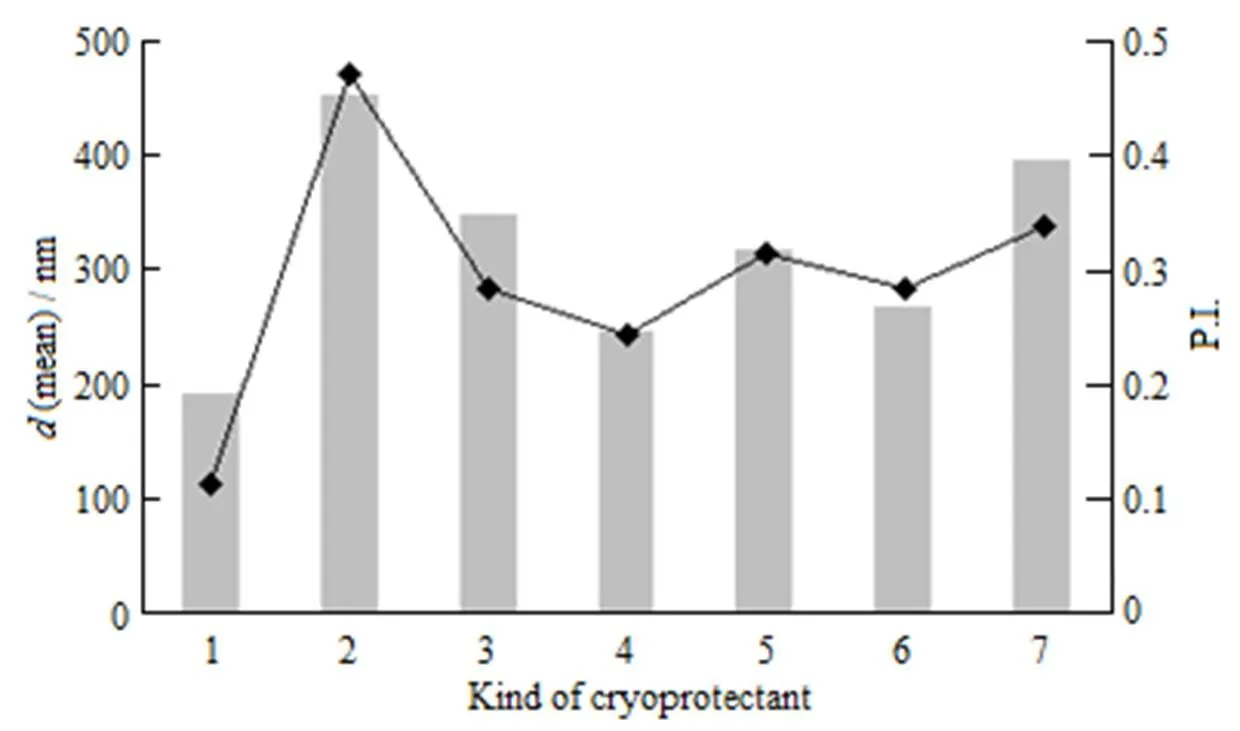
n—Mean diameter; u—P.I.; 1—Before FD.; 2—Without cryoprotectants; 3—10% Lactose; 4—100 g∙L-1 Trehalose; 5—50 g∙L-1 Mannitol; 6—100 g∙L-1 Sucrose; 7—50 g∙L-1 Glucose
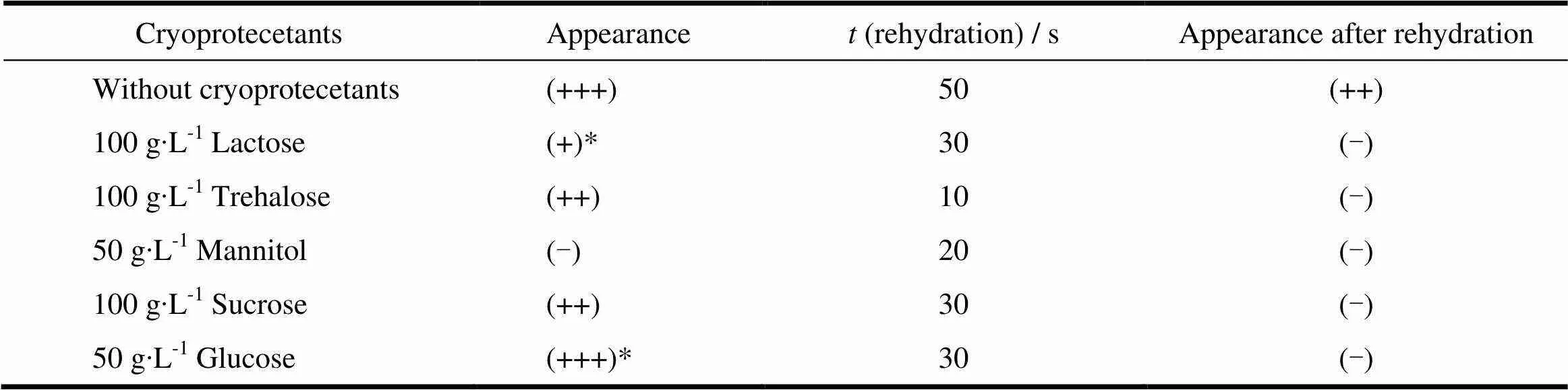
Table 1 The effect of different cryoprotectants on the characteristics of the freeze-dried products
Note: *—Means color of products deepen
结果表明:乳糖、葡萄糖和甘露醇赋型作用好,可使样品保持较好的外观形态,表面平整、细腻,但复溶后粒径明显增大,再分散效果差。海藻糖和蔗糖为冻干保护剂的样品外观不饱满、皱缩、塌陷、脱离瓶壁,对样品的赋型作用差,但复溶后粒径变化不明显,再分散效果好。
2.4.2 冻干保护剂的联合使用
单一冻干保护剂对制剂冻干的保护效果不能达到要求,故考虑冻干保护剂的复配即冻干保护剂的联合使用。
从“2.4.1”条可知,乳糖、葡萄糖和甘露醇作为冻干保护剂可起到保护冻干粉的外观即赋形作用好;而海藻糖和蔗糖作为冻干保护剂,再分散效果好,可以保护粒径。综合考虑,选择联合使用海藻糖和甘露醇考察其对冻干制剂的保护作用,结果见图5和表2。
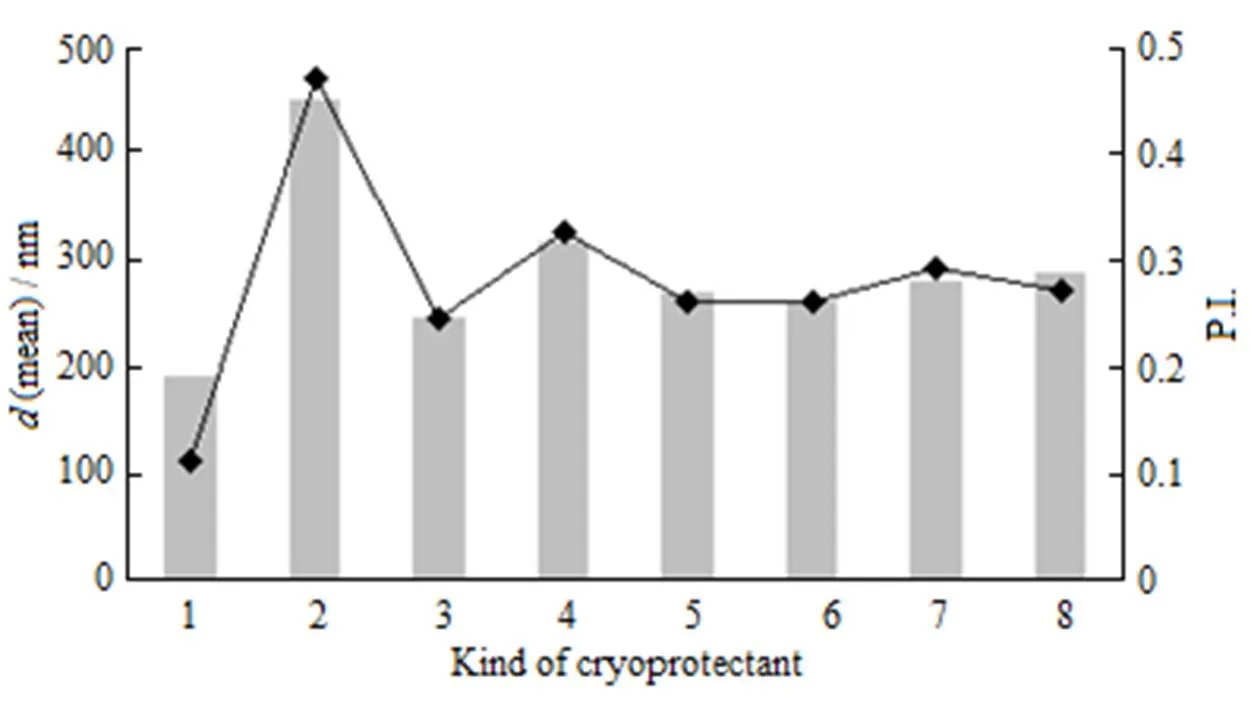
n—Mean diameter; u—P.I.; 1—Before FD.; 2—Without cryoprotectants; 3—100 g∙L-1 Trehalose; 4—50 g∙L-1 Mannitol; 5—50 g∙L-1 Trehalose + 25 g∙L-1 Mannitol; 6—50 g∙L-1 Trehalose + 50 g∙L-1Mannitol; 7—100 g∙L-1 Trehalose + 25 g∙L-1 Mannitol; 8—100 g∙L-1 Trehalose + 25 g∙L-1 Mannitol
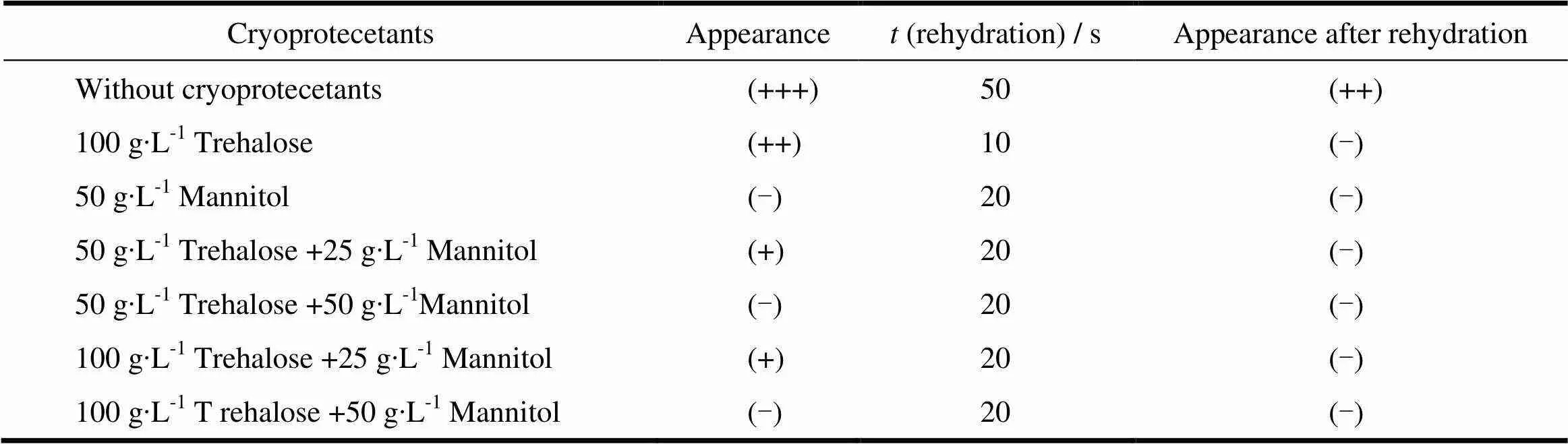
Table 2 Effect of combination use of cryoprotectants on the characteristics of the freeze-dried products
结果表明,不同比例的复合冻干保护剂的冻干品外观均良好,表面光洁平整、饱满,白色无花斑。当使用50 g∙L-1海藻糖+50 g∙L-1甘露醇时,再分散后粒径变化最小。综合外观、再分散性、水化后粒径等指标,优选保护剂处方为海藻糖和甘露醇的质量浓度比为1∶1,总糖质量浓度为100 g∙L-1。
2.5 BSA本身对纳米粒的保护作用
BSA分子质量为65 ku,属于水溶性高分子物质,考虑到BSA本身可能具有一定的冻干保护剂作用[3],因此本实验外加100 g∙L-1白蛋白作为冻干保护剂进行冻干的效果考察。结果发现以BSA作为冻干保护剂的冻干产品外观较差,塌陷且呈蜂窝状空洞,而且水化速度慢,结果见表3。因此没有选择BSA作为冻干保护剂。

Table 3 The effect of Cryoprotectants and BSA on the characteristics of the freeze-dried products
3 讨论
3.1 含量的考察
在考察冻干保护剂效果时未将包封率列为考察指标是因为发现冻干前后包封率差异不大,数据没有统计学意义。原因可能与药物和BSA结合方式有关,药物没有和BSA形成核壳结构,而是互相吸附、缠绕后形成纳米粒,因此冻干过程对包封率没有太大的影响。
3.2 蛋白保护机制的假设
冻干过程中蛋白质自身荷电性使互相之间形成复杂的静电相互作用,稳定微粒和游离的蛋白质;加之其坍塌温度较高(c为-9.5 ℃[4]),在升华干燥过程中,所形成的冻干骨架间隙内的水分是非流动的,对纳米粒起到一定的稳定作用。但是BSA支撑作用较差,而且亲水性要低于糖类冻干保护剂,因此得到的冻干产品外观不佳,水化速度慢。
关于蛋白在冷冻干燥过程中的机制,Allison[5]在1996年提出了假设,推测蛋白在冷冻干燥时的稳定作用与浓度有关,,首先在冷冻过程中,蛋白处于高浓度时,临近蛋白分子的空间排斥作用会抑制蛋白分子的伸展,冷冻时形成的冰水界面的表面积缩小,在界面上聚集和变性的蛋白就会减少。但是蛋白在溶液中的聚集也与浓度有关,据文献报道[6],蛋白质量浓度高于20 g∙L-1时,会促进聚集。
3.3 迈拉德反应 (Maillard reaction)
葡萄糖、乳糖等还原性糖的醛基有可能与蛋白质上的暴露的某些氨基酸残基(如伯胺基)发生迈拉德反应,使蛋白质活性降低,制品变黄。迈拉德反应[7-8]是非酶促褐变反应之一,指羰基化合物(糖类)和氨基化合物(氨基酸、肽和蛋白质)的反应,发生在较低的温度和较稀的溶液中。当反应温度提高或加热时间增加时,表现为色度增加,同时碳氮比、不饱和度、化学芳香性也随之增加。而蔗糖、海藻糖是非还原性糖,不会与蛋白质中氨基酸发生迈拉德反应。可见糖的还原性也会影响其对蛋白质的保护作用,还原性越弱,蛋白质冻干制品的贮存稳定性越强。
[1] 苏华, 胡晋红, 李凤前. 白蛋白纳米粒的制备工艺及其靶向性研究进展[J]. 中国药学杂志, 2005, 40(9): 641-644.
[2] 耿锟锟, 熊非, 朱家壁, 等. 用于药物制剂的冷冻干燥技术及相关影响因素[J]. 药学杂志, 2011, 35(3): 104-109.
[3] ANHORN M G, MAHLER H, LANGER K. Freeze drying of human serum albumin (HSA) nanoparticleswith different excipients[J]. International Journal of Pharmaceutics, 2008, 363: 162–169.
[4] PIKAL M J. Freeze-drying of proteins. Part Ⅱ: formulationselection[J]. Biopharm, 1990, 3(9): 26-30.
[5] ALLISON S D, DONG A, CARPENTER J F. Counteracting effects of thiocyanate and sucrose on chymotrypsinogen secondary structure and aggregation during freezing drying and rehydration[J]. Biophys, 1996, 71: 2022-2032.
[6] RUDDON R W, BEDOWS E. Assisted protein folding[J]. Biol Chem,1997, 272: 3125.
[7] MILLER D P, ANDRESON R E, DE PABLO J J. Stabilization of lactate dehydrogenase following freeze-thawing and vacuum-drying in the presence of trehalose and borate[J]. Pharm Res, 1998, 15: 1215-1221.
[8] PATIL V, DANDEKAR P , PATRAVALE V B, et al. Freeze drying: potential for powdered nanoparticles product [J]. Drying Technol, 2010, 28(5): 624-635.
(本篇责任编辑:赵桂芝)
Lyophilization optimization of doxorubicin-albumin nanoparticles
MA Yonghong, GUAN Guannan, KANG Shuangming, LI Wenpan, ZHANG Jie, HU Hangyang, CHEN Dawei*
(,,110016,)
To study the freeze-dryingprocess and cryoprotectant of DOX-BSA-NP.The process of pre-freezing and drying was investigated and the appearance of the freeze-dried preparation, the degree of rehydration and the particle size after hydration were used as indicator. The DOX-BSA-NP without any protective agent as a control, the use of a single freeze-dried protective agent and the combined use of freeze-dried protective agents were investigated.The final freeze-drying process was as follows: the samples were pre-frozenat -75 ℃ for 10 h and transferred to the freeze-drying machine with a cold trap temperature drop to -20 ℃, and the drying time was 12 h for the first drying stage. And the duration of 2 h for the second drying period. The optimal freeze-dried protective agentswere 50 g∙L-1mannitol and 50 g∙L-1trehalose.The lyophilization conditions of DOX-BSA-NPs can be preliminarily screened by the appearance of freeze-dried preparations, the degree of difficulty of rehydration and the particle size of hydration preparation.
pharmaceutics; albumin nanoparticles; cryoprotector; doxorubicin
(2018)01–0001–08
10.14146/j.cnki.cjp.2018.01.001
R944.9
A
2017-11-14
马永鸿(1984–), 男(汉族), 辽宁沈阳人, 硕士研究生, E-mail Christop@163.com;
张可(1958–), 男(汉族), 辽宁鞍山人, 教授, 博士, 博士生导师, 主要从事药物新剂型及主动靶向技术研究, Tel. 024-43520545, E–mail chendawei@syphu.edu.cn。
