2-(2-羟基)丙酰氨基-苯甲酸颗粒剂的制备及质量控制
2018-01-29李莎莎张启丽王丹琳赵云丽于治国
李 昀,李莎莎,张启丽,王丹琳,赵云丽,于治国*
2-(2-羟基)丙酰氨基-苯甲酸颗粒剂的制备及质量控制
李 昀1,2,李莎莎1,张启丽1,王丹琳1,赵云丽1,于治国1*
(1. 沈阳药科大学药学院,辽宁沈阳110016;2. 大连医科大学第二附属医院药学部,辽宁大连116027)
2-(2-羟基)丙酰氨基-苯甲酸 (HPABA) 颗粒剂的制备及其质量控制。对HPABA的平衡溶解度和油/水分配系数进行测定;对填充剂和润湿剂的种类以及颗粒的干燥温度和干燥时间进行考察,以优化处方的制备工艺,并对颗粒剂的特性及主成分的含量进行测定,以评价制备工艺的可行性。以乳糖为填充剂、水为润湿剂,在60 ℃条件下干燥2 h,制得的颗粒剂流动性好、产率高;特性检查结果均符合制剂通则要求。HPABA颗粒剂制备工艺方法可行,适合规模化生产。
药剂学;颗粒剂;高效液相色谱;2-(2-羟基)丙酰氨基-苯甲酸;油/ 水分配系数;平衡溶解度;含量测定
炎症是机体对各种刺激因子所作出的复杂的防御反应。这些刺激因子包括:物理损伤、化学物质、微生物的入侵以及免疫反应等[1-2]。病理性炎症能够对机体组织造成不可逆的过度损伤或者诱发一些炎症性疾病,如:骨关节炎、类风湿性关节炎、炎性胃肠道疾病以及哮喘等[3-5]。目前,临床上应用最多的抗炎药物是非甾体类抗炎药(NSAIDs)。然而,各种如胃肠道出血、皮肤反应、肾损害、肝损害和心血管系统不良反应等限制了NSAIDs应用[6]。因此,开发具有较好的抗炎活性、较少的不良反应并能够长期使用的抗炎药物仍然具有非常重要的现实意义。
2-(2-羟基)丙酰氨基-苯甲酸 (HPABA) 最初是从微生物的次生代谢产物中提取分离而来,并可以通过化学合成方法得到,化学结构式见图1。药效学结果显示,HPABA具有明显的抗炎镇痛活性,且其胃肠道刺激显著低于阿司匹林[7]。因此,HPABA是一个很好的抗炎候选化合物。本课题组前期的破坏实验结果显示,HPABA对光和热不敏感,即使在强酸、强碱或强氧化条件下,才有微量降解产物产生,稳定性实验结果表明HPABA耐高温和高湿[8]。HPABA为一个潜在的抗炎新化合物,但其剂型研究尚未报道。根据HPABA的理化性质及临床治疗的需要,拟将HPABA制成一种口服制剂。颗粒剂是临床用药中常用的一种药物剂型,其制备工艺简单且成本低,与片剂和胶囊剂相比,口服后没有崩解过程,迅速分散后具有较大的比表面积,具有溶出快、吸收快、给药方便,稳定、奏效快等特点。因此,本文作者拟对HPABA颗粒剂的处方工艺进行研究,并建立HPABA颗粒剂的质量控制方法。这将为HPABA剂型的进一步开发和临床应用提供理论依据。
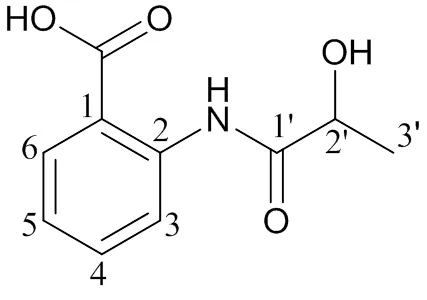
Fig. 1 The structure of HPABA
1 仪器和材料
LC-10ATVP Plus高效液相色谱仪(包括SPD-10 Avp检测器、SIL-10AF自动进样器,日本 Shimadzu有限公司),BP110S 电子天平(德国 Sartorius公司),AB135-S分析天平(瑞士METTLER TOLEDO公司),KQ-250E超声波清洗仪(江苏昆山超声仪器有限公司),PHS-2TC 精密数显酸度计(上海之信仪器有限公司),ZD-85A恒温振荡仪(金坛荣华仪器制造有限公司)。
HPABA原料药(自制,批号 20140623),HPABA对照品(纯度质量分数为99.3%,自制),HPABA颗粒剂(自制,批号 20160901、20160902、20160903),乳糖(批号 1102281)、淀粉(批号 20130561)、冰醋酸(色谱纯,天津科密欧化学试剂有限公司),盐酸(分析纯,天津凯信化学工业有限公司),乙腈(色谱纯,天津康科德科技有限公司),水(纯净水,杭州娃哈哈集团有限公司)。
2 方法与结果
2.1 HPABA颗粒剂处方前研究
2.1.1 HPABA平衡溶解度的测定
按《中华人民共和国药典》2015年版通则8005中的方法配制pH值分别为3.0、4.0、5.0、5.8、6.8、7.4和8.0的磷酸盐缓冲液(PBS)。取HPABA置于50 mL锥形瓶中,各加入上述不同pH值的磷酸盐缓冲液,涡旋振摇至药物不再溶解,于37 ℃恒温振荡器中恒温振荡72 h后取出,以1×104r·min-1离心10 min,取上清液过0.22 µm的微孔滤膜,滤液用流动相稀释至适当质量浓度,按“2.4.1”条色谱条件进样分析。另取HPABA对照溶液 (50 mg·L-1),同法测定,按外标法以峰面积计算HPABA在不同pH值缓冲液中的平衡溶解度,结果见图2。结果显示HPABA在不同pH值的缓冲液中,溶解度随pH值的增大而增加。
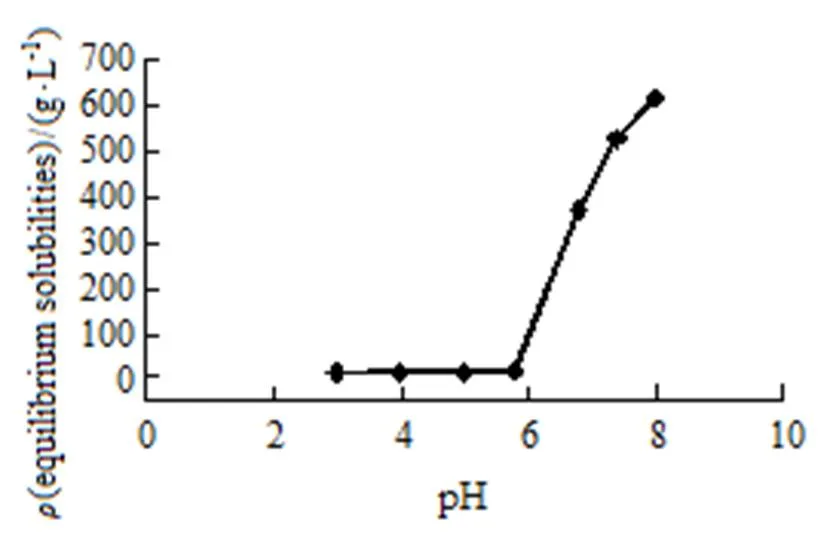
Fig. 2 Equilibrium solubilities of HPABA in the medium of different pH at 37 ℃
2.1.2 HPABA油/水分配系数的测定
取HPABA的水饱和正辛醇溶液15 mL作为油相,分别加入正辛醇饱和的水或不同pH值的磷酸盐缓冲液(pH值为3.0、4.0、5.0、5.8、6.8、7.4和8.0)15 mL作为水相,于37 ℃恒温振荡器中恒温振荡36 h后取出,以1×104r·min-1离心10 min,分离两相,分别过0.22 µm的微孔滤膜,滤液用流动相稀释至适当质量浓度,按“2.4.1”条色谱条件进样分析。另取HPABA对照溶液 (50 mg·L-1),进样分析,按外标法以峰面积计算HPABA在两相中的质量浓度。按照以下公式计算油/水分配系数:o/w=o/w。
式中o/w为HPABA的表观油/水分配系数;o和w分别为HPABA分配平衡时,正辛醇层和水相中测得的药物质量浓度(mg·L-1),测定结果见表1。结果表明HPABA在正辛醇-水中的分配系数为7.5×10-2(log= -1.126)。HPABA在正辛醇-缓冲液中的分配系数随着pH值的增大而减小,在酸性缓冲系统中的分配系数较大。

Table 1 The log Po/w of HPABA in n-octanol-water/buffer solution systems
2.2 HPABA颗粒剂处方工艺研究
2.2.1 休止角的测定
流动性的测定方法采用经典的固定漏斗法[9]。将待测物料轻轻地、均匀地落入圆盘中心部,使粉体形成圆锥体,当物料从粉体斜边沿圆盘边缘自由落下时停止加料,测定圆盘的半径()和物料的高度(),按公式tg=/计算休止角。
2.2.2 压缩度的测定
采用的是量筒法[10]。精密称取一定量干燥好的颗粒,质量记为,置于10 mL量筒中,记录初体积为0,上下震动至体积不再变化,记录体积f,按公式0=/0,f=/f计算堆密度(),按公式= (f-0)/f×100%计算压缩度。
2.2.3 吸湿百分率的测定
按《中华人民共和国药典》2015年版通则9103,将底部盛有氯化钠饱和溶液的玻璃干燥器,放入25 ℃恒温培养箱内放置24 h,当相对湿度达到75%时,在质量恒定(0)的称量瓶内加入精密称定的不同处方的颗粒(1),厚约2 mm,打开瓶盖,放入干燥器内,放置24 h后,盖上瓶盖,取出,立即称定质量(2),按下式计算吸湿率():
=[(2-0)-1]/1×100%。
2.2.4 制剂规格的确定
根据大鼠体内药效学实验结果有效剂量为25~100 mg·kg-1,折算成人(成年人体质量按60 kg计算)的剂量为250~1 002 mg·d-1,HPABA作为一个新型的非甾体类抗炎药,参考阿司匹林的临床剂量以及结合自身的药效学结果,将HPABA的规格初步定为300 mg,此外,根据临床常用及经典的市售颗粒剂装量(如三九感冒颗粒、清开灵颗粒以及板蓝根颗粒每袋的装量均为10 g),将HPABA颗粒剂的装量初步定为每袋10 g。
2.2.5 填充剂的选择
根据大量的文献查阅及固体制剂常用辅料,考察淀粉和乳糖2种填充剂。以水作为润湿剂,制软材,以手握成团,轻压即散为佳。湿法制粒,过1 000 μm筛,60 ℃干燥2 h,干燥后颗粒用1 400 μm筛整粒。以休止角、压缩度和吸湿百分率为指标来考察填充剂对颗粒流动性和吸湿性的影响,结果见表2。

Table 2 The results of the effect of different fillers on granules
根据表2结果,选择乳糖作为填充剂,颗粒流动性好且药物吸湿性更小。
2.2.6 黏合剂与润湿剂的选择
原药粉与乳糖混合均匀后,以颗粒流动性、成型率和制粒难度为参考指标,考察不同黏合剂或润湿剂对制粒情况的影响。湿法制粒,过1 000μm筛, 60 ℃干燥2 h,干燥后颗粒用1 400μm筛整粒,结果见表3。
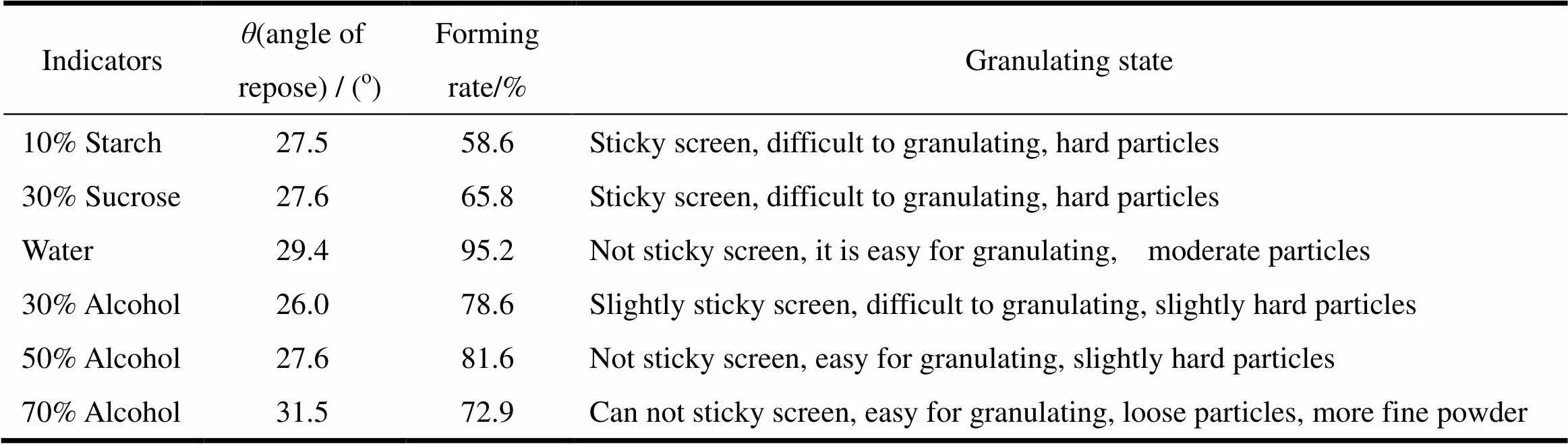
Table 3 The results of the effect of different moistening agents and adhesives on granules
由表3结果可知,当使用黏合剂时,会出现黏筛,制粒困难等现象,因此,不适合加入黏合剂;选择不同体积分数的乙醇作为润湿剂,低浓度时颗粒较硬,高浓度时细粉较多,而选择水作为润湿剂时,不黏筛,较易制粒,颗粒的流动性和成型率也较高。因此,综合考虑,选择水作为润湿剂。
2.2.7 干燥温度的选择
为保证颗粒的成型性,对颗粒的干燥温度和干燥时间进行考察,观察颗粒干燥后状态,结果见表4。
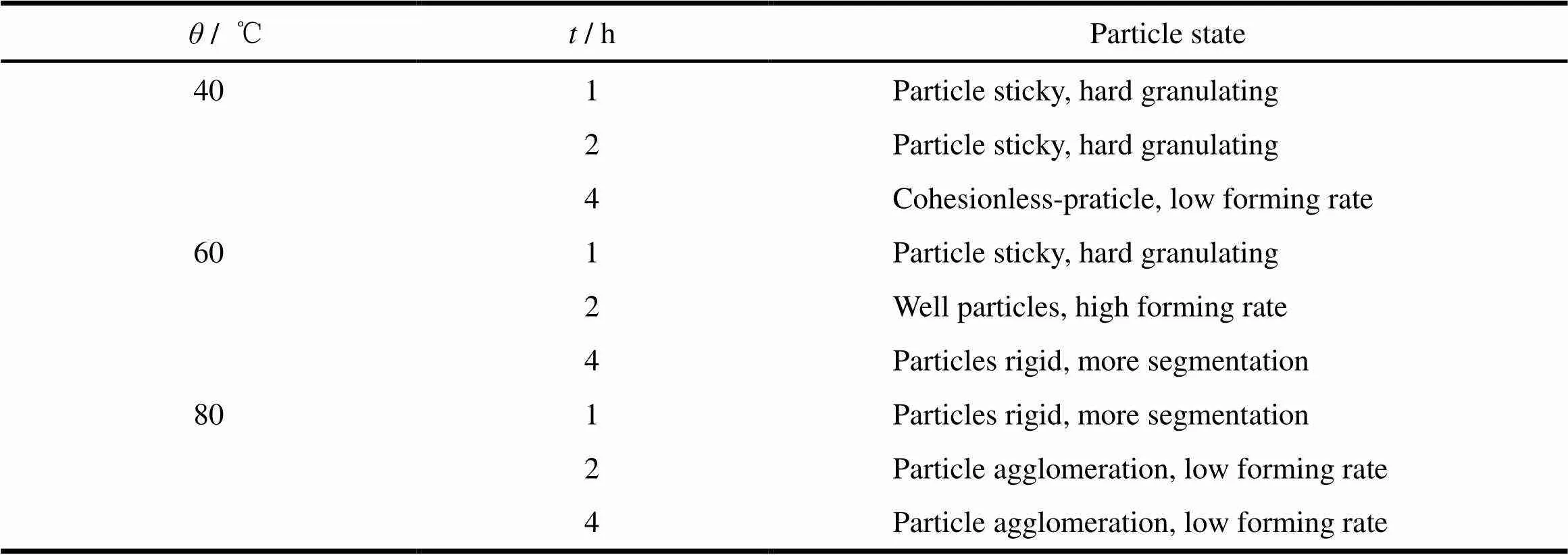
Table 4 The results of the drying temperature on granules
由表4结果可知,选择60 ℃作为干燥温度,颗粒状态最好,不结块,成型率高,因此,选择60 ℃条件下干燥2 h。
2.3 HPABA颗粒剂质量检查
2.3.1 粒度
按《中华人民共和国药典》2015年版通则0982中的第二法双筛法测定粒度和粒度分布,不能通过一号筛与能通过五号筛的总和不得超过供试量的15%。
2.3.2 干燥失重
按《中华人民共和国药典》2015年版通则0831干燥失重测定法测定,于80 ℃减压干燥至质量恒定,减失质量不得超过2.0%。
2.3.3 溶化性
取颗粒剂10 g,加热水200 mL,搅拌5 min,立即观察,可溶颗粒应全部溶化或轻微浑浊,但不得有异物。
2.3.4 检查结果
3批颗粒剂的粒度,干燥失重和溶化性检查结果见表5。

Table 5 The results of the general inspection of granules
由表5结果可知,3批HPABA颗粒剂的粒度、干燥失重和溶化性检查均符合规定。
2.4 HPABA颗粒剂含量测定
2.4.1 色谱条件
色谱柱:Thermo Hypersil GOLD C18柱(250 mm×4.6 mm,5 µm);流动相:乙腈-体积分数0.1%冰醋酸水溶液(体积比为16∶84);检测波长:250 nm;流速:1 mL·min-1;进样量:10 µL;柱温:35 ℃。
2.4.2 系统适用性试验
取HPABA供试溶液10 µL,按“2.4.1”条色谱条件进样分析,记录色谱图(图3)。结果表明,主成分色谱峰与相邻其他色谱峰的分离度大于1.5,理论塔板数按HPABA峰计不低于5 000。
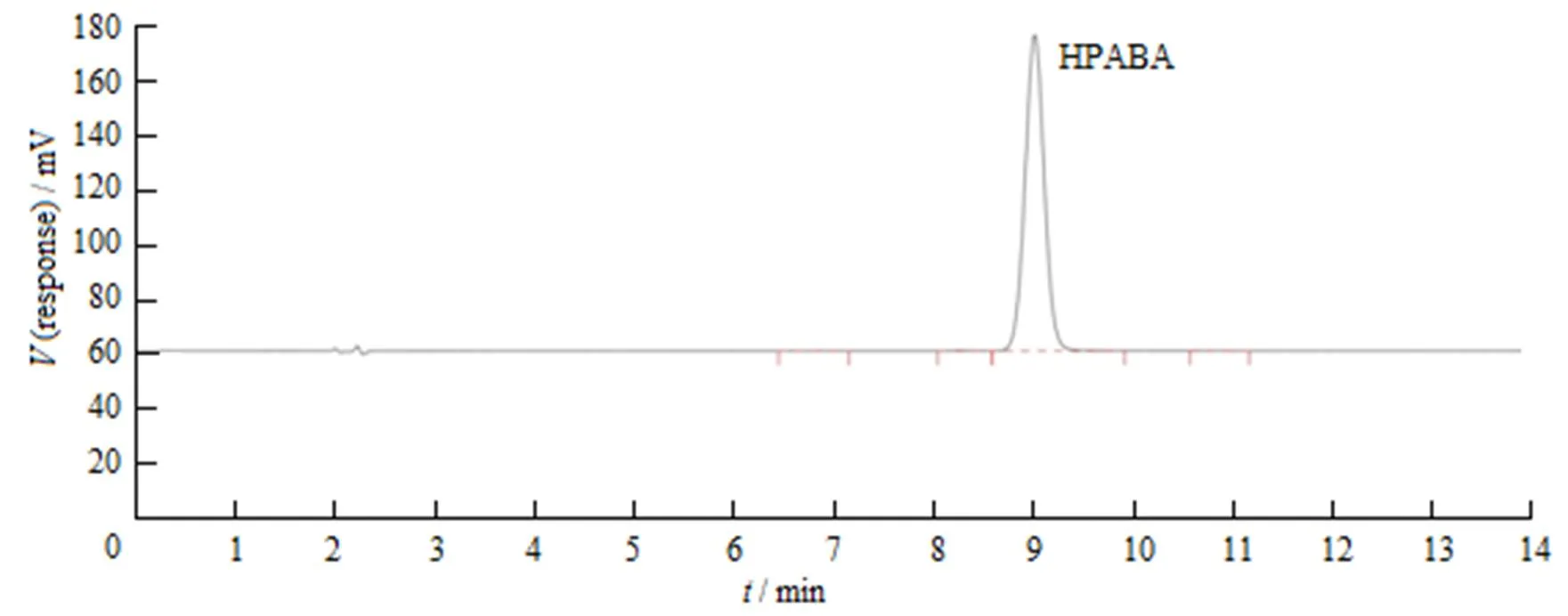
Fig. 3 The HPLC chromatogram of system suitability solution
2.4.3 样品含量测定
取HPABA颗粒剂适量,研细,精密称取适量(约相当于HPABA 25 mg),置于50 mL量瓶中,加流动相适量,超声使溶解,放冷,用流动相稀释至刻度,摇匀,离心,取上清液过 0.22 µm的微孔滤膜,精密量取续滤液1.0 mL,置于10 mL量瓶中,加流动相稀释至刻度,摇匀,取10 µL进样分析,记录色谱图;另取HPABA对照品约25 mg,置于50 mL量瓶中,加流动相溶解并稀释到刻度,摇匀,精密量取1.0 mL,置于10 mL量瓶中,加流动相稀释至刻度,摇匀,取10 µL进样分析,记录色谱图。按外标法以峰面积计算含量。3批样品(批号20160901、20160902和20160903)的含量质量分数分别为97.7%、97.1%和100.4%。
3 讨论
3.1 HPABA平衡溶解度的测定
溶解度是药物的一项重要理化性质,也是药物制剂设计的依据之一。对于固体制剂来说,在测定溶出度选择溶出介质时,需要研究药物在不同介质中的溶解度,以便选择符合漏槽条件的溶出介质。HPABA的溶解度随着pH值的增大而增大,这是由于其分子中具有羧基基团,在较高pH值下可发生解离而溶解。人体小肠的pH值为4~8,HPABA在该pH值条件下具有较好的溶解度,易于吸收。药物的溶解度对其体外的溶出和体内的吸收具有重大的影响,因此考察HPABA在不同介质中的溶解度可为其剂型设计和工艺参数的确定提供理论依据。
3.2 HPABA油/水分配系数的测定
药物在体内的吸收、分布、排泄和代谢过程与药物的水溶性和脂溶性密切相关[9-10]。药物的脂溶性大小对药物透过生物膜的能力具有很大影响,直接影响药物的吸收速度和程度。因此对HPABA的油/水分配系数进行研究,将对其体内的药动学性质的研究提供依据,这也是剂型设计的一个重要因素之一。而药物的脂溶性不仅与药物的分子结构有关,与药物所处环境的pH值也有很大关系。由结果可知,HPABA在酸性和近中性条件下脂溶性要比碱性条件下好。通常药物透过生物膜的方式主要是被动转运时,其油/水分配系数越大越容易通过细胞膜。药物的脂溶性过低(log﹤-2),药物难以透过生物膜;若药物脂溶性过高(log﹥3),则不易进入血管或淋巴管。一般而言,药物的 log值在-1~2 内,药物脂溶性和水溶性适中,具有较好的膜渗透性[11]。HPABA在酸性和近中性条件下,log值在-1~2 内,具有较好的膜渗透性。此外, HPABA在体肠吸收实验结果表明,其吸收机制不是简单的被动扩散,而是载体介导的转运或载体介导的转运与被动扩散相结合[12]。因此,油/水分配系数这一参数不是影响HPABA吸收的唯一因素。
3.3 HPABA颗粒剂制备工艺及质量控制
休止角和压缩度是体现粉体流动性的两个重要参数,休止角越小,流动性越好。一般认为≤30o流动性好,≤40o可满足生产过程中流动性的需要[10]。实践证明,压缩度在20%以下时流动性较好,当压缩度达到40%~50%时粉体很难从容器中流出。乳糖与淀粉相比,除具有较好的流动性和可压性,且无吸湿性,性质稳定,可与大多数药物配伍。此外,乳糖还兼有矫味作用,而且实验结果显示以乳糖为填充剂,颗粒的成型率更高及流动性更好。因此选择乳糖作为填充剂。本研究对该颗粒剂进行了相关特性检查及含量测定,结果均符合要求。因此,该制备工艺简单、可行,可用于规模化生产。
[1] KHATRI C K, INDALKAR K S, PATIL C R,et al. Novel 2-phenyl-4,5,6,7-tetrahydro[b]benzothiophene analogues asselective COX-2 inhibitors: Design, synthesis, anti-inflammatoryevaluation, and molecular docking studies[J]. Bioorg Med Chem Lett, 2017, 27 (8): 1721-1726.
[2] RICCIOTTI E, FITZ GERALD G A. Prostaglandins and inflammation[J]. Arterioscler Thromb Vasc Biol, 2011, 31 (5): 986-1000.
[3] CALDER P C. Fatty acids and inflammation: the cutting edge between food and pharma[J]. Eur J Pharmacol, 2011, 668: S50.
[4] CALDER P C, ALBERS R, ANTOINE J M,et al, Inflammatory disease processes and interactions with nutrition[J]. Br J Nutr, 2009, 101: S1.
[5] NATHAN C. Points of control in inflammation[J]. Nature, 2002, 420(6917): 846.
[6] SAVJANIA J K, MULAMKATTIL S, B. VARIYA B, et al. Molecular docking, synthesis and biological screening of mefenamic acid derivatives as anti-inflammatory agents[J]. Eur J Pharmacol, 2017, 801: 28-34.
[7] WANG J J, ZHAO Y L, MEN L,et al. Secondary metabolites of the marine fungus penicillium chrysogenum[J]. Chem Nat Compd, 2014, 50 (3): 405-407.
[8] 王晶晶. 2-乳酰氨基苯甲酸的合成、活性评价及质量标准研究 [D]. 沈阳: 沈阳药科大学, 2013: 38-40.
[9] 崔福德. 药剂学实验指导[M]. 第三版. 北京: 北京人民卫生出版社, 2011: 3.
[10]葛文漪. 六月青总多糖和总皂苷制备、质量标准研究及部分药效学评价[D]. 南宁: 广西医科大学, 2013: 18-19.
[11] 周云, 符旭东, 毕诗涛. 盐酸奈必洛尔平衡溶解度及表观油/水分配系数的测定[J]. 中国药师, 2017, 20 (4): 754-756.
[12] ZHANG Q L, ZHANG M Y, WANG D L, et al. Comparison of intestinal permeability and-glycoproteineffects on the intestinal absorption of enantiomers of 2-(2-hydroxypropanamido) benzoic acid in rats[J]. Chir, 2017, 29 (1): 26-32.
(本篇责任编辑:赵桂芝)
Studies on preparation and qualitycontrol of 2-(2-hydroxy- propanamido) benzoic acid
LI Yun1,2, ZHANG Qili1, LI Shasha1, WANG Danlin1, ZHAO Yunli1, YU Zhiguo1*
(1.,110016,; 2.,116027,)
To prepare 2-(2-hydroxypropanamido) benzoic acid (HPABA) granules and evaluate the quality of HPABA granules.The equilibrium solubility and oil/water partition coefficient of HPABA were investigated. In addition, the fillers, moistening agents, drying temperature and drying time were investigated to obtain an optimum prescription. Moreover, the quality of granules was evaluated according to the relevant guidelines.Lactose and water were selected as the fillers and moistening agents, respectively. The granules were dried at 60 ℃ for 2 h. Furthermore, the results of the general inspection of granules were conformed to the requirements of the general principles.The preparation technology of HPABA granules is reliable and suitable for mass production.
pharmaceutics; granules; HPLC; 2-(2-hydroxypropanamido) benzoic acid (HPABA); oil/water partition coefficient; equilibrium solubility; content determination
(2018)01-0009-08
10.14146/j.cnki.cjp.2018.01.002
R 94
A
2017-10-09
李昀(1981-), 男(汉族), 辽宁大连人, 硕士研究生, E-mail dlmuxh@126.com;
于治国(1958-),男(汉族), 山东莱西人, 教授, 博士; 博士生导师, 主要从事药品质量控制与药代动力学研究, Tel. 024-43520580, E-mail zhiguo-yu@163.com。
