碳青霉烯类耐药肺炎克雷伯菌的分子特征
2018-01-27高倩倩祝俊英秦娟秀
高倩倩, 殷 杏, 祝俊英, 秦娟秀, 黄 芊, 夏 强, 李 敏
肺炎克雷伯菌是临床上常见的条件致病菌,可引起呼吸道、泌尿道、肠道、血液及其他无菌部位(如腹腔、胸腔、关节等)的多部位感染[1]。碳青霉烯类抗生素是目前临床上治疗产超广谱β内酰胺酶(ESBL)肠杆菌科细菌感染的首选药物,然而随着临床的广泛使用,碳青霉烯类耐药肺炎克雷伯菌(CRKP)的比例逐年上升[2],产碳青霉烯酶是其耐药及广泛传播的主要原因之一,并有研究报道已出现高毒力高耐药菌株[3-4]。如果这类菌株广泛出现并传播,会造成严重的难治性感染。本课题旨在研究CRKP常见碳青霉烯类耐药基因与毒力基因的分布及分子流行病学特征。
1 材料与方法
1.1 菌株来源
收集2015年上海仁济医院和长征医院临床分离84株非重复CRKP,其中54株来自上海仁济医院,30株来自长征医院。
1.2 仪器和试剂
药敏纸片(英国OXOID公司),血琼脂培养基、MH琼脂培养基(法国生物梅里埃公司),聚合酶链反应(PCR)扩增以及纯化试剂盒(日本TaKaRa公司),PCR扩增仪(Eppendorf公司),VITEK 2-Compact全自动微生物鉴定药敏试验分析仪(法国生物梅里埃公司),基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MF, Microflex LT/Sh,BRUKER,德国)。
1.3 菌株鉴定及药敏试验
全部菌株使用VITEK 2 -Compact全自动微生物鉴定仪鉴定为肺炎克雷伯菌,并经MALDI-TOFMF仪验证。药物的敏感性通过纸片扩散法检测,检测药物有:阿米卡星、头孢他啶、庆大霉素、氨苄西林、环丙沙星、哌拉西林、氨苄西林-舒巴坦、头孢吡肟、头孢呋辛钠、头孢哌酮-舒巴坦、头孢噻肟、头孢唑林、厄他培南、美罗培南、亚胺培南15种抗菌药物。大肠埃希菌ATCC 25922为药敏试验质控菌株。
1.4 多位点序列分型(MLST)
个管家基因:rpoB、gapA、mdh、pgi、infB、tonB、infB并测序,引物参见网站:(http://bigsdb.web.pasyeur.fr/klebsiella/Klebsiella.html),测序结果提交MLST网站(http://www.pasteur.fr/recherche/Genopole/PF8/mlst/Kpneumoniae.html)进行序列比对。
1.5 高黏液表型(HM)检测
应用黏液丝试验检测,用接种环轻触血琼脂平皿上培养过夜的新鲜菌落向外牵拉,重复牵拉2次,若2次均有黏液丝形成并且长度大于5 mm即判为HM表型阳性,即该菌株为HM菌株[5]。
1.6 耐药基因及毒力基因检测
煮沸法制备模板,PCR扩增耐药基因blaKPC-2、blaNDM、blaVIM、blaOXA、blaIMP及毒力基因rmpA、mrkD、entB、ybtS、magA、iutA、allS、kfu并由上海铂尚生物有限公司完成双向测序,测序结果在NCBI上比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),引物序列及扩增条件参考文献[3, 6]。
1.7eBUEST软件分析亲缘关系
据使用eBURST软件(Version3,http://eburst.mlst.net/)进行亲缘关系分析。7个位点中6个相同定义为一组,即为克隆群,构建进化关系图谱。1个分型组中包含4个或4个以上ST型的定义为1个克隆复合体CC。每个克隆复合体中有1个经计算推测认为是起源的ST型,即为群主,该克隆复合体中的其他ST型是在起源的ST型基础上进化而来的。与起源的ST型相比,有1个管家基因编码不同的ST型称为单个位点变异型(SLV),有2个管家基因编码不同的ST型称为双位点变异型(DLV),不属于任何一个克隆复合体的ST型称为单个型。
1.8 统计方法
应用WHONET5.6软件对药敏试验结果进行统计分析,折点解读参考美国CLSI 2016标准,Fisher确切概率法,比较不同克隆型毒力基因及耐药基因的携带率;判断不同克隆型耐药差异,P <0.05为差异有统计学意义。
2 结果
2.1 菌株分布
收集2015年CRKP共84株。多来源于呼吸道标本(58.3%,49/84,包括痰、肺泡灌洗液),其次是无菌体液(17.9%,15/84),血(13.1%,11/84)和皮肤软组织(6.0%,5/84)及尿(4.8%,4/84)。菌株最多检出于ICU(31.0%,26/84),其次为外科(29.8%,25/84),干部病房(17.9%,15/84),内科(13.1%,11/84),门急诊和骨科分别检出5株和2株。
2.2MLST分析结果
84株CRKP分为8个不同ST型,其中主要的流行菌株是ST11(84.5%,71株),其余为ST15(4株)、ST323(4株)、ST1869(1株)、 ST722(1株)、 ST1647(1株)、 ST709(1株)、ST45(1株)。侵袭性感染(无菌体液和血液)的26株菌中ST11有25株(占96.2%),非侵袭性感染菌株中ST11型占79.3%(46/58),差异有统计学意义(P<0.05)。4株ST323有1株为侵袭性感染,而4株ST15均为非侵袭性感染。
2.3 药敏试验结果
84株CRKP对亚胺培南、美罗培南及厄他培南耐药率均为100%,对环丙沙星和阿米卡星耐药率分别为77.4%和82.1%,对头孢菌素类、氨基糖苷类、青霉素类耐药率均超过90%。不同ST型耐药率见表1。

表1 84株CRKP对15种抗菌药物的耐药情况Table 1 Resistant rates of 84 strains of carbapenem-resistant Klebsiella pneumoniae to antimicrobial agents[n ( % ) ]
2.4 碳青霉烯酶耐药基因分布
PCR及测序结果显示84株CRKP中78株携带碳青霉烯酶耐药基因,其中不同ST型耐药基因分布见表2。
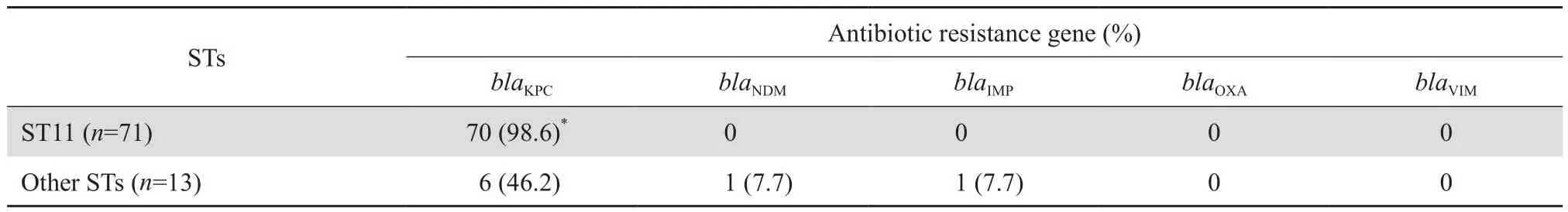
表2 不同ST型CRKP耐药基因分布情况Table 2 Prevalence of antimicrobial resistance gene in carbapenem-resistant Klebsiella pneumoniae strains in terms of ST types[n ( % ) ]
2.5HM表型检测及毒力基因分布
84株CRKP中,黏液丝试验显示2株HM 表型, MLST分型均为ST11,且携带有mrkD、entB、ybtS、rmpA和ituA毒力基因。不同ST型携带毒力基因见表3。
2.6eBURST软件分析种群结构
将本研究的数据结合PubMLST数据库中已有的肺炎克雷伯菌序列型进行eBURST分析。84株CRKP分为8个ST型,2个ST群。每个ST群分别包括2个ST型(ST11和ST1869,ST15和ST709)。其他4个ST型都是单个ST型。84株ST型菌株再与MLST数据库中相关的500株肺炎克雷伯菌比较,后者分为37个克隆群,其中有16个克隆群有其相应的群主(CC258、CC292、CC65、CC17、CC163、CC15、CC37、CC29、CC133、CC273、CC131、CC347、CC42、CC91、CC34、CC76),本实验71株ST11、4株ST15、4株ST323和1株ST45分别属于CC258、CC15、CC163克隆复合体。见图1。

表3 不同ST型CRKP毒力基因分布情况Table 3 Prevalence of virulence genes in carbapenem-resistant Klebsiella pneumoniae strains in terms of ST types[n ( % ) ]

图1 MLST数据库种群快照图Figure 1 Population snapshot in multi locus sequence typing database
3 讨 论
肺炎克雷伯菌是临床上常见的条件致病菌,CRKP的出现与播散是世界性的共同难题[1-2,7]。近年不断有报道发现了高耐药高毒力的肺炎克雷伯菌[3-4,8],该种菌株的出现给患者的生命造成了极大威胁。本研究针对耐药基因与毒力基因的携带情况及分子流行病学特征展开深入研究,以明确表型和基因特征。
本研究发现CRKP除对环丙沙星及阿米卡星的耐药率为77.4%和82.1%外,对其他临床常用多种药物高度耐药,包括青霉素类、头孢菌素类、碳青霉烯类及氨基糖苷类等,耐药率均在90%以上,使CRKP感染患者面临无药可治的风险。产碳青霉烯酶是肺炎克雷伯菌对碳青霉烯类抗生素耐药的机制之一,目前最受关注的是Ambler A组的KPC-2型碳青霉烯酶,因其通常由质粒介导,且能在不同病原菌尤其是肠杆菌科细菌中表达,故其流行范围最广[9-10]。本研究耐药基因检测结果显示,90.5%携带blaKPC-2基因,1.2%分别携带blaNDM、blaIMP,仅1株CRKP同时携带blaKPC-2和blaNDM,这与其他报道相比较低[11-12]。另外本实验中有6株未检测出碳青霉烯酶基因,其耐药机制可能与膜通透性改变或外排泵有关,同时这也提示肺炎克雷伯菌的耐药表型受多种耐药机制的影响[6]。根据不同克隆型耐药基因的分布可知,其中98.6%的ST11携带有blaKPC-2,提示产KPC酶是这2所医院CRKP的主要耐药机制。
84株CRKP的毒力基因检测发现mrkD、entB、ybtS携带率较高,达90%以上,其他毒力基因携带率较低。其中mrkD编码黏附性菌毛的黏附作用是致病的先决条件,本研究中仅检出2株mrkD阴性CRKP。entB、ybtS同属于铁载体系统,其具有双重作用,一方面能抑制T细胞增值,另一方面可以摄取铁,均被认为与肺炎克雷伯菌的毒力相关。此外,本研究还检出2株HM型菌株,其毒力基因检出率要明显高于其他非黏液型菌株,建议实验室除了开展对肺炎克雷伯菌的耐药性检测外,还应该留意检测肺炎克雷伯菌的黏液表型,并及时与临床沟通。
84株CRKP进行MLST分型,eBURST分析分为8个ST型,亲缘关系较近的有ST11和ST1869,ST15和ST709,其中84.5%的菌株为ST11,是本次研究的主要ST型,与本地区之前的报道相比,主要ST型并没有发生改变[13]。本研究也发现ST15和ST323在小范围内有一定的传播,提示耐药菌株具有多样性的特点。分子流行病学分析发现,产KPC酶的肺炎克雷伯菌主要是ST11和ST15,两者blaKPC-2阳性率之和达97.2%,主要分布在ICU及神经外科等感染多发科室。
综上所述,上海2所医院主要流行的CRKP克隆株是ST11,CRKP对大多数临床常用抗菌药物高度耐药,其主要的耐药机制是产KPC酶,并呈现出克隆传播趋势。在84株CRKP中出现2株高毒力克隆株,医院相关部门应对耐碳青霉烯类肺炎克雷伯菌开展更广范围的监测,积极控制CRKP的流行传播,尤其控制高毒力高耐药菌株的传播,同时医护人员应遵循规范化操作,尽量避免由医护人员导致的传播,临床医师在抗感染治疗时,应综合各方面考虑,合理和联合用药,尽量减轻抗生素对细菌的选择压力。
[1]TANGDEN T, GISKE CG. Global dissemination of extensively drug-resistant carbapenemase-producing Enterobacteriaceae:clinical perspectives on detection, treatment and infection control[J]. J Intern Med, 2015, 277(5): 501-512.
[2]PRESTINACI F, PEZZOTTI P, PANTOSTI A,et al.Antimicrobial resistance: a global multifaceted phenomenon[J].Pathog Glob Health, 2015, 109(7): 309-318.
[3]ZHANG Y, ZENG J, LIU W, et al. Emergence of a hypervirulent carbapenem-resistant Klebsiella pneumoniae isolate from clinical infections in China[J]. J Infect, 2015, 71(5): 553-560.
[4]ZHANG R, LIN D, CHAN EW, et al. Emergence of carbapenem-resistant serotype K1 hypervirulent Klebsiella pneumoniae strains in China[J]. Antimicrob Agents Chemother,2015, 60(1): 709-711.
[5]NADASY KA, DOMIATI-SAAD R, TIBBLE MA,et al.Invasive Klebsiella pneumoniae syndrome in North America[J].Clin Infect Dis, 2007, 45(3): e25-e28.
[6]KACZMAREK FM, DIB-HAJJF, SHANG W, et al. Highlevel carbapenem resistance in a Klebsiella pneumoniae clinical isolate is due to the combination of bla(ACT-1) beta-lactamase production, porin OmpK35/36 insertional inactivation, and down-regulation of the phosphate transport porin phoe[J].Antimicrob Agents Chemother, 2006, 50(10): 3396-3406.
[7]MUNOZ-PRICE LS, POIREL L, BONOMO RA, et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases[J]. Lancet Infect Dis, 2013, 13(9):785-796.
[8]SURGERS L, BOYD A, GIRARD PM,et al. ESBL-producing strain of hypervirulent Klebsiella pneumoniae K2, France[J].Emerg Infect Dis, 2016, 22(9):1687-1688.
[9]NORDMANN P, CUZON G, NAAS T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria[J].Lancet Infect Dis,2009, 9(4):228-236.
[10]PAPP-WALLACE KM, BETHEL CR,DISTLER AM, et al.Inhibitor resistance in the KPC-2 beta-lactamase, a preeminent property of this class A beta-lactamase[J]. Antimicrob Agents Chemother, 2010, 54(2):890-897.
[11]KHANAU, MARYAM L, ZARRILLI R. Structure, genetics and worldwide spread of New Delhi metallo-beta-lactamase(NDM): a threat to public health[J]. BMC Microbiol, 2017,17(1):101.
[12]李天骄,王旭明,符生苗,等. 海南发现4株产NDM-1多重耐药的肺炎克雷伯菌[J]. 中国热带医学, 2013,13(12):1468-1471.
[13]QI Y, WEI Z, JI S, et al. ST11, the dominant clone of KPC-producing Klebsiella pneumoniae in China[J]. J Antimicrob Chemother, 2011, 66(2):307-312.
