姜黄素-邻苯二酚共晶的制备与表征
2018-01-27邓彩赟蒋成君
邓彩赟,蒋成君
(浙江科技学院 生物与化学工程学院,杭州 310023)
姜黄素(curcumin)是从姜科植物姜黄(CurcumalongaL.)中提取的一种天然药物,具有降血脂、抗肿瘤、抗炎、利胆和抗氧化等多种药理活性[1],安全性良好。在世界某些国家或地区已被使用了数百年,尤其是在印度和中国。在印度古老的阿育吠陀医学体系中,姜黄被粉碎成糊状物,用于包扎伤口、治疗眼睛感染、烧伤、蚊虫叮咬及各种皮肤病,也以不同的形式治疗牙科疾病,以及消化不良、肠胃气胀、溃疡等消化系统疾病[2]。
姜黄素在酸性或中性环境下,主要是以β-二酮的形式存在;在碱性环境下,主要是以酮-烯醇的形式存在[3]。姜黄素难溶于水,在水中的溶解度仅为8.7 mg/L[4],在碱性环境中的水溶性虽有所提高,但稳定性降低。目前,姜黄素的难溶性是制约姜黄素成药的关键。改善姜黄素的溶解度和生物利用度的方法主要是制备新的药物剂型,如微乳、微球、固体分散体、脂质体、磷脂复合物、胶束纳米粒、环糊精包合物和滴丸[4-6]。然而,微球、固体分散体、脂质体、纳米粒等需要大量的载体辅料;微乳制剂含有大量表面活性剂,具有潜在毒性;制备磷脂复合物时需要在一定温度下药物与磷脂进行复合反应并除去溶剂,这样可能引起姜黄素的降解。药物共晶是指一个共晶形成物作为药物活性成分 (active pharmaceutical ingredient,API)与另一个或多个共晶形成物 (cocrystal coformers,CCF) 在氢键、范德华力或其他非共价键的作用下形成新的结晶[7-8]。药物共晶技术可以通过引入CCF改变API的诸多理化性质,如提高生物利用度、改善稳定性和降低成型熔点等[9-10]。更为重要的是,CCF以氢键等非共价键方式与API形成超分子共晶化合物后,还可提高原有药物活性分子的药理活性,进而为开发更具临床应用价值的新型药物提供一个新的解决途径。
共晶最常见的合成方法为溶液法和研磨法。溶液法包括挥发结晶法、反应结晶法和冷却结晶法。药物共晶若需要满足单晶X射线衍射测试的要求,则只能通过溶液法合成,例如,姜黄素-赖氨酸共晶[11]、姜黄素-间苯三酚共晶[12]等。研磨法借助于机械力的作用来制备共晶,操作简单、绿色环保,可以解决在溶液结晶期间可能形成的溶剂/水夹杂物等问题[13],例如,姜黄素与烟酰胺、阿魏酸、对苯二酚等共晶[14]。研磨时固体与固体的反应能力取决于2种分子的结构互补性和移动性。若加入少量适当的溶剂辅助研磨,则可以加快分子的扩展,提高共晶的生成速率[15],例如,姜黄素与间苯二酚、邻苯三酚共晶[16]。基于上述情况,本研究以邻苯二酚(catechol)为共晶形成物,通过研磨法制备了一个未见报道的新型药物共晶C21H20O6·C6H6O2,并用溶剂法得到规整的晶型,进一步对其进行了结构表征。
1 试 验
1.1 药品与仪器
药品为:姜黄素(质量分数95%,安耐吉化学);邻苯二酚(质量分数98%,安耐吉化学)。
仪器为:STA449F3同步热分析仪(德国耐驰仪器公司);Ultima Ⅳ系列X射线衍射仪(日本Rigaku公司);VERTEX 70红外光谱仪(德国Bruker公司);SU1510扫描电子显微镜(日本日立高新技术公司)。
1.2 试验过程
1.2.1 姜黄素-邻苯二酚共晶制备
姜黄素与邻苯二酚按摩尔比1∶1投料,准确称量姜黄素(1.842 g,5 mmol)和邻苯二酚(0.551 g,5 mmol),依次加入研钵中,室温研磨15~20 min,得到姜黄素-邻苯二酚共晶粉末,烘干。
1.2.2 差示扫描量热法测试
取姜黄素、邻苯二酚和姜黄素-邻苯二酚共晶粉末各10 mg,以空白坩埚为参比,升温速率5 ℃/min,测试温度范围50~300 ℃,在氮气保护条件下测试。
1.2.3 粉末X射线衍射
采用Ultima Ⅳ系列X射线衍射仪,射线源为 Cu/Kα(λ=0.154 nm),扫描范围为5°~60°(2θ,θ为衍射角),扫描步长为0.02°,扫描速度为4°/min,电源设置为40 kV、40 mA。
1.2.4 傅里叶红外光谱测试
分别取姜黄素、邻苯二酚和姜黄素-邻苯二酚共晶粉末微量,与溴化钾混合在玛瑙研钵中碾磨均匀,并压成透明的片状用于测试。样品的扫描范围为 4 000~400 cm-1,分辨率为4 cm-1。
1.2.5 共晶制备溶剂筛选
将姜黄素-邻苯二酚共晶粉末分别溶于以下25种有机溶剂中:乙醇、甲醇、丙酮、乙腈、乙酸乙酯、二氯甲烷、四氢呋喃、乙醇+苯(1∶1;1∶2)、甲醇+苯(1∶1;1∶2)、丙酮+苯(1∶1)、 乙醇+甲苯(1∶1)、甲醇+甲苯(1∶1)、丙酮+甲苯(1∶1)、丙酮+水(1∶1)、丙酮+二氯甲烷(1∶1)、二氯甲烷+石油醚(1∶1)、乙酸乙酯+四氢呋喃(1∶1)、乙酸乙酯+水(1∶1;1∶2)、乙酸乙酯+苯(1∶1;1∶2)、乙腈+二氯甲烷(1∶1;1∶2)。共晶粉末完全溶解后置于室温下,待有机溶剂挥发,观察是否有晶体析出。
1.2.6 电子显微镜扫描
分别取少量姜黄素-邻苯二酚共晶粉末和有机溶剂中析出的共晶,附在导电双面粘合胶带上进行喷金,在5.0 kV电压下获得不同放大倍数的扫描电子显微镜(scanning electron microscope, SEM)照片。
2 结果与讨论
2.1 姜黄素-邻苯二酚共晶制备

图1 固体颜色变化Fig.1 Change of solid color

图2 姜黄素、邻苯二酚及其共晶的DSC图Fig.2 DSC spectra of curcumin,catechol and their cocrystal
在姜黄素与邻苯二酚等摩尔比研磨的过程中,固体外观颜色从原来姜黄素的黄色粉末变成了橘红色粉末,如图1所示。
2.2 差示扫描量热法分析
姜黄素、邻苯二酚及其共晶的差示扫描量热法(differential scanning calorimetry, DSC)分析结果见图2。由图2可知,姜黄素在186.5 ℃处出现一个熔融吸热峰,同其熔点(183 ℃)接近,吸热峰为1.069 mW/mg;邻苯二酚在108.6 ℃ 处出现一个熔融吸热峰,同其熔点(105 ℃)接近,吸热峰为1.787 mW/mg;姜黄素-邻苯二酚共晶在150.3 ℃处出现一个熔融吸热峰,吸热峰为0.351 4 mW/mg,推测为其熔点。共晶熔点的改变是由于API和CCF之间形成氢键后,改变了原材料分子晶体排列,从而形成了新晶相的缘故。通常,共晶的熔点介于API和CCF之间[17]。姜黄素-邻苯二酚共晶符合这一特点,这可以作为判定新物相属于共晶的一个依据。
2.3 X射线粉末衍射分析
姜黄素、邻苯二酚及其共晶的X射线衍射分析(phase analysis of X-ray diffraction, PXRD)结果见图3。由图3可知,姜黄素-邻苯二酚共晶在11.159°、13.559°、20.800°和21.519°出现了新的特征峰,原本归属于姜黄素的15.161°、16.398°和18.180°以及邻苯二酚的16.199°、20.040°、23.059°、38.357°和40.720°的特征峰消失。图谱显示,姜黄素-邻苯二酚共晶的粉末衍射并不是2种组成物姜黄素和邻苯二酚的简单叠加,而是具有明确的特征峰,符合形成共晶的特征。

图3 姜黄素、邻苯二酚及其共晶的PXRD图Fig.3 PXRD pattern of curcumin,catechol and their cocrystal
2.4 傅里叶红外光谱分析
红外光谱采用溴化钾压片法,收集 4 000~400 cm-1数据。图4为姜黄素、邻苯二酚及其共晶的傅里叶红外光谱(Fourier transform infrared,FTIR )图。由图4可知,姜黄素和邻苯二酚的酚羟基—OH伸缩振动分别位于3 508 cm-1和3 449 cm-1,这两个吸收峰在姜黄素-邻苯二酚共晶中明显转移到了3 406 cm-1较低波数,且振动峰变宽。这是因为姜黄素-邻苯二酚共晶之间存在O—H—O氢键,形成氢键之后,化合物本身的特征峰并不会消失,只是由于形成了氢键,各个共价键的键长和键能会有略微改变,在红外图谱上表现为特征峰的位移。形成氢键之后给体上的O—H键受到较大的影响,O—H的键能降低,键的长度会增加,O—H红外振动的特征峰会发生较大的红移,红外光谱上的红移程度与所形成氢键的强度有关,形成氢键的强度越强,发生红移的位移就越大。除了酚羟基之外,还观察到其他官能团的光谱偏移,包括C=O、C—O和C=C[18]。
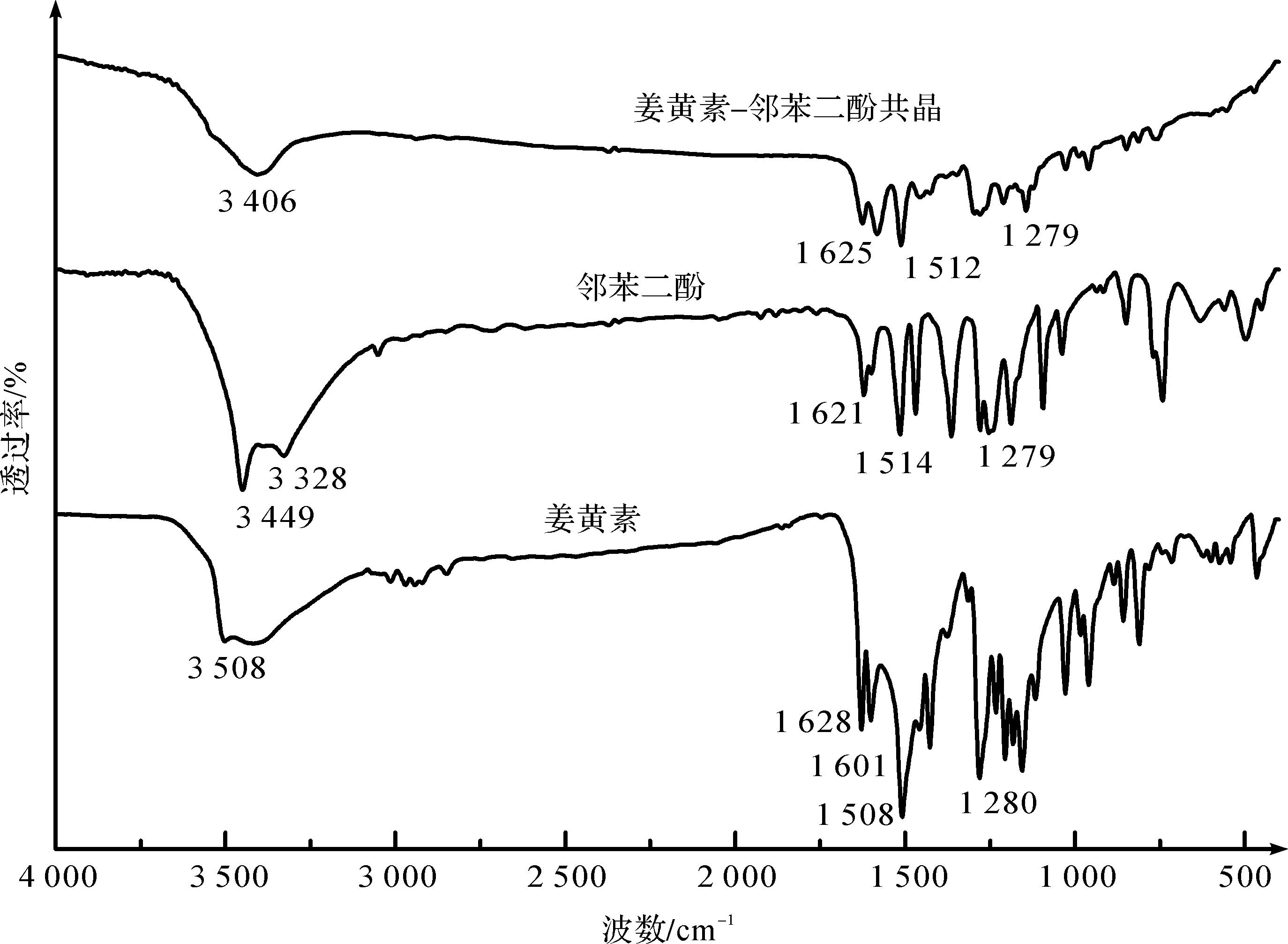
图4 姜黄素、邻苯二酚及其共晶的FTIR图 Fig.4 FTIR spectra of curcumin,catechol and their cocrystal
2.5 共晶制备溶剂筛选
为了得到规整的姜黄素-邻苯二酚共晶,筛选了25种不同的溶剂,溶解结果如表1所示。

表1 共晶溶剂筛选及结果Table 1 Screening results of cocrystal solvent

表1 (续)
在25种有机溶剂中,姜黄素-邻苯二酚共晶除了不溶于二氯甲烷+石油醚(1∶1)外,在其余溶剂中均能溶解:在乙醇溶剂中出现絮状沉淀;在甲醇+苯(1∶1)、甲醇+苯(1∶2)和甲醇+甲苯(1∶1)溶剂中出现了橘红色粉末;在丙酮+苯(1∶1)和丙酮+甲苯(1∶1)溶剂中出现了黄色粉末;在丙酮+水(1∶1)和丙酮+二氯甲烷(1∶1)溶剂中别分析出了黄色片状和橘红色片状物质;在乙腈+二氯甲烷(1∶1)和乙腈+二氯甲烷(1∶2)溶剂中出现了橘红色团聚;其余溶剂中均无固体析出。当以甲醇为溶剂时,可得到柱状规整的共晶。
2.6 扫描电子显微镜分析

图5 共晶扫描电镜图Fig.5 SEM of cocrystal
将姜黄素-邻苯二酚共晶粉末与甲醇溶剂中析出的共晶进行扫描电子显微镜分析,结果如图5所示。从扫描电镜中可以看出两者共晶的形态明显不同。姜黄素-邻苯二酚共晶粉末在5 000倍的放大倍数下,表面形态特性为不规则颗粒的聚集;在甲醇溶剂中重结晶得到的姜黄素-邻苯二酚共晶在65倍的放大倍数下,表面形态为光滑的柱状晶体。
3 结 论
本研究采用姜黄素作为药物活性成分,邻苯二酚作为共晶形成物,通过研磨法得到姜黄素-邻苯二酚新型药物共晶。在制备共晶的过程中没有加入其他溶剂,减少了非共晶组分对结晶过程的影响,减少了溶剂的负效应。DSC测定发现共晶只有1个熔点(150.3 ℃),且介于API和CCF之间;PXRD测定发现共晶并不是2种组合物的简单叠加,在11.159°、13.559°、20.800°和21.519°有新的衍射角出现;对FTIR进一步分析,共晶中的酚羟基由于形成了氢键,红外振动的特征峰发生了较大的红移。采用室温溶剂挥发法,在甲醇溶剂中重结晶得到姜黄素-邻苯二酚橘红色柱状共晶,并在扫描电子显微镜下观察到表面形态与共晶粉末有较大的差别,但姜黄素-邻苯二酚共晶是否能改善姜黄素的水溶性还有待研究。
[1] SALEM M, ROHANI S, GILLIES E R. Curcumin, a promising anti-cancer therapeutic: a review of its chemical properties, bioactivity and approaches to cancer cell delivery[J]. RSC Advances,2014,4:10815.
[2] HATCHER H, PLANALP R, CHO J, et al. Curcumin: from ancient medicine to current clinical trials[J]. Cellular and Molecular Life Sciences,2008,65(11):1631.
[3] SANPHUI P, GOUD N R, KHANDAVILLI U B R, et al. Fast dissolving curcumin cocrystals[J]. Crystal Growth and Design,2011,11(9):4136.
[4] ANAND P, KUNNUMAKKARA A B, NEWMAN R A, et al. Bioavailability of curcumin:problems and promises[J]. Molecular Pharmaceutics,2007,4(6):814.
[5] ANTONY B, MERINA B, IYER V S, et al. A pilot cross-over study to evaluate human oral bioavailability of BCM-95CG (Biocurcumax), a novel bioenhanced preparation of curcumin[J]. Indian Journal of Pharmaceutical Sciences,2008,70(4):445.
[6] 王彪, 殷志杨. 姜黄素剂型研究进展[J]. 首都医药,2012(6):55.
[7] LARAOCHOA F, ESPINOSAPEREZ G. Cocrystals definitions[J]. Supramolecular Chemistry,2007,19(8):553.
[8] GADADE D D, PEKAMWAR S S. Pharmaceutical cocrystals: regulatory and strategic aspects, design and development[J]. Advanced Pharmaceutical Bulletin,2016,6(4):479.
[9] KUMINEK G, CAO F, ROCHA A, et al. Cocrystals to facilitate delivery of poorly soluble compounds beyond-rule-of-5[J]. Advanced Drug Delivery Reviews,2016,101:143.
[10] ZHOU Z, LI W, SUN W J, et al. Resveratrol cocrystals with enhanced solubility and tabletability[J]. International Journal of Pharmaceutics,2016,509(1/2):394.
[11] 徐辉, 张方坤, 迟宗良,等. 姜黄素赖氨酸共晶的制备及不同晶型溶解性对比[J]. 中国药师,2017,20(2):209.
[12] CHOW S F, SHI L, NG W W, et al. Kinetic entrapment of a hidden curcumin cocrystal with phloroglucinol[J]. Crystal Growth and Design,2014,14(10):5080.
[13] TRASK A V, MOTHERWELL W D S, JONES W. Solvent-drop grinding: green polymorph control of cocrystallisation[J]. Chemical Communications,2004,10(7):890.
[14] GOUD N R, SURESH K, SANPHUI P, et al. Fast dissolving eutectic compositions of curcumin[J]. International Journal of Pharmaceutics,2012,439(1/2):63.
[15] KARKI S, FRISCIC T, JONES W, et al. Screening for pharmaceutical cocrystal hydrates via neat and liquid-assisted grinding[J]. Molecular Pharmaceutics,2007,4(3):347.
[16] SANPHUI P, GOUD N R, KHANDAVILLI U B R, et al. Fast dissolving curcumin cocrystals[J]. Crystal Growth and Design,2011,11(9):4135.
[17] 王义成,冯成亮,杨素勤,等. 药物共晶的最新研究进展[J]. 药学进展,2013,37(3):120.
[18] 策登道日吉,洪海龙,尤丽娟,等. 姜黄素的分离纯化及其形貌可控超细微粒的制备[J]. 中国食品添加剂,2014(3):149.
