ERK途径参与未受精蚕卵的孤雌激活
2018-01-26翁宏飚牛宝龙
翁宏飚,牛宝龙
(浙江省农业科学研究院 蚕桑所,浙江 杭州 310021)
自从上世纪三十年代发现蚕卵在一定条件下,可少量发生孤雌发育的现象以来,人们开展了大量的家蚕未受精卵的孤雌诱导实验,通过优化诱导条件,筛选易发品系,建立起高效的家蚕孤雌生殖体系[1~3]。在国内,对家蚕种质库中的保存品种进行筛选,并通过连续多代的选择,建立起全球最大的家蚕孤雌生殖种质资源库,培育的孤雌生殖家蚕品种进入生产实用[4]。在开展家蚕孤雌生殖应用研究的同时,家蚕孤雌生殖机理的研究也在不断探索中。通过家蚕孤雌生殖发育蚕卵的细胞学研究,发现46℃、18 min的热激处理,可以使阻滞于第一次减数分裂的染色体结构解体,同源染色体不再分离,直接进入第二次减数分裂模式,染色单体相互分离,从而使得子代染色体组保持与亲代相同的2 n[2]。日本学者研究发现,在家蚕嵌合体突变品系的孤雌生殖中,同时存在极体自受精和不完全减数分裂两种机制,而在可自发发生孤雌生殖的品系M90中,其孤雌生殖发育则主要为不完全减数分裂机制[5]。孤雌生殖品系的转录组学研究结果显示,许多调控途径参与了家蚕热激诱导的孤雌生殖发育[6]。
卵母细胞成熟调控是一个复杂的多因子调节过程。在脊椎动物中,卵细胞分裂阻滞于第2次成熟分裂中期,等待受精活化[7]。而在无脊椎动物中,卵母细胞发育过程中的第2次分裂阻滞发生在第1次成熟分裂中期[8]。丝裂原活化蛋白激酶(mitogen-activat⁃ed protein kinase cascade,MAPK)信号通路是细胞间信号传递的重要通路,参与细胞形态、细胞分化及细胞周期的各个环节[9]。MAPK在卵细胞减数分裂的MⅠ期/MⅡ期转变过程中保持活性,是调节卵母细胞减数分裂的中枢[10]。已有大量研究发现,MAPK信号途径参与脊椎动物卵细胞的人工活化过程[11~12],在卵受精或孤雌活化后,MAPK发生去磷酸化而失活,分裂阻滞解除,细胞恢复分裂。在对无脊椎动物叶蜂的研究中发现,MAPK信号途径参与叶蜂的孤雌生殖发育,蜂卵经人工孤雌激活,分裂阻滞解除后,随着发育时间的延长,磷酸化修饰的MAPK和MEK含量逐渐下降,激活后50 min,已检测不到磷酸化修饰的激酶[13]。定量比较MAPK信号通路基因在有性生殖品系与孤雌生殖品系间的表达差异,结果显示信号通路基因的表达,在两个品系间存在显著性差异,暗示MAPK信号通路可能参与了家蚕孤雌生殖发育[14]。
MAPK信号通路的核心是几种蛋白激酶的顺序磷酸化激活,MEK是催化MAPK磷酸化修饰的直接分子[15]。U0126是MEK1/2的高效特异性抑制剂。对叶蜂卵的研究中发现,以抑制剂U0126处理蜂卵,可以降低卵内MAPK的磷酸化水平,解除卵细胞分裂阻滞,诱导恢复分裂,达到孤雌诱导的效果[13]。家蚕孤雌生殖首先需要通过热激处理,解除细胞分裂阻滞,恢复细胞分裂过程,而后在各种机制的维护下完成胚胎发育。本研究以不同浓度的U0126注射羽化前不同时期的雌蛹,羽化后收集未受精卵,46℃、18 min热激诱导孤雌生殖,调查未受精卵的转色率、孵化率指标,结果显示U0126可以促进未受精卵孤雌生殖激活后早期胚胎的发育,提高蚕卵的转色率。
1 材料与方法
1.1 材料和主要试剂
家蚕孤雌生殖品系无14是原种54A,经连续多代热激(46℃,18 min)诱导筛选出的PL品系;多化性品系Nastari为浙江省农科院蚕桑所保存蚕品种。
抑制剂U0126购自Selleck公司(美国),溶剂DMSO购自上海生工,未受精卵热激用水浴、恒温恒湿箱购自上海博讯公司;protoCOL自动菌落计数仪(synbiosis,Cambridge,UK)为农科院质量标准研究所仪器。
1.2 方法
将U0126粉剂溶于DMSO,配制成10 mmol母液,于-20℃分管保存。使用时用PBS缓冲液稀释成工作液备用。
熟蚕上蔟结茧后,削茧鉴蛹,雌蛹常规保护至复眼着色。取10 g消特灵粉剂溶于2 L蒸馏水中,配制成蛹体消毒液。将复眼着色雌蛹浸入消毒液中1 min,捞出后放在干净的吸水纸上晾干保护。在羽化前2 d,按每蛹20 μL的注射量,给雌蛹注射U0126工作液并常规保护至羽化,每个浓度注射10颗雌蛹。蚕卵孤雌生殖诱导及蚕卵保护参照[4]方法进行。由于无14品系孤雌生殖发育良好,蚕卵发育调查时,随机称取0.1克蚕卵,统计良卵率和孵化率;多化性品系Nastari蚕卵发育初期不着色,在孵化前2~3 d开始转色。考虑到Nastari孤雌生殖蚕卵的发育较有性生殖蚕卵慢,因此在有性生殖蚕卵孵化后一周,随机称取0.15 g蚕卵,均匀摊于8 mm平皿中,用菌落计数仪统计转色蚕卵数,并计算单位重量的转色蚕卵数量,用于统计分析。仪器的设置为:曝光时间:40 ms;排除小颗粒:小于0.1 mm。每个实验均设3个重复。采用SPSS软件进行差异显著性分析。
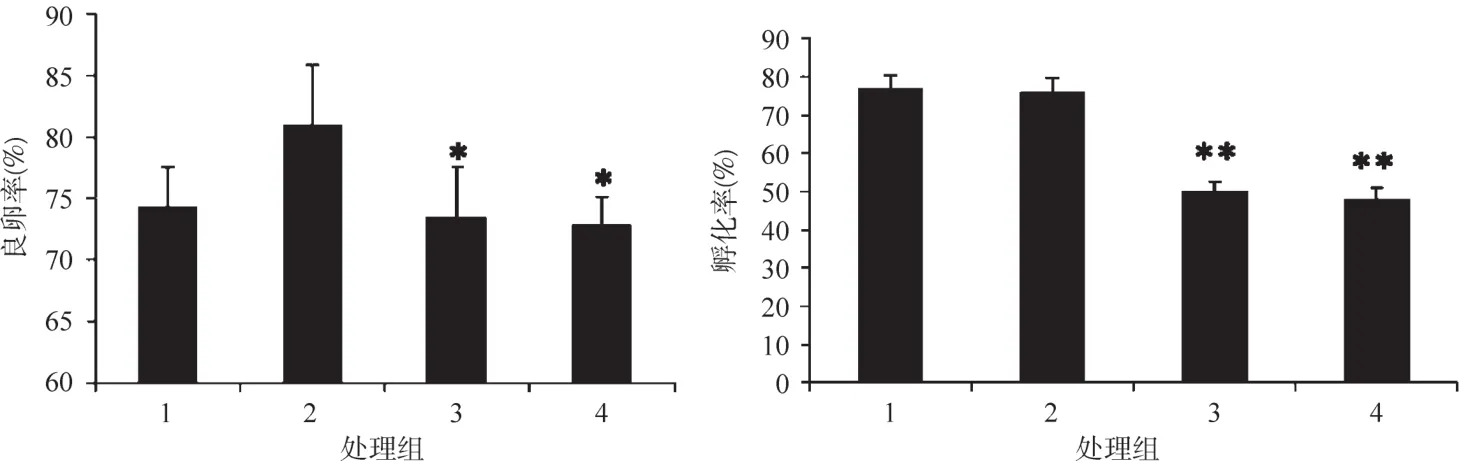
图1 U0126处理后孤雌生殖品系无14良卵率和孵化率Figure 1 Good egg rate and hatching rateof Wu14with U0126treating
2 结果与分析
2.1 品系无14的孤雌生殖激活
2017年春蚕期,无14上蔟结茧后,于6月3日注射雌蛹,6月5日羽化,常规取卵,孤雌生殖诱导,蚕卵保护及入库冷藏,8月15出库调查并开始催青。蚕卵调查结果如图1。
抑制剂U0126处理孤雌生殖品系无14后,高浓度组的良卵率指标与对照组的相仿,但低浓度组及有机溶剂DMSO组的良卵率显著下降。蚕卵孵化率指标,对照组与高浓度组无统计差别,而低浓度组及溶剂组则极显著降低。
2.2 品系Nistari的孤雌生殖激活
2017年秋蚕期,于9月13日注射处理Nistari雌蛹,9月15日羽化,收集未受精卵并进行孤雌生殖热激诱导,因Nastari品系孤雌生殖孵化率极低,而且蚕卵早期不着色,为判断发育进度,设置有性生殖蚕卵对照,同步蚕卵保护及催青,有性生殖蚕卵孵化后一周,用自动菌落计数仪调查孤雌生殖的发生情况。结果如图2。
虽然Nistari经U0126处理后,各处理组均无孵化,但各组的蚕卵转色情况并不相同。20 μmol/L处理组蚕卵转色极显著优于其他处理组;10 μmol/L处理组极显著好于5 μmol/L组和对照组;5 μmol/L组和对照组的单位卵重转色卵数则极显著高于溶剂对照组和1 μmol/L处理组。
3 讨论
目前家蚕孤雌生殖发育的调查指标主要有蚕卵着色率(孤雌生殖发生率)及催青后孵化率。普通蚕品种在受精或孤雌生殖激活后,细胞恢复分裂并开始胚胎发育约24 h~28 h,卵内浆膜形成后转为固有色,再经10 d左右催青而后孵化。现有蚕品种经热激诱导后,有较高的未受精卵着色率,平均蚕卵着色率为50%左右[4,16-17],部分蚕卵能发育到转青期和点青期,但极少孵化。本实验所用的Nistari是多化性热带白卵蚕品种,蚕卵激活开始发育后,早期蚕卵不转色,催青第7 d-8 d左右,蚕卵出现少量着色,在有性生殖蚕卵孵化后5 d内,孤雌生殖蚕卵颜色仍在变化,7 d后蚕卵颜色变化不大。因此,实验中在有性生殖蚕卵孵化后第7 d,调查孤雌生殖蚕卵的转色情况,作为Nistari孤雌生殖发育的指标。
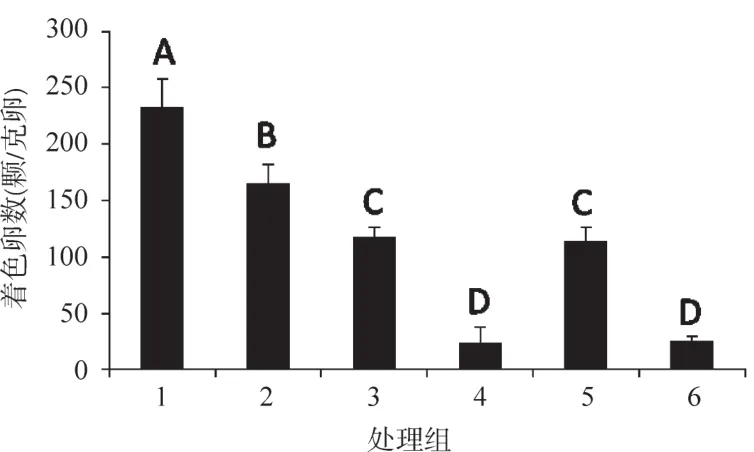
图2 U0126处理后,每克孤雌生殖蚕卵中的着色卵数Figure 2 Amount of coloring eggs in each gram of parthenogenesis eggs with U0126 treating
本实验中,经高、中浓度抑制剂处理后,Nistari品系的转色卵比例极显著高于对照。已有的研究显示,家蚕的遗腹卵率大约在10%~15%左右[18],虽然遗腹卵不等同于未成熟卵,但不能排除大部分遗腹卵属于未成熟卵,孤雌生殖诱导后不能着色而成为不良卵。考虑到用于孤雌生殖诱导的未受精卵为解剖卵,包含了全部未成熟卵,因此抑制剂处理后无14良卵率的提高虽未达显著水平,但可以确定U0126处理可以使得更多蚕卵被激活而进入胚胎发育,或有利于孤雌生殖蚕卵的发育。Nistari低浓度组和溶剂组的转色卵指标极显著低于对照组,以及无14低浓度组和溶剂组的良卵率显著低于对照组,可能是由于DMSO的细胞毒性,抑制了胚胎发育造成的。而且DMSO的细胞毒性在无14孵化率上也有体现:在低浓度组和溶剂组中,无14的孵化率极显著地低于对照组。另外,Nistari品系的不滞育和卵发育后期转色的特点,是合适的家蚕孤雌生殖研究材料。
显微观察孤雌生殖转色卵,可见蚕卵呈现块状或带状着色斑,而不是有性生殖蚕卵的完全着色形式,因此在统计着色卵指标时,可能因统计人员的不同,而出现不同的统计结果,影响结果分析。本研究中,利用自动菌落计数仪,通过设置合适的参数,可以客观、高效地统计着色卵数,因而该系统可以在家蚕孤雌生殖研究中应用。
[1] ASTAUROV B L.Artificial parthenogenesis and experi⁃mental polyploidy in silkworm[J].The Journal of Sericul⁃tural Science of Japan,1967,36:277-285.
[2] STRUNNIKOV V A.Control over Reproduction,Sex,and Heterosis of the silkworm[M].London:Harwood Academ⁃ic Publishers,1995.
[3] KLYMENKO V V.Parhenogenesis and cloning in the silkwormBombyx mori L:Problem and prospects[J].J.In⁃sectBiotech.Sericol,2001,70:155-165.
[4] 王永强,徐孟奎,何秀玲,等.家蚕现行品种孤雌生殖的研究[J].蚕业科学,2001,27(1):20-23.
[5] KUSAKABE T,KIDO K,KITA K,et al.Analysis of artifi⁃cial andspontaneousparthenogenetic development in mosa⁃ic mutationsand the parthenogenetic strain of Bombyx mo⁃ri[J].Invertebrate Reproduction&Development,2004,45(2):101-108.
[6] LIU P,WANG Y,DU X,et al.Transcriptome Analysis of Thermal Parthenogenesis of the Domesticated Silkworm[J].2015,PLOS ONE DOI:10.1371/journal.pone.0135215.
[7] MCCARTER J,BARTLETT B,DANG T,et al.On the control of oocyte meiotic maturation and ovulation in Cae⁃norhabditis elegans[J].Developmental Biology,1999,205(1):111-128.
[8] MASUI Y.Meiotic arrest in animal oocytes[M].San Di⁃ego:Academic Press,1985.
[9] SUN Q Y,BREITBRTH,SCHATTEN H.Role of the MAPK cascade in mammalian germ cells[J].Reproduc⁃tion,Fertility,and Development,1999,11(8):443-450.
[10]DUPRÉ A,HACCARD O,JESSUS C.Mos in the Oocyte:How to Use MAPK Independently of Growth Factors and Transcription to Control Meiotic Divisions[J].Journal of Signal Transduction,2011,2011(2090-1739):350412.
[11]FAN H Y,SUN Q Y.Involvement of mitogen-activated protein kinase cascade during oocyte maturation and fer⁃tilization in mammals[J].Biology of Reproduction,2004,70(3):535-547.
[12]吴晓慧,李卫平,狄文.卵母细胞减数分裂转变过程的调控机制[J].生殖与避孕,2009,29(11):741-745.
[13]DAISUKE S Y,KAZUNORI T,MEGUMI S,et al.Involve⁃ment of Mos–MEK–MAPK pathway in cytostatic factor(CSF) arrest in eggs of the parthenogenetic insect,Athalia rosae[J].Mechanisms of development,2008,125:996-1008.
[14]翁宏飚,刘培刚,牛宝龙,等.MAPK信号通路参与热激诱导家蚕未受精卵发生孤雌生殖发育的研究[J].蚕业科学,2016,42(4):0598-0605.
[15]范衡宇,佟超,陈大元,等.MAPK信号通路在卵母细胞减数分裂中的作用[J].科学通报,2002,47(9):650-656.
[16]潘少茜,李宝瑜,廖琼香,等.家蚕资源品种孤雌生殖力的研究[J].广东农业科学,1996,1996(3):40-42.
[17]白兴荣,廖鹏飞,邵榆岚,等.云南省部分家蚕品种资源的孤雌生殖发生率调查[J].蚕业科学,2012,38(5):0938-0941.
[18]严会超,林健荣,钟生泉,等.家蚕遗腹卵的研究-Ⅰ.环境条件与家蚕遗腹卵发生的关系[J].广东蚕业,1997,31(2):22-26.
