大鼠断肢不同保存方法与肌肉生物学特性的实验研究
2018-01-26阎晓丽张巍刘琳琳张树明
阎晓丽,张巍,刘琳琳,张树明
(中国人民解放军火箭军总医院骨科,北京 100088)
肌肉组织局部缺血6~8 h内退化到不可逆转的程度[1],因此缺血时间在断肢移植治疗中是很重要的影响因素。长时间的局部缺血会导致不可逆的坏死从而引发更加复杂的状况,比如肌肉萎缩和功能缺失。在断肢局部缺血超过6 h后肢体损伤严重程度评分会增加一倍[2],局部缺血超过8 h后会导致移植失败。如何最大程度地维持离断肢体功能以及尽可能延长离断肢体保存时间是当前该领域的研究热点[3]。尽管保存液对于肾、肝、心脏等器官保存和移植应用广泛,但它们很少被用于保存断肢。一些研究显示用于活体器官保存的溶液在用于保存骨骼肌时也具有良好的效果[4-5]。这些研究通过观察移植状况、三磷酸腺苷水平、病理性退化率、被电流刺激的骨骼肌的收缩力量等来评估这些被保存的骨骼肌的活力[6]。我们评估了从大鼠上分离的股四头肌在不同保存液中保存不同时间后的肌肉形态学改变。
选取6 h和24 h两个保存时间,ETK、UW和LR保存液保存肌肉用于断肢后原位移植,手术后8周分别检测肌肉再生状况(形态与功能),包括生化指标、肌肉电生理以及HE染色和马氏三色染色病理学变化,对其进行比较,以选择更适合断肢保存的溶液。
1 资料与方法
1.1 实验动物与分组 选用成年标准Wistar大鼠,雌雄不限,体重(250±50)g。断肢后再植实验中,大鼠随机分为6组,每组4~8只:ETK液保存6 h组(ETK-6 h),UW液保存6 h组(UW-6 h),LR液保存6 h组(LR-6 h);ETK液保存24 h组(ETK-24 h),UW液保存24 h组(UW-24 h),LR液保存24 h组(LR-24 h)。
1.2 保存液配置 三组不同保存液配方见表1。
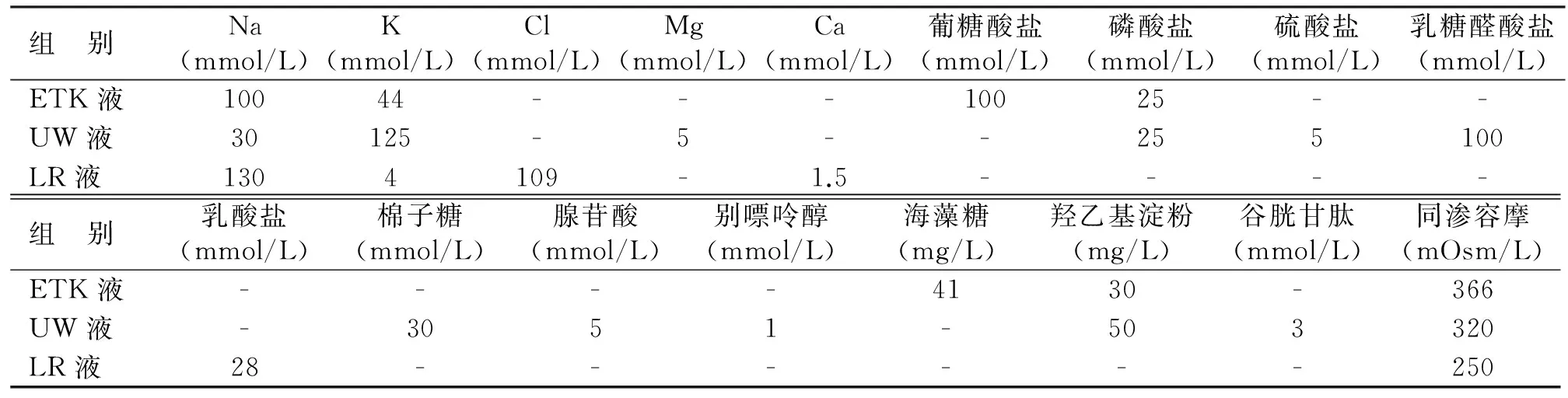
表1 不同保存液配方比较
1.3 股四头肌分离后保存 从Wistar大鼠中分离的股四头肌被切割成直径8 mm、高3 mm、重0.5 g的圆柱状。为了研究保存液对肌肉形态的影响,来自Wistar大鼠的股四头肌分别用ETK,UW溶液保存在 4℃各3 h、6 h、9 h、12 h或24 h,LR溶液用作对照组。
之后将其用10%福尔马林溶液固定,石蜡包埋。用苏木精和伊红染色然后观察切片(3 μm)。随机选取股四头肌中央部分的横切面观察高度压缩化的肌纤维和半球形肌纤维的数量,以及出现间质水肿的部分占全部面积的比例(Leica CTR 6000),并用图像分析系统Image J进行处理,分析损坏的肌纤维百分比及间质水肿的出现情况。
1.4 保存液保存移植断肢 用10%水合氯醛按4 mL/kg体质量进行腹腔注射,麻醉后的大鼠仰卧位,固定头和四肢。打开股内侧皮肤,切口3 cm左右,逐层分离肌肉至股骨裸露。切断股骨并立即浸入装有ETK液、UW液或者LR液的无菌塑料培养箱。为了评估保存液对断肢是否有长期维持功能的作用,供体断肢被保存在4℃中持续6 h或24 h,我们进行了原位移植[7]。
1.5 手术步骤 切断股骨处,用18号针作为髓内棒固定移植物。在显微镜下操作,股骨动脉和血管用10-0尼龙线捆合,坐骨神经用10-0尼龙线缝合;肌肉和皮肤用4-0尼龙线缝合。操作结束后,不使用全身性抗凝血剂或抗生素,平均手术时间为60 min[8]。
1.6 生化指标检测 断肢在4℃保存液保存6 h或24 h后进行原位移植手术,术后60 min颈静脉取血,用于检测血清内肌酸磷酸激酶(creatine phosphokinase,CPK),天冬氨酸转氨酶(aspartate aminotransferase,AST),丙氨酸转氨酶(alanine aminotransferase,ALT),肌酸酐(creatinine,Cr)(试剂盒均购自Sigma,St.Louis,MO USA);乳酸脱氢酶(lactate dehydrogenase,LDH),尿素氮(bloodurea nitrogen,BUN)及钾(potassium,K)(试剂盒均购自南京建成)的含量水平。
1.7 电生理学分析 手术8周后使用丹麦美敦力公司Keypoint系统进行复合肌肉动作电位(compound muscle action potential,compound motor action potential,CMAP)记录。麻醉状态下,暴露移植侧的坐骨神经,安放刺激电极置于坐骨神经缝合处10 mm处刺激坐骨神经(0.2 mA单向脉冲,1 Hz,脉冲持续时间1 ms)。将记录电极贴近胫骨前肌记录,记录电极和刺激电极的距离标准为30 mm。记录胫骨前肌的运动潜伏期和振幅[9]。
1.8 再植肢体肌肉的组织学分析 在电生理学分析结束后,取下胫骨前肌,称量胫骨前肌。用10%福尔马林固定肌肉,石蜡包埋。在苏木精-伊红染色及马氏三色染色(用于鉴别纤维组织)之后检查组织样本。我们观察了肌肉纤维的直径和纤维化区域(马氏三色染色后的蓝色长胶状区域)所占的百分比。视野内随机选取横切面内的一百个肌肉细胞进行测量。
2 结 果
2.1 组织学分析分离的肌肉 在LR组中的3 h后检测到高水平的肌肉纤维损伤及间质水肿。在所有时间段内,ETK组中损伤的肌纤维百分比都低于LR组(P<0.05,见图1)。更进一步,在3 h、6 h、12 h和24 h时,ETK和UW组中的间质水肿现象都明显低于LR组(P<0.05,见图2)。
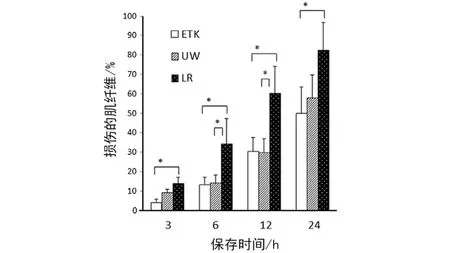
图1 保存在ETK液、UW液和LR液中3、6、12和24 h后损伤的肌纤维所占百分比比较
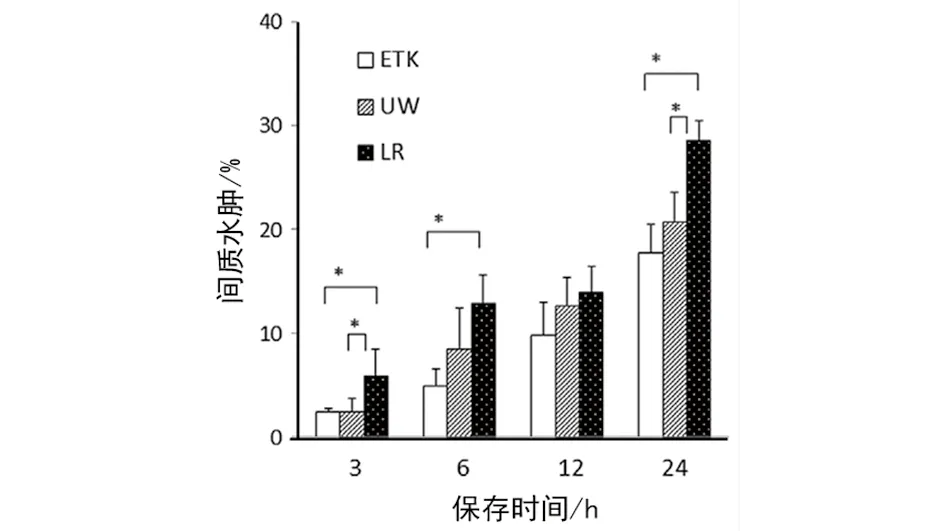
图2 保存在ETK液、UW液和LR液中3、6、12和24 h后损伤的水肿区域比较
2.2 保存液保存6 h后的断肢再植 在三组ETK、UW和LR保存液6 h保存后移植的模型中,移植8周后的断肢存活率为100%。血样本在手术后60 min取得。第8周时,全部的鼠用于电生理学和组织学检测。三组血清中CPK及钾的含量见表2。在血清中各组的AST,ALT,LDH,Cr和BUN没有明显区别。

表2 保存液中浸泡6 h后移植模型中移植60min后受体血浆CPK及钾的含量
我们检查了三组的肌肉潜伏期和振幅[5](见图3a)。三组没有明显的运动延迟区别(见图3b),相反,LR组的振幅相比于ETK和UW组显著降低(P<0.05,见图3c)。保存在ETK-6 h,UW-6 h或者LR-6 h组中胫骨前肌横切面见图4。马氏三色染色显示出纤维化区域在三组中没有明显区别,而LR组肌肉细胞直径明显小于ETK组和UW组(P<0.05);ETK和LR组的一个明显区别就是胫骨前肌湿重也有差异(P<0.05,见表3)。
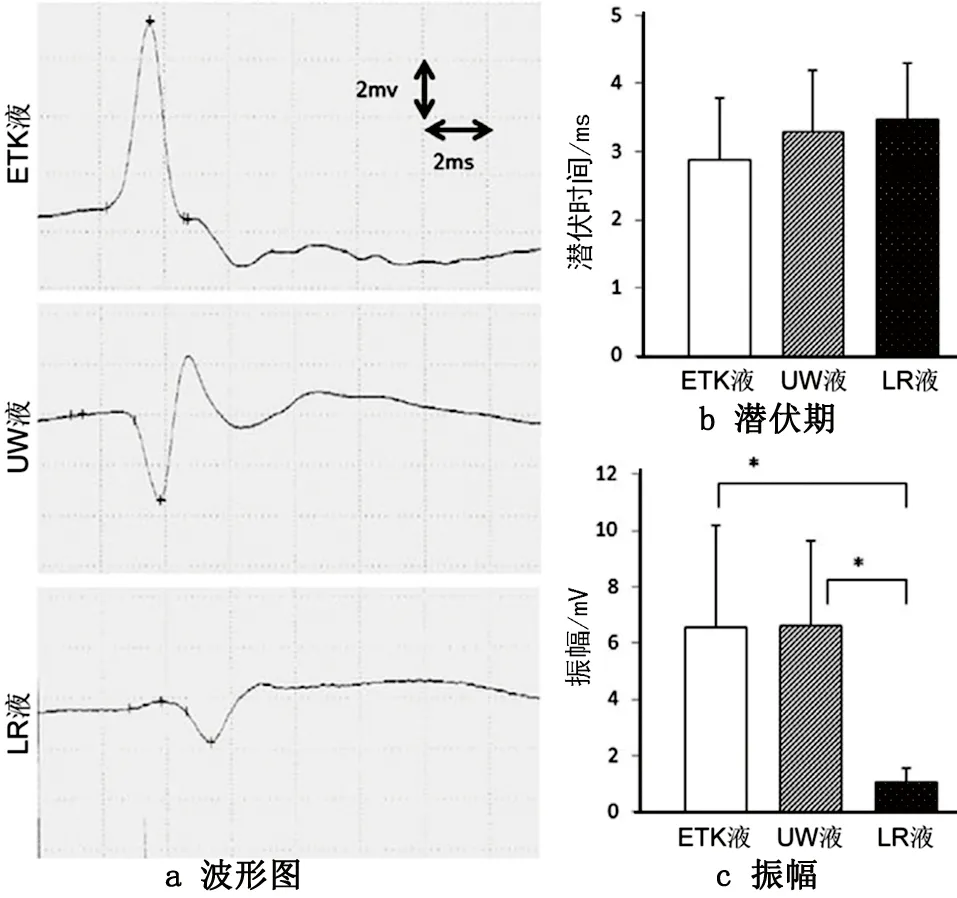
图3 保存液中浸泡6 h后移植模型中的电生理水平
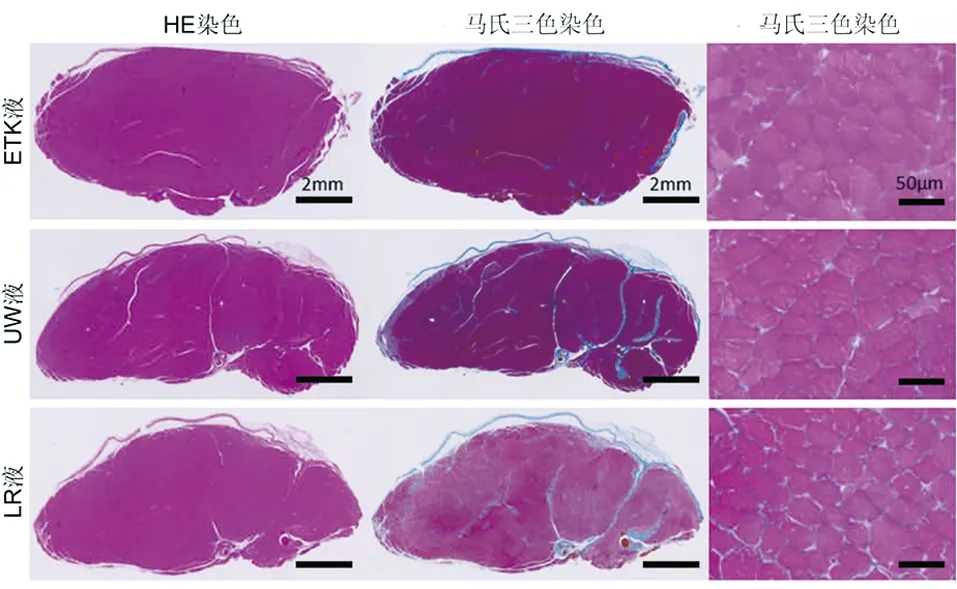
图4 保存液中浸泡6 h后移植模型手术后8周时对胫骨前肌横切面用苏木精-伊红及马氏三色法染色
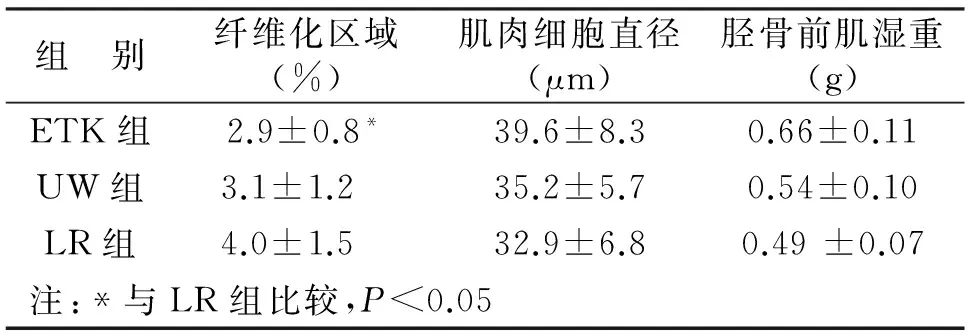
组 别纤维化区域(%)肌肉细胞直径(μm)胫骨前肌湿重(g)ETK组2.9±0.8*39.6±8.30.66±0.11UW组3.1±1.2 35.2±5.70.54±0.10LR组4.0±1.5 32.9±6.80.49±0.07注:*与LR组比较,P<0.05
2.3 保存液保存24 h后的断肢再植 对照组(立刻移植),ETK组,UW组和LR组移植8周后的断肢成活率分别为100%,80%,80%,37.5%。我们术后60 min取血样,检测CPK和血钾水平,发现LR组血清中CPK比其他组高出许多(P<0.05,见表4),8只大鼠中5只在移植60 min后血清CPK水平大于13 000 IU/L并且在前4天死亡。LR组中钾的含量高于没有进行保存处理的对照组和ETK组(P<0.05)。四组中血清的AST、ALT、LDH、Cr和BUN没有明显差异。

表4 保存液中浸泡24 h后移植模型中移植8周后受体血浆CPK及钾的含量
我们统计了四组中的电生理波形图(见图5a)。LR组内存活的5只鼠中均无电信号。对照组的末端潜伏期相对于其他两组短,并且UW的末端潜伏期明显长于ETK组。对照组的振幅高于UW组和ETK组(P<0.05,见图5b~5c)。在ETK和UW组中,24 h保存后移植的肌肉末端潜伏期和振幅与6 h保存后移植的几乎相同。
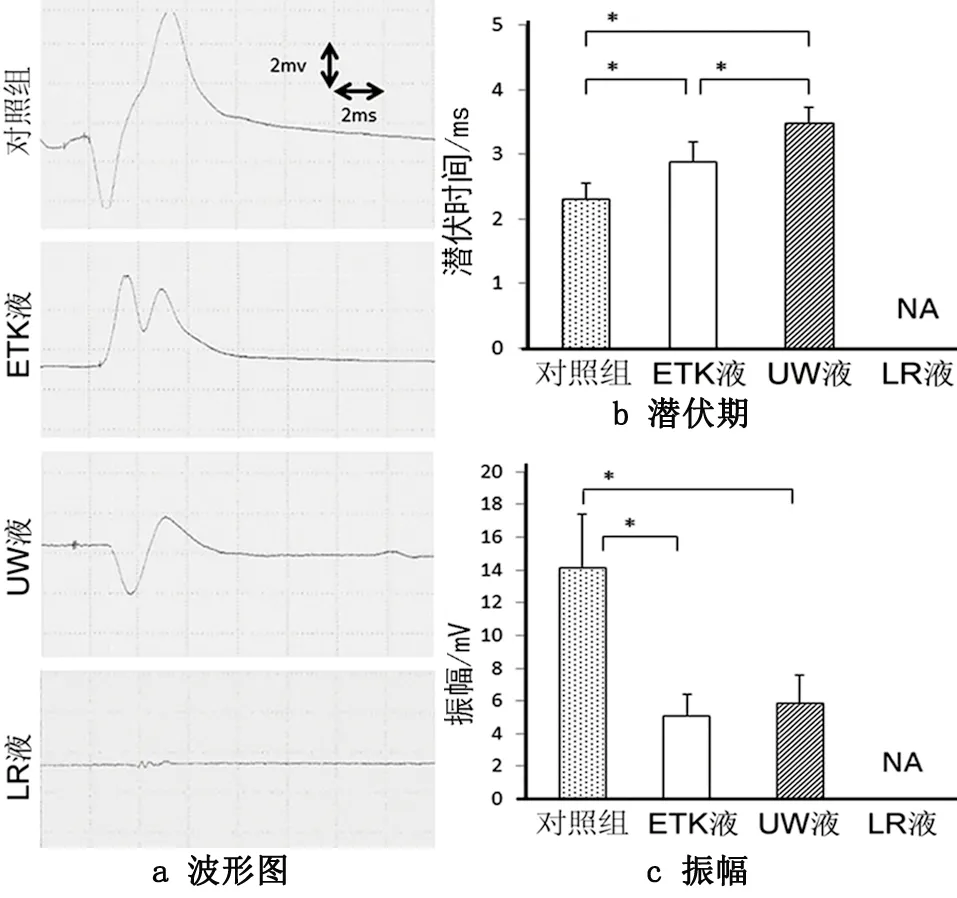
图5 保存液中浸泡24 h后移植模型中的电生理水平
LR组的纤维化区域(马氏染色呈蓝色)比其他组大(见图6)。LR组的纤维化区域百分比明显高于ETK、UW及对照组(P<0.05),这个结果与6 h组结果相反。LR组肌细胞直径明显小于其它三组(P<0.05)。对照组(立刻移植)、ETK组、UW组的胫骨前肌湿重没有明显差异(见表5)。
3 讨 论
当前用于保存截肢的方法包括将断肢用含生理盐水的纱布将其包裹并迅速低温保存[10]。这个方法本质上与70年前报道的Allen的方法很类似。而新的保存方法在很长时间内都没有得到发展。已经报道了动物实验研究肌肉保存及复合材料的组织移植,包括用器官保存液、选择最佳温度、移植前对组织进行灌注[11]。这些实验研究展示了多种有用的保存溶液,但迄今为止仍没有被广泛用于保存截肢的保存液。
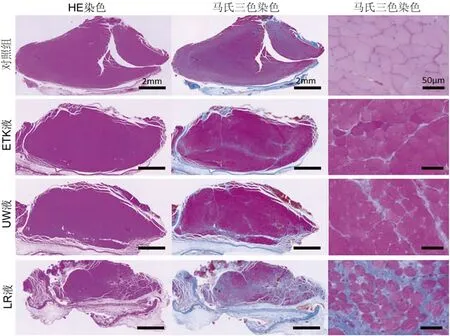
图6 保存液中浸泡24 h后移植模型手术后8周时对胫骨前肌横切面用苏木精-伊红及马氏三色法染色
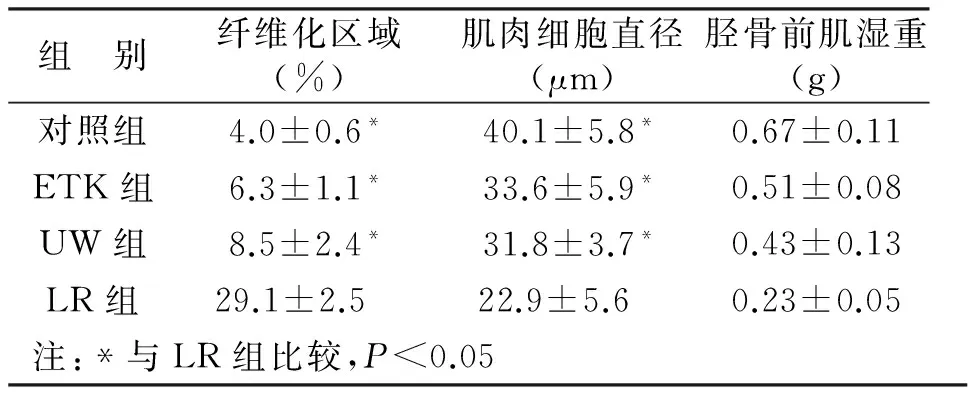
组 别纤维化区域(%)肌肉细胞直径(μm)胫骨前肌湿重(g)对照组4.0±0.6*40.1±5.8*0.67±0.11ETK组6.3±1.1*33.6±5.9*0.51±0.08UW组8.5±2.4*31.8±3.7*0.43±0.13LR组29.1±2.5 22.9±5.6 0.23±0.05注:*与LR组比较,P<0.05
保存溶液灌注组织是常用的实体器官保存方式。然而,将灌注法应用于骨骼肌目前仍有争议[12]。同时,外伤性截断肢体和手指经常发生在工厂、农场等地方而非医院。在这些地方,如果没有合适的器材,将受伤组织浸入保存液是最好的选择。因此,我们在实验中选择了简单地组织浸泡模型。
这里我们应用了ETK液和UW液来保存肌肉。ETK是一种仿胞外溶液,而UW是仿胞内溶液。我们的数据显示UW组移植后血清钾的含量高于ETK组。尽管ETK组和UW组的肢体没有显示出明显的存活率差异,但血钾过高将可能导致毒血性休克[3,13-14]。因此,仿胞外型溶液由于其低钾的特点,可能会是保存肌肉组织更好的选择。ETK溶液也有另外一项优势:在室温下其组成成分在三年内十分稳定[15]。而UW液由于会发生谷胱甘肽氧化作用,溶液需要被冷藏并在短时间内使用[16]。所以ETK液用于预防意外的截肢性损伤更有优势,它可以在救护车及初级诊所长期保存。
当下,成功的断肢移植不止被定义为断肢处出现血管循环,同时要求肢体功能也被保留下来。一些动物实验评估了局部缺血-再灌注肢体功能的恢复状况。Song等报道了状态良好的大鼠同种异体肢体移植,并采用皮肤反应测试,步态分析和电生理学进行评估[17]。Tsuji等[6]在大鼠肢体移植后进行了电生理学实验,并发现坐骨神经的远端运动潜伏期在3周时会伴随着肢体局部缺血时间延长而上升。这里我们使用电生理学研究保存溶液的效用,结果表明这种方法可能有助于肌肉功能恢复及坐骨神经再生。但是我们的电生理学结果看起来与肌肉萎缩和纤维性变化很类似。
LR组中血清CPK水平明显高于其他组(P<0.05),同时,LR组中钾的含量明显高于对照组和ETK组(P<0.05)。基于我们的数据,我们提出假设:持续的局部缺血导致了再移植毒血症,导致肾功能紊乱和心机能不全。相反,ETK和UW溶液会保护肌肉,增强大鼠断肢肌肉接受再植的能力。综上所述,我们证明了ETK和UW器官保存溶液可以在断肢移植时保护肌肉功能和形态,并提高在长时间范围内受体的存活率,且ETK液更优于UW液。
[1]Prucz RB,Friedrich JB.Upper extremity replantation:current concepts[J].Plast Reconstr Surg Glob,2014,133(2):333-342.
[2]Guerrero A,Gibson K,Kralovich K A,et al.Limb loss following lower extremity arterial trauma:what can be done proactively?[J].Injury,2002,33(9):765-769.
[3]McCutcheon C,Hennessy B.Systemic reperfusion injury during arm replantation requiring intraoperative amputation[J].Anaesth Crit Care,2002,30(1):71-73.
[4]van der Heijden EPAB,Kroese ABA,Werker PMN,et al.Improving the preservation of isolated rat skeletal muscles stored for 16 hours at 4 degrees C[J].Transplant,2000,69(7):1310-1322.
[5]Tsuchida T,Kato T,Yamaga M,et al.The effect of perfusion with UW solution on the skeletal muscle and vascular endothelial exocrine function in rat hindlimbs[J].J Surg Res,2003,110(1):266-271.
[6]Tsuji N,Yamashita S,Sugawara Y,et al.Effect of prolonged ischaemic time on muscular atrophy and regenerating nerve fibres in transplantation of the rat hind limb[J].J Plast Surg Hand Surg,2012,46(3-4):217-221.
[7]吕青,周明武,郑喜灿,等.大鼠断肢保存方法与血管组织病理变化的实验研究[J].解放军护理杂志,2003,20(9):9-10.
[8]芦笛,刘虎仙,韩岩.威斯康星大学保存液用于大鼠离断肢体低温灌注保存实验[J].解放军医学院学报,2016 (7):792-797.
[9]佟晓杰,张彩顺,曹德寿,等.脱细胞异体神经移植物桥接大鼠坐骨神经缺损促进神经-肌结构重建和功能恢复的实验研究[J].解剖学报,2005,36(1):1-5.
[10]Lloyd MS,Teo TC,Pickford MA,et al.Preoperative management of the amputated limb[J].Emerg Med J,2005,22(7):478-480.
[11]Chin KY,Hart AM.Temporary catheter first perfusion during hand replantation with prolonged warm ischaemia[J].J Plast Reconstr Aesthet Surg,2012,65(5):675-677.
[12]Cavadas P C,Ibez J,Thione A,et al.Bilateral trans-humeral arm transplantation:result at 2 years[J].Am J Transplant,2011,11(5):1085-1090.
[13]Juang SE,Huang HW,Kao CW,et al.Effect of university of wisconsin and histidine-tryptophan-ketoglutarate preservation solutions on blood potassium levels of patients undergoing living-donor liver transplantation[J].Transplantation Proceedings,2012,44(2):366-368.
[14]Chen F,Nakamura T,Wada H.Development of new organ preservation solutions in Kyoto University[J].Yonsei Med J,2004,45(6):1107-1114.
[15]Yoshida H,Okuno H,Kamoto T,et al.Comparison of the effectiveness of ET-Kyoto with Euro-Collins and University of Wisconsin solutions in cold renal storage[J].Transplant,2002,74(9):1231-1236.
[16]Canelo R,Hakim NS,Ringe B.Experience with hystidine tryptophan ketoglutarate versus University Wisconsin preservation solutions in transplantation[J].Int Surg,2003,88(3):145-151.
[17]Song YX,Muramatsu K,Kurokawa Y,et al.Functional recovery of rat hind-limb allografts[J].J Reconstr Microsurg,2005,21(7):471-476.
