玉米储藏真菌早期预测的研究
2018-01-26欧阳毅祁智慧李春元张海洋
欧阳毅, 祁智慧, 李春元,张海洋 ,唐 芳
(1.国家粮食局科学研究院,北京 100037;2.中央储备粮通辽东郊直属库,内蒙古 通辽 028012)
我国是玉米生产和消费大国。玉米作为饲料和食品行业的主要原料之一,其储藏安全尤为重要。玉米籽粒含有丰富的营养物质,且胚部较大、吸湿性强 ,与小麦、稻谷等粮种相比,其耐储性较差,储藏过程中易受到微生物生长的影响而发生霉变[1]。微生物生长会引起玉米干物质减少,水分增加,异味产生和色泽变化,种子发芽率下降及品质降低[2-3]。近年来,收储的玉米水分上升,加上玉米是“北粮南运”的主要粮种之一,玉米在储运期间水分和温度偏高导致的霉变问题日渐突出,进行玉米储藏真菌生长规律的研究,对高水分玉米短期储藏的安全性进行预测,对保障我国玉米储藏安全十分必要。
粮食发热是由真菌引起的[4],最早在粮食上生长的储藏真菌是局限曲霉和灰绿曲霉[5], Barron等对玉米储藏真菌进行研究,提出引起粮食劣变的主要真菌是灰绿曲霉和白曲霉[6]。当20%~50%粮食受到灰绿曲霉的侵染时,表示粮食储藏失去稳定性,当5%~10%粮食受到黄曲霉和白曲霉的侵染时,粮食已经发生变质并且很快会发热[8]。玉米储藏真菌的生长受到玉米自身水分和储藏环境条件的影响。许多学者曾对温湿度、pH、营养成分等各类储粮相关的生态因子进行系统的研究,探索了储粮真菌的最低生长水分和生长环境条件[8-13],其中最主要的因素是水分和温度[14]。不同的温度和水分组成了粮食复杂的储藏环境,同时又与储粮微生物相互关联,形成粮食储藏生态体系。唐芳等研究了不同水分的玉米储藏过程中主要危害真菌灰绿曲霉和白曲霉生长演替的规律[15],陈娟等利用微生物活性值研究了不同温湿度条件下玉米储藏真菌的活动变化规律[16],在不同水分和温度条件下,玉米储藏真菌生长早期预测的研究报道较少。本实验对玉米储藏水分和温度的变化,与真菌生长规律关系进行了研究,初步建立玉米储藏水分、温度与真菌起始生长时间预测关系曲线,旨在为我国玉米储藏安全早期预测提供依据。
1 材料与方法
1.1 样品
玉米样品,质量中等,水分为12.2%,2008年新收玉米。
1.2 试剂和仪器
SMART显微镜:重庆奥特公司;HPS-250生化培养箱:哈尔滨东联电子技术开发有限公司;PL3002-IC电子分析天平:梅特勒—托利多仪器(上海)有限公司;DHG-9246A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;JSFM-1粮食水分测试粉碎磨:成都粮食储藏科学研究所。
实验用水均为去离子水。
1.3 实验方法
1.3.1 样品着水和储藏
将清理、除杂后的玉米样品均分为约5 kg每份的若干等份,采用喷雾着水法,边喷水变搅拌,使玉米着水均匀,将玉米样品水分调至实验所需水分,装入袋中密封,置于5 ℃环境中平衡10 d。每次着水量≤2%,如着水量超过2%,则需多次着水,多次平衡,操作方法同上。将平衡后的样品再均分为6等份,分装于1.0 L广口瓶中,加塞,置于不同温度恒温箱中储藏。
1.3.2 粮食真菌检测方法——孢子计数法[17]
称取10.0 g粮食样品,于80 mL具塞试管中,加30 mL水,加塞,用力上下振荡1 min,用300目滤布过滤,取滤液虹吸进入血球计数板计数区,置于显微镜下进行真菌孢子计数。
1.3.3 水分测定方法
采用GB/T 5497—85 粮食、油料检验 水分测定法。
1.4 数据处理方法
采用EXCEL软件处理实验数据。
2 结果与分析
2.1 样品着水均匀性检验
玉米储藏真菌生长与储藏水分密切相关,实验着水的均匀性直接影响实验检测结果的准确性,因此,对着水平衡后的玉米样品着水均匀性进行了检验,2次平行测定结果取平均值,结果见表1。

表1 玉米着水均匀性检验(n=6)
由表1可知,调节6个水分的玉米,经多次着水平衡后,进行均匀性检验,平均水分为12.2%、12.9%、13.5%、13.9%、14.7%、15.7%,相对标准偏差(RSD)范围0.3%~0.8%。结果表明,各水分样品均具有良好的均匀性。
2.2 玉米储藏水分、温度与真菌生长的关系
各水分玉米样品分别放在10、15、20、25、30、35 ℃6个温度下储存,每隔10 d对储存的玉米样品进行取样,按照1.3.2方法对样品中真菌孢子进行检测,实验周期180 d,结果见图1(a~f)。




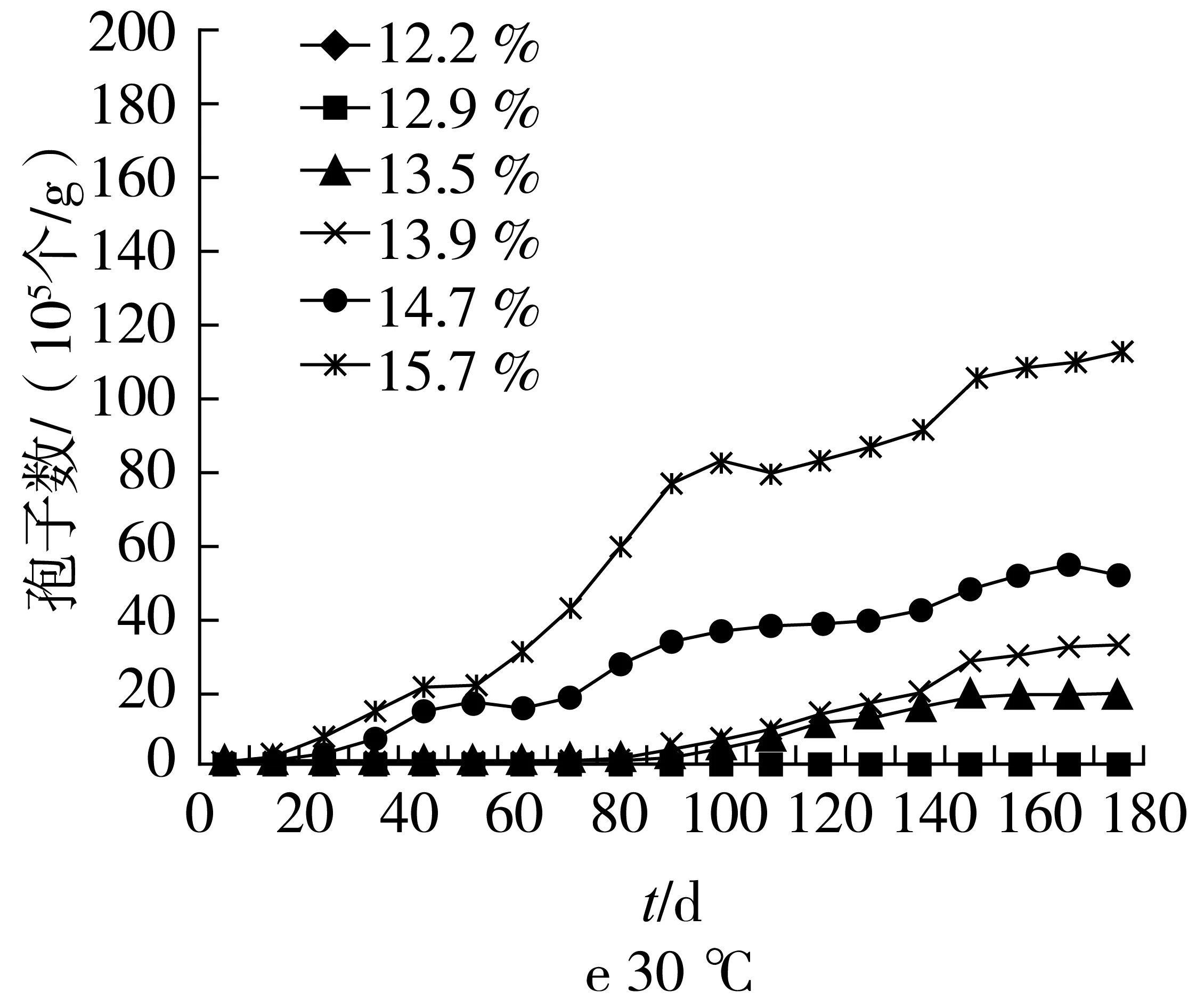

图1 玉米储藏水分、温度与真菌生长关系
从图1(a~f)中可看出真菌生长与水分、温度和玉米储存时间的变化关系。12.2%水分的样品,在各实验温度下储存180 d,均未检出真菌生长。12.9%水分的样品在25 ℃及以下储存半年时间,均未检出真菌生长,长期储存是安全的。在30 ℃和35 ℃高温条件下储存,分别在180 d和100 d检出真菌生长,检出量在105个/g,参照储粮真菌危害检测判定方法[17],玉米储藏状况处于临界状态,经显微观察,此阶段灰绿曲霉生长为主,且生长缓慢,对玉米储藏品质危害较小。13.5%水分的玉米在35 ℃和30 ℃温度下分别储存至80 d和120 d时,真菌孢子检出量达106个/g,达到危害等级,在25 ℃条件下储存180 d,虽有真菌生长检出,但数量级在105个/g,处于临界状态,可见在35 ℃连续高温不超过二个月,30 ℃不超过4个月的北方地区,水分13.5%的玉米可安全度夏储存。13.9%水分玉米20 ℃以下储存半年,未检出真菌生长,20 ℃低温长期储藏可保证储藏安全,25 ℃储藏70 d后检出真菌生长,由此可见,东北地区夏季短期高温,但粮堆温度25 ℃不超过70 d时,基本可保证安全度夏。14.7%和15.7%水分的玉米在20 ℃及以上储藏均有真菌生长检出,随着水分升高,真菌生长逐渐加快,玉米储藏水分与真菌生长速度有良好的相关性。
从图1可以看出,不同水分的玉米在不同的温度下储藏,真菌生长速度存在明显差异。15 ℃及以下储存,大部分玉米储藏真菌生长相对缓慢,低温对真菌生长有一定抑制作用。在玉米储藏真菌生长的影响因素中,水分是真菌生长的决定性因素,温度影响真菌生长速度。
2.3 玉米储藏水分、温度与真菌起始生长时间关系曲线
幂函数可用于描述2个变量之间的非线性关系。在上述研究的基础之上,对玉米储存水分、温度以及真菌起始生长时间进行幂函数曲线拟合,得到玉米储藏水分、温度与真菌起始生长时间关系曲线、拟合方程和拟合度R2,结果见图2和表2。
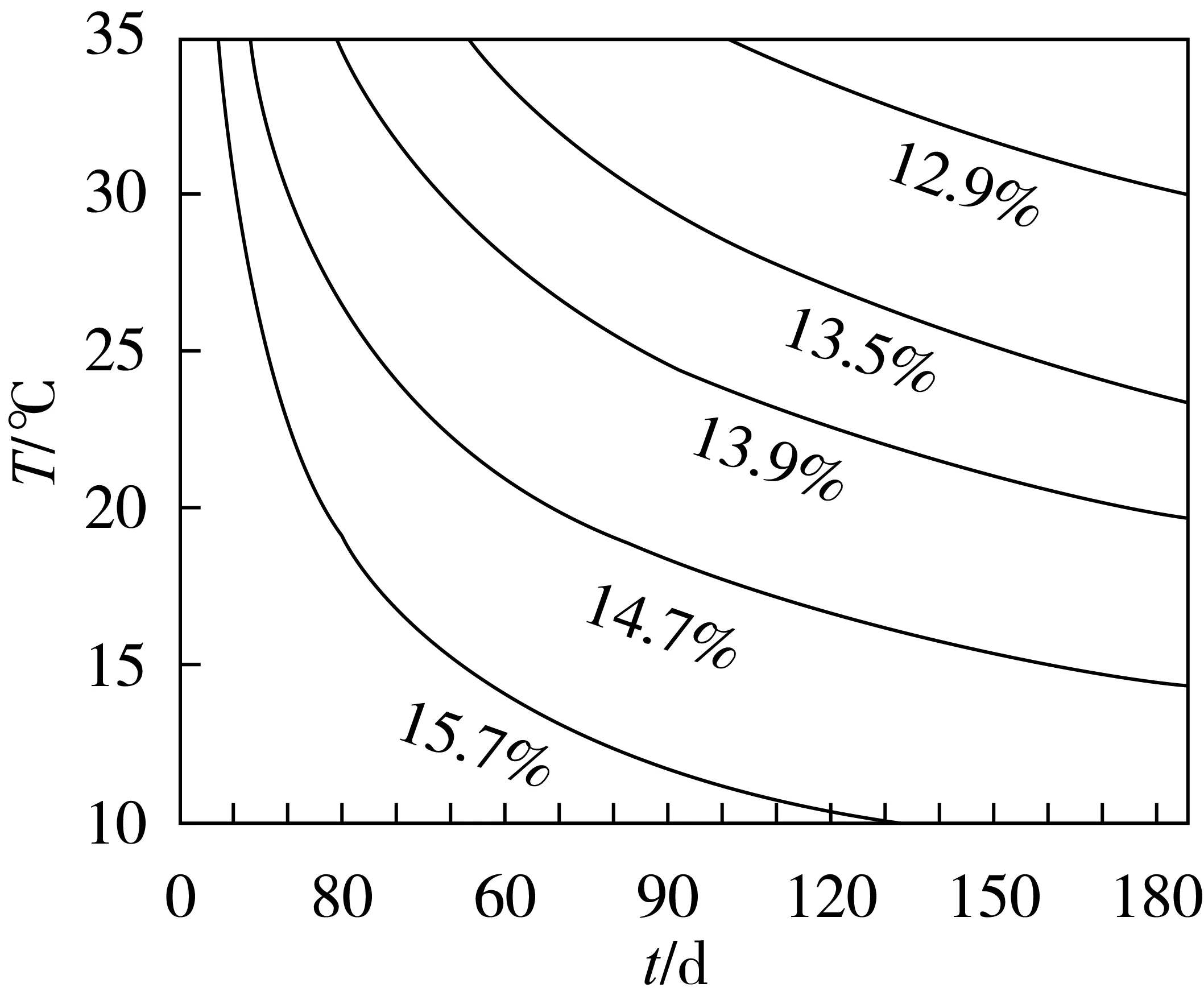
图2 玉米储藏水分、温度与真菌生长起始时间预测关系曲线
表2 不同水分玉米储藏真菌幂函数拟合方程

水分/%幂函数拟合方程R212.9y=135.16x-0.293113.5y=125.95x-0.3220.965013.9y=100.19x-0.3120.972614.7y=83.403x-0.3360.931315.7y=86.492x-0.4440.9913
根据不同温度条件下,不同水分的玉米样品储藏真菌生长起始时间实验,得到了玉米储藏水分、温度和真菌生长起始时间预测关系曲线(如图2所示),图中每条曲线代表不同的样品水分,对应不同的温度(纵坐标),可得到相应的真菌生长起始时间。
从图2和表2可看出,将不同水分的玉米储藏温度与真菌起始生长时间进行幂函数拟合,拟合度R2均在0.9以上,结果表明,各水分玉米、储藏温度和真菌生长起始时间具有良好的相关性。在高水分玉米实际储藏中,不同水分的玉米,受储藏温度的影响,安全储藏期差别较大。可依据当地储藏环境最高温度,通过查阅图2或表2中方程计算,预估出真菌起始生长时间,用于指导高水分玉米的短期安全储藏操作。本曲线是在理想等温条件下得到的,但在实际玉米储藏过程中,粮堆温度在短期内会有变化,建议以最高温度进行真菌生长预测。在使用本曲线时,还应结合当地储粮实际情况综合考虑,对储藏玉米水分准确定值非常关键。
3 结论
研究了玉米储藏水分、温度及真菌生长关系,结果表明, 12.2%水分玉米在储藏期间未检出真菌生长。12.9%水分玉米在30 ℃和35 ℃高温条件下储藏半年,储藏后期虽然有真菌生长检出,但对储藏品质影响较小,基本可以保证储藏安全。13.5%水分玉米在25 ℃及以下储藏半年是安全的,在我国北方地区基本可以安全度夏。13.9%水分玉米在20 ℃低温条件下储藏半年是安全的,在东北地区基本可以安全度夏。14.7%和15.7%水分的玉米在20 ℃及以上储藏均有真菌生长检出,随着水分升高,真菌生长逐渐加快。15 ℃以下低温储藏对真菌生长有一定抑制作用。
通过对玉米储藏水分、温度与真菌生长规律的研究,得到了玉米储藏水分、温度与真菌起始生长时间预测关系曲线。依据当地储藏环境最高温度,通过查阅曲线图,可对高水分玉米短期安全储藏期进行预测,用于指导高水分玉米储藏。
[1]路茜玉主编.粮油储藏学. 中国财政经济出版社 [M], 1988.
[2]Foote W D. Factors in marketing corn. University of Nebraska- Lincoln: Part of agriculture commons, and the Curriculum and Instruction Commons, G80-518, 1980.
[3]黄淑霞. 霉菌对储藏期玉米种子发芽率的影响 [J]. 中国种业, 2010(6): 46-48
[4]Gilman J C, Barron D H. Effect of molds on temperature of stored grain [J]. Plant Physiology, 1930, 5(4): 565-573.
[5]Magan N, Lacey J. Effect of water activity, temperature and substrate on interactions between field and storage fungi [J]. Transactions of the British Mycological Society, 1984, 82(1): 83-93.
[6]Barron G L, Lichtwardt R W. Quantitative estimations of the fungi associated with dete- rioration of stored corn in Iowa [J]. Lowa state College Journal of Science, 1959, 34: 147- 155.
[7]《粮食储藏》编写组. 粮食储藏 [M]. 北京: 中国财政经济出版社, 1980.
[8]Magan N, Lacey J. Effect of temperature and pH on water relation of field and storage fungi [J]. Transactions of the British Mycological Society, 1984, 82(1): 71-81.
[9]Magan N, Lacey J. Effect of gas composition and water activity on growth of field and storage fungi and their interactions [J]. Transactions of the British Mycological Society, 1984, 82(2): 305-314.
[10]Bottomley R A, Christensen C M, Geddes W F. Grain storage studies DC. The influence of various temperature, humidities, and oxygen concentration on mold growth and bio- chemical change in stored yellow corn [J]. Cereal Chemistry, 1950: 271-296.
[11]Koehler B. Fungus growth in shelled corn as affected by moisture [J]. Journal of Agricultural Research, 1938, 56(4): 291-307.
[12]Abdullah N, Nawawi A, Othman I. Fungal spoilage of starch- based foods in relation to its water activity (aw) [J]. Journal of Stored Products Research, 2000, 36(1): 47-54.
[13]黄淑霞, 蔡静平, 田海娟. 主要粮食品种储藏期间霉菌活动特性研究 [J]. 中国粮油学报, 2010, 25(1): 99-102.
[14]Sauer D B, Storey C L, Walker D E. Fungal populations in U.S. farm- stored grain and their relationship to moisture, storage time, regions, and insect infestation [J]. Phytopathology, 1984, 74(9): 283-284.
[15]唐芳, 程树峰, 武松陵. 玉米储藏主要危害真菌生长规律的研究 [J]. 中国粮油学报, 2008, 23 (5): 137-140.
[16]陈娟, 蔡静平, 黄淑霞, 李振权. 玉米储藏霉菌活动预测的研究 [J]. 粮油加工, 2007(5): 91-93.
[17]程树峰, 唐芳, 武松陵. 储粮真菌危害早期检测方法的研究 [J]. 中国粮油学报, 2011, 26(4): 85-88.●
