猴头菇多糖对氧化应激状态下仔猪回肠形态结构及通透性的影响
2018-01-26张建龙丘富安马玉芳黄一帆
张建龙,丘富安,董 星,秦 韬,马玉芳,黄一帆*,李 健*
(1. 福建农林大学 福建省兽医中药与动物保健重点实验室,福州 350002;2. 中西兽医结合与动物保健福建省高等学校重点实验室,福州 350002)
氧化应激作为诱发多种疾病的重要病理机制之一,导致畜禽生长缓慢、体重下降、饲料利用率低,幼龄畜禽出现发育不良、腹泻、肠道绒毛萎缩和隐窝增生、成活率低下等情况,对畜禽养殖产生巨大影响。研究表明,中药多糖作为免疫添加剂,对免疫系统具有广泛的调节作用[1-3]。
人工诱发氧化应激是一种常见的试验方法,常用的有大肠杆菌、沙门菌与高温灭活的葡萄球菌三种氧化应激原,其中大肠杆菌是使用最普遍的一种菌种,具体模型的建立是在试验猪腹膜或者静脉注射一定剂量的大肠杆菌脂多糖(LPS)。脂多糖(LPS)是存在于革兰阴性菌细胞壁中的致病成分,已有众多研究使用LPS构建细胞[4-6]和动物[7-8]的氧化应激模型。LPS既可以诱导产生大量的ROS,又是生猪氧化应激继发内毒血症过程中重要的毒力因子,因此更具生产实际意义。
猴头菇(Hericiumerinaceus)是一种药用食用菌,具有抗氧化、抗衰老、保肝利肝、提高免疫力等的功效[9-11],因为大量的人工栽培使得其成本降低,在日常食品中深受青睐。猴头菇多糖(Hericiumerinaceuspolysaccharide,HEP)作为猴头菇内的主要活性物质,在动物保健和治疗上有着良好的疗效。然而,用HEP对猪肠道氧化应激的研究目前还比较鲜少,因此,本试验利用LPS建立氧化应激模型,来探究HEP对猪肠道氧化应激作用的各方面影响。
1 材料与方法
1.1 试验材料
选购45头健康的(28±3)日龄断奶仔猪(杜洛克×长白×大白),猴头菇多糖(HEP):购自上海康舟真菌多糖有限公司,纯度为50%,脂多糖(LPS):大肠杆菌血清型055:B5,Sigma公司提供,qPCR试剂盒和反转录试剂盒由TaKaRa公司提供。其他试剂还有蛋白裂解液、BCA蛋白浓度测定试剂盒(cwbiotech 02912E)、蛋白marker(Biomed)、PVDF膜0.45 μm(Millipore)、丙烯酰胺、双丙烯酰胺(Amresco)、SDS(Sigma L4390)、HRP标记山羊抗兔一抗(Jackson111-035-003)、HRP标记山羊抗鼠二抗(Jackson115-035-003)等。
1.2 试验仔猪分组及处理
将45头仔猪按体重相近原则随机分为5个处理组:空白组、模型组(LPS)、0.2% HEP组、0.4% HEP组、0.6% HEP组,分别饲喂基础日粮、基础日粮、添加0.2%、0.4%、0.6% HEP的基础日粮。每个处理组9个重复,每个重复1头仔猪,试验周期21 d。第21天,分别对模型组、0.2% HEP组、0.4% HEP组、0.6% HEP组仔猪腹腔注射100 μg·kg-1BW脂多糖(LPS),空白组注射等剂量灭菌生理盐水(NS)。试验于福建莆田优利可农牧发展有限公司进行,每天喂食3次,单栏饲养,圈舍自然通风,且不定期进行消毒。
1.3 样品采集
注射LPS后第3小时,每个处理组随机挑选3头试验猪,前腔静脉采血15 mL左右,2 000 r·min-1离心20 min分离血清,用于检测抗氧化指标以及谷氨酰胺和二胺氧化酶。试验猪于采血完成后立即宰杀,从腹腔内取3~5 cm的回肠;取部分肠组织置于10%多聚甲醛磷酸缓冲液中固定,用于制作切片;另取部分肠组织置于液氮中冻存,用于检测紧密连接相关基因和蛋白质的表达情况。
1.4 HEP对氧化应激仔猪血清抗氧化指标的影响
过氧化氢酶(CAT)测定试剂盒(可见光法)、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(比色法)、总超氧化物歧化酶(SOD)测定试剂盒(WST-1法)和丙二醛(MDA)测定试剂盒(TBA法),购自南京建成生物工程研究所,采用分光光度法测定,详细步骤参照试剂盒说明书要求完成。
1.5 HEP对氧化应激仔猪肠血清GLN含量和DAO活性的影响
谷氨酰胺(GLN)试剂盒和二胺氧化酶(DAO)试剂盒购自南京建成生物工程研究所,采用改良分光光度法,按试剂盒说明测定回肠中谷氨酰胺(GLN)和二胺氧化酶(DAO)活性。
1.6 HEP对氧化应激仔猪回肠形态结构的影响
将保存在4%多聚甲醛的小肠组织经过“浸洗→脱水→透明→浸蜡→包埋→切片→贴片→烘干→脱蜡入水”制备石蜡切片后,通过苏木精-伊红(HE)染色。每张切片选取2个视野,每个视野连续测定10 根肠绒毛,运用Imageproplus6.0软件计算肠绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度(V/C)值。
1.7 HEP对氧化应激仔猪回肠紧密连接的影响
1.7.1 RNA提取和反转录 RNA的提取按照组织匀浆研磨的方法,将提取出的总RNA溶于DEPC水中测定其OD值,OD260 nm/OD280 nm在1.8~2.0之间的说明其纯度相对较高,经PCR反应扩增后取8 μL·孔-1的PCR反应液进行琼脂凝胶电泳试验。
1.7.2 RT-PCR测定 根据GenBank中猪源Occludin、Claudin和ZO-1全长序列,用Oligo 7.0软件设计引物,内参基因为GAPDH,按试剂盒说明书要求,采用12.5 μL的体系,将反应液加到Real Time PCR管内进行Real Time PCR反应,循环参数:98 ℃ 2 min 初期变性;98 ℃ 10 s、60 ℃ 10 s、68 ℃ 30 s,40 个循环。采用双△Ct+标准曲线扩增效率校正法,用10倍梯度稀释法制作标准曲线,每个样品3个重复,计算公式为相对表达量=2-△△Ct,△△Ct=(Ct目的基因-Ct管家基因)试验组-(Ct目的基因-Ct管家基因)对照组。
表1基因的扩增引物序列
Table1Geneamplificationprimersequence

基因Gene引物序列(5'→3')Primersequence产物长度/bpLengthofproducts登录号AccessionNo.GAPDHForward:ACATCATCCCTGCTTCTACTGGReversed:CTCGGACGCCTGCTTCAC188AF017079OccludinForward:ACGAGCAGCAAAGGGATTCTTCReversed:TCACACCCAGGATAGCACTCATT152NM_001163647.2ClaudinForward:TGCCTCAGTGGAAGATTTACTCCReversed:TGGTGTTCAGATTCAGCAAGGA147NM_001244539.1ZO-1Forward:AGTTTGATAGTGGCGTTGACACReversed:GCTGAAGGACTCACAGGAACA106XM_005659811.1
1.7.3 Western blot检测 RIPA buffer提取细胞总蛋白质,按照Braford蛋白质定量试剂盒说明书测定蛋白质样品的浓度,使用山羊抗兔IgG(H+L)HRP 1∶10 000,室温孵育1 h。蛋白质经SDS-PAGE电泳并转移至PVDF膜。以5% BSA-PBST稀释一抗后4 ℃水平摇床孵育过夜。次日用5%BSA-PBST稀释二抗,加入1∶10 000的山羊抗兔IgG(H+L)HRP室温孵育1 h,加入ECL曝光显影。
1.8 数据分析
所有指标均以孔为统计单位,采用Excel对测得的数据进行初步整理,试验数据采用统计软件SPSS17.0进行单因素方差分析(ONE-WAY ANOVA)和Duncan氏多重比较,以P<0.05为差异显著性标准,P<0.01为差异极显著,结果用平均值±标准差表示。
2 结 果
2.1 HEP对氧化应激仔猪血清抗氧化指标的影响
HEP对氧化应激仔猪血清抗氧化指标的影响结果如图1所示。根据图1A所知,经处理过的各组血清中的CAT含量显著低于空白组(P<0.05),0.6% HEP组显著高于LPS组(P<0.05)。根据图1B所知,处理过的各组血清中SOD的含量显著低于空白组(P<0.05),0.6% HEP组显著高于LPS组(P<0.05)。根据图1C可知,处理过的各组血清中的GSH-Px含量显著低于空白组(P<0.05),HEP组显著高于LPS组(P<0.05)。根据图1D可知,各组血清中的MDA的含量相比较,0.2%、0.4% HEP组相比空白组显著升高(P<0.05),LPS组和0.6% HEP组相比空白组极显著升高(P<0.01),各HEP组比LPS组显著降低(P<0.05)。
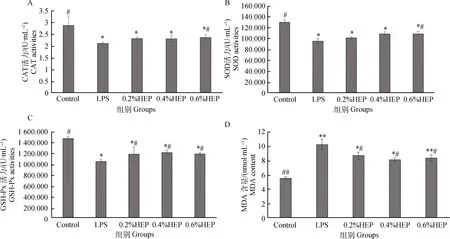

与空白对照组比较,*. P<0.05,**. P<0.01;与LPS组比较,#. P<0.05,##. P<0.01;下同。A. HEP对氧化应激仔猪血清CAT的影响;B. HEP对氧化应激仔猪血清SOD的影响;C. HEP对氧化应激仔猪血清GSH-Px的影响;D. HEP对氧化应激仔猪血清MDA的影响Compared with control group, *. P<0.05, **. P<0.01; Compared with LPS group, #. P<0.05, ##. P<0.01; The same as follows. A. Effects of HEP on serum CAT in oxidative stress piglets; B. Effects of HEP on serum SOD in oxidative stress piglets; C. Effects of HEP on serum GSH-Px in oxidative stress piglets; D. Effects of HEP on serum MDA in oxidative stress piglets图1 HEP对氧化应激仔猪血清抗氧化指标的影响Fig.1 Effects of HEP on serum antioxidant indexes in oxidative stress piglets(±s, n=3)
2.2 HEP对氧化应激仔猪血清GLN含量和DAO活性的影响
HEP对氧化应激仔猪血清GLN含量和DAO活性的影响结果如图2所示。各组间血清中谷氨酰胺的含量由图2A所知,LPS处理组的GLN水平显著低于空白组(P<0.05),经HEP处理后的各组GLN水平显著高于LPS组(P<0.05)。图2B反映了各组血清中DAO的含量变化情况,LPS组的DAO水平极显著高于空白组(P<0.01),HEP处理组的DAO水平显著低于LPS组(P<0.05)。


A. HEP对氧化应激仔猪血清谷氨酰胺含量的影响;B. HEP对氧化应激仔猪血清二胺氧化酶活性的影响A. Effects of HEP on serum GLN in oxidative stress piglets; B Effects of HEP on serum DAO in oxidative stress piglets图2 HEP对氧化应激仔猪血清GLN含量和DAO活性的影响Fig.2 Effects of HEP on serum GLN and DAO in oxidative stress piglets(±s, n=3)
2.3 HEP对氧化应激仔猪回肠形态结构的影响
HEP对氧化应激仔猪回肠结构的影响如图3所示。图3A表示HEP对氧化应激仔猪回肠绒毛的影响,其中,a图表示绒毛的高度,空白组极显著地高于其余各组(P<0.01),LPS组极显著低于其余各组(P<0.01);b图表示隐窝的深度,空白组极显著低于其余各组(P<0.01),LPS组显著高于0.2% HEP组(P<0.05),极显著地高于0.4%、0.6% HEP组(P<0.01);c图表示绒毛高度/隐窝深度的情况,空白组极显著高于其余各组(P<0.01),LPS组极显著地低于其余各组(P<0.01)。
图3B反映了HEP对氧化应激仔猪回肠形态结构的影响,由图b可见:回肠组织绒毛上皮细胞的单层柱状上皮细胞局部糜烂脱落,隐窝结构受损,黏 膜层局部区域隐窝结构消失,组织疏松,表明造模成功。图c、d、e均显示:回肠上皮绒毛上皮细胞可见少量脱落,隐窝结构清晰,黏膜层及黏膜下层结构较正常,高剂量HEP组和空白组的结果基本相似。

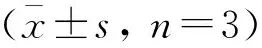
A. HEP对氧化应激仔猪回肠绒毛的影响;B. HEP对氧化应激仔猪回肠形态结构的影响(图a~e分别为空白组、LPS组、0.2%HEP组、0.4%HEP组和0.6%HEP组),100×A. Effects of HEP on ileal villi of oxidative stress piglets; B. Effects of HEP on ileal morphology of oxidative stress piglets (Fig. a-e were control group, LPS group, 0.2% HEP group, 0.4% HEP group and 0.6% HEP group, respectively), 100×图3 HEP对氧化应激仔猪回肠结构的影响Fig.3 Effects of HEP on ileal morphology of oxidative stress piglets(±s, n=3)
2.4 HEP对氧化应激仔猪回肠紧密连接蛋白mRNA的影响
HEP对氧化应激仔猪回肠紧密连接的影响结果如图4。图4A表示HEP对氧化应激仔猪紧密连接基因转录的影响,可知:LPS组的3种紧密连接(tight junction,TJ)基因转录量极显著地低于空白组的转录量(P<0.01)。0.4% HEP组的ZO-1 mRNA和ClaudinmRNA转录量极显著地高于LPS组(P<0.01),0.2%、0.6% HEP组显著高于LPS组(P<0.05);0.2% HEP组的OccludinmRNA转录量显著高于LPS组(P<0.05),但极显著低于其他2个HEP组和空白组(P<0.01);0.4%、0.6% HEP组极显著地高于LPS组(P<0.01)。
HEP对氧化应激仔猪紧密连接蛋白表达的影响结果如图4 B和C所示。根据图4C可以看出,三组TJ蛋白相对表达量中,LPS组均极显著地低于空白组(P<0.01)。各HEP组的Claudin蛋白、Occludin蛋白极显著地低于空白组(P<0.01),0.2%、0.4% HEP组ZO-1蛋白极显著地低于空白组(P<0.01),0.6% HEP组显著低于空白组(P<0.05)。各HEP组三种TJ蛋白表达量(除0.2% HEP组Claudin外)均极显著(P<0.01)高于LPS值。
3 讨 论
3.1 HEP对氧化应激仔猪血清抗氧化指标的影响
MDA、SOD、GSH-Px、CAT是动物机体抗氧化系统成分,用以清除氧自由基,从而调节氧自由基的生成和清除之间的动态平衡[12-14]。本试验结果显示,氧化应激状态下的仔猪血清中的抗氧化指标有了明显变化,SOD、GSH-Px、CAT指数下降和MDA指数升高,饲料中添加HEP后,这些指标都在向着正常的趋势逐渐发展,这说明HEP具有一定抗氧化的能力,且浓度的不同所造成的影响也不同,中等剂量的HEP有着较好的抗氧化应激能力。

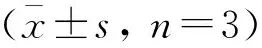
A. HEP对氧化应激仔猪紧密连接基因转录的影响;B. HEP对氧化应激仔猪紧密连接蛋白表达的影响;C. HEP对氧化应激仔猪紧密连接蛋白相对表达结果A. Effects of HEP on TJ gene transcription of oxidative stress piglets; B. Effects of HEP on TJ protein expression of oxidative stress piglets; C. Effects of HEP on TJ protein relative expression图4 HEP对氧化应激仔猪紧密连接蛋白表达的影响Fig.4 Effects of HEP on expression of tight junction in ileum from oxidative stress piglets(±s, n=3)
3.2 HEP对氧化应激仔猪肠黏膜完整性的影响
小肠是动物机体内吸收转运物质和预防疾病的重要组织器官,小肠绒毛是其发挥生理功能的基本功能单位,肠绒毛高度、隐窝深度和V/C是小肠黏膜结构完整性的重要衡量指标[15]。本试验结果显示,LPS应激严重破坏了仔猪小肠黏膜形态的完整性,使小肠黏膜功能受损,在添加了HEP之后,随着剂量的升高,肠黏膜的形态明显出现改善。同时,根据绒毛高度、隐窝深度和V/C值可以分析出,HEP具有保护肠黏膜的作用,增强肠黏膜对氧化应激的抵御能力,使肠道的结构和功能保持完整。
GLN是哺乳动物体内的一类条件必需氨基酸,它能有效保护肠道黏膜结构,防止黏膜萎缩,改善肠道免疫功能[16],因此,血浆中GLN活性可直接反映肠道结构和功能的完整性。DAO是一种具有高度活性的细胞内酶,跟小肠黏膜中核酸、蛋白质的合成密切相关,可作为肠道黏膜结构与功能状态的理想指标,其含量与肠道损伤程度呈正相关,与肠黏膜DAO活性呈负相关[17-19]。LPS的刺激,导致仔猪产生氧化应激,在破坏肠道结构的同时,引起机体GLN含量的下降和DAO含量的升高。通过在日粮中添加HEP的试验结果显示,不同剂量的HEP对GLN和DAO均有一定程度的影响,使受损的肠黏膜得到一些改善。
3.3 HEP对氧化应激仔猪回肠紧密连接的影响
紧密连接是保护肠黏膜屏障和肠上皮细胞间最主要的连接方式,对紧密连接起关键作用的是连接蛋白ZO-1、Claudin、Occludin[20-22]。本试验结果显示,LPS应激后,回肠中ZO-1、Claudin、Occludin蛋白表达量均显著下降,饲料中添加HEP后,下降程度得到显著抑制。这表明LPS的应激破坏了仔猪回肠上皮细胞的紧密连接结构,而HEP能抑制经LPS应激后肠上皮细胞紧密连接mRNA及蛋白质表达量的下降,提高紧密连接基因表达量,从而保护肠黏膜屏障功能。
4 结 论
日粮中添加猴头菇多糖能缓解氧化应激造成的回肠黏膜损伤,维持肠上皮细胞通透性。
[1] 周 雄, 周汉林, 王定发, 等. 中草药添加剂在养殖生产中的应用现状及展望[J]. 贵州农业科学, 2016, 44(7): 77-80.
ZHOU X, ZHOU H L, WANG D F, et al. Current situation and prospects of the application of Chinese herbal medicine feed additives[J].GuizhouAgriculturalSciences, 2016, 44(7): 77-80. (in Chinese)
[2] 赵成坚, 李 力, 徐永莉, 等. 中药饲料添加剂对荷斯坦公牛血液生化指标及生长发育的影响[J]. 动物医学进展, 2016, 37(6): 59-62.
ZHAO C J, LI L, XU Y L, et al. Effects of Chinese herb feed additives on growth and blood biochemical indexes in Holstein Bulls[J].ProgressinVeterinaryMedicine, 2016, 37(6): 59-62. (in Chinese)
[3] 吴 超, 张 莉, 吴跃明, 等. 中草药添加剂对早期断奶仔猪生长性能和肠道菌群的影响[J]. 中国畜牧杂志, 2010, 46(3): 31-35, 52.
WU C, ZHANG L, WU Y M, et al. Effects of Chinese herb additives on growth performance and intestinal microflora of weaned piglets[J].ChineseJournalofAnimalScience, 2010, 46(3): 31-35, 52. (in Chinese)
[4] ZHANG M, PAN H, XU Y, et al. Allicin decreases lipopolysaccharide-induced oxidative stress and inflammation in human umbilical vein endothelial cells through suppression of mitochondrial dysfunction and activation of Nrf2[J].CellPhysiolBiochem, 2017, 41(6): 2255-2267.
[5] YAO H, SUN Y P, SONG S S, et al. Protective effects of dioscin against lipopolysaccharide-induced acute lung injury through inhibition of oxidative stress and inflammation[J].FrontPharmacol, 2017, 8: 120.
[6] WU G J, ZHOU W H, ZHAO J F, et al. Matrine alleviates lipopolysaccharide-induced intestinal inflammation and oxidative stress via CCR7 signal[J].Oncotarget, 2017, 8(7): 11621-11628.
[7] HASSAN H M, GUO H L, YOUSEF B A, et al. Dexamethasone pretreatment alleviates Isoniazid/Lipopolysaccharide hepatotoxicity: inhibition of inflammatory and oxidative stress[J].FrontPharmacol, 2017, 8: 133.
[8] FU C L, DAI X G, YANG Y, et al. Dexmedetomidine attenuates lipopolysaccharide-induced acute lung injury by inhibiting oxidative stress, mitochondrial dysfunction and apoptosis in rats[J].MolMedRep, 2017, 15(1): 131-138.
[9] 樊伟伟, 黄惠华. 猴头菇多糖研究进展[J]. 食品科学, 2008, 29(1): 355-358.
FAN W W, HUANG H H. Advances onHericiumerinaceuspolysaccharides[J].FoodScience, 2008, 29(1): 355-358. (in Chinese)
[10] ZHU Y, LI Q, MAO G H, et al. Optimization of enzyme-assisted extraction and characterization of polysaccharides fromHericiumerinaceus[J].CarbohydrPolym, 2014, 101: 606-613.
[11] KHAN M A, TANIA M, LIU R, et al.Hericiumerinaceus: an edible mushroom with medicinal values[J].JComplementIntegrMed, 2013, 10(1): 253-258.
[12] 张克烽, 张子平, 陈 芸, 等. 动物抗氧化系统中主要抗氧化酶基因的研究进展[J]. 动物学杂志, 2007, 42(2): 153-160.
ZHANG K F, ZHANG Z P, CHEN Y, et al. Antioxidant defense system in animals[J].ChineseJournalofZoology, 2007, 42(2): 153-160. (in Chinese)
[13] 尹 杰. 出生和早期断奶对仔猪抗氧化系统发育的影响及其机理研究[D]. 北京: 中国科学院大学, 2015.
YIN J. Effects of birth and early weaning on antioxidative system development of piglets and its mechanism[D]. Beijing: University of Chinese Academy of Sciences, 2015. (in Chinese)
[14] 成传尚, 薛红星, 彭 健. 日粮中添加酚类抗氧化剂对断奶仔猪抗氧化系统及生长性能的影响[C]//中国畜牧兽医学会动物营养学分会第七届中国饲料营养学术研讨会论文集. 郑州: 中国畜牧兽医学会动物营养学分会, 2014: 5-6.
CHENG C S, XUE H X, PENG J. Effects of dietary phenol antioxidants on antioxidant system and growth performance of weaned[C]//Animal Nutrition Branch Chinese Association of Animal Science and Veterinary Medicine. Zhengzhou: Animal Nutrition Branch of China Institute of Animal Husbandry and Veterinary Medicine, 2014: 5-6. (in Chinese)
[15] 姜慧慧, 黄丽娜, 吴宝成, 等. 猴头菇多糖对MDRV感染番鸭病死率及肠道形态结构的影响[J]. 中国家禽, 2015, 37(5): 22-26.
JIANG H H, HUANG L N, WU B C, et al. Effects of hericium polysaccharide powder on mortality rate and intestinal morphology of muscovy ducks infected with muscovy duck reovirus[J].ChinaPoultry, 2015, 37(5): 22-26.(in Chinese)
[16] 朱 翠, 蒋宗勇. 谷氨酰胺对早期断奶仔猪肠黏膜免疫的调节作用[J]. 中国畜牧兽医, 2011, 38(8): 10-16.
ZHU C, JIANG Z Y. Regulative function of glutamine on intestinal mucosal immunity in early-weaning piglets[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2011, 38(8): 10-16. (in Chinese)
[17] 汤 菲, 徐海涛, 贾克然. 二胺氧化酶的临床应用[J]. 临床误诊误治, 2014, 27(8): 112-115.
TANG F, XU H T, JIA K R. Clinical application of diamine oxidase[J].ClinicalMisdiagnosis&Mistherapy, 2014, 27(8): 112-115. (in Chinese)
[18] AHRENS F, GBEL G, GARZ B, et al. Release and permeation of histamine are affected by diamine oxidase in the pig large intestine[J].InflammRes, 2002, 51(S1): 83-84.
[19] FUKUDOME I, KOBAYASHI M, DABANAKA K, et al. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats[J].MedMolMorphol, 2014, 47(2): 100-107.
[20] 胡彩虹, 钱仲仓, 刘海萍, 等. 高锌对早期断奶仔猪肠黏膜屏障和肠上皮细胞紧密连接蛋白表达的影响[J]. 畜牧兽医学报, 2009, 40(11): 1638-1644.
HU C H, QIAN Z C, LIU H P, et al. Effect of high level of zinc oxide on tight junction protein expression in intestinal epithelial cells and intestinal mucosal barrier in early weaning piglets[J].ActaVeterinariaetZootechnicaSinica, 2009, 40(11): 1638-1644. (in Chinese)
[21] BERKES J, VISWANATHAN V K, SAVKOVIC S D, et al. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation[J].Gut, 2003, 52(3): 439-451.
[22] HU C H, XIAO K, LUAN Z S, et al. Early weaning increases intestinal permeability, alters expression of cytokine and tight junction proteins, and activates mitogen-activated protein kinases in pigs[J].JAnimSci, 2013, 91(3): 1094-1101.
