同时加速溶剂萃取/气相色谱-质谱法测定植物中13种有机磷酸酯
2018-01-25王诗雨孙丽娜
罗 庆,王诗雨,孙丽娜,王 辉
(沈阳大学 环境学院 区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044)
有机磷酸酯(Organophosphate esters,OPEs)作为一种阻燃剂或增塑剂广泛应用于家具家装材料、电子设备、塑料制品以及地板抛光剂中[1]。特别是在欧美各国因多溴联苯醚(Polybrominated diphenyl ethers,PBDEs)的生物毒性和环境风险,在逐步禁止PBDEs的生产和使用后,OPEs在近十几年来的生产量和使用量均快速增加[2-3]。但是OPEs并不安全,已有多项研究表明有机磷酸酯具有潜在的生物毒性效应,并且能在生物体内富集[4-5]。而且OPEs主要以添加方式而非化学键合方式加入材料中,大多数具有半挥发性,很容易通过挥发、产品磨损和渗漏等方式进入到各种环境介质中[6]。目前,对于水、土、气等环境介质中OPEs的相关研究正在全面开展[7-12]。但关于植物中OPEs的研究相对较少。因此,为了开展植物中OPEs的相关研究,亟需建立便捷、准确、灵敏的植物中OPEs的分析方法。
目前,OPEs的检测主要采用气相色谱/氮磷检测器(GC/NPD)、气相色谱-质谱(GC-MS)和液相色谱-质谱(LC-MS)。NPD对含磷化合物具有较好的选择性和较高的灵敏度,但存在稳定性低和共流出等问题[13]。LC-MS对OPEs有非常好的灵敏度和特异性,但基质干扰影响了其应用,选用电喷雾离子源(ESI)时[14]干扰尤甚。GC-MS是检测OPEs的常用方法,但也面临碎片离子过多、麦氏重排等问题影响灵敏度[15-16]。固体样品中的OPEs主要采用索氏萃取、超声萃取、振荡萃取、微波辅助萃取或加速溶剂萃取等方法提取,然后采用硅胶、氧化铝、弗罗里硅土或氨基键合硅胶(PSA)等净化填料来净化提取液。提取和净化分两步进行,不仅增加了样品的前处理时间,也加大了有机溶剂的消耗量。
本研究基于加速溶剂萃取仪的特殊构造,将样品的提取和净化同时进行,并采用具有较高选择性和灵敏度的气相色谱-离子阱二级质谱法检测,建立了同时测定植物中13种OPEs的分析方法,并应用于实际样品的分析,效果较为理想。
1 实验部分
1.1 仪器与试剂
TRACE GC Ultra-PolarisQ 气 相 色 谱 质 谱 仪:配AI /AS 3000 自动进样器,Xcalibur 1.4 工作站(美国 ThermoFisher 公司);氮气吹扫仪(MG-2200,日本Tokyo Rikakikai公司);加速溶剂萃取仪(ASE300,美国 ThermoFisher 公司);真空冷冻干燥系统(FDU-1100,日本Tokyo Rikakikai公司)。
磷酸三乙酯(Triethyl phosphate,TEP)、磷酸三丙酯(Tripropyl phosphate,TPrP)、磷酸三正丁酯(Tri-n-butyl phosphate,TnBP)、磷酸三(2-氯乙基)酯(Tris-(2-chloroethyl)phosphate,TCEP)、磷酸三(1,3-二氯丙基)酯(Tris-(1-chloro-2-propyl)phosphate,TCPP)、磷酸三-(2-氯丙基)酯(Tris[2-chloro-1-(chloromethyl) ethyl]phosphate,TDCP)、磷酸丁氧基乙基酯(Tri-butoxyethyl phosphate,TBEP)、磷酸三苯酯(Triphenyl phosphate,TPhP)、磷酸二苯基-2-乙基己酯(2-Ethylhexyl diphenyl phosphate,EHDPP)、磷酸三辛酯(Tri(2-ethylhexyl) phosphate,TEHP)和磷酸三甲苯酯(Tricresyl phosphate,TCrPs)均购自德国Dr.Ehrenstorfer公司,磷酸三异丁酯(Tri-iso-butyl phosphate,TiBP)和三苯基氧膦(Triphenylphosphine oxide,TPPO)购自加拿大TRC公司。氘代磷酸三正丁酯(TnBP-d27)和氘代磷酸三苯酯(TPhP-d15)购自加拿大CDN公司。
正己烷、丙酮、二氯甲烷和乙酸乙酯均为色谱纯,活性碳(粉末)、硅胶、弗罗里硅土、中性氧化铝和氨基键合硅胶(PSA)均为分析纯。硅胶和中性氧化铝在使用前于200 ℃下活化24 h,弗罗里硅土在400 ℃下活化8 h,并用相对于净化材料质量比为3%的去离子水灭活。
1.2 萃取与净化方法
植物样品采集后冷冻保存,真空冷冻干燥后使用。
在34 mL不锈钢加速溶剂萃取池底部放置一张纤维素滤膜,称取5.00 g活化硅胶和5.00 g活性炭粉末先后放置于萃取池中,然后在活性炭粉末上覆盖一张纤维素滤膜,再称取2.00 g过1 mm筛的植物样品置于萃取池中,之后加入20 ng内标化合物,搅拌均匀,萃取池的剩余空间用硅藻土充满,随后进行加速溶剂萃取与净化。
加速溶剂萃取条件:萃取溶剂为正己烷-丙酮(1∶1,体积比),萃取压力为1 500 psi,萃取温度为100 ℃,静态萃取时间为10 min,冲洗体积为60%池体积,氮气吹扫时间为60 s,萃取循环次数为2次。
萃取液氮气吹扫至近干,100 μL正己烷定容,待GC-MS/MS分析。
1.3 气相色谱-质谱条件
色谱条件:色谱柱为DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气,恒流模式,流速为1 mL/min,采用脉冲不分流进样,脉冲压力为20 psi,进样量为2 μL,进样口温度为250 ℃,色谱柱升温程序:初始柱温50 ℃,保持1 min,以10 ℃/min升至180 ℃,保持8 min,以20 ℃ /min升至240 ℃,保持8 min,以3 ℃/min升至255 ℃,再以30 ℃/min升至300 ℃,保持5 min。
质谱条件:EI源(70 eV),离子源温度为250 ℃,连接线温度为280 ℃,溶剂延迟时间为6 min,采用选择反应监测模式(SRM)。
1.4 质量保证/质量控制
由于OPEs的广泛使用,避免背景污染是检测OPEs的关键步骤。因此,在样品采集、存储、转移和提取等过程中应避免使用塑料和橡胶制品;为了降低OPEs的光降解,采用棕色玻璃瓶。此外,所有玻璃瓶均在450 ℃下煅烧4 h并用丙酮和乙酸乙酯淋洗,锡箔纸覆盖。为了监测方法的背景污染,每检测12个样品插入1个方法空白。
2 结果与讨论
2.1 气相色谱-质谱条件的优化
在全扫描模式下,对500 μg/L的OPEs标准品进行分析,通过调整色谱柱升温程序、载气流速和进样模式等参数,基本实现了15种OPEs(13种目标化合物、2种内标化合物)的基线分离。
在最优的气相色谱条件下,获得15种OPEs的色谱保留时间,并以相对丰度高和质量数大为标准选择每个OPE的母离子。然后,主要优化共振激发电压和“q”值两个离子阱二级质谱参数,以获得最优的选择性和灵敏度。其余的二级质谱参数选择默认值,隔离窗为1m/z、隔离时间为12 ms、激发时间为15 ms。
以二级质谱图中含有5%~10%的母离子为标准,优化每个OPE的共振激发电压;为了最大化子离子的丰度,优化每个OPE的“q”值。最优的二级质谱条件见表1。
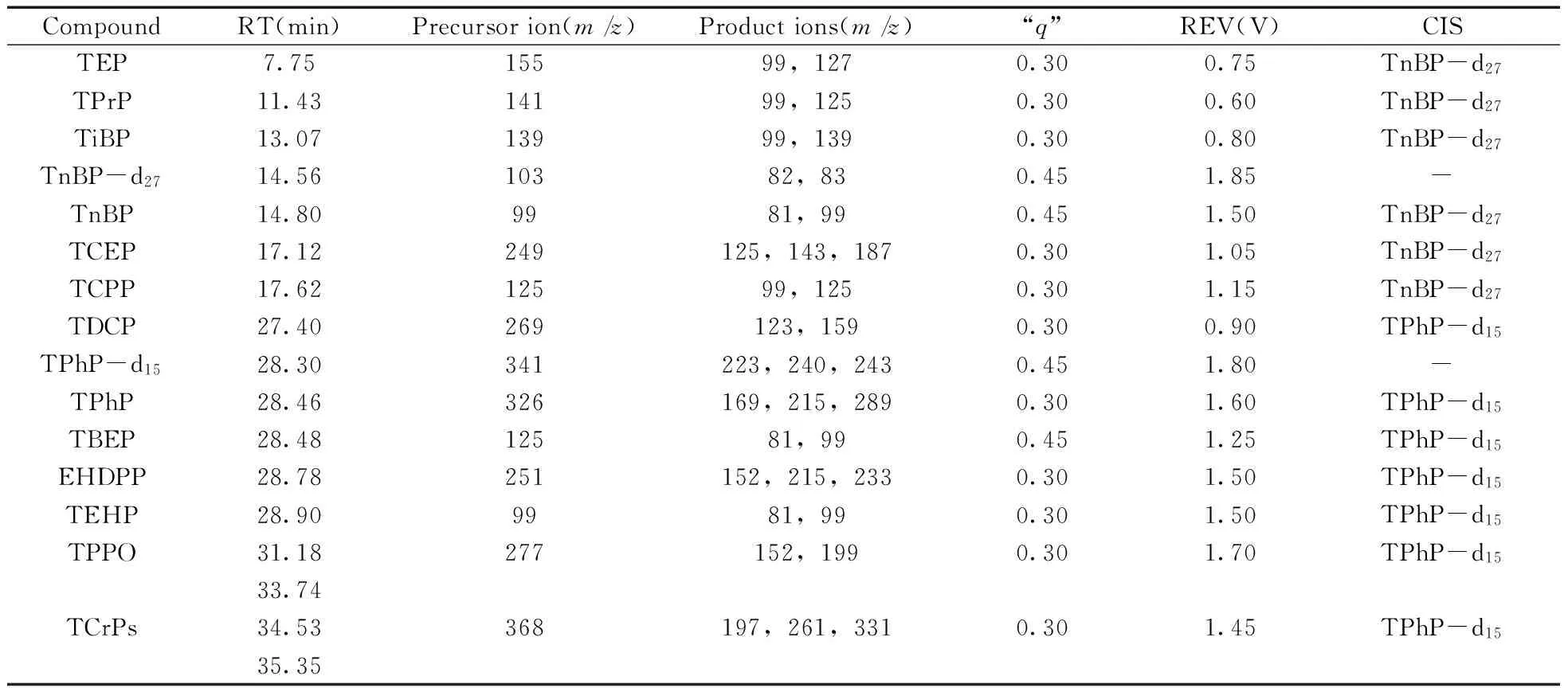
表1 OPEs的保留时间、母离子、子离子、“q”值、共振激发电压和相应的内标化合物Table 1 Retention time(RT),precursor and product ions,“q” value,resonant excitation voltage(REV) and corresponding internal standards(CIS)
2.2 萃取与净化方法的优化
2.2.1净化材料与萃取溶剂的选择由于OPEs的萃取和净化同时进行,所选择的萃取溶剂需要既能从植物样品中有效萃取出目标化合物,也能从净化材料中有效洗脱出目标化合物,同时少洗脱出干扰物质;所选择的净化材料需要达到净化目的,既能使吸附的目标化合物被萃取溶剂洗脱,也能使吸附的干扰物质少被洗脱出。因此,净化材料和萃取溶剂的选择需同时进行。此外,为了在萃取池中形成有效的净化层,本研究添加的净化材料质量为5 g。
植物样品中含有大量的色素类物质,严重干扰目标化合物的检测,常规的净化材料如硅胶、弗罗里硅土等不能有效去除这类物质,而活性炭具有较强的吸附能力,能有效吸附色素类物质,同时也对目标化合物具有较强的吸附作用。因此,本研究首先选用活性炭作为净化材料,考察常用的萃取溶剂正己烷-丙酮(1∶1,体积比)、正己烷-二氯甲烷(1∶1,体积比)、二氯甲烷、二氯甲烷-乙酸乙酯(1∶1,体积比)与乙酸乙酯的萃取和净化效果。结果表明,正己烷-二氯甲烷(1∶1)对TBEP的萃取效果较差,加标回收率仅为67.3%,并且萃取液的颜色深黄;二氯甲烷对TBEP和TEHP的萃取效果较差,加标回收率分别为62.9%和51.2%;正己烷-丙酮(1∶1)、二氯甲烷-乙酸乙酯(1∶1)和乙酸乙酯对13种OPEs的萃取效果相近,但二氯甲烷-乙酸乙酯(1∶1)和乙酸乙酯的萃取液呈深黄色,不利于GC-MS检测,而正己烷-丙酮(1∶1)的萃取液颜色较浅且清澈。因此,选择正己烷-丙酮(1∶1)作为萃取溶剂。
为去除植物样品中的其它干扰物质,本研究考察了常用的净化材料硅胶、中性氧化铝、弗罗里硅土、PSA以及硅胶-中性氧化铝(1∶1,质量比)的萃取和净化效果。结果表明,当选用中性氧化铝作为净化材料时,TCEP、TPPO和TCrPs的回收率较低,分别为45.9%、45.3%和49.3%;当选用弗罗里硅土作为净化材料时,TEHP的回收率较低,仅为57.0%;当选用PSA作为净化材料时,TEP、TEHP和TPPO的回收率较低,分别为61.5%、62.6%和65.6%;当选用硅胶-中性氧化铝(1∶1)作为净化材料时,TPhP、TEHP和TCrPs的回收率较低,分别为55.1%、57.9%和60.6%;而当选用硅胶作为净化材料时,13种OPEs的回收率较好,均大于70%。因此,选用硅胶作为净化材料。
2.2.2加速溶剂萃取条件的优化首先,本研究考察了萃取温度(60、80、100、120、140 ℃)对萃取和净化效果的影响,结果如图1所示。当萃取温度为140 ℃时,萃取液呈黑色,为了不影响GC-MS的性能,140 ℃条件下的萃取液未检测。从图1可以看出,当萃取温度为60 ℃和80 ℃时,TPrP和TCrPs的回收率均较低,分别为66.1%、65.9%和61.6%、62.2%,其它OPEs的回收率与100、120 ℃时差异不大。当萃取温度为100 ℃和120 ℃时,13种OPEs的回收率均无显著差异,回收率为68.2%~91.9%,满足痕量分析的要求;但是120 ℃时萃取液的颜色较深,并且萃取温度越高消耗的能量越多。因此,本研究选择萃取温度为100 ℃。

图1 不同萃取温度下的萃取净化效果(n=3)Fig.1 Recoveries of organophosphate esters at different extraction temperatures(n=3)
考察了静态萃取时间(5、10、15、20 min)对萃取和净化效果的影响(图2)。结果表明,当静态萃取时间为5 min时,仅TPrP的回收率较低,为66.2%。静态萃取时间为10、15、20 min时,13种OPEs的回收率无显著差异,回收率为73.7%~88.2%,满足痕量分析的要求。因此,为了缩短分析时间,本研究选择静态萃取时间为10 min。
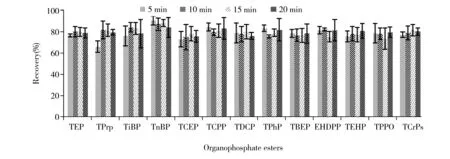
图2 不同静态萃取时间下的萃取净化效果(n=3)Fig.2 Recoveries of organophosphate esters at different extraction times(n=3)
最后,本研究考察了循环次数(1、2、3次)对萃取和净化效果的影响。结果表明,当循环次数为1次时,TEP、TCEP和TBEP的回收率较差,分别为46.3%、56.0%和51.4%。循环次数为3次时,13种OPEs的回收率与循环2次相比并未显著增加。因此,为了减少有机溶剂的用量,本研究选择循环次数为2次。
2.3 方法评价
2.3.1背景污染为了监测方法的背景污染,通过多次萃取,制作空白植物样品,并且每分析12个样品插入1个方法空白。结果显示,该方法的背景污染很低,低于方法检出限。因此,在实际检测中可忽略背景污染。
2.3.2方法的线性范围、检出限与定量下限选用TnBP-d27和TPhP-d15作为内标化合物,质量浓度均为200 μg/L,采用内标法对13种OPEs进行定量,不同的目标化合物对应不同的内标化合物(见表1)。
配制7个不同浓度的13种OPEs混合标准溶液进行测定,每个浓度重复3次,以目标化合物与内标化合物的峰面积比为纵坐标、目标化合物的浓度为横坐标,进行线性回归分析,得到13种OPEs的线性范围和相关系数。结果如表2所示,13种OPEs的线性关系良好,相关系数均大于0.99。
依据美国环保局联邦法规法典第40部分第136节附录B[17]计算方法检出限。按照本方法萃取和检测8个加标水平为5 ng/g的空白加标植物样品,计算标准偏差。方法检出限为3倍的标准偏差,方法定量下限为10倍的标准偏差。结果如表2所示,13种OPEs的方法检出限为0.79~2.27 ng/g,方法定量下限为2.65~7.59 ng/g。
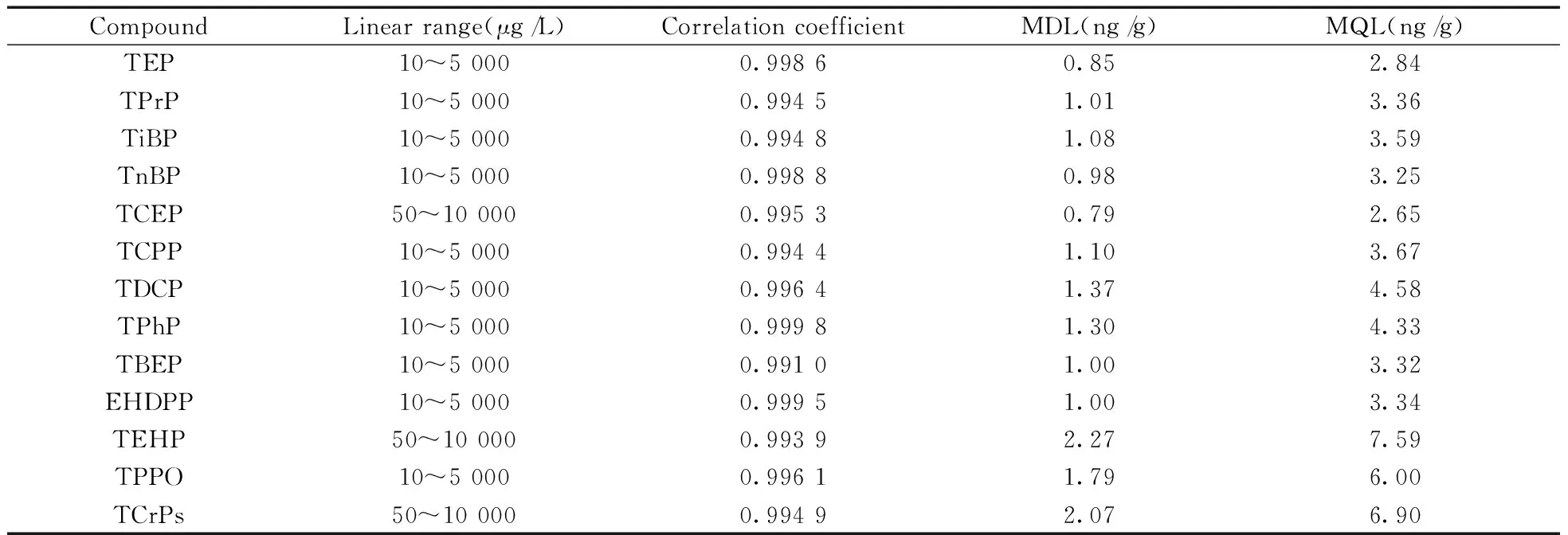
表2 方法的线性范围、相关系数、检出限和定量下限Table 2 Linear range,correlation coefficient,method detection limit(MDL) and method quantitation limit(MQL)
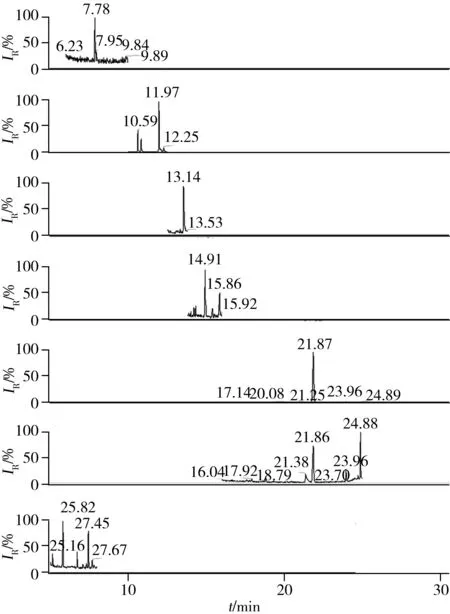
2.3.3方法的回收率与精密度在植物样品中分别添加一定浓度的13种OPEs混合标准品,加标水平分别为5、25、50 ng/g,每个水平平行测定7次,计算回收率和相对标准偏差(RSD)。结果如表3所示,13种OPEs的回收率为76.9%~113.0%,RSD为2.0%~14.6%,基本满足痕量分析的要求。图3为添加水平为25 ng/g的植物样品的GC-MS/MS色谱图。
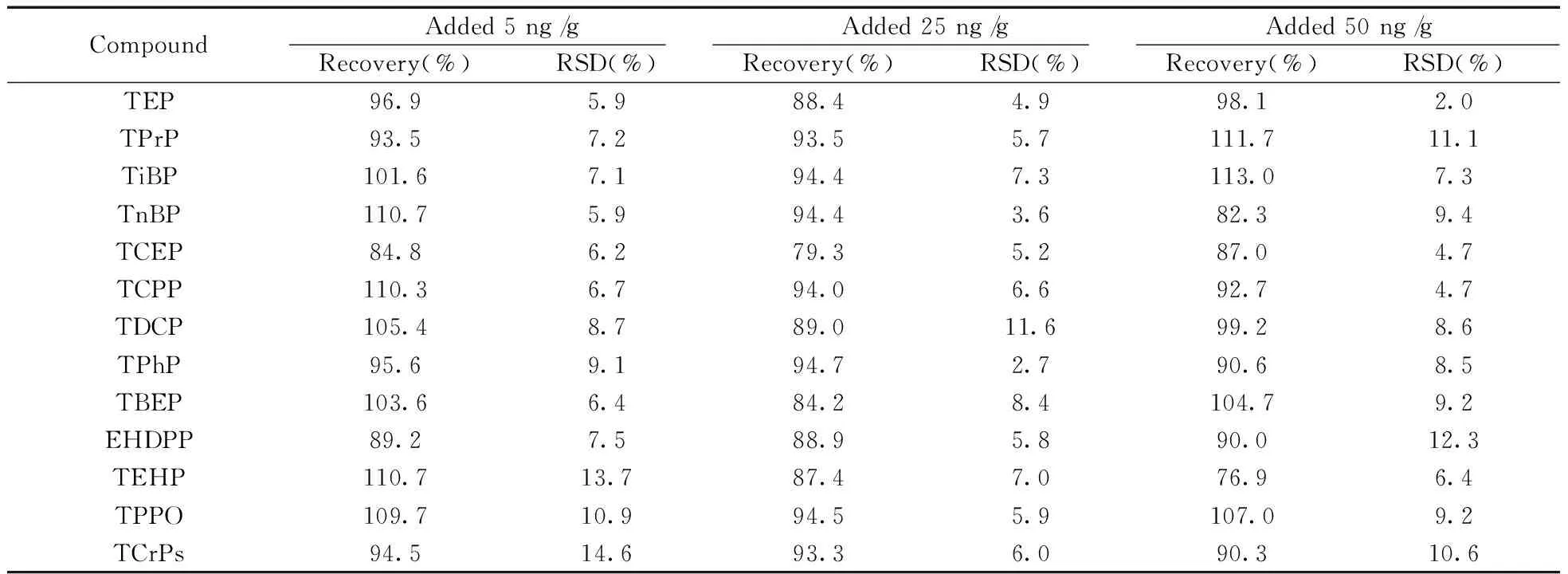
表3 不同加标水平下方法的回收率和精密度(n=7)Table 3 Recoveries and precision of method(n=7)

图3 添加水平为25 ng/g的植物样品的GC-MS/MS色谱图
Fig.3 GC-MS/MS chromatograms of 13 OPEs obtained for the spiked plant sample(25 ng/g)
2.4 实际样品分析
采用本方法对沈阳市沈北新区某地膜上的小白菜样品进行分析,结果显示13种OPEs均有检出。其中,TiBP、TnBP、TCPP、TDCP、TPhP、TBEP和EHDPP的含量分别为3.76、4.08、4.03、4.85、4.56、3.64、3.51 ng/g,TEP、TPrP、TCEP、TEHP、TPPO和TCrPs的含量均在方法检出限与定量下限之间。图4为该小白菜样品的GC-MS/MS色谱图。
3 结 论
本文建立了同时加速溶剂萃取和净化、气相色谱-离子阱二级质谱检测植物中13种有机磷酸酯阻燃剂/增塑剂的分析方法。实验优化了气相色谱分离条件和离子阱二级质谱参数,在最佳条件下的方法学评价结果表明,该方法具有较好的准确度和精密度,13种有机磷酸酯的加标回收率为76.9%~113.0%,相对标准偏差为2.0%~14.6%,检出限为0.79~2.27 ng/g,定量下限为2.65~7.59 ng/g。该方法前处理简单、分析时间短、有机溶剂消耗量少,可用于植物样品中有机磷酸酯类阻燃剂/增塑剂的快速、准确检测。
[1] Makinen M S E,Makinen M R A,Koistinen J T B,Pasanen A L,Pasanen P O,Kalliokoski P J,Korpi A M.Environ.Sci.Technol.,2009,43(3):941-947.
[2] Xia C H,Lam J C,Wu X G,Sun L G,Xie Z Q,Lam P K.Chemosphere,2011,82(1):18-24.
[3] European Flame Retardants Association(EFRA).Keeping Fire in Check in Building and Construction,[2012-03].
[4] Farhat A,Crump D,Chiu S,Williams K L,Letcher R J,Gauthier L T,Kennedy S W.Toxicol.Sci.,2013,134(1):92-102.
[5] Meeker J D,Stapleton H M.Environ.HealthPerspect.,2010,118:318-323.
[6] Yan X J,He H,Peng Y,Wang X M,Gao Z Q,Yang S G,Sun C.Chin.J.Anal.Chem.(严小菊,何欢,彭英,王晓萌,高占啟,杨邵贵,孙成.分析化学),2012,40(11):1693-1697.
[7] Li C X,Zhao X L,Gao L H,Shi Y L,Tan W Q,Cai Y Q.J.Instrum.Anal.(李闯修,赵晓丽,高立红,史亚利,谭伟强,蔡亚岐.分析测试学报),2016,35(2):194-199.
[8] Wang R M.PreliminaryStudyofOrganophosphateEsterFlameRetardantsinRiversaroundtheBohaiSea.Yantai:Yantai Institute of Coastal Zone Research,Chinese Academy of Sciences(王润梅.环渤海主要入海河流有机磷酸酯阻燃剂的初步研究.烟台:中国科学院烟台海岸带研究所),2015.
[9] Gao L H.OccurrenceandDistributionofOrganophosphateEstersintheUrbanAreaofBeijing.Beijing:University of Science and Technology Beijing(高立红.北京市城市环境有机磷酸酯污染水平和分布特征研究.北京:北京科技大学),2016.
[10] Yin H L,Li S P,Ye Z X,Liang J F,You J J.ActaSci.Circum.(印红玲,李世平,叶芝祥,梁金凤,游俊杰.环境科学学报),2016,36(2) :606-613.
[11] Yang F X,Ding J J,Huang W,Xie W,Liu W P.Environ.Sci.Technol.,2014,48(1):63-70.
[12] Salamova A,Hermanson M H,Hites R A.Environ.Sci.Technol.,2014,48(11):6133-6140.
[13] Garcia M,Rodriguez I,Cela R.J.Chromatogr.A,2007,1152:280-286.
[14] Chu S G,Letcher R J.Anal.Chim.Acta,2015,885:183-190.
[15] Aragón M,Marcé R M,Borrull F.Talanta,2012,101(1):473-478.
[16] Ma Y,Hites R A.J.MassSpectrom.,2013,48:931-936.
[17] USEPA.EPA Regulation 40 CFR Part 136(Appendix B) Appendix B to Part 136 — Definition and Procedure for the Determination of the Method Detection Limit—Revision 1.11.US Environmental Protection Agency(EPA).Available at http://www.ecfr.gov/.[2013].
