发酵有机肥对主养草鱼池塘水质调控效果研究
2018-01-24季英杰陈杰玉王海鹏缑敬伟何绪刚
季英杰 邓 闵 陈杰玉 王海鹏 缑敬伟 何绪刚,
(1. 华中农业大学水产学院, 武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 3. 池塘健康养殖湖北省工程实验室, 水产养殖国家级实验教学示范中心(华中农业大学),武汉 430070)
当前, 我国精养池塘普遍面临着水质劣化、调控效果差等环境问题。一个重要原因是饲料中氮素转化成为鱼肉的效率通常不高[1], 未被鱼类利用的有机态氮素逐渐矿化成为氨氮, 进而氧化成为亚硝态氮、硝态氮等无机形态。其中, 氨氮和亚硝态氮对鱼类等水生生物有强毒性[2]。在养殖中后期,随着投饲量逐渐增加, 常引起氨氮、亚硝态氮等有害氮素过量堆积[3,4], 不仅导致水体营养失衡, 藻类单一化, 水质易波动, 而且有害氮素直接毒害鱼类,降低鱼类免疫力, 频繁暴发病害[2,5]。这是目前我国精养池塘普遍遇到的共性问题。因此, 精养池塘水质调控应重点考虑如何抑制过高浓度有害氮素产生、如何均衡主要营养元素含量等。所以, 研究高密度放养、大量投饲精养池塘水质调控方式方法十分必要。
发酵有机肥不仅富含浮游植物生长所必须的营养元素, 而且富含蛋白酶、淀粉酶、脂肪酶和磷酸酶等胞外酶, 以及乳酸菌、芽孢杆菌等有益微生物, 可加速分解水中有机质, 改良水体环境[6], 抑制水体中有害菌的繁殖生长[7], 因而成为精养池塘兼具肥效的“微生态制剂”。但目前鲜见关于发酵有机肥调控水质的研究报道。本研究通过监测发酵有机肥定期使用后水质理化指标、浮游生物群落结构及水体微生物丰度等变化, 以评价发酵有机肥抑制高浓度有害氮素产生、改善水体环境效果, 研究结果为指导精养池塘合理使用发酵有机肥调控水质提供参考和借鉴。
1 材料与方法
1.1 实验池塘与材料
实验于2015年7月至2016年6月在湖北省荆州市公安县崇湖渔场华中农业大学实验示范基地进行。选择基地6口草鱼(Ctenopharyngodon idellus)主养池塘为研究对象, 其中3口为对照池塘(1#、2#和3#), 3口为实验池塘(12#、13#、14#), 6口池塘日常管理一致, 只是实验池塘定期施放发酵有机肥。6口池塘面积均为3000 m2, 水深1.5—2.0 m, 各池配备一台投饵机和一台1.5 kw增氧机。6口池塘放养量一致, 均放养2龄草鱼种, 规格1.5—1.8 kg/尾,放养量为900 kg/池, 花鲢(Aristichthys nobilis)50 kg/池, 规格500—600 g/尾; 白鲢(Hypophthalmichthys molitrix)300 kg/池, 规格200—300 g/尾。草鱼成鱼饲料为荆州大海饲料有限公司提供的海大708型饲料, 每天投喂量80 kg/池, 阴雨天酌情减量投喂。实验用发酵有机肥由湖北炎农生物科技有限公司提供。实验开始前测定发酵生物肥总氮、总磷及有益微生物占总微生物量的比例(总氮8.60%、总磷2.28%、芽孢杆菌11%、乳酸菌58.57%)。
1.2 实验设计
实验塘每月施发酵有机肥一次, 每次40 kg/池,施肥时将有机肥加到船舱加入池水混匀后全池均匀泼洒, 连续晴天时间段施肥, 阴雨天不施肥。具体施肥时间为: 2015年7月20日、8月10日、9月13日, 10月4日以及2016年4月11日、5月7日、6月10日。每月采样1次, 用于浮游生物、水质理化指标和细菌丰度检测; 细菌种类检测只在施肥前期(2015年7月31日)和施肥中后期(2015年10月9日)进行。
1.3 实验采样与分析
选择晴天上午10:00采样, 具体采样时间为:2015年7月31日、8月26日、9月20日、10月9日以及2016年4月27日、5月24日、6月24日。采样点为池塘4个角及对角线交叉点, 四角点离池边1 m, 采集水面下50 cm、池底以上50 cm的混合样。水样取自5个样点等体积混合后用于各指标的测定。水化指标: 温度、溶解氧(DO)、pH采用美国YSI便携式水质分析仪现场测定, 测试点为水面下50 cm处;亚硝态氮(-N)、硝态氮(-N)、铵态氮(-N)、可溶性磷酸盐(-P)、总磷(TP)和总氮(TN), 按照水质理化指标国标方法进行测定[8]。浮游动植物定性、定量, 样品采集与分析参考《淡水浮游生物研究方法》[9], 根据文献[10, 11]计数浮游动植物的种类和密度。细菌丰度测定参照李博[12]、郑天凌等[13]方法进行; 细菌种类使用MiSeq高通量测序方法进行判别, 具体方法和步骤如下: 首先提取水样细菌总DNA[14], 设计并合成引物接头(测序区域: V3+V4: 338F-806R), PCR采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase进行PCR扩增, MiSeq PE文库的制备, 最后进行MiSeq高通量测序[15]。
1.4 数据处理及分析
计算浮游动植物优势度Y(采用Y>0.02作为优势种判别标准)[16]、Shannon-Wiener多样性指数[17]、Margalef丰富度指数[18]和Pielou均匀度指数[19]。组间差异性检验使用SPSS19.0软件, 以P<0.05表示具有显著性差异。结果以平均数±标准差(MS±SD)表示。使用graphpad prism 6.0作图。
2 结果
2.1 水体理化指标
总体上, 实验塘和对照塘水质各理化指标变化趋势基本相同。实验期间实验塘与对照塘水温基本一致, 变幅均为21.6—32.2℃。实验塘、对照塘DO养殖前期(4、5月份)均高于养殖中后期(6—10月份), 且相同时间点实验塘DO均高于对照塘,4月份及7—10月份差异达到显著水平(P<0.05)(图1a)。pH的变化范围在6.65—8.51, 实验塘与对照塘pH除6、7月份以外, 其余月份差异不显著(P>0.05)(图1b);-N整体呈现持续上升趋势, 实验塘上升幅度要低于对照塘实验塘-N浓度, 8—10月份显著低于对照塘(P<0.05), 4—7月份两者无显著差异(P>0.05)(图1c);-N整体呈现先升后降趋势, 8月份为转折点, 实验塘-N浓度8月份显著低于对照塘(P<0.05), 其他时间段两者无显著差异(P>0.05)(图1d); TN、TP、-N、-P实验塘与对照塘变化趋势相同且各时间节点均无显著差异(P>0.05), 4—10月TN、TP呈逐渐升高趋势;-N是先升后降, 8月份是转折点;-P整体呈上升态势, 只在8月份出现小的转折(图1e—h)。
2.2 浮游植物群落结构
浮游植物种类、优势种及多样性实验期间共检出浮游藻类6门49属96种, 分属于蓝藻门、绿藻门、裸藻门、甲藻门、隐藻门和硅藻门; 实验组池塘共检出86种, 对照池塘检出73种, 名录见表 1。
对照池塘优势种有6种: 球衣藻Chlamydomonas globoza、绿色裸藻Euglena viridis、鱼形裸藻Euglena pisciformis、尖针杆藻Synedra acus、啮蚀隐藻Cryptomonas erosa、卵形隐藻Cryptomonas ovata; 实验池塘优势种相同, 但缺少尖针杆藻(表 2);优势种分属于绿藻门、裸藻门、隐藻门。球衣藻、啮噬隐藻和卵形隐藻多出现在4、5和6月份;绿色裸藻和鱼形裸藻在8、9月份出现最多。
在实验期间, 实验塘Shannon-Wiener多样性指数、Margalef丰富度指数和Pielou均匀度指数各时间节点均高于对照塘; 实验塘的Shannon-Wiener指数、Margalef指数和Pielou指数各月份之间的波动幅度均小于对照塘(表 3)。实验塘Shannon-Wiener指数、Margalef指数和Pielou指数7个月份的平均值(分别为2.62±0.26、3.66±0.35、0.45±0.03)均高于对照塘(1.93±0.32、3.03±0.22、0.36±0.05)。
浮游植物的密度和生物量在实验期间, 对照塘浮游植物密度的变化范围是(1.07—3.63)×107ind./L, 实验塘的变化范围是(2.31—7.93)×107ind./L; 实验塘月平均生物量 (68.21±25.13) mg/L是对照塘(24.51±12.10) mg/L的2.78倍。对照塘生物量养殖前期(4—6月份)较高, 养殖中后期(7—10月份)较低; 实验塘生物量除6月份略高于对照塘外, 其他各月份均显著高于对照塘(P<0.05)(图2)。
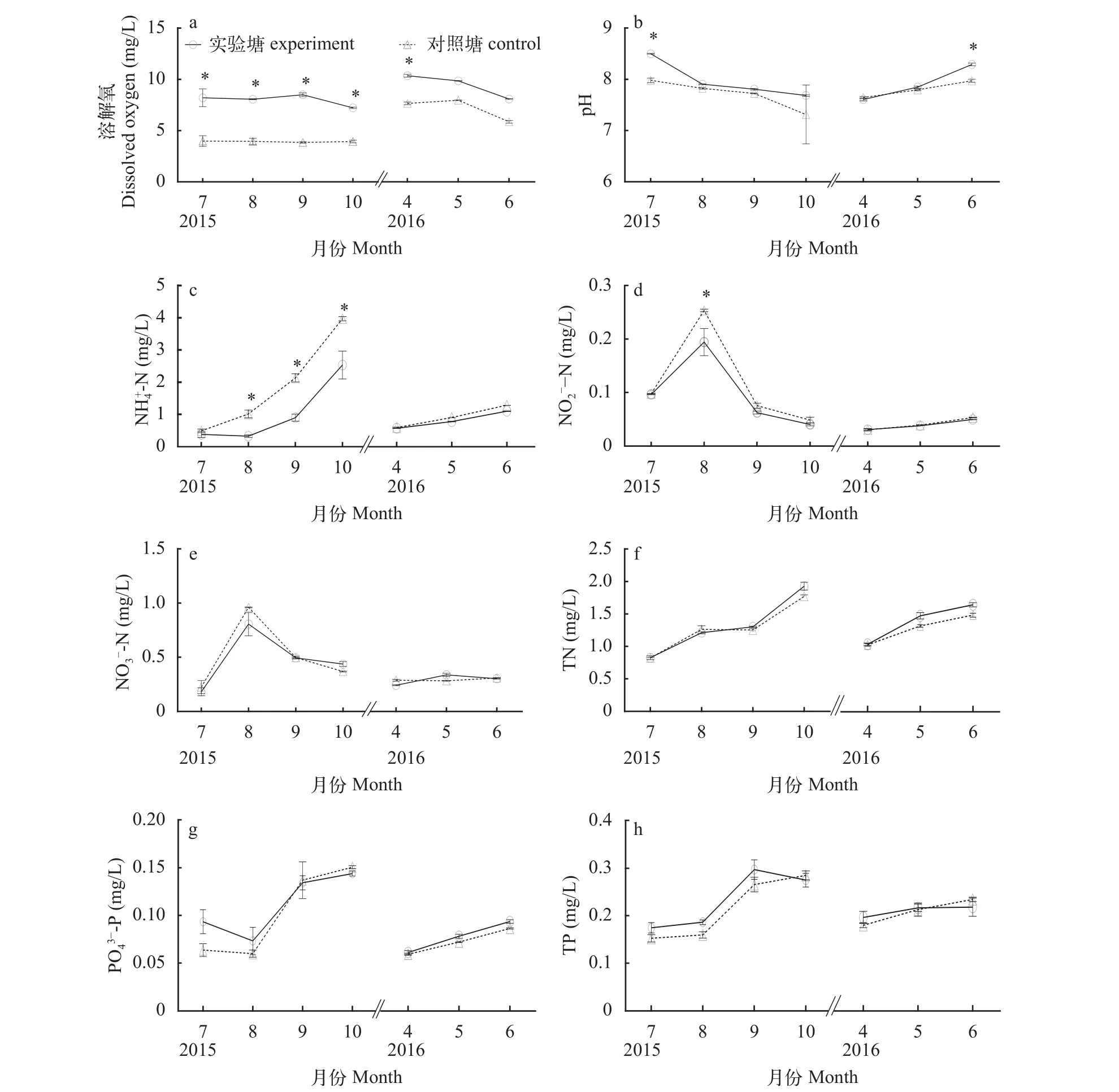
图1 各月份水化指标Fig. 1 Monthly hydration index
2.3 浮游动物群落结构
浮游动物种类、优势种共检出原生动物17属20种, 轮虫13属21种, 枝角类2属2种和桡足类2属2种(表 4), 原生动物、轮虫、枝角类和桡足类
种类数分别占总动物种类数的44.44%、46.67%、4.45%和4.45%。

表 1 实验期间检出的浮游植物种类Tab. 1 Phytoplankton species during the experiment
浮游动物优势种有原生动物包括: 小单环栉毛虫、尾泡焰毛虫、滚动焰毛虫、肾形肾形虫、梨形四膜虫、绿草履虫、旋回侠盗虫、绿急游虫, 轮虫包括: 针簇多肢轮虫、前节晶囊轮虫、萼花臂尾轮虫、角突臂尾轮虫、暗小异尾轮虫(表 5)。
浮游动物生物量实验期间, 实验塘、对照塘浮游动物生物量分别波动于2.28—21.91 mg/L和0.66—6.28 mg/L, 实验塘平均生物量(9.83±5.74) mg/L是对照塘(2.26±1.49) mg/L的4.35倍。实验塘浮游动物生物量各月份显著高于对照塘(P<0.05)(图3)。在浮游动物中, 轮虫比重最大, 实验塘轮虫月平均生物量(8.46±5.54) mg/L明显高于对照塘轮虫生物量(1.54±1.20) mg/L, 其次是原生动物, 枝角类和桡足类数量最少。对照塘4—7月动物生物量逐渐升高, 而后降低, 10月份略有增加; 实验塘4—6月份逐渐降低, 7月份生物量突然增加, 而后逐渐降低,10月份数量增加达到最大值。
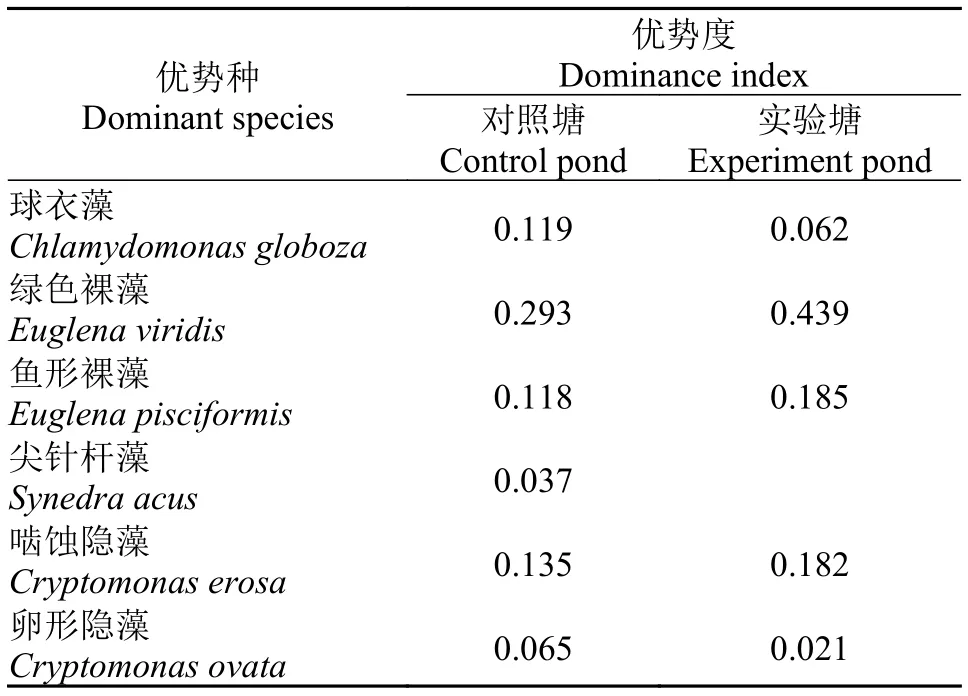
表 2 浮游植物主要优势种的优势度(Y>0.02)Tab. 2 Dominance index of dominant species of phytoplankton
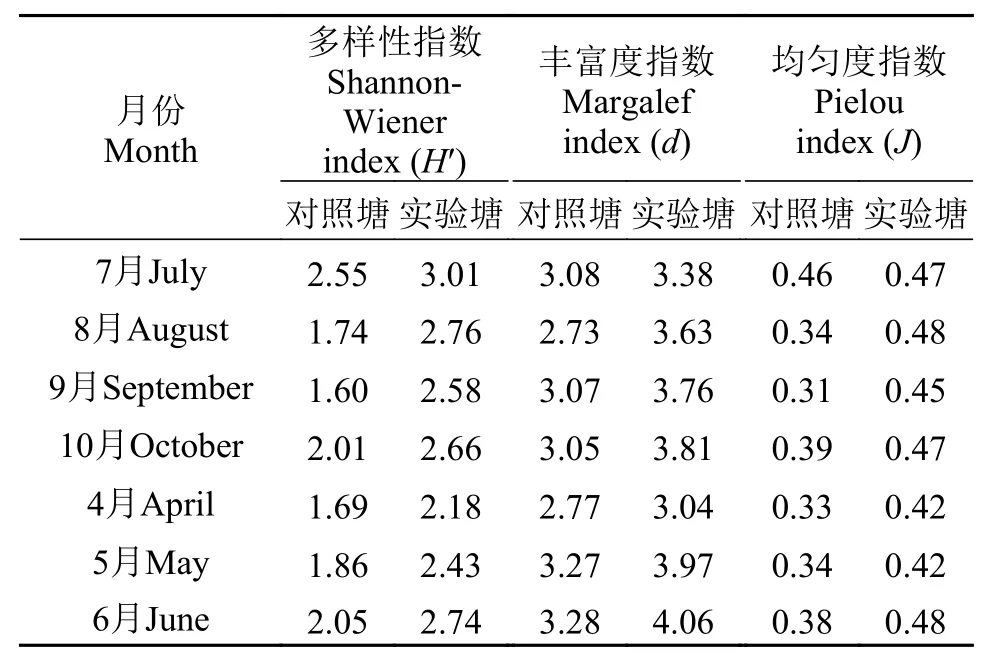
表 3 浮游植物的多样性指数Tab. 3 Diversity index of Phytoplankton
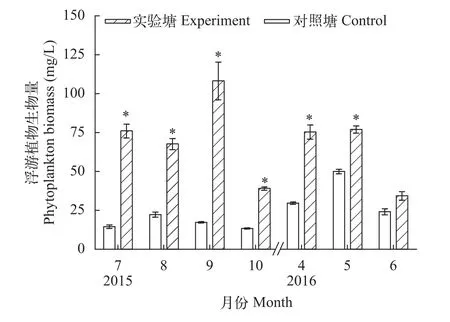
图2 浮游植物生物量Fig. 2 Phytoplankton biomass
2.4 水体细菌种类和丰度
细菌种类池塘水体中共检出细菌13门101属, 其中变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)占优势(图4a); 相对丰度较高的属为乳酸菌属(Lactococcus)、芽孢杆菌属(Bacillus)、鲸杆菌属(Cetobacterium)、蓝细菌(Cyanobacteria)、气单胞菌属(Aeromonas)、拟杆菌属(Bacteroides)、节杆菌属(Arthrobacter)、假单胞菌属(Pseudomonas)、12up、聚球藻属(Synechococcus)和亚硝化单胞菌属(Nitrosomonas)。发酵有机肥对有益菌增殖有显著促进作用, 施肥后期, 实验塘乳酸菌属、芽孢杆菌属、鲸杆菌属、节杆菌属、亚硝化单胞菌属相对丰度分别为(0.61±0.17)%、(0.89±0.29)%、(0.20±0.031)%、(0.04±0.0082)%和(0.34±0.037)%,分别是对照塘的3倍、3倍、2倍、4倍和1.42倍(图4b)。发酵有机肥未引起气单胞菌等致病菌相对丰度增高, 施肥后期, 实验塘气单胞菌属相对丰度为(0.11±0.037)%, 对照塘为(0.10±0.016)%, 两者差异不显著(图4b)。
细菌丰度实验期间, 实验塘和对照塘细菌丰度变化趋势相同, 均表现为养殖前期(4—6月份)较低, 养殖中后期(7—10月份)较高(图5)。发酵有机肥显著增加了细菌丰度: 实验塘细菌丰度6、8、9、10月份均显著高于对照塘(P<0.05)(图5)。在实验期间, 实验塘细菌平均丰度为(6.53±2.13)×106ind./mL, 对照塘为(5.05±2.10)×106ind./mL, 实验塘是对照塘的1.29倍。
3 讨论
3.1 发酵有机肥对水质的改善作用
实验结果表明, 发酵有机肥对养殖中后期池塘
水体较高浓度的铵态氮和亚硝态氮有显著平抑作用。在养殖前中期(4—7月份), 池塘水体-N浓度一直处于较低水平(<1 mg/L), 但到了养殖中后期(8—10月份), 水体中-N浓度快速上升, 此时,实验塘-N浓度却显著低于对照塘(图1c), 表明发酵有机肥对髙浓度-N的抑制作用显著。同样地, 在-N浓度不高(<0.01 mg/L)的时间段, 实验塘-N浓度与对照塘变化趋势相同且差异不显著, 但在-N浓度飙升的8月份, 实验塘-N浓度则显著低于对照塘(图1d), 表明发酵有机肥对髙浓度-N的抑制作用也很显著。池塘铵态氮主要来源于有机物矿化分解及生物代谢排氨, 而亚硝态氮主要经氨氧化而来[20]。发酵有机肥抑制-N及-N浓度的途径主要有三条。一是通过增加浮游植物丰度, 促进浮游植物吸收利用-N。对照塘4—6月份浮游植物生物量维持较高水平(21.64—52.34 mg/L)(图2), 对氨氮吸收作用较强; 而在7—10月份对照塘浮游植物生物量反而降低(12.56—25.34 mg/L), 对氨氮吸收作用减弱, 加之残饵、粪便等积累, 有机物矿化产氨大幅增加等,共同导致水体-N浓度的上升。在发酵有机肥促进下, 实验塘浮游植物生物量一直维持较高水平(图2), 保持了较高的-N吸收率, 促使-N浓度降低。二是通过促进水体异养菌的生长, 强化异养菌吸收利用-N。异养菌可直接吸收利用氨氮合成自身蛋白质[21]。发酵有机肥大幅增加了水体芽孢杆菌和乳酸菌等异养菌丰度, 对-N的降低起到了重要作用。三是通过硝化、反硝化等氮循环途径。养殖期间, 实验塘和对照塘的-N、-N浓度均呈先上升后下降的趋势(图1d, e), 表明池塘水体硝化和反硝化反应均顺利进行。水体中-N、-N主要经硝化作用产生[22], 又经反硝化作用去除[23,24]。一般认为, 硝化作用为耗氧反应(即水体高溶解氧量有利于硝化作用), 而反硝化作用通常发生在厌氧条件下[23]。养殖前期-N浓度实验塘与对照塘无显著差异, 但养殖后期却显著低于对照塘(图1c);-N、-N实验塘变化趋势与对照塘相同且浓度相近, 仅8月份-N浓度显著低于对照塘(图1d, e)。在试验后期检测到实验塘亚硝化单胞菌属平均占比(0.34±0.037)%,是对照塘的1.42倍, 表明发酵有机肥不但不会干扰硝化、反硝化作用, 反而有促进作用。

表 4 实验期间检出的浮游动物种类Tab. 4 Zooplankton species during the experiment
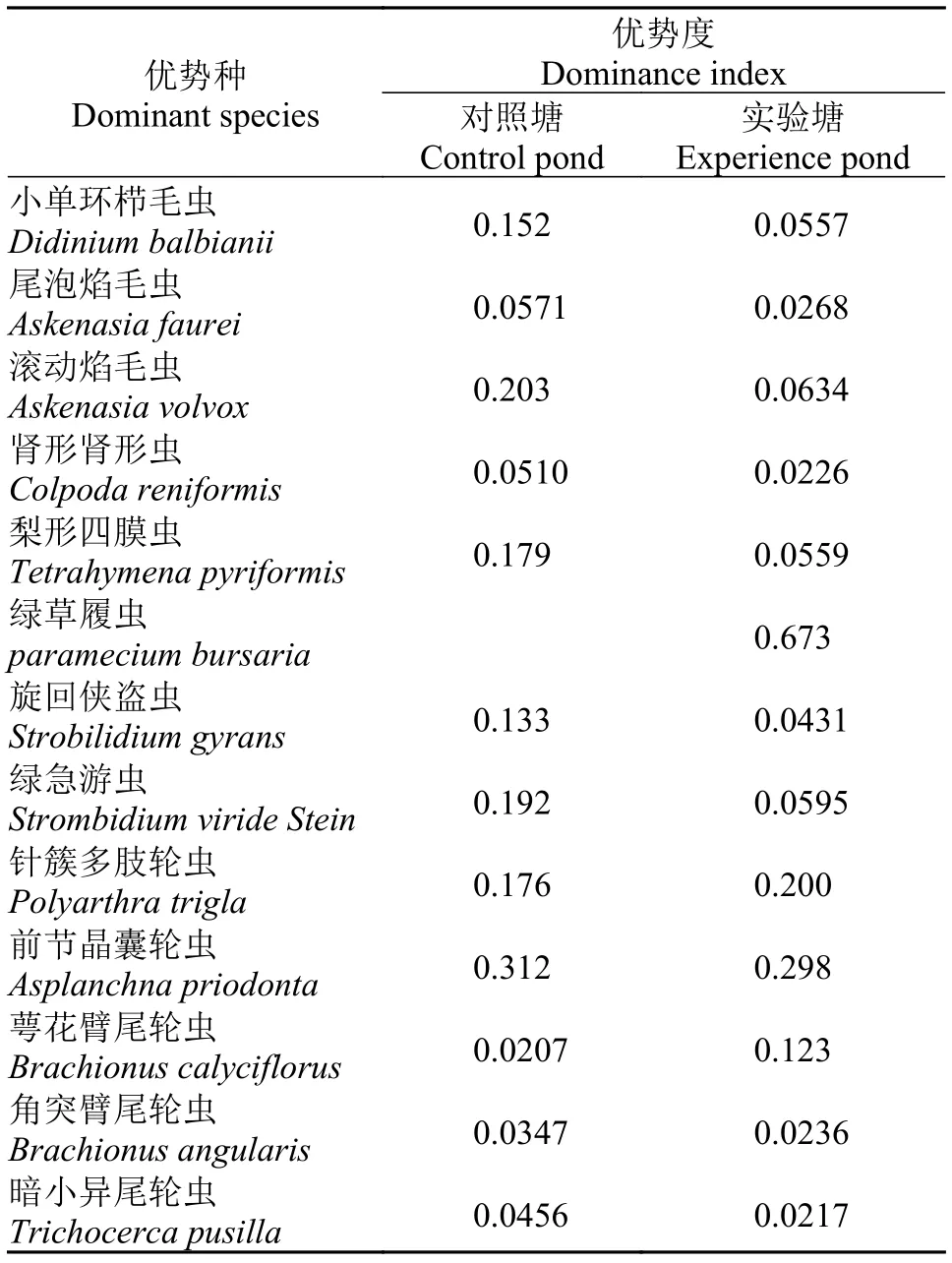
表 5 浮游动物主要优势种的优势度(Y>0.02)Tab. 5 Dominance index of dominant species of zooplankton
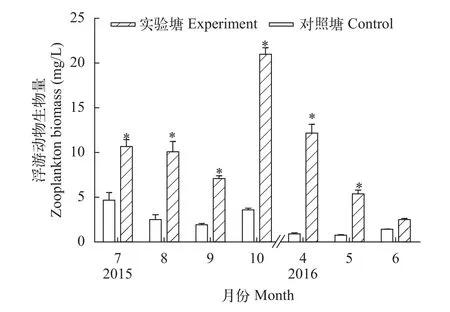
图3 浮游动物生物量Fig. 3 Zooplankton biomass
养殖期间, 实验塘DO均明显高于对照塘(图1a), 说明发酵有机肥增氧效果显著, 原因是其增加了浮游植物生物量(图2), 促进了光合作用产氧量[25]。发酵有机肥对TN、TP、-P和pH等均未产生显著影响(图1), 表明发酵有机肥不会产生水体pH剧烈波动及TN、TP堆积等负面作用。
实验期间, 发酵有机肥增加了浮游动植物种类数量(表 1、表 4), 也增加了浮游植物多样性(表 3),促使浮游生物群落结构更加稳定[26], 不仅对抑制蓝藻等有害水华的爆发十分有益[27], 而且也增进了池塘水质的稳定[28], 进而有助于避免鱼病的暴发。
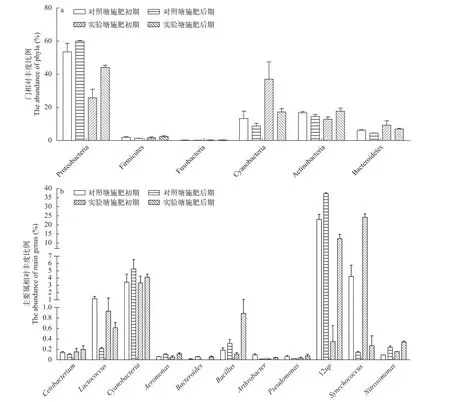
图4 门水平和主要属水平细菌相对丰度Fig. 4 Relative abundance of phyla and main genus (%)
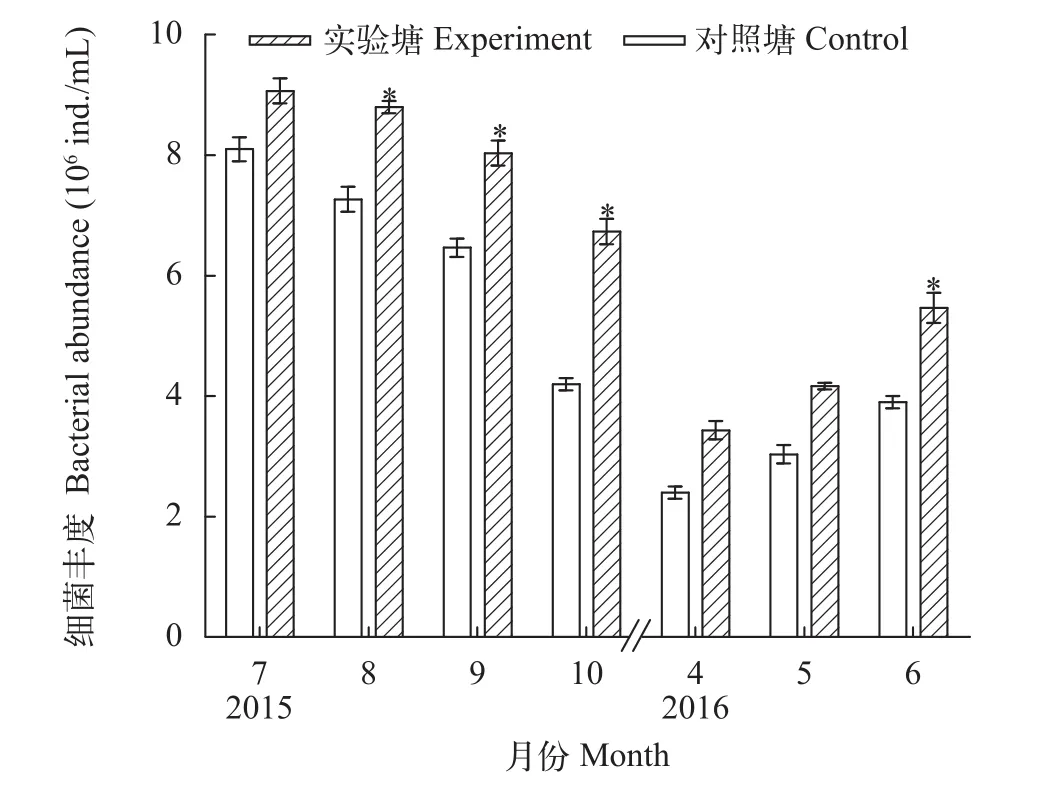
图5 细菌丰度的变化Fig. 5 The dynamics of bacterial abundance
3.2 发酵有机肥的肥水效果
研究结果表明, 发酵有机肥显著增加了浮游生物生物量(图2、图3)和细菌丰度(图5), 表现出了优异的肥水效果, 对加快滤食性鱼类生长、促进滤食性鱼类增产非常有利[29]。有研究指出白鲢易消化的藻类有隐藻、硅藻等[30]。曾青兰[31]指出鲢、鳙可以消化裸藻门中的扁裸藻, 消化率在50%以上。实验发现, 发酵有机肥能有效增加滤食性鱼类所喜食的隐藻和扁裸藻的生物量。本实验混养量白鲢48.91 g/m3、花鲢8.15 g/m3, 实验表明发酵有机肥可以增加浮游生物多样性; 增加实验塘中浮游动物所占比例(试验塘12.59%, 对照塘7.47%), 有利于鳃耙较大的花鲢摄食浮游动物。有研究表明, 鲢的放养量达到50 g/m3可控制水体水华的发生[32], 与本实验的套养比例结果相符。实验发现, 施加发酵有机肥可以增加蓝藻门中平裂藻和蓝纤维藻数量, 而其生物量占比与对照组相比无明显变化, 与韩士群等提出的平裂藻和蓝纤维藻容易被鲢消化[33]的观点相符, 在该混养模式下有利于保证白鲢对藻类的摄食需求。
研究结果发现, 对照塘养殖前期(4—6月份)浮游植物生物量比养殖中后期(7—10月份)高(图2),但浮游动物生物量则刚好相反(图3)。出现这一现象的原因是, 在养殖中后期(7—10月份)水体细菌丰度较养殖前期有大幅增加[34](图5), 为浮游动物提供了大量饵料[35], 弥补了浮游植物饵料资源的不足。养殖中后期细菌丰度大幅增加, 是养殖过程投饲引起池塘有机物大量堆积造成的[36]。发酵有机肥不仅增加了细菌绝对丰度, 而且对有益菌属的乳酸菌属、芽孢杆菌属、鲸杆菌属和节杆菌属等相对丰度增高也有显著促进作用。乳酸菌和芽孢杆菌等数量增加对去除水体高氨氮和亚硝态氮十分有利; 鲸杆菌属是草鱼肠道产B12的主要细菌, 对促进草鱼的消化吸收纤维素十分有益[37]; 节杆菌具有非常强的聚磷能力[38]。有益菌数量增加对抑制病原微生物生长、提高机体免疫力等有一定的积极作用[39—41]。
综上, 发酵有机肥肥效突出, 改善池塘水环境效果显著, 主要表现为: 大幅提升浮游生物生物量和细菌丰度, 尤其促进了鲢鳙等易于消化的种类和数量增加, 提高了池塘初级生产力, 对滤食性鱼类有显著增产作用; 平抑高浓度-N、-N及增氧作用显著; 增加了浮游生物种类与多样性, 促进水质更加稳定; 同时不会引起pH、TN、TP等显著变化。建议: 高密度放养、大量投饲的精养池塘宜定期施放发酵有机肥以改善水质、增进池塘养殖效益。
[1]Li B, Liang X F, Liu L L,et al. Effects of dietary protein levels on growth, feed utilization and the enzymes activity on nitrogen metabolism of grass carp (Ctenopharyngodon idellus) [J].Acta Hydrobiologica Sinica, 2014,38(2): 233—240 [李彬, 梁旭方, 刘立维, 等. 饲料蛋白水平对大规格草鱼生长、饲料利用和氮代谢相关酶活性的影响. 水生生物学报, 2014, 38(2): 233—240]
[2]Yu R L, Nie X P. Toxicity of molecular ammonia & nitrite to fishes and the control measures [J].Journal of Fishery Sciences of China, 1999, 6(3): 73—77 [余瑞兰,聂湘平. 分子氨和亚硝酸盐对鱼类的危害及其对策. 中国水产科学, 1999, 6(3): 73—77]
[3]Gao P, Jiang M, Zhao Y J,et al. Variation rules of water quality and budget of nitrogen and phosphorus in ponds with grass carp as the dominant cultured species [J].Journal of Yunnan Agricultural University, 2009, 24(1):71—77 [高攀, 蒋明, 赵宇江, 等. 主养草鱼池塘水质指标的变化规律和氮磷收支. 云南农业大学学报, 2009,24(1): 71—77]
[4]Yang S P, Qiu D Q. Water quality in the high-density shrimp culturing ponds [J].Aquatic Sciences, 2006, 25(9):459—462 [杨世平, 邱德全. 对虾高密度养殖过程中水质的周期变化与分析. 水产科学, 2006, 25(9):459—462]
[5]Steven R K, Vicki S B, Thomas L M. Effect of acclimation time on nitrite movement across the gill epithelia of rainbow trout: the role of“chloride cells” [J].The Progressive Fish-Culturist, 1982, 44(44): 126—130
[6]Li W F, Deng B, Chen N N,et al. Effects ofBacilluson water quality, growth and antioxidant activity of intestinal mucosa ofCtenpharyngodon idellus[J].Journal of Hydroecology, 2012, 33(1): 65—70 [李卫芬, 邓斌, 陈南南, 等. 芽孢杆菌对草鱼生长和肠粘膜抗氧化功能及养殖水质的影响. 水生态学杂志, 2012, 33(1): 65—70]
[7]He Y J. Study on ammoniaand nitrite reducing in pond using microorganism [D]. Nanjing: Nanjing Agricultural University, 2007 [何义进. 微生态制剂降解养殖水体氨氮及亚硝酸盐的研究. 南京: 南京农业大学. 2007]
[8]HJ 535-2009, People’s Republic of China industry protection standards [S]. Beijing: China Environmental Science Press. 2010 [HJ 535-2009 中华人民共和国行业保护标准. 北京: 中国环境科学出版社. 2010]
[9]Zhang Z S, Huang X F. Research Methods of Freshwater Plankton [M]. 1991, 333—339 [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 1991, 333—339]
[10]Hu H J, Wei Y X. Algal of China, Systematics, Taxonomy and Ecology [M]. Beijing: Science Press. 2006,23—903 [胡鸿钧, 魏印心. 中国淡水藻类—系统、分类及生态. 北京: 科学出版社. 2006, 23—903]
[11]Liu J K. Advanced Hydrobiology [M]. Beijing: Science Press. 1999, 176—223 [刘健康. 高级水生生物学. 北京:科学出版社. 1999, 176—223]
[12]Li B. A preliminary study on bacterial productivity in different grass carp polyculture eco-systems and analysis of bacterial community [D]. Ocean University of China,Qingdao. 2013 [李博. 草鱼混养生态系统细菌生产力和群落结构的实验研究. 中国海洋大学, 青岛. 2013]
[13]Zheng T L, Wang F, Xu M Z,et al. Bacterial production ,biomass and role in microbial loop in Taiwan strait [J].Oceanologia et Limnologia Sinica, 2002, 33(4): 415—423 [郑天凌, 王斐, 徐美珠, 等. 台湾海峡海域细菌产量,生物量及其在微食物环中的作用. 海洋与湖沼, 2002,33(4): 415—423]
[14]Zhang H, Zhou T, Wang Y. Bacterial composition in the intestine of freshwater pearl mussel and co-cultured fishes in an integrated culture pond [J].Acta Hydrobiologica Sinica, 2013, 37(5): 824—835 [张涵, 周涛, 王岩. 综合养殖池塘中三角帆蚌和鱼类肠道细菌的组成. 水生生物学报, 2013, 37(5): 824—835]
[15]Fouhy F, Deane J, Rea M C,et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations [J].PloS One, 2015,10(3): e0119355
[16]Wang Y L, Yuan Q, Shen X Q. Ecological character of phytoplankton in spring in the Yangtze River estuary and adjacent waters [J].Journal of Fishery Sciences of China,2005, 12(3): 300—306 [王云龙, 袁骐, 沈新强. 长江口及邻近水域春季浮游植物的生态特征. 中国水产科学,2005, 12(3): 300—306]
[17]Shannon C E, Weaver W. The Mathematical Theory of Communication [M]. Urbana IL: University of Illinois Press. 1949, 623—656
[18]Ulanowicz R E. Information theory in ecology [J].Computers Chemist, 2001, 25(4): 393—399
[19]Pielou E C. An Introduction to Mathematical Ecology [J].Bioscience, 1971, 24(2): 7—12
[20]Wang W Q, Wen M M, Chai S W. Nitrogenous forms,distribution and environmental impacts in the sediment of aquacutural water columm [J].Aquatic Sciences, 2004,23(1): 29—32 [王文强, 温枚茂, 柴士伟. 养殖水体沉积物中氮的形态、分布及环境效益效应. 水产科学, 2004,23(1): 29—32]
[21]Ebeling J M, Timmons M B, Bisogni J J. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems [J].Aquaculture, 2006, 257(1):346—358
[22]Zhou X P, Wang J G, Xue L X,et al. N and P removal characters of eutrophic water body under planted float [J].Chinese Journal of Applied Ecology, 2005, 16(11):2199—2203 [周小平, 王建国, 薛利红, 等. 浮床植物系统对富营养化水体中氮、磷净化特征的初步研究. 应用生态学报, 2005, 16(11): 2199—2203]
[23]He J Z, Zhang L M. Advances in ammonia-oxidizing microorganisms and global nitrogen cycle [J].Acta Ecologica Sinica, 2009, 29(1): 406—415 [贺纪正, 张丽梅. 氨氧化微生物生态学与氮循环研究进展. 生态学报, 2009,29(1): 406—415]
[24]Li P, Zhang S, Liu D L. Study progress of bacterial aerobic denitrification [J].Journal of Microbiology, 2005,25(1): 60—64 [李平, 张山, 刘德立. 细菌好氧反硝化研究进展. 微生物学杂志, 2005, 25(1): 60—64]
[25]Ibrahim N, Naggar G E. Water quality, fish production and economics of Nile tilapia,Oreochromis niloticus, and African catfish,Clarias gariepinus, monoculture and polycultures [J].Journal of the World Aquaculture Society, 2010, 41(4): 574—582
[26]Garg S K, Bhatnagar A. Effect of different doses of organic fertilizer (cow dung) on pond productivity and fish biomass in stillwater ponds [J].Journal of Applied Ichthyology, 1999, 15(1): 10—18
[27]Pechar L. Long-term changes in fish pond management as‘an unplanned ecosystem experiment’: importance of zooplankton structure, nutrients and light for species composition of cyanobacterial blooms [J].Water Science and Technology, 1995, 32(4): 187—196
[28]Qin J, Culver D A, Yu N. Effect of organic fertilizer on heterotrophs and autotrophs: implications for water quality management [J].Aquaculture Research, 1995, 26(12):911—920
[29]Garg S K, Bhatnagar A. Effect of fertilization frequency on pond productivity and fish biomass in still water ponds stocked withCirrhinus mrigala(Ham.) [J].Aquaculture Research, 2000, 31(5): 409—414
[30]ЛИ Ш H-X O, Б Й ΓO-ДУH. BЫPAЩИBAHИE ПЛAHКTOHA OPΓAHИЧECКИMИ УДOБPEHЯMИ ДЛЯ PЫБHOΓO XOЗЯЙCTBA, 1956, (2): 200—208[黎尚豪, 白国栋. 施用有机肥料以繁殖浮游生物. 水生生物集刊, 1956, (2): 200—208]
[31]Zeng Q L. Study on the digestion of phacus byHypophthalmichthus molithixandAristichthys nobilis[J].Journal of Anhui Agricultural Sciences, 2001, 29(4):549—552 [曾青兰. 鲢、鳙鱼对扁裸藻消化利用的研究.安徽农业科学, 2001, 29(4): 549—552]
[32]Han S Q, Fan C X, Yan S H. Study on the plankton communities and its biomanipulation in the eutrophicated beach ponds [J].Acta Hydrobiologica Sinica, 2006,30(3): 344—348 [韩士群, 范成新, 严少华. 滩涂富营养池塘中浮游生物种群结构及其生态调控研究. 水生生物学报, 2006, 30(3): 344—348]
[33]Han S Q, Zhang Z H, Yan S H,et al. Population and biomass of algae in embanked fish pond ecosystem along coastal area [J].Acta Hydrobiologica Sinica, 2001, 25(4):317—323 [韩士群, 张振华, 严少华, 等. 海涂围滩养鱼生态系统中藻类种群和生物量的研究. 水生生物学报,2001, 25(4): 317—323]
[34]Qin J, Culver D A, Yu N. Effect of organic fertilizer on heterotrophs and autotrophs: implications for water quality management [J].Aquaculture Research, 1995, 26(12):911—920
[35]Li H B, Yang Q, Zhou F. Research advances on microbial food loop in marine ecosystem [J].Marine Environmental Science, 2012, 31(6): 927—932 [李洪波, 杨青, 周峰. 海洋微食物环研究新进展. 海洋环境科学, 2012,31(6): 927—932]
[36]Yu Z G, Lin F X, He J. Study on the relationship between heterotrophic bacteria and shrimp disease [J].Acta Oceanologica Sinica, 1995, 17(3): 85—91 [于占国, 林凤翱, 贺杰. 异养细菌与虾病关系的研究. 海洋学报, 1995,17(3): 85—91]
[37]Sugita H, Miyajima C, Deguchi Y. The vitamin B12-producing ability of the intestinal microflora of freshwater fish [J].Aquaculture, 1991, 92: 267—276
[38]Chen Y, Yang X L, Cao Y S. Study on isolation, identification and phosphate accumulating capacity ofArthrobactersp [J].Journal of Anhui Agricultural Sciences,2011(1): 447—450 [陈燕, 杨小龙, 曹郁生. 1 株高效聚磷节杆菌的分离鉴定及其聚磷特性研究. 安徽农业科学, 2011(1): 447—450]
[39]Sun Y Z, Yang H L. A review: distribution and manipulation of fish gut microflora [J].Aquatic Sciences, 2008,27(5): 257—261 [孙云章, 杨红玲. 浅谈鱼类消化道微生物的分布及调控. 水产科学, 2008, 27(5): 257—261]
[40]Hua X M, Zhou H Q, Qiu X Z,et al. Effects of dietaryBallussp. and selenoyeast on the growth and disease resistance of allogynogenetic crucian carp [J].Journal of Fisheries of China, 2001, 25(5): 448—453 [华雪铭, 周洪琪, 邱小琮, 等. 饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响. 水产学报, 2001, 25(5):448—453]
[41]Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S,et al.Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11) [J].Aquaculture, 2000, 191(4): 271—288
