双指数DWI在鉴别诊断肌营养不良与糖原累积病中的价值
2018-01-24冉君李小明
冉君, 李小明
近端肢体无力是肌病患者最常见的临床表现,临床上糖原累积病(glycogen storage diseases,GSDs)和肌营养不良(muscular dystrophies,MDs)患者均可表现为亚急性发病,逐渐加重,双侧对称性近端肢体无力、疲劳、行走困难及血清肌酶升高。GSDs是以糖原代谢异常为特点的一组遗传异质性的代谢疾病[1],可引起剧烈疲劳,运动不耐受等症状,主要包括糖原合成、分解或酵解异常。GSDs主要分为肝脏型和肌肉型,而肌糖原过多是肌肉型GSDs的标志[2]。临床上,代谢性肌病具有诊断难、治疗难的特点,易被误诊为多发性肌炎、肌营养不良、重症肌无力等疾病。MDs是一组临床及基因异质性的神经肌肉疾病,主要表现为近端肢体无力、肌萎缩、腱反射消失等[3]。肌肉MR成像是辅助诊断肌病的重要手段,肌病急性期或亚急性期可表现为相对对称的局灶或弥漫性肌肉水肿。因此,各型肌病急性期或亚急性期在T2WI抑脂序列上均可表现为高信号[4],受累肌肉组织在T1WI上可表现为局灶性或弥漫性脂肪沉积,肌营养不良患者常表现为肌肉组织的脂肪沉积[5,6],但是脂肪沉积并不是肌营养不良的特异性表现,它还可以见于其他类型肌病患者。MR相关新技术可能有助于对临床表现相似的不同类型肌病进行鉴别诊断。近年来,定量T2值及扩散加权成像(diffusion weighted imaging,DWI)技术被广泛应用于炎性肌病[7-9]。DWI作为一种特殊的MR成像技术,能提供组织内水分子的运动情况[9,10]。本研究通过对比分析正常对照组、GSDs组和MDs组患者的肌肉组织水分子的扩散特点,旨在探讨双指数模型DWI在诊断和鉴别诊断GSDs与MDs中的价值。
材料与方法
1.病例资料
2013年9月至2015年10月,根据Bohan和Peter诊断标准[11]结合患者血清学检查、临床表现、肌肉活检结果,搜集明确诊断为肌病的19例患者,主要临床症状为对称性的相对近端肢体无力,血清肌酸激酶水平升高,其中GSDs患者7例(GSDs组,男5例,女2例,年龄18~42岁,平均28岁),MDs患者12例(MDs组,男6例,女6例,年龄20~51岁,平均29岁);同时搜集11例健康志愿者作为对照组,男7例,女4例,年龄24~40岁,平均32岁。本研究获得本院道德伦理委员会的审核通过,所有参与者检查前均签署知情同意书。
2.检查方法
采用 GE 3.0T磁共振扫描仪(Signa Excite HD,Milwaukee,WI)行MRI检查,8通道torso体线圈,取仰卧位对患者的双侧大腿行MRI扫描。扫描参数:轴面T1WI序列,TR 420 ms,TE 7.2 ms;T2WI+FS序列,TR 3600 ms,TE 85.5 ms;平面回波DWI,TR 3600 ms,TE 85.5 ms,激励次数为3次,矩阵128×128,层厚6 mm,视野38 cm×38 cm,b值包括0、20、50、100、200、300、400、500、600、700、800、900、1000、1100、1200 s/mm2,在MADC工作站(ADW4.4,GE HealthCare)上测量ADC值。每例患者完成所有扫描大约需要20 min。
3.图像分析
由两位有5年以上工作经验的放射科医生在不知患者信息的情况下对所有图像进行分析。在T2WI(b=0 s/mm2)图像基础上手动勾画双侧大腿七块肌肉(股直肌、股中间肌、股外侧肌、股内侧肌、大收肌、半腱肌及股二头肌长头)的ROI范围(面积55~70 mm2),然后在双指数ADC图上复制同样大小的ROI,根据同层面的T1WI图保证每个ROI尽量避开皮下脂肪、血管和骨头。分别计算3组样本的双指数模型的相关参数(包括ADCstandard,ADCfast和ADCslow),ADCstandard是指b值从0~1200 s/mm2的平均值。
4.统计学分析
采用SPSS 19.0软件进行统计学分析。双指数模型DWI的相关参数采用中位数和25%~75%的可信区间表示。采用非参数Kruskal-Wallis检验比较三组间相关参数的差异。以P<0.05为差异有统计学意义。
结果
正常对照组与肌病组在年龄和性别上差异无统计学意义。对照组、GSDs和MDs三组右侧大腿水肿肌群于b=0、20、300、600、1000 s/mm2上均表现为高信号(图1)。病变肌肉组织与正常组织在伪彩图上可见颜色分布的差异(图2)。
正常对照组,所选肌肉的平均ADCstandard(H=11.944,P=0.063)、 ADCfast(H=1.968,P=0.923)和ADCslow(H=11.002,P=0.088)差异无统计学意义。正常对照组ADCstandard的平均值为1.68(1.54~1.79)×10-3mm2/s,GSDs组为1.48(1.36~1.63)×10-3mm2/s,MDs 组为1.60(1.48~1.70)×10-3mm2/s。对照组ADCslow的平均值为1.37(1.26~1.50)×10-3mm2/s,GSDs组为1.22(1.14~1.34)×10-3mm2/s,MDs组为1.34(1.23~1.48)×10-3mm2/s。正常对照组ADCfast的平均值为7.42(6.53~8.81)×10-3mm2/s,GSDs组为7.92(6.21~10.56)×10-3mm2/s,MDs组为8.06(6.02~12.50)×10-3mm2/s,三组间ADCstandard(H=19.748,P=0.000)和ADCslow(H=15.982,P=0.000)差异有统计学意义,ADCfast差异无统计学意义(H=2.541,P=0.281)。对于三组ADCstandard的平均值,GSDs组水肿肌肉明显低于对照组(P=0.000)和MDs组(P=0.034),GSDs组水肿肌肉的ADCslow平均值亦明显低于对照组(P=0.000)和MDs组(P=0.003,图3)。
讨 论
近年来,DWI的双指数模型越来越多应用于中枢神经系统,特别是诊断神经系统疾病[12,13]。事实上,组织内水分子的扩散是一个非常复杂的过程,有学者通过研究提出,DWI双指数模型应该包括细胞内和细胞外的成分[14,15]。多数研究认为ADCslow指细胞内水分子的扩散而ADCfast则反映的是细胞外水分子的扩散[16,17]。有学者利用DWI的不同b值进行研究,发现细胞内和细胞外的确有两种不同的表观扩散系数,即慢速扩散和快速扩散[18]。笔者未检索到利用双指数模型DWI鉴别诊断炎性肌病的相关报道,同时本研究也证实了双指数模型DWI非常有助于分析肌肉组织内水分子的运动情况。
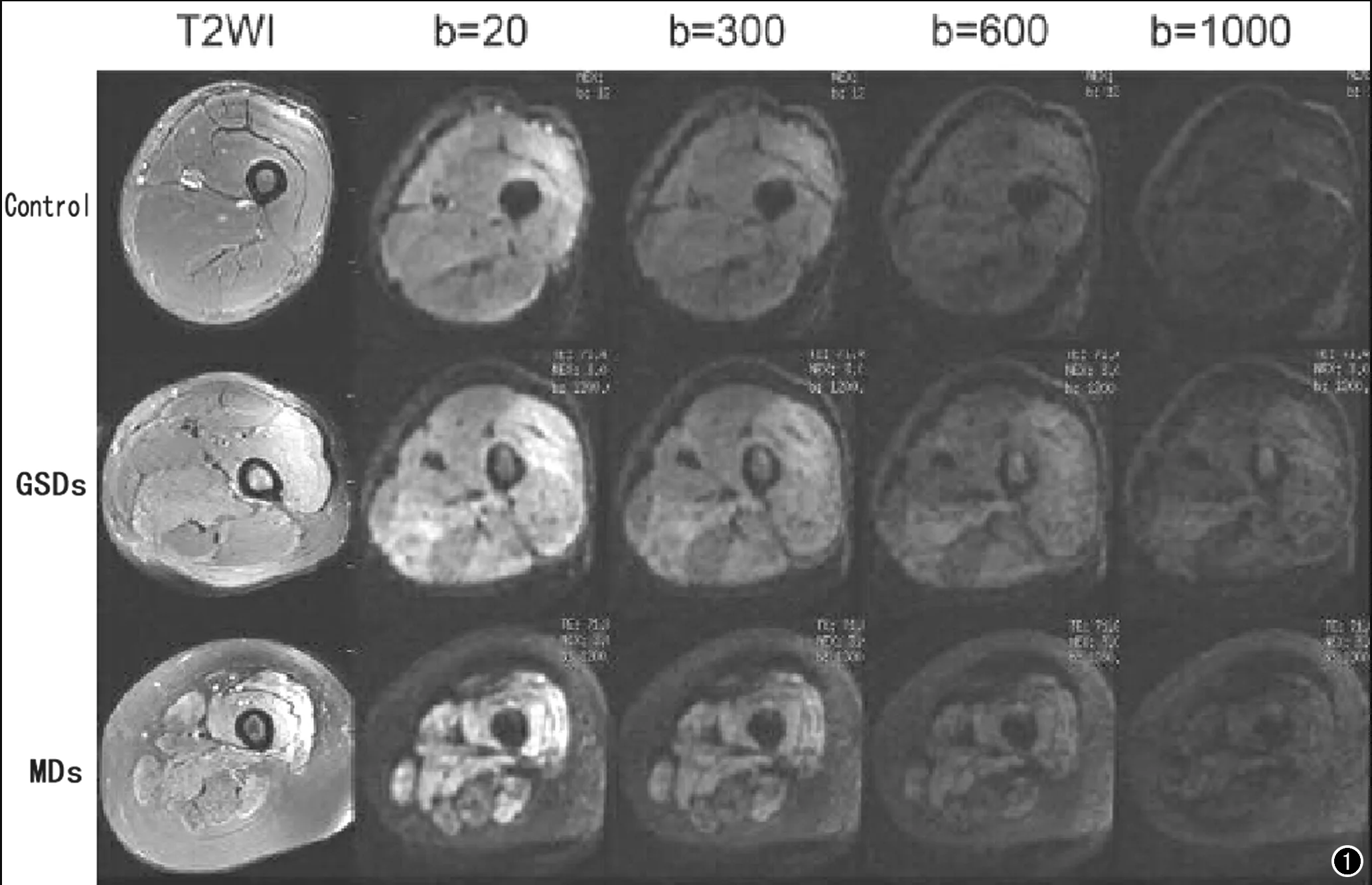
图1 对照组、GSDs组和MDs组一侧大腿肌群在不同b值下的DWI图像。
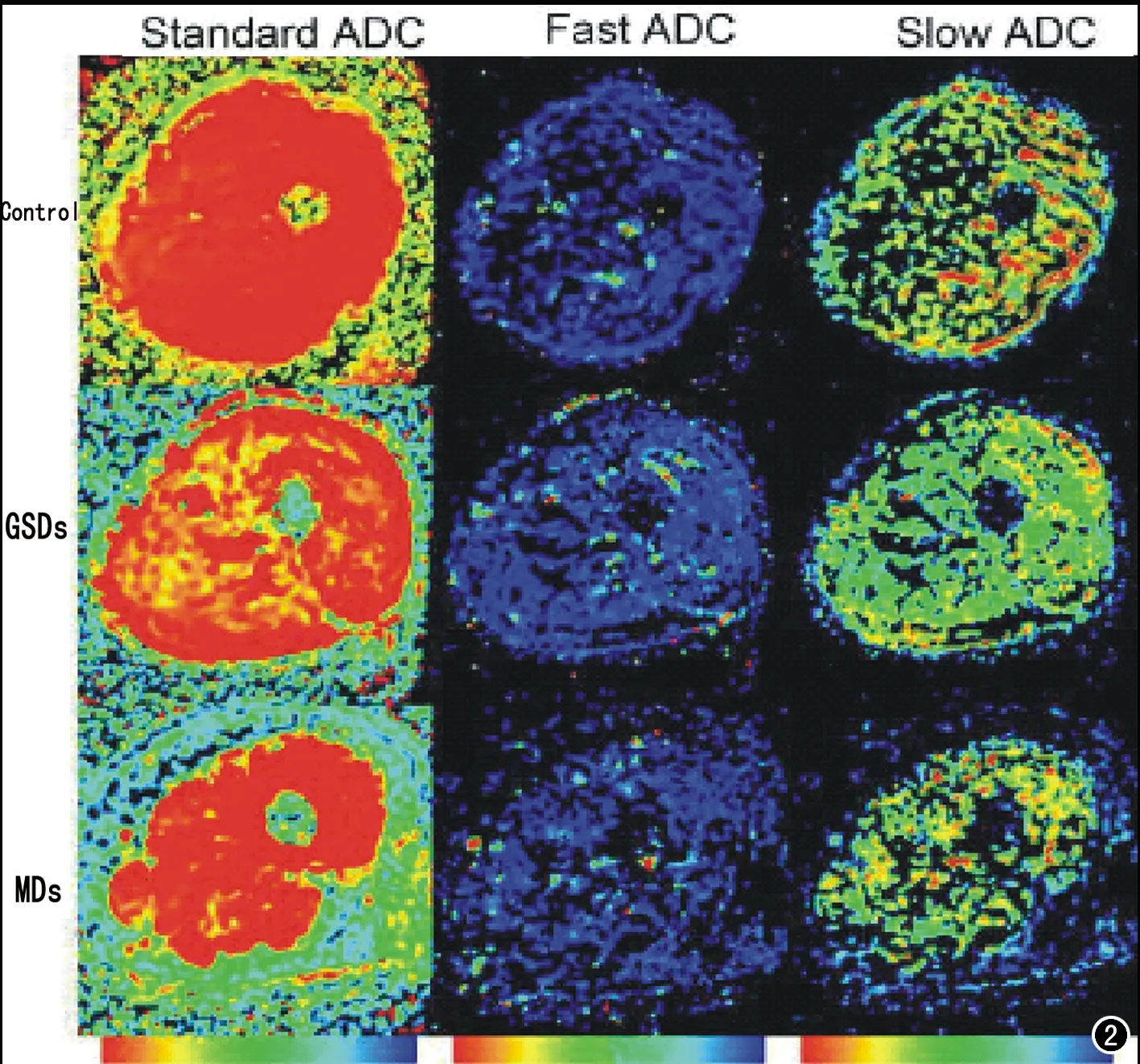
图2 单侧大腿肌群经工作站后处理得到的双指数模型参数的伪彩图。
本研究结果显示双指数模型DWI可用于研究肌肉组织。Daniel等[17]同样利用双指数模型DWI研究了人体运动前后肌肉组织的扩散信号特点,肌肉的ADC值反映了水分子在组织内的运动情况,正常对照组肌肉的平均ADC值为1.68(1.54~1.79)×10-3mm2/s,稍高于Qi等[10]的研究结果,笔者分析造成这种差异的原因可能与扫描参数和样本量的差异有关。本研究通过表观扩散系数双指数模型对GSDs和MDs患者的水肿肌肉进行定量分析研究,从而鉴别诊断GSDs和MDs。本研究中MDs组的ADCstandard值明显高于GSDs组,造成这种差异的原因可能包括以下几个方面:①ADCstandard值反映的是水分子通过毛细血管灌注、细胞间隙及穿过细胞膜的整体情况,ADCstandard值的差异反映了这两种肌病炎性程度不同,尽管他们在T2WI上均表现为水肿信号,本研究结果提示MDs患者的炎性水肿程度可能高于GSDs;②在肌病的一系列病理变化中,炎症水肿和脂肪沉积可同时存在于肌病组织中,造成GSDs组的ADCstandard值明显低于MDs组的原因可能是因为GSDs患者更容易出现脂肪沉积[19, 20]。Qi等[10]通过研究发现在肌病的病理过程中,肌肉组织内脂肪的沉积可以减少水的含量并限制水分子的扩散,同时有研究发现肌肉组织脂肪沉积的含量越多,组织的ADC值越低,脂肪细胞可以较密实地填充在组织内从而导致组织内自由水含量减少;③对肌病的病理进行分析,学者们发现伴随有炎性浸润、纤维化的退变及再生的肌纤维呈弥散分布[21,22]。不同表型肌病的ADCstandard值的差异提示肌纤维退化和再生的无规律性,因为DWI的表观扩散系数和肌纤维的方向也具有相关性[23]。
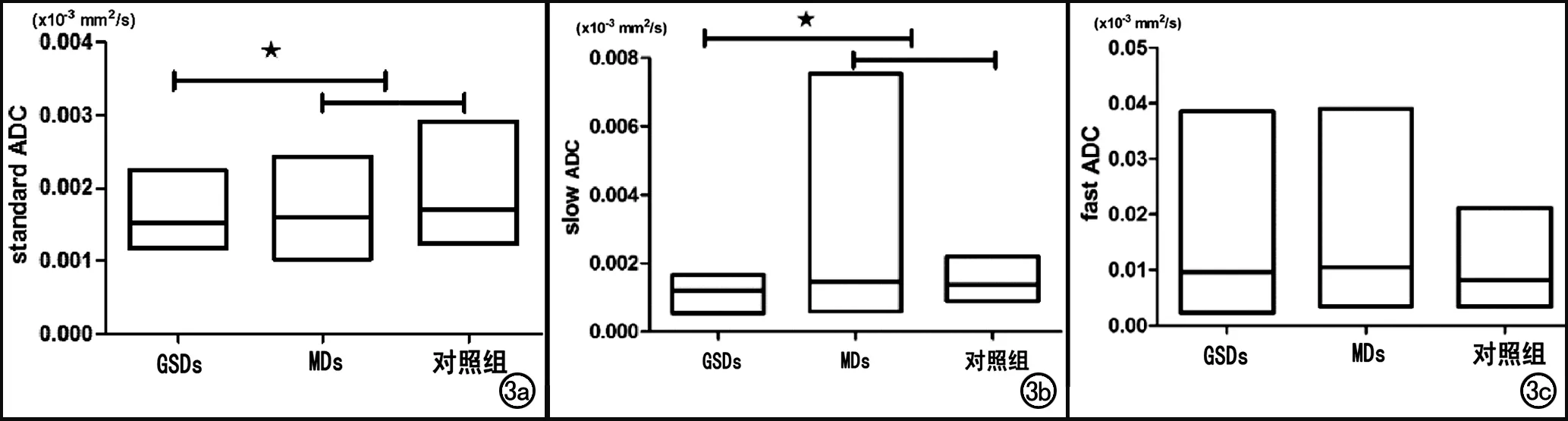
图3 三组间ADCstandard 、ADCslow、ADCfast值比较示意图。a) ADCstandard 值比较示意图(★差异有统计学意义); b) ADCslow值比较示意图(★差异有统计学意义); c) ADCfast值比较示意图,三组间差异无统计学意义。
值得一提的是,本研究结果显示GSDs组的ADCslow值明显低于MDs组。本研究更进一步证实了ADCslow值可以鉴别MDs和GSDs,GSDs患者的ADCslow值明显低于MDs,基于水分子的扩散具有区室差异,组织ADCslow值与细胞内水分子的状态和含量有关,造成这种差异的原因可能是GSDs的肌纤维内沉积了糖原空泡[24],造成细胞内水分子的容积减少并限制了自由水分子的移动。另一种解释是糖原分子沉积在细胞内,从而使水分子以结合态的形式存在[2],从而影响了ADCslow值。肌营养不良蛋白连接细胞膜构成细胞骨架,在细胞膜的稳定性中具有重要作用[3]。肌营养不良的细胞膜受损,导致细胞通透性增加,可使细胞内水分子和其他小分子含量增加。因此,ADCstandard和ADCslow值可联合起来鉴别诊断GSDs与MDs。本研究发现三组的ADCfast值差异不具有统计学意义,这与Liu等[25]认为乳腺良性肿瘤和恶性肿瘤的ADCfast值差异不具有统计学意义相一致。
本研究的主要不足是病例数相对较少,推断结果的稳定性值得商榷,我们将收集更多的病例进行后续研究;另一不足之处在于没有利用DWI的单指数模型进行对照研究,单指数模型DWI可能也具有较高的价值,此外,本研究对每类肌病的发展程度没有进行详尽地描述。
[1] Angelin Ci.State of the art in muscle glycogenoses[J].Acta Myol,2010,29(2):339-342.
[2] Ribeiro WP,Valberg SI,Pagan JD,et al.The effect of varying dietary starch and fat content on serum creatine kinase activity and substrate availability in equine polysaccharide storage myopathy[J].J Vet Intern Med,2004,18(6):887-894.
[3] Guiraud S,Aartsma-Rus A,Vieira NM,et al.The pathogenesis and therapy of muscular dystrophies[J].An Rev Genomics Hum Genet,2015,16(7):281-308.
[4] Kumar Y,Wadhwa V,Lauren P,et al.MR imaging of skeletal muscle signal alterations:systematic approach to evaluation[J].Eur J Radiol,2016,85(8):922-935.
[5] Bihan DL,Turner R,Douek P,et al.Diffusion MR imaging:clinical applications[J].AJR,1992,159(6):591-599.
[6] Bihan DL,Breton E,Lallemand D,et al.MR imaging of intravoxel incoherent motions:application to diffusion and perfusion in neurologic disorders[J].Radiology,1986,161(2):401-407.
[7] Yao L,Yip AL,Shrader JA,et al.Magnetic resonance measurement of muscle T2,fat-corrected T2and fat fraction in the assessment of idiopathic inflammatory myopathies [J].Rheumatology,2016,55(3):441-449.
[8] Ababneh Z,Beloeil H,Berde CB,et al.Biexponential parameterization of diffusion and T2relaxation decay curves in a rat muscle edema model:decay curve components and water compartments[J].Magn Reson Med,2005,54(3):524-531.
[9] Tuor UI,Kozlowski P,Del Bigio MR,et al.Diffusion- and T2-weighted increases in magnetic resonance images of immature brain during hypoxia-ischemia:transient reversal posthypoxia[J].Exp Neurol,1997,150(2):321-328.
[10] Qi J,Olsen NJ,Price RR,et al.Diffusion-weighted imaging of inflammatory myopathies:polymyositis and dermatomyositis[J].J Magn Reson Imaging,2008,27(1):212-217.
[11] Iaccarino L,Pegoraro E,Bello L,et al.Assessment of patients with idiopathic inflammatory myopathies and isolated creatin-kinase elevation[J].Auto Immun Highlights,2014,5(3):87-94.
[12] Schwarcz A,Ursprung Z,Berente Z,et al.In vivo brain edema classification:New insight offered by large b-value diffusion-weighted MR imaging[J].J Magn Reson Imaging,2007,25(1):26-31.
[13] Steier R,Aradi M,Pal J,et al.A biexponential DWI study in rat brain intracellular oedema[J].Eur J Radiol,2012,81(8):1758-1765.
[14] Dalakas MC,Hohlfeld R.Polymyositis and dermatomyositis[J].Lancet,2003,362(9388):971-982.
[15] Van Zijl PC,Moonen CT,Faustino P,et al.Complete separation of intracellular and extracellular information in NMR spectra of perfused cells by diffusion-weighted spectroscopy[J].Proc Natl Acad Sci USA,1991,88(8):3228-3232.
[16] Bihan DL,Breton E,Lallemand D,et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J].Radiology,1998,168(4):497-505.
[17] Daniel M.In vivo measurement of diffusion and pseudo-diffusion in skeletal muscle at rest and after exercise[J].Magn Reson Imaging,1995,13(2):193-199.
[18] Mulkern RV,Zengingonul HP,Robertson RL,et al.Multi-component apparent diffusion coefficients in human brain:relationship to spin-lattice relaxation[J].Magn Reson Med,2000,44(5):292-300.
[19] Gershen LD,Prayson BE,Prayson RA.Pathological characteristics of glycogen storage disease III in skeletal muscle[J].J Clin Neurosci,2015,22(10):1674-1675.
[20] Heinicke K,Dimitrov IE,Romain N,et al.Reproducibility and absolute quantification of muscle glycogen in patients with glycogen storage disease by13C NMR spectroscopy at 7Tesla[J].PloS One,2014,9(10):e108706.
[21] Bertini E,D'Amico A,Gualandi F,et al.Congenital muscular dystrophies:a brief review[J].Semin Pediatr Neurol,2011,18(4):277-288.
[22] McMillan AB,Shi D,Pratt SJ,et al.Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions[J].J Biomed Biotechnol,2011,2011:970726.
[23] Robertson RL,Ben-Sira L,Barnes PD,et al.MR line-scan diffusion-weighted imaging of term neonates with perinatal brain ischemia[J].AJNR,1999,20(9):1658-1670.
[24] Shin YS.Glycogen storage disease:clinical,biochemical,and molecular heterogeneity[J].Semin Pediatr Neurol,2006,13(2):115-120.
[25] Liu C,Liang C,Liu Z,et al.Intravoxel incoherent motion (IVIM) in evaluation of breast lesions:comparison with conventional DWI[J].Eur J Radiol,2013,82(12):e782-789.
