实验设计在ADC药物处方筛选中的应用
2018-01-23杜翊章燕珍谭小钉
杜翊+章燕珍+谭小钉


摘 要 目的:运用实验设计(DOE)方法优化抗体偶联药物(ADC)处方筛选,以得到适用于该ADC药物的较优处方。方法:利用JMP 10软件进行DOE,考察蛋白浓度、pH、蔗糖和吐温20浓度等因素对ADC药物稳定性的影响。结果:经过DOE方法的优化,得到了蛋白浓度(10 mg/ml)、pH (5.0)、蔗糖浓度[6%(w/v)]和吐温20浓度[0.02%(w/v)]的优选组合。结论:DOE方法能优化处方,提高ADC药物的稳定性,为其他ADC药物的处方筛选提供了借鉴。
关键词 实验设计 ADC药物 处方筛选
中图分类号:R927.11; R979.19 文献标识码:A 文章编号:1006-1533(2018)01-0071-05
Application of design of experiment in the formulation screening of antibody drug conjugate
DU Yi, ZHANG Yanzhen, TAN Xiaoding*
(Central Research Institute, Shanghai Pharmaceuticals Holding Co., Ltd., Shanghai 200237, China)
ABSTRACT Objective: To optimize the formulation screening of antibody drug conjugate (ADC) by a method of design of experiment (DOE) so as to obtain a superior formulation for the ADC drug. Methods: DOE was performed by a software JMP 10 to investigate the effects of the concentrations of protein, sucrose and polysorbate 20 and pH value on the stability of ADC drug. Results: A preferred combination including 10 mg/ml protein, 6% (w/v) sucrose and 0.02% (w/v) polysorbate 20 and pH 5.0 was obtained by optimization of DOE method. Conclusion: DOE can optimize the formulation and improve the stability of ADC drug. This study can also provide a reference for the screening of other ADC drugs.
KEY WORDS design of experiment; ADC drugs; formulation screening
在過去的几十年中,抗肿瘤药物研发取得巨大进展,尤其是生物制品的出现,使临床可选的抗肿瘤药物品种显著增加。传统小分子化疗药物具有非特异性,容易引起严重的不良反应;具有靶向性的单克隆抗体选择性较强,不良反应较轻,但是由于单克隆抗体靶向治疗的有效率并不高,且存在耐药与疗效问题,因此,抗体-药物偶联物(antibody-drug conjugate,ADC)作为一种新型药物结合了抗体的靶向性和小分子药物的细胞毒作用[1-2]。ADC药物进入体内后,通过单抗的导向作用与靶细胞表面的抗原结合,进入靶细胞内,然后通过化学或酶促作用释放小分子药物而杀灭靶细胞[3]。
ADC药物制剂处方开发的目标是确保为患者提供质量稳定可靠的产品。与传统单抗药物相比,在安全、质量和疗效等方面,ADC药物具有其独特的物理化学性质。其质量属性通常可以分为三类:与抗体本身相关、与小分子药物相关及与抗体-小分子偶联形式相关。如抗体本身相关的聚体,可影响药物的免疫原性[4]及药代动力学特性;游离小分子会影响药物的安全性;抗体药物偶联比可影响药物安全性和药代动力学特性[5]。这些关键属性都可能因处方的不同而改变,因此,筛选出好的处方对于ADC药物保持良好的稳定性和安全性具有重要意义。
实验设计(DOE)是以数理统计和概率论为基础、合理安排实验的方法论,研究如何制定实验方案,以提高效率,缩小误差,高效且经济地获取数据,并进行分析处理,最后得出正确的结论。传统的多数设计是先追求目标值,通过筛选不同因素来减少波动,结果只能得到单因素的最优化,但是由于参数搭配不佳而整体性能不稳定。田口方法则是先追求产品的稳定性,通过分析质量特性与不同元素之间的非线性关系(交互作用),找出稳定性的最佳水平组合[6-7]。随着DOE的广泛使用,越来越多的DOE软件得到开发和应用,如SPSS、Minitab、JMP等。其中,JMP是赛仕软件公司(Statistical Analysis System)推出的一种交互式可视化统计分析软件,其实验设计内容丰富,实验设置灵活,分析功能强大,可大大提高实验效率[8-10]。因此,本研究应用JMP 10.0软件进行田口实验设计,对得到的数据进行分析,预测实验结果并找出最佳参数。
1 材料与方法
1.1 ADC药物
本研究中的ADC药物为注射用重组抗HER2人源化单克隆抗体-MCC-DM1偶联剂,是一种由氨基酸序列和曲妥珠单抗(赫赛汀,herceptin)相同的抗体与细胞毒类药物美登素衍生物(DM1)通过不可裂解的硫醚连接桥偶联而成的制剂,连接分子(linker)为SMCC。由上海医药集团股份有限公司中央研究院生物药物室制备。endprint
1.2 主要仪器和试剂
BSA822电子天平(赛多利斯公司);Akta avant蛋白纯化系统(GE);1260高效液相色谱仪(安捷伦公司);SpectraMax M5多功能酶标仪及SoftMax分析软件(美国Molecular Devices);PA 800 plus毛细管电泳仪(贝克曼公司);紫外分光光度计(Thermo Fisher Scientific)。琥珀酸、吐温20(J. T. Baker);蔗糖、氢氧化钠(湖南尔康制药股份有限公司);超纯水(自制)。
1.3 处方DOE设计
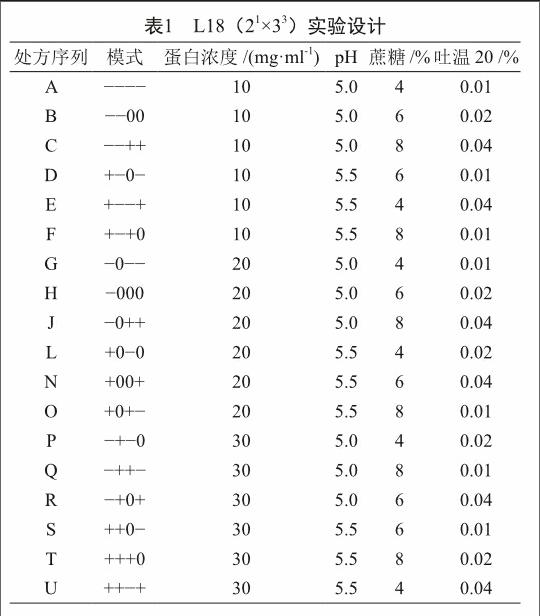
根据单因素实验结果选取蛋白浓度、pH、蔗糖浓度及吐温20浓度用于DOE试验。利用JMP 10.0进行DOE设计,其中蛋白浓度选取3水平、pH为2水平、蔗糖浓度为3水平、吐温20浓度为3水平,共设计18个试验组(表1)。
1.4 缓冲液置换及稳定性考察
称取适量的蔗糖、琥珀酸和吐温20溶解于超纯水中,用3 mol/L氢氧化钠调节溶液pH,配制成表1中的不同蔗糖浓度、不同pH和不同吐温20浓度的处方缓冲溶液。
使用Akta avant蛋白纯化系统连接分子筛将适量的ADC药物样品置换至上述配制好的处方溶液中。置换好后的溶液无菌过滤并分装至6 ml的灭菌西林瓶中,压塞,
加铝塑盖,在25 ℃条件下进行加速稳定性实验,考察时间为3个月。
2 质量指标
方法均为企业自行开发并验证。
2.1 尺寸排阻色谱法(SEC)纯度分析
色谱柱:TSKgel G3000SWXL(7.8 mm×300 mm,5 mm);流动相:(20 mmol/L 磷酸二氢钾+0.25 mol/L氯化钾,pH=6.95±0.05)-异丙醇=85∶15;流速:0.5 ml/min;上样量:100 mg;柱温:室温;样品池温度:8 ℃;检测波长:280 nm。用Agilent 1260高效液相分析系統对实验结果进行数据处理,用面积归一化法计算纯度。
2.2 CE-SDS纯度分析
将样品用纯水稀释至5.0 mg/ml,将20 ml 样品、75 ml SDS-MW样品缓冲液、2 ml内标和 5 ml 0.25 mol/L碘乙酰胺(非还原CE-SDS)混匀后,65 ℃孵育4 min,冷却至室温,取100 ml,采用Beckman PA800 plus毛细管电泳系统上样分析, 于15 kV分离,毛细管温度及样品传送带温度均为20 ℃,检测波长为220 nm。
2.3 游离小分子分析
色谱柱:Agilent ZORBAX 300SB-C18(4.6 mm×100 mm,3.5 mm);流动相:0.02% TFA水溶液(流动相A),0.02% TFA乙腈溶液(流动相B);流速:1.0 ml/min;上样量:20 ml;柱温:30 ℃;检测波长:252 nm。用Agilent 1260高效液相分析系统对实验结果进行数据处理,用面积归一化法计算游离小分子的量。
2.4 体外生物学活性分析
0.25% Trypsin-EDTA消化BT-474细胞,用 DMEM/ F12完全培养基将细胞重悬,调整活细胞密度至1.5×105 cells/ml,100 ml/孔加入96孔板,37 ℃,5% CO2恒温培养箱中培养2~4 h。用DMEM/F12完全培养基将抗体稀释至5 mg/ml,再用稀释液2倍系列稀释(共9个梯度),50 μl/孔加入96孔细胞培养板,以DMEM/F12完全培养基作为阴性对照,以参比品作为阳性对照。37 ℃,5% CO2恒温培养箱中培养5 d,加入CCK-8染色液,每孔25 ml。5% CO2、37 ℃恒温培养箱培养4~6 h。以450 nm读取酶标仪上吸光度值。结果计算:利用SoftMax软件分析数据,以抗体浓度对数为横坐标,对应吸光度值为纵坐标,选用四参数方程回归模型,拟合抗体剂量效应曲线。按下式计算生物学活性:
3 结果
3.1 处方筛选SEC、CE-SDS、游离小分子及体外生物学活性结果
本研究中采用SEC聚体、CE-SDS小分子片段、游离小分子含量及体外生物学活性进行后续的分析,结果如图1所示。
25 ℃加速条件放置下,SEC聚体、CE-SDS小分子片段和游离小分子3个月与0个月的差值越小表示处方前后变化越小,越稳定。图1初步显示:可以看出高浓度蛋白的处方SEC聚体变化明显高于低浓度蛋白的处方。低、中浓度蛋白组的体外生物学活性整体高于高浓度蛋白组。
3.2 处方DOE数据分析
选择SEC聚体、CE-SDS小分子片段、游离小分子25 ℃加速3个月与0个月时的变化值和3个月时各处方的体外生物学活性为响应值,应用JMP 10.0软件对田口正交表L18(21×33)中的处方进行预测刻画,刻画结果如图2所示,各处方的刻画意愿如表2所示。
图2显示pH较低时,处方的意愿增高;蛋白浓度10 mg/ml和20 mg/ml对于整体意愿的影响比30 mg/ml小;10 mg/ml时的最佳处方意愿值0.76,20 mg/ml时的最佳处方意愿值为0.71,30 mg/ml时最佳处方意愿值仅0.51。因此为了保证ADC药物的稳定,处方蛋白浓度应该低于30 mg/ml。表2显示处方B和处方H的意愿值分别为0.76和0.71,二者的意愿值相差不大,为了后续工艺的可行性及临床使用的方便性和安全性,最终选择蛋白浓度为20 mg/ml,即最后选择的 ADC药物的较优处方为处方H,即pH 5.0、蛋白浓度 20 mg/ml、蔗糖含量6%(w/v)及吐温20含量0.02%(w/v),并对该处方的一批成品进行长期稳定性考察。endprint
3.3 长期稳定性考察结果
对上述处方下的一批成品进行长期稳定性考察。长期稳定性试验温度定为2~8 ℃,考察12个月。分别在试验期第0、3、6、9、12个月末取样分析SEC纯度、游离小分子药物、DAR和生物活性等相关指标,结果如图3所示。
图3表明成品在2~8 ℃条件下放置12个月期间,SEC纯度、CE-SDS纯度、生物学活性、游离小分子和DAR均无明显变化。说明在优化处方(处方H)下,样品在2~8 ℃条件放置12个月后质量稳定性良好。
4 讨论
本研究通过对蛋白浓度、pH、蔗糖浓度和吐温20浓度的优化,筛选出优化处方H,即20 mg/ml ADC药物、6%(w/v)蔗糖、0.02%(w/v)吐温20和pH 5.0。在该处方下,样品在25℃加速3个月后,聚体、小分子片段及游离小分子的变化较小,体外生物学活性较高,经JMP 10.0預测刻画后,意愿值较高。经长期稳定性考察,ADC药物的各项理化性质保持良好的稳定性,表明该处方适合此ADC药物。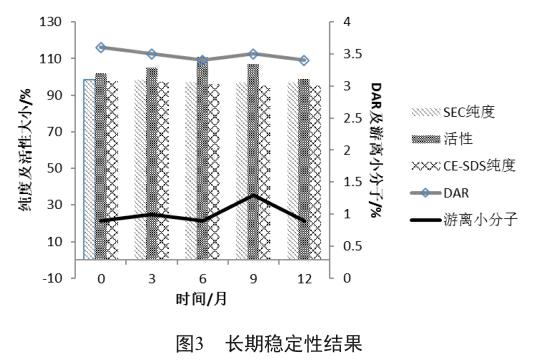
抗体偶联药物的处方研发与传统药物类似,尽管如此,当将小分子与偶联药物的质量属性一起考虑时,制剂处方开发将变得更加复杂,需要考虑的因素更多。聚体是由天然或变性单体组成的高分子量蛋白质,是导致免疫原性的重要因素之一[11-13];聚体和小分子片段为样品中的大小变异体,影响样品整体的纯度;样品中游离小分子的含量则影响安全性,若样品中存在较高的游离小分子药物,将对正常细胞造成严重损伤[14-15]。生物学活性测定是生物测定的重要内容,因此,本研究采用SEC聚体、CE-SDS小分子片段、游离小分子和体外生物学活性作为刻画的关键质量属性,得到了使ADC药物稳定的优化处方。表明这四个关键质量属性适合用于ADC药物处方筛选的DOE刻画。此DOE方法达到了预期的优化效果,且具有较好的稳定性。本研究将田口正交法用于ADC药物处方筛选设计中,通过较少的实验次数,获取优化后的设计参数,提高设计效率,降低了设计成本,为其他ADC药物的处方筛选提供了借鉴。
参考文献
[1] Staub A, Guillarme D, Schappler J, et al. Intact protein analysis in the biopharmaceutical field[J]. Pharm Biomed Anal, 2011, 55(4) : 810-822.
[2] Beck A, Wagner-Rousset E, Ayoub D, et al. Characterization of therapeutic antibodies and related products[J]. Anal Chem, 2013, 85(2): 715-736.
[3] 朱贵东, 傅阳心. 设计新一代抗体药物偶联物[J]. 药学学报, 2013, 48(7): 1053-1070.
[4] Büttel IC, Chamberlain P, Chowers Y, et al. Taking immunogenicity assessment of therapeutic proteins to the next level[J]. Biologicals, 2011, 39(2): 100-109.
[5] Perez HL, Cardarelli PM, Deshpande S, et al. Antibodydrug conjugates: current status and future directions[J]. Drug Discov Today, 2014, 19(7): 869-881.
[6] 曾凤章, 赵霞. 田口方法及其标准化设计[J]. 机械工业标准化与质量, 2003(11): 7-9.
[7] Ross PJ. Taguchi techniques for quality engineering[M]. New York: McGraw-Hill, 1988.
[8] 梁锏文, 李智斌, 陈柏铨. 利用JMP软件优化威兰胶发酵培养基[J]. 食品研究与开发, 2016, 37(18): 104-108.
[9] 吴繁, 刘化勇, 丁雪梅, 等. 基于 JMP 软件中定制设计的纯棉和纯毛织物熨烫参数优化对比研究[J]. 毛纺科技, 2016, 44(4): 10-14.
[10] 雷伟, 汪圣毅, 张涛, 等. JMP定制实验设计优化胃癌患者PBMC分离方案[J]. 基因组学与应用生物学, 2017(5): 1749-1754.
[11] Niebecker R, Kloft C. Safety of therapeutic monoclonal antibodies[J]. J Curr Drug Saf, 2010, 5(4): 275-286.
[12] 朱宏斌, 杨向民, 陈志南. 治疗性单抗的免疫原性研究进展[J]. 中国免疫学杂志, 2009, 25(3): 286-289.
[13] Chirino AJ, Ary ML, Marshall SA. Minimizing the immunogenicity of protein therapeutic[J]. Drug Discov Today, 2004, 9(2): 82-90.
[14] 宗英, 毛煜, 张晓芳, 等. 抗体偶联药物临床前安全性评价关注点[J]. 中国新药杂志, 2013, 22(23): 2759-2778.
[15] 朱芹汶, 周婧琪. 抗体-药物偶联物( ADCs) 的研发进展及其关键影响因素探讨[J]. 药物生物技术, 2016, 23(5): 431-436.endprint
