饲料脂肪水平对大口黑鲈形体指标、组织脂肪酸组成、血清生化指标及肝脏抗氧化性能的影响
2018-01-23朱婷婷李晨晨马红娜罗嘉翔周歧存
朱婷婷 金 敏 孙 蓬 李晨晨 马红娜 罗嘉翔 袁 野 周歧存
(宁波大学海洋学院鱼类营养研究室,宁波 315211)
大口黑鲈(Micropterussalmoides),属鲈形目(Perciformes),鲈亚目(Porcoidei),太阳鱼科(Cehtrachidae),黑鲈属(Micropterus),原产于北美洲,是一种世界性的游钓鱼类。大口黑鲈根据形态学和原产地的地理分布方面的不同,被分为2个亚种:大口黑鲈北方亚种(M.salmoidessalmoides)和大口黑鲈佛罗里达亚种(M.salmoidesfloridanus)[1]。大口黑鲈是一种生长快、抗病力强、肉质鲜美、耐低温、营养较为丰富的名贵肉食性鱼类[2-3],20世纪70年代末,我国台湾省从国外引进此鱼,并在1983年成功进行人工繁殖,同年引入广东省,经过多年的养殖发展,已成为国内重要的淡水养殖品种之一[4]。近年来,我国大口黑鲈的年产量保持在10万t以上,其中,大口黑鲈的主要养殖区域在广东省,年产量是国内总产量的75%[5]。
脂肪作为三大营养素之一,是鱼类重要的能源物质,对生长起着重要的作用[6-7]。饲料中缺乏脂肪或脂肪提供量不足,会引起必需脂肪酸和脂溶性维生素的缺乏,而鱼类自身又不能合成必需脂肪酸,就会造成鱼类生长缓慢、抗病力低[8-11],还会使代谢紊乱,最终导致鱼类消耗饲料蛋白质作为生长所需的能量[8]。因此,饲料中添加适宜的脂肪可以起到促进鱼类生长、节约蛋白质的作用。然而,饲料中脂肪水平过高也会使代谢系统紊乱、机体组织器官受损[12-13]、机体内脂肪酸重新合成受到抑制,从而影响水产动物的发育和免疫应答[14-15]。
脂类在鱼体内消化吸收后,会以甘油三酯的形式储存在肠道、肌肉、肝脏等组织内[16]。脂肪及脂肪酸的积累会对鱼体内的各组织器官产生不利影响,如作为脂肪代谢主要器官的肝脏,过量的脂肪积累会形成脂肪肝。一般情况下,饲料中含有的脂肪越多,在肝脏中积累的脂肪越多。
目前,大口黑鲈饲料在蛋白质和氨基酸方面的研究[17-20]较多,而对脂肪及脂肪酸的研究较少。基于此,本试验在已有研究的基础上,设计3个脂肪水平(5.76%、11.05%、17.65%),研究饲料脂肪水平对大口黑鲈形态学、组织脂肪酸组成、血清生化指标及肝脏抗氧化指标的影响,从而为大口黑鲈资源节约型配合饲料的研制提供基础数据和理论参考。
1 材料与方法
1.1 试验饲料
本试验以白鱼粉、豆粕、小麦蛋白粉、小麦粉为蛋白质源,鱼油、豆油、大豆卵磷脂为脂肪源,配制脂肪水平分别为5.76%、11.05%、17.65%的3种等氮试验饲料,试验饲料组成及营养水平见表1,试验饲料的脂肪酸组成见表2。

表1 试验饲料组成及营养水平(风干基础)
1)矿物质预混料和维生素预混料参照Mai等[21]配制。Mineral premix and vitamin premix were prepared according to Mai, et al[21].
2)总能为计算值,其他营养水平为实测值。Gross energy was a calculated value, while the other nutrient levels were measured values.
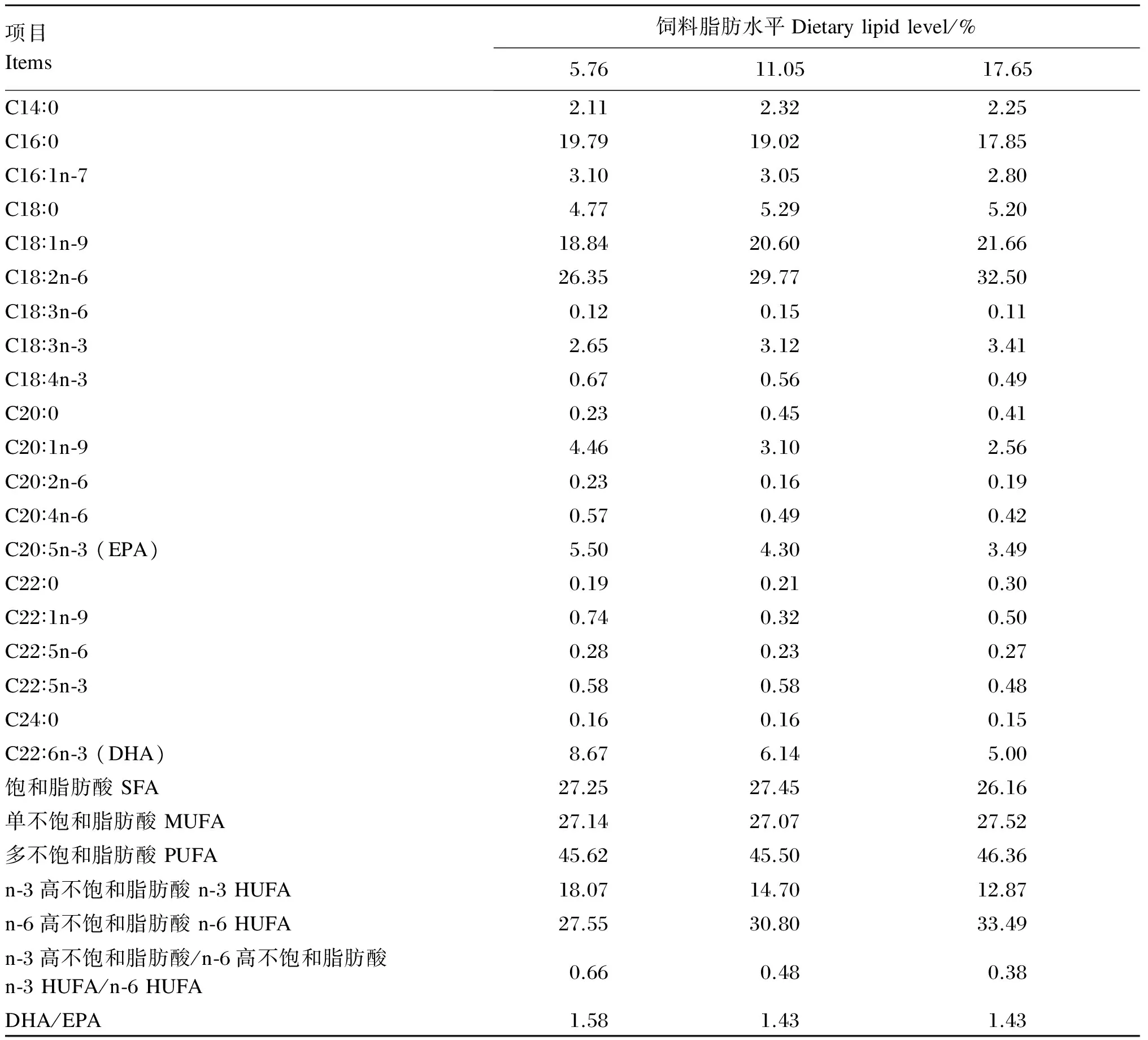
表2 试验饲料脂肪酸组成(占总脂肪酸的百分比)
将所有原料粉碎后,过80目筛,按照表1的配方准确称重,并混合均匀,其中维生素和矿物质预混料等微量添加成分采取逐级稀释法混合均匀,之后加入适量的水,用搅拌机均匀混合后,压制成粒径分别为1.5和2.0 mm的颗粒饲料。在烘箱中90 ℃熟化30 min,取出阴干至水分为10%左右,放入封口袋中,置于-20 ℃冰箱中保存。
1.2 饲养管理
试验用大口黑鲈幼苗购自湖州南浔和孚鸿浩水产家庭农场,在宁波大学海洋学院鱼类营养研究室养殖车间内进行养殖试验。在试验前,大口黑鲈幼苗用商业饲料驯化2周。暂养2周后,饥饿24 h,挑选个体大小一致、健康无病的初始体质量为(4.12±0.02) g大口黑鲈幼鱼270尾,随机分在9个300 L的养殖桶里,每个桶30尾鱼。每种饲料随机投喂3个养殖桶,每天投喂2次,时间分别为08:00和18:00,每次投喂量为体质量的3%~4%。每天换水量为50%,试验中记录投喂量和死亡情况,及时捞出死鱼并称重记录。每2周称1次体质量,并根据体质量调整投饵量。养殖周期为8周,在此期间,水温为22.2~31.0 ℃,溶解氧浓度在6.0 mg/L以上,pH为7.5~8.0。
1.3 样品采集
养殖试验结束后,饥饿24 h,将试验鱼用丁香酚(1∶10 000)麻醉后,每个养殖桶随机取3尾鱼,测量其体质量、体长,解剖取内脏,分离肝脏和腹腔脂肪,分别称重,用来计算肝体比(HSI)、脏体比(VSI)、脂体比(IPF)及肥满度(CF)。每个养殖桶另随机取6尾鱼,从尾静脉采血于1.5 mL离心管内,于4 ℃冰箱中静置过夜,3 500 r/min离心10 min制得上清液,放置在-80 ℃冰箱中保存备用。将采过血的鱼解剖,取其肝脏于2.0 mL离心管内,用于抗氧化指标及脂肪酸组成的测定;剥离其背部侧线以上的肌肉于4.0 mL离心管内,用于肌肉脂肪酸组成的测定。
1.4 测定方法
饲料常规营养成分分析:参照AOAC(1995)[22]方法,采用105 ℃恒干恒重法测定水分含量;采用脂肪测定仪(SX360)测定粗脂肪含量,其原理是索氏抽提法;采用蛋白质测定仪(Leco FB-528)测定粗蛋白质含量,其原理是热导吸收法;采用马弗炉550 ℃焚烧失重法测定粗灰分含量,个别方法有改进。
血清指标分析:谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)的活性及葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总蛋白(TP)的含量采用生化分析仪(Pro-M)测定。
脂肪酸组成分析:将肌肉和肝脏冷冻干燥48 h,在氯仿-甲醇溶液中抽提脂肪进行前处理后,送到中国科学院宁波材料技术与工程研究所测试中心,使用气相-质谱仪(GCMS-QP2010 Plus,SHIMADZU)进行脂肪酸的甲酯化,用面积归一法求得各类脂肪酸的相对百分含量。
肝脏抗氧化指标分析:谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、过氧化氢酶(CAT)、碱性磷酸酶(AKP)的活性以及丙二醛(MDA)的含量均采用南京建成工程生物研究所生产的试剂盒进行测定。
1.5 计算公式
肥满度(g/cm3)=100×W/L3;脏体比(%)=100×Wv/W;脂体比(%)=100×WI/W;肝体比(%)=100×Wh/W。
式中:W表示鱼体质量(g);L表示鱼体长(cm);Wv表示内脏重;WI表示腹腔脂肪重;Wh表示肝脏重(g)。
1.6 数据处理及分析
数据先用Excel 2007处理,然后采用SPSS 16.0软件进行分析。试验结果进行单因素方差分析(one-way ANOVA),差异显著时,用Turkey法多重检验分析组间差异显著性,P<0.05为差异显著。结果用平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 饲料脂肪水平对大口黑鲈形体指标的影响
饲料脂肪水平对大口黑鲈形体指标的影响见表3。饲料脂肪水平对大口黑鲈的肝体比和肥满度没有产生显著影响(P>0.05),其中肝体比有随着饲料脂肪水平的升高而升高的趋势,以17.65%脂肪组最高。脂体比随着饲料脂肪水平的升高而上升,17.65%脂肪组显著高于5.76%脂肪组(P<0.05);脏体比随着饲料脂肪水平的升高先升高后下降,以11.05%脂肪组最高,显著高于5.76%和17.65%脂肪组(P<0.05)。

表3 饲料脂肪水平对大口黑鲈形体指标的影响
同行数据肩标无字母或相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values without letter or with the same small letter superscripts indicated no significant difference (P>0.05), while with different small letter superscripts indicated significant difference (P<0.05). The same as below.
2.2 饲料脂肪水平对大口黑鲈组织脂肪酸组成的影响
饲料脂肪水平对大口黑鲈肌肉脂肪酸组成的影响见表4。相关性分析表明大口黑鲈肌肉脂肪酸的组成与饲料脂肪酸的组成存在正相关关系,肌肉中DHA的比例及n-3高不饱和脂肪酸(HUFA)/n-6 HUFA、C22∶6n-3(DHA)/C20∶5n-3(EPA)随着饲料脂肪水平的升高而表现出下降的趋势,与饲料中三者的变化趋势相一致,均以5.76%脂肪组最高。随着饲料脂肪水平的升高,肌肉中饱和脂肪酸(SFA)的比例下降,而多不饱和脂肪酸(PUFA)的比例上升。n-6 HUFA的比例随着饲料脂肪水平的升高而显著上升(P<0.05),这也与饲料中n-6 HUFA比例的变化趋势相一致。

表4 饲料脂肪水平对大口黑鲈肌肉脂肪酸组成的影响(占总脂肪酸的百分比)
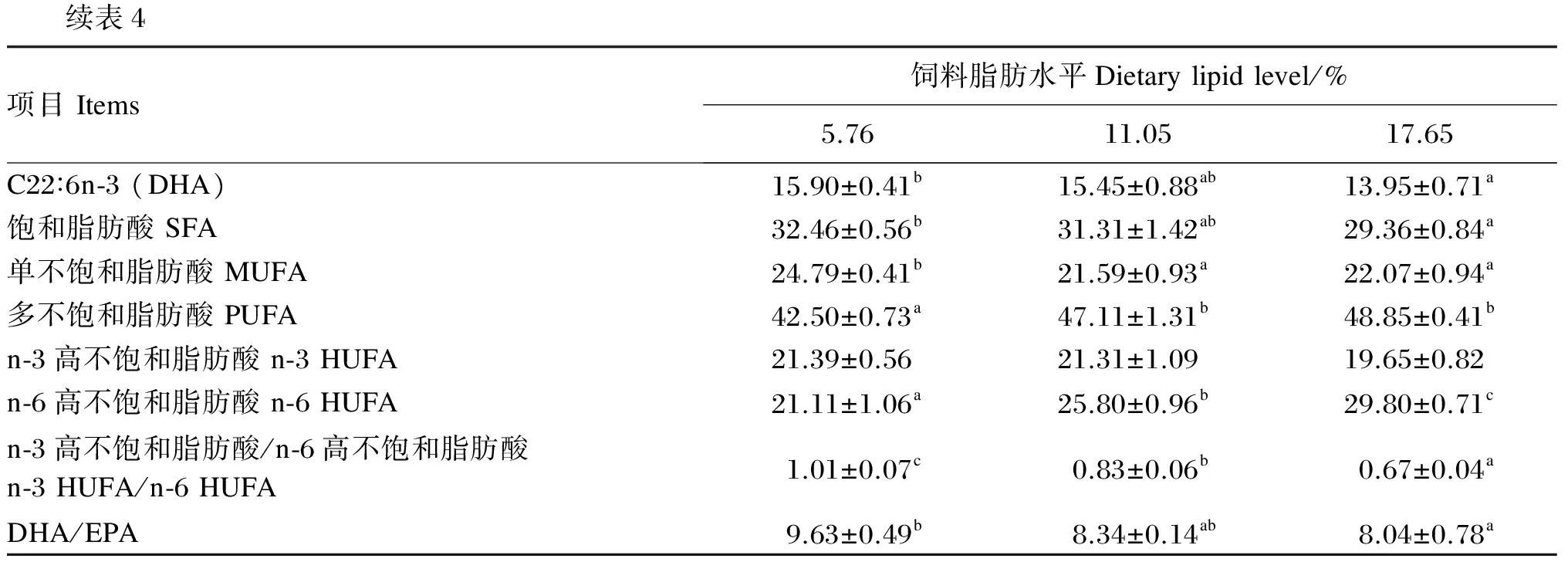
续表4项目Items饲料脂肪水平Dietarylipidlevel/%5.7611.0517.65C22∶6n⁃3(DHA)15.90±0.41b15.45±0.88ab13.95±0.71a饱和脂肪酸SFA32.46±0.56b31.31±1.42ab29.36±0.84a单不饱和脂肪酸MUFA24.79±0.41b21.59±0.93a22.07±0.94a多不饱和脂肪酸PUFA42.50±0.73a47.11±1.31b48.85±0.41bn⁃3高不饱和脂肪酸n⁃3HUFA21.39±0.5621.31±1.0919.65±0.82n⁃6高不饱和脂肪酸n⁃6HUFA21.11±1.06a25.80±0.96b29.80±0.71cn⁃3高不饱和脂肪酸/n⁃6高不饱和脂肪酸n⁃3HUFA/n⁃6HUFA1.01±0.07c0.83±0.06b0.67±0.04aDHA/EPA9.63±0.49b8.34±0.14ab8.04±0.78a
饲料脂肪水平对大口黑鲈肝脏脂肪酸组成的影响见表5。相关性分析表明,大口黑鲈肝脏脂肪酸的组成与饲料、肌肉脂肪酸的组成存在正相关关系,肝脏中DHA比例及n-3 HUFA/n-6 HUFA、DHA/EPA随着饲料脂肪水平的升高而下降,而n-6 HUFA的比例则随着饲料脂肪水平的升高而显著上升(P<0.05),与饲料、肌肉中这四者的变化趋势相一致,其中5.76%脂肪组中n-3 HUFA/n-6 HUFA显著高于其他2组(P<0.05)。随着饲料脂肪水平的升高,肝脏中SFA的比例下降,而PUFA的比例上升,这也同肌肉中这两者的变化趋势相一致。

表5 饲料脂肪水平对大口黑鲈肝脏脂肪酸组成的影响(占总脂肪酸的百分比)
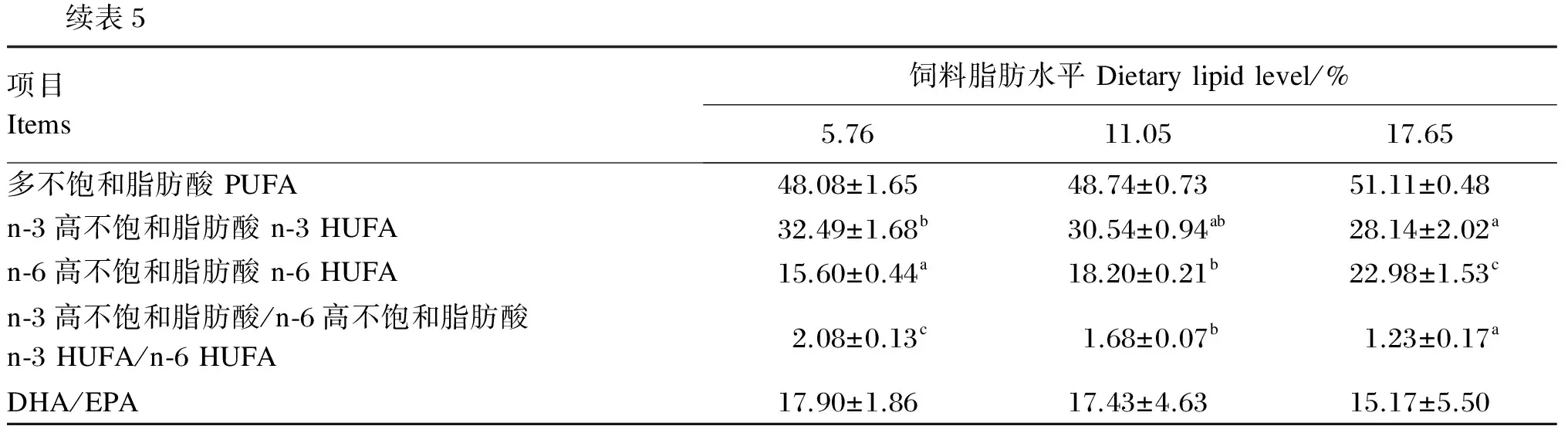
续表5项目Items饲料脂肪水平Dietarylipidlevel/%5.7611.0517.65多不饱和脂肪酸PUFA48.08±1.6548.74±0.7351.11±0.48n⁃3高不饱和脂肪酸n⁃3HUFA32.49±1.68b30.54±0.94ab28.14±2.02an⁃6高不饱和脂肪酸n⁃6HUFA15.60±0.44a18.20±0.21b22.98±1.53cn⁃3高不饱和脂肪酸/n⁃6高不饱和脂肪酸n⁃3HUFA/n⁃6HUFA2.08±0.13c1.68±0.07b1.23±0.17aDHA/EPA17.90±1.8617.43±4.6315.17±5.50
2.3 饲料脂肪水平对大口黑鲈血清生化指标的影响
饲料脂肪水平对大口黑鲈血清生化指标的影响见表6。饲料脂肪水平对大口黑鲈血清中谷草转氨酶活性及葡萄糖、总蛋白含量没有产生显著影响(P>0.05),其中,谷草转氨酶活性和葡萄糖含量有随饲料脂肪水平的升高呈现先降低后升高的趋势,而总蛋白含量的变化趋势则是相反的。饲料脂肪水平由5.76%升高到11.05%或17.65%,大
口黑鲈血清中碱性磷酸酶活性以及总胆固醇、高密度脂蛋白、低密度脂蛋白含量均显著升高(P<0.05),而谷丙转氨酶活性则显著下降(P<0.05),但上述指标在11.05%和17.65%脂肪组之间均没有显著差异(P>0.05)。大口黑鲈血清中甘油三酯含量随着饲料脂肪水平的升高表现为先上升再下降的趋势,11.05%脂肪组显著高于5.76%和17.65%脂肪组(P<0.05)。

表6 饲料脂肪水平对大口黑鲈血清生化指标的影响
2.4 饲料脂肪水平对大口黑鲈肝脏抗氧化指标的影响
饲料脂肪水平对大口黑鲈肝脏抗氧化指标的影响见表7。饲料脂肪水平对大口黑鲈肝脏SOD、GSH-Px、AKP、ALT活性及MDA含量均没有产生显著影响(P>0.05),其中,GSH-Px活性和MDA含均随着饲料脂肪水平的升高而下降,且均以17.65%脂肪组最低,而AKP、ALT活性则随着饲料脂肪水平的升高先下降再升高。大口黑鲈肝脏CAT活性以11.05%脂肪组最高,显著高于5.76%和17.65%脂肪组(P<0.05)。大口黑鲈肝脏AST活性以17.65%脂肪组最高,显著高于5.76%和11.05%脂肪组(P<0.05)。
3 讨 论
3.1 饲料脂肪水平对大口黑鲈形体指标的影响
脂肪作为鱼类必需的营养物质,是能量的主要来源之一,对其生命活动有着重要的作用[23],肉食性鱼类对脂肪的需求大于草食性鱼类,冷水性鱼类大于暖水性鱼类[24]。在饲料中添加适宜的脂肪对蛋白质具有明显的节约作用[8,25]。一般而言,随着饲料脂肪水平的升高,肝脏脂肪含量也会相应增加,这是因为饲料中的高脂可以促进肝脏脂肪数量的增多[26],使脂肪细胞的体积变大[27],从而使更多的脂肪被肝脏容纳[28],最终使肝体比变大。本研究结果表明,饲料脂肪水平对大口黑鲈的肥满度和肝体比没有显著影响,而脂体比随饲
料脂肪水平的升高而显著升高,这与上述结论不同,但与黑线鳕[29](MelanogrammusaeglefinusL.)、瓦氏黄颡鱼[30](Pelteobaggrusvachelli)、大西洋庸鲽[28](Atlanticsalmon)等鱼类的研究结果相符,说明大口黑鲈可能将肝脏中过量的脂肪储存在腹腔中[6],减少肝脏细胞脂肪的储存量。
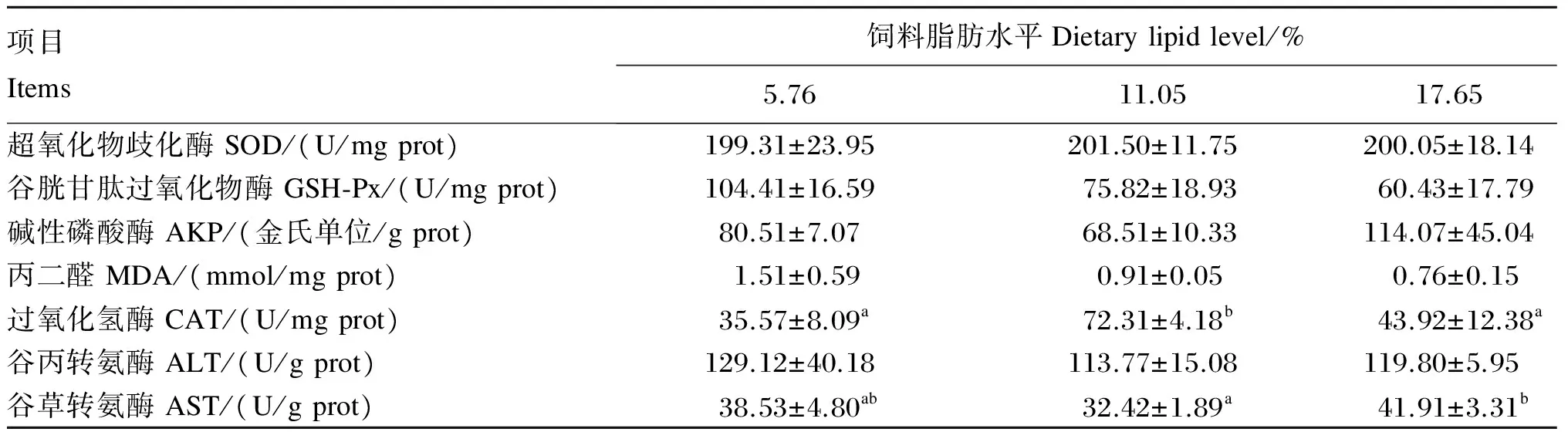
表7 饲料脂肪水平对大口黑鲈肝脏抗氧化指标的影响
3.2 饲料脂肪水平对大口黑鲈组织脂肪酸组成的影响
有研究表明,鱼类可以合成单不饱和脂肪酸(MUFA)和SFA,但是亚麻酸(C18∶3n-3)和亚油酸(C18∶2n-6)作为淡水鱼类的必需脂肪酸,不能被合成,只能通过食物来摄取[31],MUFA能使低密度脂蛋白含量下降[32]。目前,在鲈鱼(Atractoscionnobilis)[33]、杂交罗非鱼[34]的研究中报道,鱼类摄食饲料中的脂肪酸组成会影响鱼类本身的脂肪酸组成。本试验结果表明,大口黑鲈肌肉和肝脏脂肪酸组成受饲料脂肪酸组成的影响,随着饲料脂肪水平的升高,肌肉和肝脏中SFA的比例为下降趋势,PUFA的比例为升高趋势,这与饲料中对应脂肪酸的变化规律有较高的一致性。鱼体脂肪酸中n-3 HUFA/n-6 HUFA是决定水产品质量优劣的重要因素之一,WHO/FAO的推荐值是在0.1~0.2[35],在大口黑鲈的试验中,肌肉n-3 HUFA/n-6 HUFA大于WHO/FAO推荐值,因此大口黑鲈的肌肉营养价值比较高。
大多数研究报告显示,比起EPA,鱼体能积累更多的DHA[28,36-37]。这与本试验所得结果一致,即大口黑鲈肌肉DHA的比例要远远高于EPA的比例。DHA和EPA对鱼类的生长起着重要的作用,Trushenski等[38]指出,军曹鱼需要依靠补充DHA才能满足长链n-3 PUFA的需求,在石斑鱼细胞防御机制中,DHA比EPA更加关键[39]。因此,在大口黑鲈肌肉中DHA的积累量高于EPA有着非常重要的意义。
3.3 饲料脂肪水平对大口黑鲈血清生化指标的影响
鱼类血液生理生化指标与自身的营养状况、代谢及疾病有着紧密关系,当外界环境发生变化时,鱼体受到影响,鱼类在环境应激下的健康状态都会通过血液的生理生化指标反映出来[40]。胆固醇代谢是脂质代谢的重要部分之一,胆固醇主要由肝脏产生,要和脂蛋白结合才能运输[41],肝脏中的总胆固醇含量升高会影响肝脏细胞的功能。脂蛋白分为高密度脂蛋白和低密度脂蛋白,高密度脂蛋白能将肝脏外的胆固醇送到肝脏分解,而低密度脂蛋白的作用正好相反,将肝脏内的胆固醇输送到各个组织中[42]。在大菱鲆[16](Psettamaxima)和团头鲂[43](Megalobramaamblycephala)的研究中发现,血液中甘油三酯含量随饲料脂肪水平的升高而升高,说明鱼体为应对高脂饲料,提高了对脂肪的吸收及运输能力。在本试验中,血清中甘油三酯含量随饲料脂肪水平的升高表现出先升高后下降的趋势,这与向枭等[14]在白甲鱼和赵巧娥等[44]在鳡幼鱼上所得结果一致。王兴强等[45]认为,鱼类能够吸收饲料中的脂肪并转化为游离脂肪酸,最后进入肝脏中。因此,当饲料脂肪水平低于11.05%时,大口黑鲈摄食的脂肪量随饲料脂肪水平的升高而变大,使肝脏中游离氨基酸变多,从而使肝脏中合成及向外输送更多的甘油三酯,最终使血清中的甘油三酯含量增多;而饲料脂肪水平高于17.65%时,大口黑鲈提高了对脂肪的吸收及运输能力,血清中甘油三酯的含量会减少[46]。本试验中,当饲料脂肪水平高于11.05%时,大口黑鲈肝脏脂肪积累增多,导致肝细胞受损,减弱了肝脏合成甘油三酯的能力。
在动物体内,碱性磷酸酶直接参与磷酸基团的代谢和转移,与脂质、蛋白质等代谢有关,同时受到机体生长阶段、营养状况和环境变化及疾病的影响[47]。当动物肝脏受损时,血清的碱性磷酸酶活性会显著升高[48]。本试验中,随着饲料脂肪水平的升高,血清中碱性磷酸酶活性表现为升高的趋势,这与在奥尼罗非鱼[48]上的研究结果基本一致。
3.4 饲料脂肪水平对大口黑鲈肝脏抗氧化指标的影响
SOD和CAT作为生物抗氧化酶的重要组成酶类,可以保护细胞,使其免受过氧化损伤。GSH-Px作为机体中重要的过氧化物分解酶,能把有害的过氧化物还原成无害的羟基化合物,起到保护细胞膜的结构和功能的作用[32]。MDA作为油脂氧化酸败的终产物之一,可以直接用来评价机体的氧化损伤程度[49]。本试验中,肝脏中SOD和CAT的活性随饲料脂肪水平的升高而表现为先升高后下降的趋势,表明一定的饲料脂肪水平可以提高大口黑鲈肝脏中抗氧化酶的活性,从而提高大口黑鲈的抗氧化能力,但是过高的脂肪水平会使肝脏的抗氧化能力减弱。随着饲料脂肪水平的升高时,肝脏中GSH-Px的活性及MDA的含量均表现为下降趋势,这与施兆鸿等[50]在褐菖鲉上的研究结果一致,分析原因可能是由于大口黑鲈在高脂饲料下肝脏中积累了大量的脂肪,导致MDA含量上升,使肝脏细胞受到损伤。
4 结 论
饲料脂肪水平能够影响大口黑鲈的脂肪沉积,改变大口黑鲈组织脂肪酸组成,并且通过影响血清中高密度脂蛋白和低密度脂蛋白的含量,改变大口黑鲈对脂肪的转运和利用能力,且当饲料脂肪水平超过11.05%时,容易使大口黑鲈的肝功能受损。
[1] BROWN T G,RUNCIMAN B,POLLARD S,et al.Biological synopsis of largemouth bass (Micropterussalmoides)[J].Canadian Manuscript Report of Fisheries and Aquatic Sciences,2009,2884:1-27.
[2] 朱志明,朱旺明,蓝汗冰.加州鲈(Micropterussalmoides)生物学特性和营养需求研究进展[J].饲料工业,2014,35(16):31-36.
[3] 丁庆秋,陈宇航,曹双俊,等.大口黑鲈的营养需求研究进展[J].养殖与饲料,2013,9(11):38-43.
[4] 刘淑梅,倪信岳.加州鲈不同发育阶段的食性[J].水产科技情报,1996,23(5):225-228.
[5] 李静红,雷光英,李丽雪,等.广东加州鲈产业现状及发展建议[J].水产养殖,2012(9):21-24.
[6] 覃川杰,陈立侨,李二超,等.饲料脂肪水平对鱼类生长及脂肪代谢的影响[J].水产科学,2013,32(8):485-491.
[7] 徐后国.饲料脂肪酸对鲈鱼幼鱼生长、健康及脂肪和脂肪酸积累的影响[D].博士学位论文.青岛:中国海洋大学,2013.
[8] 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996.
[9] JAFRI A K.Effect of dietary carbohydrate-to-lipid ratio on growth and body composition of walking catfish (Clariasbatrachus)[J].Aquaculture,1998,161(1/2/3/4):159-168.
[10] TAN Q,XIE S,ZHU X,et al.Effect of dietary carbohydrate to lipid ratios on growth and feed utilization in Chinese longsnout catfish (LeiocassislongirostrisGünther)[J].Journal of Applied Ichthyology,2007,23(5):605-610.
[11] CHOU B S,SHIAU S Y.Optimal dietary lipid level for growth of juvenile hybrid tilapia,Oreochromisniloticus×Oreochromisaureus[J].Aquaculture,1996,143(2):185-195.
[12] 李坚明,甘辉,冯广朋,等.饲料脂肪含量与奥尼罗非鱼幼鱼肝脏形态结构特征的相关性[J].南方水产科学,2008,4(5):37-43.
[13] 池作授,耿旭,郭云学,等.奥尼罗非鱼仔稚鱼饲料中适宜脂肪水平的研究[J].中国饲料,2010(20):32-37.
[14] 向枭,周兴华,陈建,等.饲料脂肪水平对白甲鱼幼生长性能、体组成和血清生化指标的影响[J].动物营养学报,2013,25(8):1805-1816.
[15] SARGENT J R,HENDERSON R J,TOCHER D R.The lipids[M]//HALVER J E.Fish nutrition.London:Academic Press,1989:154-209.
[16] REGOST C,ARZEL J,CARDINAL M,et al.Dietary lipid level,hepatic lipogenesis and flesh quality in turbot (Psettamaxima)[J].Aquaculture,2001,193(3/4):291-309.
[17] 梁勤朗.饲料蛋白质水平与必需氨基酸补充对大口黑鲈生长、体组成和免疫力的影响[D].硕士学位论文.上海:上海海洋大学,2012.
[18] 陈乃松,梁勤朗,肖温温,等.在低蛋白质饲料中补充必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响[J].水生生物学报,2014,38(2):262-271.
[19] 周恒永,大口黑鲈对饲料中精氨酸需求量的研究[D].硕士学位论文.上海:上海海洋大学,2011.
[20] 王广军,吴锐全,谢骏,等,大口黑鲈对四种蛋白质饲料原料的表观消化率研究[J].渔业现代化,2008,35(6):36-39.
[21] MAI K,WAN J,AI Q,et al.Dietary methionine requirement of large yellow croaker,PseudosciaenacroceaR[J].Aquaculture,2006,253(1):564-572.
[22] AOAC.Official methods of analysis[S].16th ed.Arlington,VA:Association of Official Analytical Chemists,1995.
[23] 王庆萍,方春林.鱼类脂肪需求研究概述[J].江西水产科技,2010(4):7-9.
[24] 蒋阳阳.不同蛋白质、脂肪和糖水平对团头鲂幼鱼生长性能、体组成和生理生化指标的影响[D].硕士学位论文.南京:南京农业大学,2012.
[25] DIAS J,ALVREZ M J,DIEZ A,et al.Regulation of hepatic lipogenesis by dietary protein/energy in juvenile European seabass (Dicentrarchuslabrax)[J].Aquaculture,1998,161(1/2/3/4):169-186.
[26] UMINO T,NAKAGAWA H,ARAI K.Development of adipose tissue in the juvenile red sea bream[J].Fisheries Science,1996,62(4):520-523.
[27] BELLARDI S,BIANCHINI M L,DOMENIS L,et al.Effect of feeding schedule and feeding rate on size and number of adipocytes in rainbow troutoncorhynchusmykiss[J].Journal of the World Aquaculture Society,1995,26(1):80-83.
[28] NANTON D A,LALL S P,MCNIVEN M A.Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock,MelanogrammusaeglefinusL.[J].Aquaculture Research,2001,32(S1):225-234.
[29] HELLAND S J,GRISDALE-HELLAND B.The influence of replacing fish meal in the diet with fish oil on growth,feed utilization and body composition of Atlantic salmon (Salmosalar) during the smoltification period[J].Aquaculture,1998,162(1/2):1-10.
[30] 袁立强,马旭洲,王武,等.饲料脂肪水平对瓦氏黄颡鱼生长和鱼体色的影响[J].上海水产大学学报,2008,17(5):577-584.
[31] 吉红,田晶晶.高不饱和脂肪酸(HUFAs)在淡水鱼类中的营养作用研究进展[J].水产学报,2014,38(9):1650-1665.
[32] 黄文文,李弋,周岐存.不同品质鱼粉对黄颡鱼幼鱼生长性能、饲料利用及肝脏抗氧化能力的影响[J].动物营养学报,2015,27(12):3744-3753.
[34] HUANG C H,HUANG M C,HOU P C.Effect of dietary lipids on fatty acid com position and lipid peroxidation in sarcoplasm ic reticulum of hybrid tilapia,Oreochromisniloticus×O.aureus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,120(2):331-336.
[35] 何志刚,刘文革,伍远安,等.饲料脂肪水平对芙蓉鲤鲫形体指标、组织脂肪含量与脂肪酸组成的影响[J].饲料研究,2016(6):36-41.
[36] XU J H,QIN J,YAN B L,et al.Effects of dietary lipid levels on growth performance,feed utilization and fatty acid composition of juvenile Japanese seabass (Lateolabraxjaponicus) reared in seawater[J].Aquaculture International,2011,19(1):79-89.
[37] MARTINS D A,VALENTE L M P,LALL S P.Effects of dietary lipid level on growth and lipid utilization by juvenile Atlantic halibut (Hippoglossushippoglossus,L.)[J].Aquaculture,2007,263(1/2/3/4):150-158.
[38] TRUSHENSKI J,SCHWARZ M,BERGMAN A,et al.DHA is essential,EPA appears largely expendable,in meeting the n-3 long-chain polyunsaturated fatty acid requirements of juvenile cobia Rachycentron canadum [J].Aquaculture,2012,326/327/328/329:81-89.
[39] LIN Y H,SHIAU S Y.Dietary lipid requirement of grouper,Epinephelusmalabaricus,and effects on immune response[J].Aquaculture,2003,225(1/2/3/4):243-250.
[40] DJANGMAH J S.The effects of feeding and starvation on copper in the blood and hepatopancreas,and on blood proteins ofCrangonvulgaris(Fabricius)[J].Comparative Biochemistry and Physiology,1970,32(4):709-731.
[41] 周顺伍.动物生物化学[M].3版.北京:中国农业出版社,2001:126-127.
[42] DEPLANO M,CONNESR,DIAZJ P,et al.Intestinal steatosis in the farm-reared sea bass Dicentrarchus labrax[J].Diseases of Aquatic Organisms,1989,6:121-130.
[43] LI X F,LIU W B,JIANG Y Y,et al.Effects of dietary protein and lipid levels in practical diets on growth performance and body composition of blunt snout bream (Megalobramaamblycephala) fingerlings[J].Aquaculture,2010,303(1/2/3/4):65-70.
[44] 赵巧娥,朱邦科,沈凡,等.饲料脂肪水平对鳡幼鱼生长、体成分及血清生化指标的影响[J].华中农业大学学报,2012,31(3):357-363.
[45] 王兴强,段青源,麦康森,等.养殖鱼类脂肪肝研究概况[J].海洋科学,2002,26(7):36-39.
[46] LIN D,MAO Y Q,CAI F S.Nutritional lipid liver disease of grass carpCtenopharyngodonidullus(C. et V.)[J].Chinese Journal of Oceanology and Lim nology,1990,8(4):363-373.
[47] 徐奇友,许红,李婵,等.用豆油代替鱼油对虹鳟生长、非特异性免疫和组织酶活性的影响[J].大连水产学院学报,2009,24(2):104-108.
[48] 甘晖,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J].上海海洋大学学报,2009,18(1):35-41.
[49] 文远红,黄燕华,王国霞,等.蝇蛆粉替代鱼粉对黄颡鱼抗氧化指标、消化酶活性及前肠、肝胰脏组织结构的影响[J].饲料工业,2015,36(4):29-35.
[50] 施兆鸿,岳彦峰,彭士明,等.饲料脂肪水平对褐菖鲉血清生化指标、免疫及抗氧化酶活力的影响[J].中国水产科学,2013,20(1):101-107.
*Corresponding author, professor, E-mail: zhouqicun@nbu.edu.cn
