介孔二氧化硅在药物递送系统中的研究进展
2018-01-23汪顺浩潘雪婷申鹤云刘惠玉
崔 妍,汪顺浩,潘雪婷,申鹤云,刘惠玉
(北京化工大学 北京市生物加工过程重点实验室,北京 100029)
近年来,纳米技术的发展为克服临床传统药物溶解度低、选择性弱、生物分布性及药代动力学差等诸多问题带来了曙光。目前,多种纳米材料,如二氧化硅、脂质体、碳材料、层状氢氧化物以及聚合物[1-2]等均被报道可用于药物递送的载体。然而,这些新型药物载体系统仍有较多局限,例如:二氧化硅溶胶和药物的直接混合会导致药物的非均匀分散,从而使药物的释放速率受到样品批次的影响[3]。脂质体载体稳定性较差,且易被网状内皮系统清除,致使到达病灶区的药物较少[4]。此外,也有研究表明,一些交联的壳聚糖微球生物相容性较差[5]。因此,理想的纳米药物载体系统应当满足生物安全性好、结构与缓控释性能稳定等基本条件。
2001年,Vallet-Regí等[1]首次提出了使用介孔材料MCM-41(Mobil composition of matter-41)作为新型药物递送系统,从而掀起了介孔二氧化硅作为药物递送载体的研究热潮[6]。已有研究表明,介孔二氧化硅具有多种优异的理化性质,如良好的体内外生物相容性、热稳定性等,使其十分适用于药物载体[7-8]。而其结构上的优势,如可调的孔径、高孔容及高比表面积,则可以保证多种药物分子的有效负载和封装[9-10]。另外,被多种基团表面修饰后介孔二氧化硅可以对多种外源及内源性刺激(如光、pH和温度等)具有响应性,进而使药物能够可控释放[11-13]。
本文中,笔者首先介绍了目前广泛应用于药物递送系统的主要介孔二氧化硅体系;其次,针对介孔二氧化硅的结构特性,探讨了药物递送效率的重要影响因素(孔径、孔容和比表面积等),并总结了近年来基于介孔二氧化硅的主要刺激响应性药物递送系统;最后,阐述了该系统在生物相容性方面的研究进展,期望为今后开发新的药物递送系统提供依据。
1 介孔二氧化硅药物递送系统
1.1 MCM结构的介孔二氧化硅
MCM是mobil composition of matter的简称。MCM系列的介孔二氧化硅主要是美孚石油公司以硅酸乙酯为硅源,通过胶束软模板法合成。在MCM系列中,针对MCM-41的研究最为普遍。MCM-41具有由规整的圆柱形介孔排列而成的一维孔道结构,孔径可以在2.0~6.5 nm之间调节[14](图1)。正是由于具有这种有序可控的孔道结构,MCM-41可以使药物均匀地装载,并实现药物的有效递送。
Qu等[15]利用MCM-41系统作为水溶性药物卡托普利的载体,发现其可以使药物缓慢可控地释放。Mathew等[16]利用N-[3-(三甲氧基硅基)丙基]苯胺和苯基三甲氧基硅烷修饰的MCM-41来用作难溶性药物的载体。Rakhshaei等[17]将掺入氧化锌的MCM-41作为药物载体,并与羧甲基纤维素水凝胶组合制备形成了柔性纳米复合水凝胶膜,再用四环素研究了纳米复合水凝胶膜的药物递送性能,结果显示四环素可以持续可控地释放。
MCM-48是MCM体系中另一类重要的介孔二氧化硅材料。与MCM-41的单向孔道不同,MCM-48具有两套相互独立的三维立方螺旋孔道网络结构,因而具有比MCM-41更高的吸附动力学参数,且传质更快[18]。Izquierdo-Barba等[19]对负载布洛芬的MCM-48进行了体外释药研究,结果表明,MCM-48也可以作为良好的药物递送载体。

图1 MCM-41形成的机制示意[14]Fig.1 Mechanistic pathways for the formation of MCM-41[14]
1.2 SBA结构的介孔二氧化硅
SBA是santa barbara amorphous的简称。SBA系列的介孔二氧化硅是利用嵌段型表面活性剂通过软模板法来合成,具有高度有序的六边形结构,孔径在5~30 nm范围内可调[20]。其中,研究较为广泛的是SBA-15。由于其孔壁较厚,相对于MCM系列材料来说,SBA-15的水热稳定性更好,且SBA-15的孔径通常大于MCM-41的孔径,这对药物分子体积的限制作用会更小。
Wang等[21]分别用SBA-15以及氨丙基修饰的SBA-15作为黄芩苷的药物载体,其中药物的负载量分别为36.3%和39.1%(质量分数),药物的释放量则分别为72.2%和98.4%。类似地,Eren等[22]用氨丙基修饰的SBA-15以及硼掺杂的SBA-15作为难溶性药物塞来昔布的载体,结果表明:前者可以使药物缓慢可控地释放,而后者则表现为突释。这均揭示了药物释放行为高度依赖于SBA-15不同的表面性质。近期,Cussa等[23]利用SBA-15作为镇痛药酮咯酸氨丁三醇的药物载体,显著改善了该药的控制释放行为,并增强了镇痛效果。
1.3 HMS结构的介孔二氧化硅
HMS是hollow mesoporous spheres的简称,是一种中空介孔材料。HMS可以通过软模板法或硬模板法来合成,其具有可调的孔径和中空空隙。与传统的介孔材料相比,其在药物递送和扩散方面表现出更多的优势。
Zhu等[24]报道了利用HMS作为布洛芬的药物载体。将HMS的药物吸附量与MCM-41进行比较,结果表明,HMS具有比MCM-41更大的药物吸附量。进一步使用阿司匹林作为模型药物研究结果也表明,由于HMS具有较高的比表面积和中空结构,在HMS中阿司匹林的吸附量高于常规的MCM-48和MCM-41。同时,他们发现HMS、MCM-48和MCM-41作为阿司匹林的药物递送系统,在体外释放过程中同样具有持续释放的特性,并遵循Fickian扩散机制。

A1—以C16TAB合成的MCM-41粉末(未压制);A2—以C16TAB合成的MCM-41片状固体(经压制);B1—以C12TAB合成的MCM-41粉末(未压制);B2—以C12TAB合成的MCM-41片状固体(经压制)图2 不同孔径的MCM-41布洛芬释放曲线[1]Fig.2 Percentage of Ibuprofen released from MCM-41[1]
Li等[25]利用金纳米颗粒和十六烷基三甲基溴化铵作为双模板合成了一系列壳厚度可调的HMS,并将其作为多柔比星的药物载体研究了体外释药行为。结果发现通过调整壳层的厚度,可以灵活方便地控制HMS中药物的释放。Fu等[26]和Yang等[27]则在HMS表面修饰多种基团使其成为多功能智能响应性药物载体。
如上所述,由于可控的孔径、高的比表面积以及表面易修饰的特性,多种介孔二氧硅体系均可以作为良好的药物递送系统。
2 介孔二氧化硅载体中药物递送效率的影响因素
2.1 孔径
一般情况下,药物的吸附是将高度浓缩的药物溶液浸泡在介孔二氧化硅基质中来实现的,而该方法主要依赖于基质的吸附性能。基质的孔径决定了可吸附到孔道中药物分子的大小。孔径的减小必然会导致药物吸附量及释放速率的降低,这与空间位阻效应相关联[28]。
Vallet-Regí等[1]使用不同链长的表面活性剂十二烷基三甲基溴化铵(C12TAB)和十六烷基三甲基溴化铵(C16TAB)制备得到不同孔径的MCM-41,并将其作为布洛芬的药物载体,结果显示:使用C16TAB获得的具有较大孔径的MCM-41药物递送系统,体外释药24 h后,约有68%的药物被释放出来。相比之下,用C12TAB获得的MCM-41在同一时间段内仅释放了55%的药物。同时,研究结果表明,用以吸附药物的MCM-41初始状态不同对药物的释放行为也有一定的影响(图2)。进一步的研究也证实了介孔二氧化硅的孔径是影响药物释放速率的关键因素之一[29]。当MCM-41药物递送系统的孔径在2.5~3.6 nm时,药物释放速率会随孔径的增大而显著增加。类似地,Jia等[30]通过控制反应时间合成了3种不同孔径的介孔二氧化硅,并将其作为紫杉醇的载体研究了药物的体外释放行为,发现了药物的释放速率依赖于孔径的大小。
2.2 比表面积
大量研究已经表明,比表面积是影响亲水性及含官能团药物分子吸附量的重要因素。具有更多硅羟基的介孔二氧化硅能够提供更多的活性位点,从而增加了药物吸附量[31]。Azais等[32]合成了Brunauer-Emmett-Teller(BET)比表面积分别为987和775 m2/g的MCM-41。两者在相同的条件下吸附布洛芬的量分别为670和600 mg/g,这表明了药物吸附量会随着比表面积的增加而增加。
2.3 孔容
药物与介孔的相互作用是表面吸附作用,然而药物与药物之间的静电相互作用可能会导致孔道的堵塞。因此,孔容亦是影响药物吸附量的重要因素。简而言之,孔容越大,药物的吸附量越高。已有研究表明,孔容分别为1.18和0.82 cm3/g的MCM-41对卡托普利的吸附量可以达到33.99%和23.60%(质量分数)[33]。因此,孔容是影响药物吸附量的另一个重要因素。
2.4 孔结构类型
介孔二氧化硅的孔结构类型对药物的吸附和释放也有一定的影响。已有研究表明,相互连通的孔道类型能够提供更为通畅的通气过程。具有三维立方连通孔道的SBA-1与具有相似孔径和比表面积而无连通孔道的SBA-3相比,SBA-1具有更快的药物释放速率[34]。另外,研究还表明,相对于其他类型的孔结构,笼状一维结构的孔道能够提供更高的药物吸附量以及更缓慢的药物释放速率[34]。Kjellman等[35]分别利用有无微孔的SBA-15作为疏水性药物达沙替尼的载体,并研究了它们的体外释放行为,结果显示:具有微孔的SBA-15体外释药行为更为理想,在初始状态,药物释放速率较高,之后则保持在一定的水平范围。这可能是由于微孔的存在能够使难溶性药物以单个分子的形式被限制在孔道中,进而使药物可以稳定地释放。然而,当无微孔存在时,药物更容易结晶成稳固的且不易溶的水合物形式,从而导致药物的释放速率随着时间的推移而降低。
2.5 表面官能化
通常情况下,药物分子通过弱的非共价相互作用(如氢键、物理吸附和静电相互作用)与介孔二氧化硅相结合。因此,采用适当的官能团对其进行修饰可以改善药物的吸附和释放性能。Mortazavi等[36]用3-氨丙基三乙氧基硅烷改性后的MCM-41作为布洛芬的药物载体,结果表明:由于改性后的MCM-41与药物形成了较强的共价键,使得药物释放速度减缓,从而实现药物的可控释放。Bouchoucha等[37]用磷酸酯硅烷对介孔二氧化硅进行表面修饰,发现其可以更好地控制带正电荷药物的吸附和释放。
2.6 壳层厚度
对于中空介孔二氧化硅而言,壳层的厚度也会影响药物的释放行为。正如图3所示,在相同时间内,随着壳层厚度的减小,药物的释放百分量明显增加,而空心尺寸的变化则对药物释放量的影响较小。这主要是由于HMS的壳层越薄,其对药物扩散的限制能力越弱,药物的释放百分量显著增加。但空心尺寸的变化并不会影响药物的扩散能力,不同空心尺寸的HMS药物释放百分量基本相同。因此,药物的释放行为主要受壳层厚度的影响[25]。
综上所述,在介孔二氧化硅药物递送系统中,载体对药物的吸附和释放性能是衡量药物递送效率的重要指标。药物的递送效率主要与介孔二氧化硅的孔径、孔容、比表面积、孔结构类型及表面官能化有关。孔径和孔容主要通过空间位阻来影响药物的吸附与释放。而比表面积和表面官能化则主要通过增加活性作用位点以及药物与介孔二氧化硅的相互作用力来增加药物的吸附量。孔道的结构类型在一定程度上也会影响药物的吸附和释放。此外,对于中空介孔二氧化硅而言,其壳层的厚度会影响药物的扩散能力进而影响药物的释放性能。

C—核;S—壳图3 不同外壳厚度(左)和空心大小(右)的HMS药物释放曲线[25]Fig.3 Percentage of drug released from HMS with different shell thicknesses (left) and various sizes of hollow cores (right)[25]
3 刺激响应性药物递送系统
3.1 pH响应性的药物递送系统
迄今为止,研究者已经开发出了多种pH响应性的药物递送系统。生物体内pH的变化主要来源于以下两点:与正常组织相比,肿瘤部位的pH为5.8~7.6[38];人体整个胃肠道的pH范围较为广泛,胃内的pH为1.0~3.0,小肠内的pH 为6.5~7.0,而结肠的pH为7.0~8.0[39]。因此,基于酸性pH响应的药物递送系统可以靶向地控制药物释放到肿瘤部位。
Fisher等[40]利用Al-MCM-41和荧光素作为模型首次研究了pH变化对药物分子释放的影响。近年来,Li等[41]利用两种不同功能化的环糊精,通过疏水相互作用与MCM-41连接,将抗菌药物莫西沙星封装在孔道中。当pH降低时,功能化的环糊精发生质子化解离而使药物释放出来。Cheng等[42]将D-α-琥珀酸生育酚聚乙二醇酯与聚多巴胺官能化的介孔二氧化硅作为pH响应性的药物递送系统,用于可控地递送多柔比星来治疗非小细胞肺癌。Rim等[43]则利用可吸收的磷化钙(CaP)包被的介孔二氧化硅作为pH响应性药物递送系统。当pH较低时,CaP溶解使封装的药物更容易地释放出来。Li等[44]设计合成了一种以金纳米粒子为核心、碳-介孔二氧化硅为外壳的中空纳米胶囊,进一步将多柔比星装载在纳米胶囊中形成了复合的药物递送系统。由于pH的变化,药物分子和纳米胶囊间的范德华力发生改变而使药物释放出来。Kienzle等[45]介绍了一种新型的树突状介孔二氧化硅,并使其作为肿瘤坏死因子α(TNF-α)的pH响应性递送系统。
3.2 氧化还原响应性药物递送系统
利用氧化还原反应介导药物释放是刺激响应性药物递送系统中的又一实例。二硫键易于与各种还原剂发生反应,因而具有敏感的氧化还原特性,可以作为氧化还原响应性药物递送系统的作用位点。
Xiao等[46]将富含色氨酸的支链肽通过二硫键与介孔二氧化硅连接而使药物封装在孔道中。一旦其被吞入癌细胞中,胞内高浓度的谷胱甘肽会使二硫键断裂,支链肽脱离,促使药物从孔道中释放出来。Wu等[47]成功合成了一种中空介孔有机硅,并通过二硫键在其上连接聚β-氨基酯作为siRNA以及多柔比星的氧化还原响应性药物递送系统。Palanikumar等[48]通过一锅法合成了聚合物连接的介孔二氧化硅,合成过程中添加含有硫醇的配体分子,使负载在孔道中的药物分子可以通过胞内的还原性微环境靶向释放。类似地,Zhang等[49]通过一锅法合成了含有二硫键的介孔二氧化硅作为多柔比星的氧化还原响应性药物递送系统。
3.3 温度响应性药物递送系统
在刺激响应性药物递送系统中,除pH和氧化还原响应外,另一种常见的刺激响应方式是温度响应。其中,将连接有聚N-异丙基丙烯酰胺(pNIPAM)的介孔二氧化硅作为温度响应性复合药物递送系统的研究最为普遍。pNIPAM是一种理想的温度敏感性聚合物,其可以在低临界溶解温度(LCST)(约32 ℃)下完成亲水性到疏水性的转变[50]。
介孔二氧化硅与pNIPAM复合材料主要通过以下原理来实现温度响应。首先将pNIPAM聚合物沉积在介孔二氧化硅的孔内或表面。在LCST以下时,由于pNIPAM分子链溶胀阻塞孔道,且pNIPAM和药物分子间可以形成氢键,能够防止药物从孔道中释放。在LCST之上时,聚合物转变为疏水性并收缩,导致孔道的开放和氢键的断裂,进而使药物分子释放出来[51]。Ugazio等[52]利用介孔二氧化硅与pNIPAM复合材料作为槲皮素的温度响应性药物递送系统,并将其应用在皮肤病治疗方面。Bathfield等[53]则直接将pNIPAM和硅源混合,一步合成了温度响应性的药物递送系统,该方法简单又快捷。
Ruiz-Hernandez等[54]和Schlossbauer等[55]探索了一种新型的基于DNA热响应性药物递送系统,其中DNA/磁性纳米颗粒和生物素标记的DNA能够覆盖介孔二氧化硅的孔道。在特定的DNA解链温度下,DNA双链打开使孔道开放,从而释放装载在孔中的模型药物(图4)。
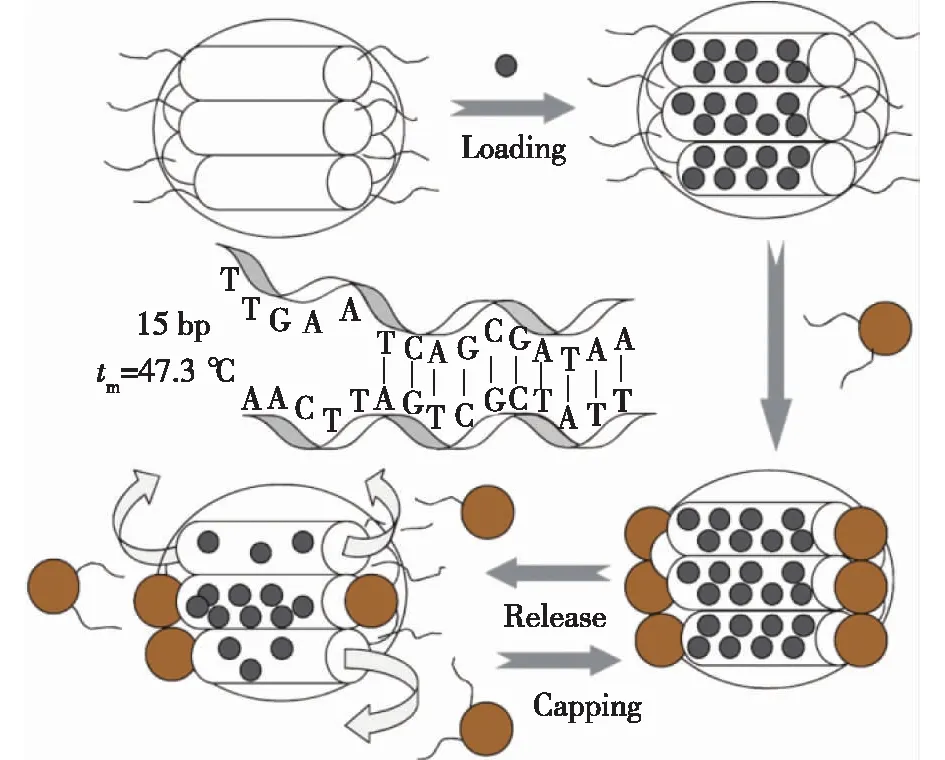
tm—DNA解链温度;bp—碱基对图4 DNA/磁性纳米颗粒-介孔二氧化硅作为 热响应性药物递送系统的示意图[54]Fig.4 Schematic illustration of the magnetic mesoporous silica coated with DNAfor thermo-responsive controlled drug release[54]
3.4 光响应性药物递送系统
光也是刺激响应性药物递送系统的一种刺激因素。Ferris等[56]报道了在MCM-41中装载偶氮苯衍生物,从而开发了光响应性药物递送系统。偶氮苯及其衍生物在紫外-可见光下可以发生可逆性转变。在可见光下,偶氮苯衍生物为反式结构,可以与β-环糊精结合而阻止MCM-41孔道中药物的释放。在300~380 nm光照射下,它的结构从反式转变为顺式,而从β-环糊精上解离下来,MCM-41孔道中药物得以释放。因此,偶氮苯及其衍生物能够对药物释放具有光响应性。
此外,Guardado-Alvarez等[57]介绍了基于光不稳定性香豆素分子的近红外光(near infrared,NIR)响应性药物递送系统。他们将香豆素分子结合到改性后的介孔二氧化硅表面,并进一步将β-环糊精分子与香豆素分子非共价连接,阻止药物释放。在800 nm的光照下,香豆素与介孔二氧化硅间的共价键断裂,从而使药物分子与β-环糊精分子快速释放。Yang等[58]以金纳米笼为核心,介孔二氧化硅和pNIPAM为外壳合成了NIR响应的复合药物递送系统。在NIR照射下,金纳米笼可以有效地将吸收的光能转化为热能,使pNIPAM分子链收缩,进而促进介孔二氧化硅孔道中的药物释放(图5)。类似地,Li等[44]合成了内核为金纳米粒子、外壳为碳-二氧化硅的复合纳米胶囊,用以装载多柔比星,结果表明该复合体系能够实现药物对NIR响应性的靶向释放。Liu等[59]则制备了外层连接单壁碳纳米管的介孔二氧化硅作为多柔比星的NIR响应性药物递送系统。
3.5 超声响应性药物递送系统
超声波具有非侵入性、无电离辐射等优点,且可以通过调谐频率、占空比和超声时间来调节组织穿透深度,因此,可作为药物可控释放的外部刺激因素。
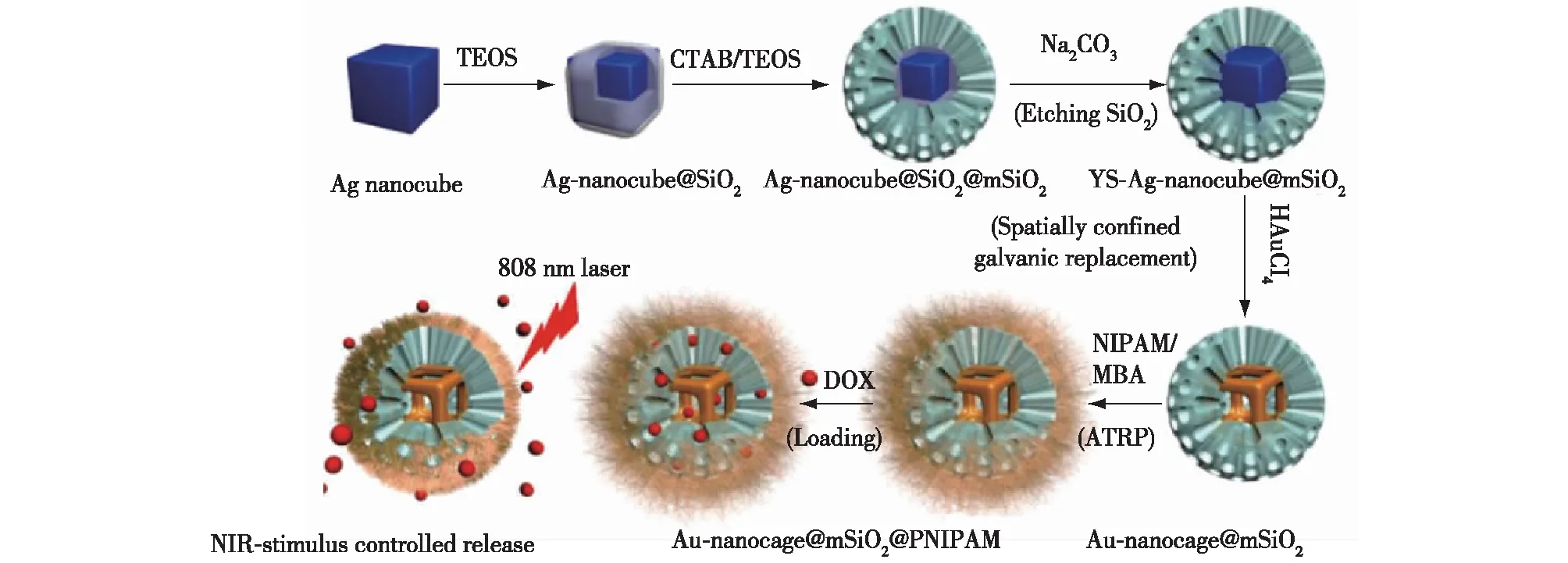
TEOS—原硅酸四乙酯;MBA—N,N′-亚甲基双丙烯酰胺;ATRP—原子转移自由基聚合;NIPAM—N-异丙基丙烯酰胺图5 金纳米笼-介孔二氧化硅- pNIPAM核壳复合结构作为NIR响应性药物递送系统的示意[58]Fig.5 Schematic illustration of the gold nanocages@mesoporous silica core-shell structure coated with a smart polymer (Au-nanocage@mSiO2@pNIPAM) for NIR-response controlled drug release[58]
在Kim等[60]的研究工作中,他们利用聚二甲基硅氧烷-介孔二氧化硅复合材料来装载布洛芬,使其可以在超声刺激下释放。Paris等[9]开发了一种新型的温度-超声双重响应性药物递送系统。他们将一种温度响应性和超声响应性的共聚物接枝在介孔二氧化硅表面上。在4 ℃时,温度响应性聚合物为亲水性,药物分子可以扩散到开放的孔道中。在37 ℃时,其则转变为疏水性阻止药物分子进出孔道。然而,在超声波的作用下,超声响应性疏水聚合物四氢吡喃甲基丙烯酸酯可以被水解为亲水性的甲基丙烯酸,极性的变化会引起孔道的开放进而使药物分子释放出来。Lv等[61]合成了介孔二氧化硅与微泡复合材料来作为超声响应性的药物递送系统。他们利用表面修饰叶酸的介孔二氧化硅装载丹参酮IIA,并将其封装在气体填充的微泡中,在超声波的刺激下,微泡破裂而使药物释放出来。
如上所述,为了使药物能够可控释放,人们开发出了多种刺激响应性药物递送系统。在这个系统中,载有药物分子的介孔二氧化硅可以被各种“门卫”(gatekeepers)(如纳米粒子、大分子化合物和聚合物等)所覆盖,药物分子不能从孔道中释放。只有在一定的外界环境(如pH、还原剂、光、热和超声等)刺激下,“门卫”才能被移除,从而使药物释放出来。
4 介孔二氧化硅药物递送系统的生物相容性
众所周知,作为药物载体的材料会不可避免地暂时或永久性地滞留在体内,在一定程度上必然会影响机体的功能。因此,一种材料能否作为药物的载体,生物相容性是首要考虑的因素[28]。
Lu等[62]研究了Hela细胞(人宫颈癌细胞)对不同粒径介孔二氧化硅的摄取能力,结果表明:细胞摄取量从高到低依次对应的粒径为50、30、110、280和170 nm,其中50 nm的介孔二氧化硅细胞摄取量约是30 nm的2.5倍。He等[63]发现残留的表面活性剂会导致一定的细胞毒性,表面活性剂的浓度(1 mg/mL)较低时,介孔二氧化硅对MDA-MB-468细胞(人乳腺癌细胞)和COS-7细胞(猴肾细胞)的毒性均较低,而表面活性剂的浓度(10 mg/mL)较高时,细胞毒性则迅速增加。
Huang等[64]利用介孔二氧化硅静脉给药1 d和18 d后,测定了不同形状的介孔二氧化硅对血液生化指标的影响,结果表明:所测定的生化指标值,如红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC)、血小板(PLT)和白细胞(WBC)等均在正常范围内,不同形状的介孔二氧化硅均未显示出明显的毒性,这表明了介孔二氧化硅具有优异的生物相容性。He等[65]分别研究了不同粒径(80、120、200和360 nm)的球形介孔二氧化硅通过静脉给药后的体内生物分布,研究发现:静脉注射后,不同粒径大小的介孔二氧化硅主要分布在肝脏和脾脏中,少数分布在肾脏和心脏中,且较小粒径的颗粒具有更长的血液循环时间。Fu等[66]则系统地研究了不同给药途径下介孔二氧化硅的生物相容性,他们发现:相比于皮下注射和肌内注射,口服和静脉给药后,其具有更好的生物相容性。这说明给药方式在一定程度上会影响介孔二氧化硅的体内摄取,进一步影响其生物相容性。
总而言之,在一定剂量范围内,介孔二氧化硅的体内外研究中均显示其具有良好的生物相容性,尤其是对其进行修饰后可以进一步地降低毒性。然而,更为深入的毒性机制仍需要更加细致的研究。
5 总结和展望
介孔二氧化硅具有稳定的介孔结构、大的比表面积和良好的生物相容性,这使其可以作为优良的药物递送载体。针对基于介孔二氧化硅的药物递送系统,文中更进一步探讨了影响药物递送效率的参数,如孔径、孔容、比表面积以及表面官能化等。此外,通过对介孔二氧化硅进一步功能化修饰,可以使其对某些外部刺激(如pH、氧化还原环境、温度、光以及超声等)具有一定的响应性,进而能够实现对负载药物的靶向释放。
然而,介孔二氧化硅药物递送系统也存在一些亟待解决的问题。首先,尽管传统的聚乙二醇化在一定程度上能够减小介孔二氧化硅的非特异性摄取,但其在肝脏和脾脏等非靶向器官中的广泛累积仍然不可避免。因此,探索新的靶向配体用以修饰介孔二氧化硅,以增强其在靶向细胞及器官的累积是十分必要的。其次,为了达到治疗目的,通常需要持续多次给药以达到有效的药物浓度,故介孔二氧化硅的降解性能尤为重要。虽然介孔二氧化硅能够代谢为可清除的硅酸盐,但在多数情况下,它被生物降解的速度非常慢,因此,它的降解性能仍需要进一步提高。最后,纵然介孔二氧化硅在一些体内外研究中已经被证实其具有良好的生物相容性,但由于人体生理环境复杂,它的生物安全性还远远不能确定,将介孔二氧化硅应用于临床仍具有巨大的挑战。此外,除了急性毒性之外,介孔二氧化硅引起的慢性毒性(如遗传毒性)也不容忽视,但目前针对介孔二氧化硅对胚胎发育影响的研究仍旧较少。相信随着研究的进一步深入,以上问题均能够被依次解决,从而使介孔二氧化硅应用于药物递送系统的前景更加广阔。
[2] SOKOLSKY-PAPKOV M,AGASHI K,OLAYE A,et al.Polymer carriers for drug delivery in tissue engineering[J].Adv Drug Deliver Rev,2007,59(4):187-206.
[3] TOURNÉ-PÉTEILH C,BRUNEL D,BÉGU S,et al.Synthesis and characterisation of ibuprofen-anchored MCM-41 silica and silica gel[J].New J Chem,2003,27(10):1415-1418.
[4] SHARMA A,SHARMA U S.Liposomes in drug delivery:progress and limitations[J].Int J Pharm,1997,154(2):123-140.
[5] WATANABE J,IWAMOTO S,ICHIKAWA S.Entrapment of some compounds into biocompatible nano-sized particles and their releasing properties[J].Colloid Surface B,2005,42(2):141-146.
[6] MANZANO M,VALLET-REGM.New developments in ordered mesoporous materials for drug delivery[J].J Mater Chem,2010,20(27):5593-5604.
[7] TANG F,LI L,CHEN D.Mesoporous silica nanoparticles:synthesis,biocompatibility and drug delivery[J].Adv Mater,2012,24(12):1504-1534.
[8] YANG S,CHEN D,LI N,et al.Hollow mesoporous silica nanocarriers with multifunctional capping agents for in vivo cancer imaging and therapy[J].Small,2016,12(3):360-370.
[9] PARIS J L,CABAAS M V,MANZANO M,et al.Polymer-grafted mesoporoussilica nanoparticles as ultrasound-responsive drug carriers[J].ACS Nano,2015,9(11):11023-11033.
[10] WANG X,LI X,ITO A,et al.Silica nanospheres:hollow structure improved anti-cancer immunity of mesoporous silica nanospheres in vivo[J].Small,2016,12(26):3602-3602.
[11] MENG H,XUE M,XIA T,et al.Autonomous in vitro anticancer drug release from mesoporous silica nanoparticles by pH-sensitive nanovalves[J].J Am Chem Soc,2010,132:12690-12697.
[12] CHEN F,HONG H,GOEL S,et al.In vivo tumor vasculature targeting of CuS@MSN basedtheranostic nanomedicine[J].ACS Nano,2015,9(4):3926-3934.
[13] HWANG A A,LU J,TAMANOI F,et al.Functional nanovalves on protein-coated nanoparticles for in vitro and in vivo controlled drug delivery[J].Small,2015,11(3):319-328.
[14] BECK J S,VARTULI J C,ROTH W J,et al.A new family of mesoporous molecular sieves prepared with liquid crystal templates[J].J Am Chem Soc,1992,114:10834-10843.
[15] QU F,ZHU G,HUANG S,et al.Effective controlled release of Captopril by silylation of mesoporous MCM-41[J].ChemPhysChem,2006,7(2):400-406.
[16] MATHEW A,PARAMBADATH S,PARK S S,et al.Hydrophobically modified spherical MCM-41 as nanovalve system for controlled drug delivery[J].Micropor Mesopor Mat,2014,200:124-131.
[17] RAKHSHAEI R,NAMAZI H.A potential bioactive wound dressing based on carboxymethyl cellulose/ZnO impregnated MCM-41 nanocomposite hydrogel[J].Mat Sci Eng C,2017,73:456-464.
[18] LEE J W,SHIM W G,MOON H.Adsorption equilibrium and kinetics for capillary condensation of trichloroethylene on MCM-41 and MCM-48[J].Micropor Mesopor Mat,2004,73:109-119.
[19] IZQUIERDO-BARBA I,MARTINEZ,DOADRIO A L,et al.Release evaluation of drugs from ordered three-dimensional silica structures[J].Eur J Pharm Sci,2005,26(5):365-373.
[20] ZHAO D,FENG J,HUO Q,et al.Triblock copolymer syntheses of mesoporous silica with periodic 50 to 300 angstrom pores[J].Science,1998,279:548-552.
[21] WANG H,GAO X,WANG Y,et al.Effect of amine functionalization of SBA-15 on controlled baicalin drug release[J].Ceram Int,2012,38(8):6931-6935.
[22] EREN Z S,TUNÇER S,GEZER G,et al.Improved solubility of celecoxib by inclusion in SBA-15 mesoporous silica:drug loading in different solvents and release[J].Micropor Mesopor Mat,2016,235:211-223.
[23] CUSSA J,JUREZ J M,COSTA M B G,et al.Nanostructured SBA-15 host applied in ketorolac tromethamine release system[J].J Mater Sci Mater Med,2017,28(8):113.
[24] ZHU Y,SHI J,LI Y,et al.Hollow mesoporous spheres with cubic pore network as a potential carrier for drug storage and its in vitro release kinetics[J].J Mater Res,2005,20(1):54-61.
[25] LI Y,LI N,PAN W,et al.Hollow mesoporous silica nanoparticles with tunable structure for controlled drug delivery[J].ACS Appl Mater Interfaces,2017,9(3):2123-2129.
[26] FU J,CHEN T,WANG M,et al.Acid and alkaline dual stimuli-responsive mechanized hollow mesoporous silica nanoparticles as smart nanocontainers for intelligent anticorrosion coatings[J].ACS Nano,2013,7(12):11397-11408.
[27] YANG S,CHEN D,LI N,et al.Hollow mesoporous silica nanocarriers with multifunctional capping agents for in vivo cancer imaging and therapy[J].Small,2016,12(3):360-370.
[28] VALLET-REGM,BALAS F,ARCOS D.Mesoporous materials for drug delivery[J].Angew Chem Int Ed,2007,46(40):7548-7558.
[29] HORCAJADA P,RMILA A,PÉREZ-PARIENTE J,et al.Influence of pore size of MCM-41 matrices on drug delivery rate[J].Micropor Mesopor Mat,2004,68:105-109.
[30] JIA L,SHEN J,LI Z,et al.In vitro and in vivo evaluation of paclitaxel-loaded mesoporous silica nanoparticles with three pore sizes[J].Int J Pharm,2013,445(1/2):12-19.
[31] YANG P,GAI S,LIN J.Functionalized mesoporous silica materials for controlled drug delivery[J].Chem Soc Rev,2012,41(9):3679-3698.
[32] AZAIS T,TOURNÉ-PÉTEILH C,AUSSENAC F,et al.Solid-state NMR study of ibuprofen confined in MCM-41 material[J].Chem Mater,2006,18(26):6382-6390.
[33] QU F,ZHU G,HUANG S,et al.Controlled release of Captopril by regulating the pore size and morphology of ordered mesoporous silica[J].Micropor Mesopor Mat,2006,92:1-9.
[34] ANDERSSON J,ROSENHOLM J,AREVA S,et al.Influences of material characteristics on ibuprofen drug loading and release profiles from ordered micro- and mesoporous silica matrices[J].Chem Mater,2004,16(21):4160-4167.
[35] KJELLMAN T,XIA X,ALFREDSSON V,et al.Influence of microporosity in SBA-15 on the release properties of anticancer drug dasatinib[J].J Mater Chem B,2014,2(32):5265-5271.
[36] MORTAZAVI Y,GHOREISHI S M.Synthesis of mesoporous silica and modified as a drug delivery system of ibuprofen[J].J Nanostruct,2016,6(1):86-89.
[37] BOUCHOUCHA M,CTÉ M F,RENÉ C,et al.Size-controlled functionalized mesoporous silica nanoparticles for tunable drug release and enhanced anti-tumoral activity[J].Chem Mater,2016,28(12):4243-4258.
[38] WIKE-HOOLEY J L,HAVEMAN J,REINHOLD H S.The relevance of tumour pH to the treatment of malignant disease[J].Radiother Oncol,1984,2(4):343-366.
[40] FISHER K A,HUDDERSMAN K D,TAYLOR M J.Comparison of micro- and mesoporous inorganic materials in the uptake and release of the drug model fluorescein and its analogues[J].Chem Eur J,2003,9(23):5873-5878.
[41] LI Z,CLEMENS D L,LEE B Y,et al.Mesoporous silica nanoparticles with pH-sensitive nanovalves for delivery of moxifloxacin provide improved treatment of lethal pneumonic tularemia[J].ACS Nano,2015,9(11):10778-10789.
[42] CHENG W,LIANG C,XU L,et al.TPGS-functionalized polydopamine-modified mesoporous silica as drug nanocarriers for enhanced lung cancer chemotherapy against multidrug resistance[J].Small,2017,DOI:10.1002/smll.201700623.
[43] RIM H P,MIN K H,LEE H J,et al.pH-Tunable calciumphosphate covered mesoporous silica nanocontainersfor intracellular controlled release of guest drugs[J].Angew Chem Int Ed,2011,50(38):8853-8857.
[44] LI L,CHEN C,LIU H,et al.Multifunctional carbon-silica nanocapsules with gold core for synergistic photothermal and chemo-cancer therapy under the guidance of bimodal imaging[J].Adv Funct Mater,2016,26(24):4252-4261.
[45] KIENZLE A,KURCH S,SCHLÖDER J,et al.Dendritic mesoporous silica nanoparticles for pH-stimuli-responsive drug delivery of TNF-alpha[J].Adv Healthc Mater,2017,DOI:10.1002/adhm.201700012.
[46] XIAO D,HU J J,ZHU J Y,et al.A redox-responsive mesoporous silica nanoparticle with a therapeutic peptide shell for tumor targeting synergistic therapy[J].Nanoscale,2016,37(8):16702-16709.
[47] WU M,MENG Q,CHEN Y,et al.Large pore-sized hollow mesoporous organosilica for redox-responsive gene delivery and synergistic cancer chemotherapy[J].Adv Mater,2016,28(10):1963-1969.
[48] PALANIKUMAR L,CHOI E S,CHEON J Y,et al.Noncovalent polymer-gatekeeper in mesoporous silica nanoparticles as a targeted drug delivery platform[J].Adv Funct Mater,2015,25(6):957-965.
[49] ZHANG Q,SHEN C,ZHAO N,et al.Redox-responsive and drug-embedded silica nanoparticles with unique self-destruction features for efficient gene/drug codelivery[J].Adv Funct Mater,2017,DOI:10.1002/adfm.201606229.
[50] HESKINS M,GUILLET J E.Solution properties of poly (N-isopropylacryl-amide)[J].J Macromol Sci:Part A Chem,1968,2(8):1441-1455.
[51] CHANG B,SHA X,GUO J,et al.Thermo and pH dual responsive,polymer shell coated,magnetic mesoporous silica nanoparticles for controlled drug release[J].J Mater Chem,2011,21(25):9239-9247.
[52] UGAZIO E,GASTALDI L,BRUNELLA V,et al.Thermoresponsive mesoporous silica nanoparticles as a carrier for skin delivery of quercetin[J].Int J Pharm,2016,511(1):446-454.
[53] BATHFIELD M,REBOUL J,CACCIAGUERRA T,et al.Thermosensitive and drug-loaded ordered mesoporous silica:a direct and effective synthesis using PEO-b-PNIPAM block copolymers[J].Chem Mater,2016,28(10):3374-3384.
[54] RUIZ-HERNANDEZ E,BAEZA A,VALLET-REGM.Smart drug delivery through DNA/magnetic nanoparticle gates[J].ACS Nano,2011,5(2):1259-1266.
[55] SCHLOSSBAUER A,WARNCKE S,GRAMLICH P M E,et al.A programmable DNA-based molecular valve for colloidal mesoporous silica[J].Angew Chem Int Ed,2010,49(28):4734-4737.
[56] FERRIS D P,ZHAO Y L,KHASHAB N M,et al.Light-operated mechanized nanoparticles[J].J Am Chem Soc,2009,131:1686-1688.
[57] GUARDADO-ALVAREZ T M,SUDHA DEVI L,RUSSELL M M,et al.Activation of snap-top capped mesoporous silica nanocontainers using two near-infrared photons[J].J Am Chem Soc,2013,135:14000-14003.
[58] YANG J,SHEN D,ZHOU L,et al.Spatially confined fabrication of core-shell gold nanocages@mesoporous silica for near-infrared controlled photothermal drug release[J].Chem Mater,2013,25(15):3030-3037.
[59] LIU J,WANG C,WANG X,et al.Mesoporous silica coated single-walled carbon nanotubes as a multifunctional light-responsive platform for cancer combination therapy[J].Adv Funct Mater,2015,25(3):384-392.
[60] KIM H J,MATSUDA H,ZHOU H,et al.Ultrasound-triggered smart drug release from a poly (dimethylsiloxane)-mesoporous silica composite[J].Adv Mater,2006,18(23):3083-3088.
[61] LV Y,CAO Y,LI P,et al.Ultrasound-triggered destruction of folate-functionalized mesoporous silica nanoparticle-loaded microbubble for targeted tumor therapy[J].Adv Healthc Mater,2017,DOI:10.1002/adhm.201700354.
[62] LU F,WU S H,HUNG Y,et al.Size effect on cell uptake in well-suspended,uniform mesoporous silica nanoparticles[J].Small,2009,5(12):1408-1413.
[63] HE Q,ZHANG Z,GAO Y,et al.Intracellular localization and cytotoxicity of spherical mesoporous silica nano-and microparticles[J].Small,2009,5(23):2722-2729.
[64] HUANG X,LI L,LIU T,et al.The shape effect of mesoporous silica nanoparticles on biodistribution,clearance,and biocompatibility in vivo[J].ACS Nano,2011,5(7):5390-5399.
[65] HE Q,ZHANG Z,GAO F,et al.In vivo biodistribution and urinary excretion of mesoporous silica nanoparticles:effects of particle size and PEGylation[J].Small,2011,7(2):271-280.
[66] FU C,LIU T,LI L,et al.The absorption,distribution,excretion and toxicity of mesoporous silica nanoparticles in mice following different exposure routes[J].Biomaterials,2013,34(10):2565-2575.
