去乙酰化酶1在肝癌干细胞更新中的机制研究
2018-01-23牛静伟张勤生王桂菊
牛静伟,张勤生,王桂菊
1. 中国人民解放军第152中心医院消化内科,河南 平顶山 467000; 2. 河南中医药大学附属第二医院肝胆脾胃科; 3. 南阳南石医院病理科
肝细胞癌(hepatocellular cancer,HCC)表现出形态学、细胞和分子异质性[1]。最近的研究已经证明,癌细胞的一个亚群-癌症干细胞(cancer stem cells,CSCs)具有增殖、自我更新并促进肿瘤形成的能力[2]。肝CSCs能够通过一些表面标记物被富集,如CD13、CD24、CD90和CD133等[3-7],且CD24能通过STAT3介导的Nanog调控作用促进肝CSCs的自我更新和致肿瘤性[4]。已有的研究[8]证明,转录因子Nanog是肝CSCs的一个独特标记物,且在肝CSCs自我更新过程中发挥重要的调控作用。然而,肝CSCs如何维持自我更新能力仍然未知。去乙酰化酶1(sirtuins,SIRT1)能催化脱去组蛋白和非组蛋白的乙酰基[9]。癌症中,SIRT1在恶性组织和细胞中持续上调表达,且已经证明其与癌症的快速进展和预后不良有关[10]。SIRT1在维持胚胎干细胞和造血干细胞自我更新过程中发挥重要作用,尤其是在应激条件下[11]。然而,SIRT1在肝CSCs更新中的作用仍然未知。本研究探讨了SIRT1在肝CSCs更新中的作用及相关分子机制,以期为肝癌的临床治疗提供思路。
1 材料与方法
1.1材料与仪器HEK-293FT细胞、稳定表达Nanog-GFP的Huh7细胞株由本实验室保存。恒温CO2培养(美国Thermo Fisher)、多功能酶标仪(美国BioTek公司)、流式细胞仪(美国BD公司)。
1.2主要试剂DMEM/F12 培养基、DMEM培养基均购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS,以色列BI公司);胰蛋白酶、Polybrene均购自美国Sigma公司;细胞因子bFGF、EGF、HGF均购自美国Pepro Tech公司;B27(美国Gibco公司);谷氨酰胺(上海生工);青霉素、链霉素(美国Sigma公司)。完全培养基的成分如下:DMEM、质量浓度为100 g/L的胎牛血清、青霉素与链霉素(100 U/ml、100 μg/ml);成球培养基: DMEM/F12培养基、bFGF(20 ng/ml)、EGF(20 ng/ml)、HGF(10 ng/ml)、B27(50×)、谷氨酰胺(2 mmol/L)、青霉素与链霉素(100 U/ml、100 μg/ml)。兔抗人SIRT1、鼠抗人SOX2抗体(美国SantaCruz公司);鼠抗人c-Myc抗体、兔抗人Nanog抗体(美国Abcam公司);鼠抗人α-tubulin抗体(美国Sigma公司);HRP标记的羊抗兔/鼠IgG(美国Abcam公司)。质粒转染试剂盒X-TremeGENE HP DNA Transfection Reagent(德国Roche),DAPI(上海碧云天生物技术研究所),Transwell 细胞小室(德国 Merck Millipore 公司)。
1.3肝CSCs的获取将本实验室保存的稳定感染Lv-PNanog-GFP慢病毒的Huh7细胞扩大培养后,胰酶消化细胞,培养基终止消化,离心收集细胞,PBS重悬细胞,细胞悬液过200目筛网后,流式细胞仪分选GFP阳性细胞,这群Huh7-Nanogpos细胞为肝CSCs。细胞株培养于质量浓度为100 g/L FBS的DMEM培养基中,于37 ℃,体积分数为5%的CO2饱和湿度下进行培养。稳定传代2~3代后,取对数生长期细胞进行后续实验。
1.4肝CSCs转染肝CSCs接种于6孔板中,采用质量浓度为100 g/L FBS+DMEM培养基培养至细胞汇合度达到60%后,实验组每孔加入100 nmol/L SIRT1特异性siRNA及5 μl LipofectamineTM2000;对照组每孔加入100 nmol/L阴性对照(NC-siRNA)及5 μl的LipofectamineTM2000。对于逆转实验,转染SIRT1特异性siRNA后24 h,再转染过表达SOX2质粒,每孔加入3 μg质粒及2 μl LipofectamineTM2000。每孔加入无血清DMEM培养基至终体积2 ml,置于37 ℃,体积分数为5%的CO2、饱和湿度培养箱中培养6 h,然后更换完全培养基继续培养。
1.5球体形成检测Huh7-Nanogpos细胞转染NC-siRNA或siSIRT1后48 h,两组细胞均用常规方法收集:胰酶消化细胞,质量浓度为100 g/L FBS+DMEM终止消化,离心,PBS重悬细胞,然后对照组和实验组细胞均用流式细胞仪以30个/孔的密度接种于低黏附96孔细胞培养板中,每组8个重复孔,培养板孔中预先加入100 μl成球培养基,37 ℃,体积分数为5%的CO2培养箱培养。3 d后补充1次成球培养基150 μl,继续培养7 d后,光学显微镜下计数不同处理组成球个数,并计算球体形成率。成球率(%)=(平均细胞球数/接种细胞数)×100%。
1.6克隆形成能力检测过表达SIRT1的Huh7-Nanogpos及空载体对照细胞均用常规方法收集:胰酶消化细胞,培养基终止消化,离心,PBS重悬细胞,然后对照组和实验组细胞均用流式细胞仪以50个/孔的密度接种于24孔细胞培养板中,每组12个重复孔,培养板孔中预先加入500 μl 质量浓度为100 g/L FBS+DMEM,于37 ℃,体积分数为5%的CO2培养箱培养。每隔3 d更换1次新鲜培养基,培养12 d后,弃掉培养基,PBS洗2遍,使用质量浓度为40 g/L的多聚甲醛固定30 min后吸去,质量浓度为4 g/L 结晶紫溶液染色5 min后吸去,用去离子水洗弃残余的结晶紫溶液,自然风干,计数不同处理组细胞数大于50个的克隆并计算克隆形成率。克隆形成率(%)=(平均克隆形成数/接种细胞数)×100%。
1.7Westernblotting检测SIRT1、SOX2、c-Myc和Nanog表达胰酶消化并收集经特定处理的细胞,用含有蛋白酶抑制剂的NP40裂解液重悬裂解细胞,冰上裂解30 min,15 000×g离心10 min,收集细胞裂解上清用于跑SDS-PAGE。然后将总蛋白转移至PVDF膜上,膜经质量浓度为50 g/L 脱脂奶粉室温封闭1 h后,孵育一抗。一抗稀释比例如下:抗SIRT1抗体,1∶1 000、抗SOX2抗体,1∶1 000、抗c-Myc抗体,1∶500、抗Nanog抗体,1∶1 000、抗α-tubulin抗体:1∶5 000,4 ℃孵育过夜。HRP标记的羊抗鼠/兔二抗(1∶5 000),室温孵育2 h。α-tubulin为上样的内参蛋白。目的蛋白用ECL发光液进行显色。使用GeneTools图像分析系统对目的蛋白的灰度值进行分析。
1.8BALB/c裸鼠成瘤实验1×106个NC-siRNA或siSIRT1转染的肝脏CSCs通过皮下注射的方式注射入BALB/c皮下组织,每组5只裸鼠。分为NC-siRNA组、siSIRT1组、非肝脏CSCs组和非肝脏CSCs+SIRT1过表达组。接种后每天观察裸鼠肿瘤生长情况,并且每隔5 d测量一次肿瘤体积。5周后,将所有实验裸鼠颈椎脱臼处死,去除瘤体,测量肿瘤的长径和短径。皮下肿瘤体积(TV)计算公式:TV=0.5×A×B2(A、B分别代表瘤体长径和短径),根据测量结果计算肿瘤体积,分析不同SIRT1表达情况对肝脏CSCs致肿瘤性的影响。
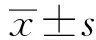
2 结果
2.1SIRT1在在肝CSCs中过表达Western blotting检测结果表明,SIRT1在肝脏CSCs表达显著高于非-CSCs(见图1A,P<0.001)。而免疫荧光染色结果也证实,SIRT1在肝CSCs中高表达(见图1B)。
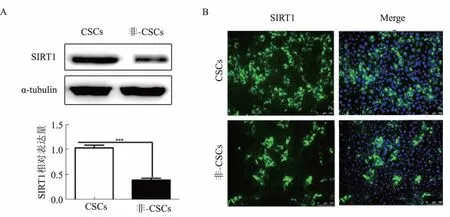
图1 肝脏CSCs中SIRT1表达情况 A: Western blotting检测结果;B: 免疫荧光染色检测(200×)Fig 1 Expression of SIRT1 in liver CSCs A:detection results of Western blotting; B:detection of immunofluorescense assay(200×)
2.2SIRT1余肝脏CSCs自我更新和致肿瘤性有关结果表明,敲低SIRT1表达能显著抑制肝脏CSCs克隆形成和球体形成能力(见图2A和2C)。BALB/c裸鼠成瘤体内实验结果表明,沉默SIRT1表达能显著抑制皮下肿瘤模型小鼠体内肿瘤生长(见图2B)。
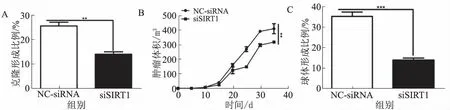
2.3过表达外源性SIRT1能恢复肝脏非-CSCs的自我更新能力Western blotting检测结果表明,肝脏非-CSCs中SIRT1表达量显著升高(见图3A,P<0.001),且过表达SIRT1提高了肝脏非-CSCs的克隆形成能力(见图3B)。肿瘤启动实验结果表明,实验小鼠移植肝脏非-CSCs后,体内形成小型肿瘤,而移植过表达SIRT1的肝脏非-CSCs的小鼠体内肿瘤体积明显更大(见图3C)。
注:**P<0.01; *** P<0.001。
注:**P<0.01; *** P<0.001。
2.4敲低或抑制SIRT1活性降低肝CSCs的干性特征结果表明,敲低SIRT1表达的同时也抑制了SOX2表达水平(见图4A)。而SIRT1特异性抑制剂TV6抑制SIRT1表达的同时也抑制了SOX2表达(见图4B)。SIRT1可能直接调控SOX2表达从而调控肝CSCs的自我更新能力。
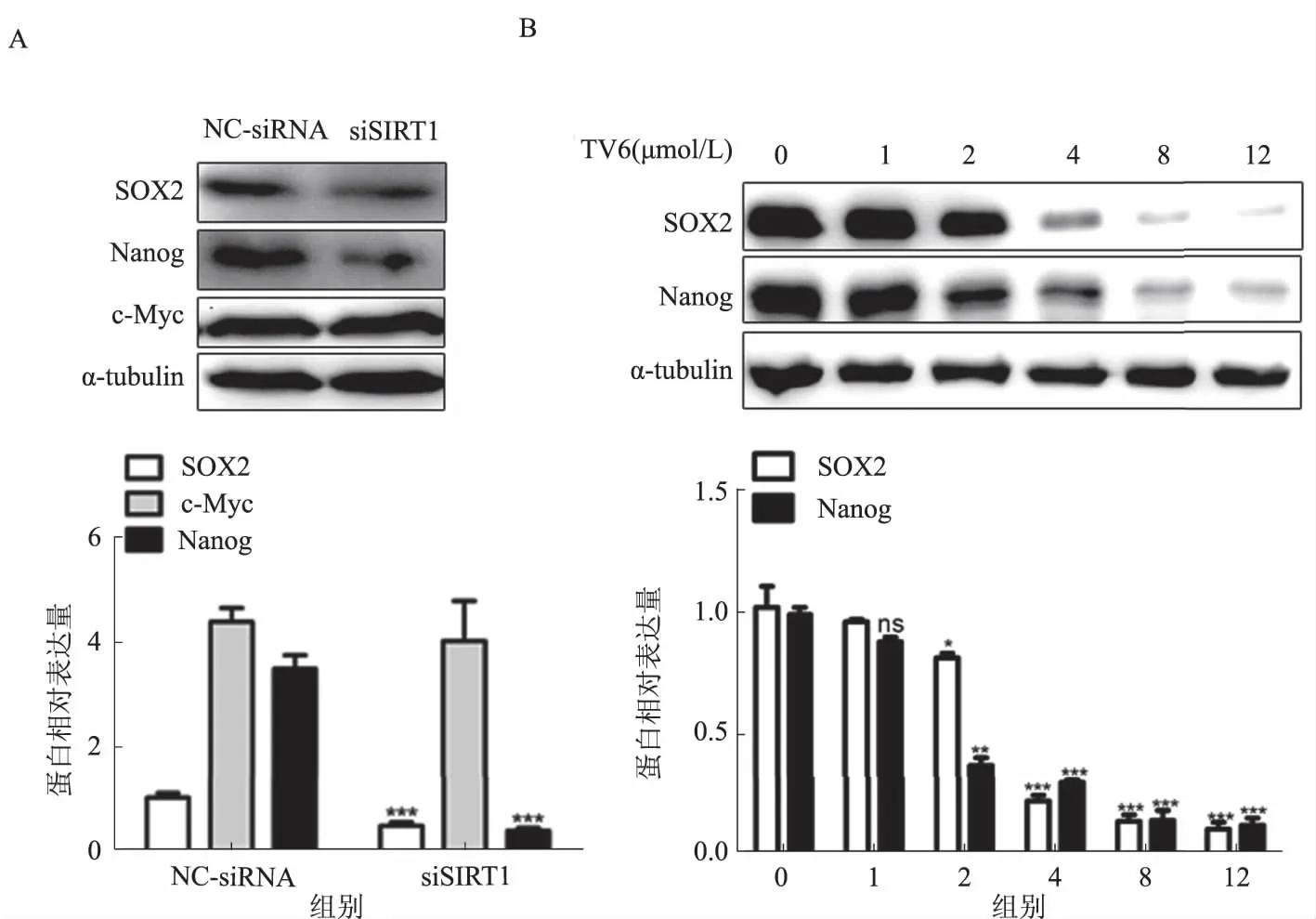
注:*P<0.05; ** P<0.01;*** P<0.0010。
2.5SIRT1通过SOX2调控肝CSCs的自我更新SIRT1的蛋白表达与SOX2呈正相关(见图5A)。过表达外源性SOX2能部分逆转敲低SIRT1表达所导致的肝CSCs克隆形成下降(见图5B)。肿瘤启动实验结果表明,过表达外源性SOX2能部分逆转敲低SIRT1表达所导致的肝CSCs致肿瘤性下降(见图5B)。
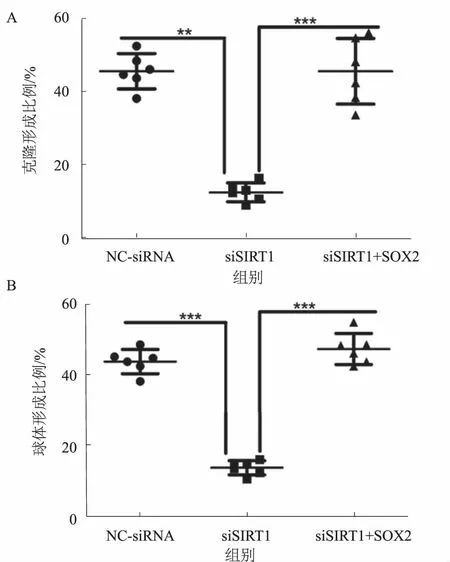
注:**P<0.01; *** P<0.001。
3 讨论
尽管研究已经证明SIRT1是一种肿瘤抑制因子,但也有一些研究表明SIRT1能够促进肿瘤进展[12]。对于HCC,SIRT1在肿瘤组织中过度表达,且其在肿瘤细胞生长和致肿瘤性方面发挥重要作用[13],表明SIRT1在HCC中是一种致癌基因。本研究进一步证实,SIRT1在干样特性的HCC细胞亚群中过度表达,且其对于该类型细胞的自我更新和致肿瘤性的维持是必需的。
以前的报道认为,SIRT1能通过消除活性氧自由基及抑制p53表达而抑制造血干细胞分化,且有助于干细胞池的维持[14-15]。且SIRT1通过p53脱乙酰作用增强iPSC生成[16]。这些研究表明,SIRT1催化的p53脱乙酰作用有助于干细胞的生物特性的形成。由于p53突变和失调表达主要在癌症和HCC细胞中发生,SIRT1似乎不太可能通过调控p53表达而调控肝CSCs的自我更新和致肿瘤性。因此,本研究集中探讨了SIRT1的功能对多能性转录因子表达的影响。本研究结果表明,SIRT1能调控SOX2表达,且进一步的研究证实,SOX2是SIRT1-介导的肝CSCs自我更新和致肿瘤性中的主要调控因子。
SOX2是SOX基因家族的一员,其编码的SOX2蛋白能结合特异性的DNA靶序列,引起DNA发生一定程度的弯曲,从而调控靶基因的转录[17]。有研究表明,生殖细胞肿瘤中SOX2表达异常升高[18];BILD等[19]的研究发现,卵巢癌患者生存时间不足5年的患者其组织中SOX2表达水平显著高于生存时间超过5年的患者;SANADA等[20]研究发现,随着胰腺癌的进展,胰腺癌组织中SOX2表达量逐渐增加。由此可见,SOX2基因的表达与癌症的发生、发展密切相关。本研究发现,SIRT1能通过调控SOX2表达而调控肝CSCs的自我更新和致肿瘤性。这可能揭示,SIRT1调控肝CSCs更新和致肿瘤性的一种可能的机制,具体的分子机制还需要进一步深入研究。
总之,当前的研究证明,SIRT1的高水平表达对于维持人肝CSCs的未分化状态是必需的。这种效应是通过SIRT1靶向其下游分子SOX2发挥的。然而,作为一种转录因子,SOX2下游的靶向分子仍不清楚,这是我们下一步的研究重点。但本研究仍为SIRT1作为肝癌治疗的新型靶位点提供了初步的理论依据。
[1] SHACKLETON M, QUINTANA E, FEARON E R, et al. Heterogeneity in cancer: cancer stem cells versus clonal evolution [J]. Cell, 2009, 138(5): 822-829. DOI: 10.1016/j.cell.2009.08.017.
[2] TORRE-HEALY L A, BEREZOVSKY A, LATHIA J D. Isolation, characterization, and expansion of cancer stem cells [J]. Methods Mol Biol, 2017, 1553(2): 133-143. DOI: 10.1007/978-1-4939-6756-8_10.
[3] HARAGUCHI N, ISHII H, MIMORI K, et al. CD13 is a therapeutic target in human liver cancer stem cells [J]. J Clin Invest, 2010, 120(9): 3326-3339. DOI: 10.1172/JCI42550.
[4] LEE T K, CASTILHO A, CHEUNG V C, et al. CD24(+) liver tumor-initiating cells drive self-renewal and tumor initiation through STAT3-mediated NANOG regulation [J]. Cell Stem Cell, 2011, 9(1): 50-63. DOI: 10.1016/j.stem.2011.06.005.
[5] YANG Z F, HO DW, NG M N, et al. Significance of CD90+ cancer stem cells in human liver cancer [J]. Cancer Cell, 2008, 13(2): 153-166. DOI: 10.1016/j.ccr.2008.01.013.
[6] MA S, LEE T K, ZHENG B J, et al. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway [J]. Oncogene, 2008, 27(12):1749-1758. DOI: 10.1038/sj.onc.1210811.
[7] ZHAO W, WANG L, HAN H, et al. 1B50-1, a mAb raised against recurrent tumor cells, targets liver tumor-initiating cells by binding to the calcium channel α2δ1 subunit [J]. Cancer cell, 2013, 23(4):541-556. DOI: 10.1016/j.ccr.2013.02.025.
[8] SHAN J, SHEN J, LIU L, et al. Nanog regulates self-renewal of cancer stem cells through the insulin-like growth factor pathway in human hepatocellular carcinoma [J]. Hepatology, 2012, 56(3): 1004-1014. DOI: 10.1002/hep.25745.
[9] ROTH M, CHEN W Y. Sorting out functions of sirtuins in cancer [J]. Oncogene, 2014, 33(13): 1609-1620. DOI: 10.1038/onc.2013.120.
[10] MING M, SOLTANI K, SHEA C R, et al. Dual role of SIRT1 in UVB-induced skin tumorigenesis [J]. Oncogene, 2015, 34(3): 357-363. DOI: 10.1038/onc.2013.583.
[11] OU X, CHAE H D, WANG R H, et al. SIRT1 deficiency compromises mouse embryonic stem cell hematopoietic differentiation, and embryonic and adult hematopoiesis in the mouse [J]. Blood, 2011, 117(2): 440-450. DOI: 10.1182/blood-2010-03-273011.
[12] HERRANZ D, SERRANO M. SIRT1: recent lessons from mouse models [J]. Nat Rev Cancer, 2010, 10(12): 819-823. DOI: 10.1038/nrc2962.
[13] JANG K Y, NOH S J, LEHWALD N, et al. SIRT1 and c-Myc promote liver tumor cell survival and predict poor survival of human hepatocellular carcinomas [J]. PLoS One, 2012, 7(9): e45119. DOI: 10.1371/journal.pone.0045119.
[14] LEKO V, VARNUM-FINNEY B, LI H, et al. SIRT1 is dispensable for function of hematopoietic stem cells in adult mice [J]. Blood, 2012, 119(8): 1856-1860. DOI: 10.1182/blood-2011-09-377077.
[15] MATSUI K, EZOE S, ORITANI K, et al. NAD-dependent histone deacetylase, SIRT1, plays essential roles in the maintenance of hematopoietic stem cells [J]. Biochem Biophys Res Commun, 2012, 418(4): 811-817. DOI: 10.1016/j.bbrc.2012.01.109.
[16] LEE Y L, PENG Q, FONG S W, et al. Sirtuin 1 facilitates generation of induced pluripotent stem cells from mouse embryonic fibroblasts through the miR-34a and p53 pathways [J]. PLoS One, 2012, 7(9): e45633. DOI: 10.1371/journal.pone.0045633.
[17] WEGNER M. From head to toes: the multiple facets of Sox proteins [J]. Nucleic Acids Res, 1999, 27(6):1409-1420.
[18] LOOIJENGA L H. Human testicular (non) seminomatous germ cell tumours: the clinical implications of recent pathobiological insights [J]. J Pathol, 2009, 218(2):146-162. DOI: 10.1002/path.2522.
[19] BILD A H, YAO G, CHANG J T, et al. Oncogenic pathway signatures in human cancers as a guide to targeted therapies [J]. Nature, 2006, 439(7074): 353-357. DOI: 10.1038/nature04296.
[20] SANADA Y, YOSHIDA K, OHARA M, et al. Histopathologic evaluation of stepwise progression of pancreatic carcinoma with immunohistochemical analysis of gastric epithelial transcription factor SOX2: comparison of expression patterns between invasive components and cancerous or nonneoplastic intraductal components [J]. Pancreas, 2006, 32(2): 164-170. DOI: 10.1097/01.mpa.0000202947.80117.a0.
