MicroRNA-144-3p在胰腺癌中的表达及其对胰腺癌侵袭转移的影响
2018-01-23罗和生陈小丽黄晓东
罗和生, 陈小丽, 田 霞, 黄晓东
1.武汉大学人民医院消化内科,湖北 武汉 430060; 2.武汉大学附属同仁医院(武汉市第三医院)消化内科
胰腺癌是一种高度侵袭性的恶性肿瘤,在美国是排名第四的肿瘤相关致死性疾病,有超过一半的胰腺癌患者确诊时已属晚期,5年生存率低于5%[1]。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是最常见的胰腺癌类型,早期症状不明显,容易发生远处转移,因而预后差,死亡率高。微小RNA(microRNA,miRNA)是一类进化上高度保守,长约22个核苷酸的内源性非编码小RNA,通过与靶mRNA的3′非编码区(3′-untranslated region, 3′UTR)不完全或完全互补结合,抑制靶mRNA的翻译或降解靶mRNA,在转录后水平调节基因的表达。研究[2]表明,miRNA与肿瘤的形成密切相关,胰腺癌中异常表达的miRNA可能通过调节原癌基因或抑癌基因的表达参与胰腺癌的发生、发展。有研究[3-5]报道,miR-144-3p通过不同的调控机制,在多种肿瘤中扮演抑癌基因的角色,例如胃癌、肾细胞癌、脑胶质瘤等,其中包括miR-144-3p通过靶向作用于原癌基因c-Met抑制脑胶质瘤细胞的增殖和侵袭[5]。虽然miR-144-3p在肿瘤中的报道较多,但在胰腺癌中的研究甚少,因此,本研究通过检测胰腺癌组织和细胞系中miR-144-3p的表达,观察其对胰腺癌侵袭转移的影响。
1 材料与方法
1.1临床标本本研究收集13对胰腺癌组织和对应癌旁组织标本(距癌组织边界≤3 cm),样本取自2015年12月至2017年3月武汉市中心医院肝胆胰外科行胰十二指肠切除术的患者,男7例,年龄(4±9)岁;女6例,年龄(5±10)岁。所有标本术后病理诊断均为PDAC。组织标本离体后迅速置于液氮速冻,后储存于-80 ℃备用。本研究经医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2细胞系及细胞培养人胰腺癌细胞系PANC-1、MIA PaCa-2、BxPC-3、AsPC-1、SW1990和胰腺导管正常细胞H6C7均购自美国典藏细胞库(ATCC),其中,PANC-1和MIA PaCa-2生长于DMEM培养基,BxPC-3和AsPC-1生长于RPMI 1640培养基,所有培养基均加入质量浓度为100 g/L的胎牛血清和10 g/L的青-链霉素,置于37 ℃,体积分数为5%的CO2的培养箱中恒温培养。
1.3主要试剂和仪器DMEM培养基、RPMI-1640培养基、转染用OPTI-MEM培养基、胎牛血清购自美国Gibco公司;miR-144-3p mimic及mimic NC购自上海吉玛公司;miR-144-3p逆转录试剂盒购自广州锐博公司;荧光定量PCR试剂盒购自北京康为世纪公司;TRIzol、Lipofectamine LTX购自美国Invitrogen公司;Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司;BCA蛋白测定试剂盒购自美国Thermo公司,ECL化学发光试剂盒购自美国GE公司;鼠抗人β-actin单克隆抗体、羊抗鼠IgG和羊抗兔IgG购自美国Santacruz公司,兔抗人ETS1多克隆抗体购自美国Abcam公司。紫外分光光度计购自美国Beckman公司、实时荧光定量PCR仪(StepOne plus)购自美国Lifetechnologies公司。
1.4qRT-PCR检测miR-144-3p的表达组织及细胞总RNA的提取采用TRIzol试剂,操作步骤按照试剂盒说明书进行。本文通过microRNA数据库miRBase中的TargeScan和miRDBA数据库均可预测到miR-144-3p可能的靶基因ETS1。紫外分光光度计检测RNA的纯度及浓度,取1 μg总RNA与1 μl逆转录酶、3 μl逆转录引物混合,在15 μl反应体系中,16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,进行逆转录。然后取1.33 μl逆转录产物 cDNA 与1 μl引物混合,在20 μl 反应体系中,95 ℃变性10 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。U6作内对照,miR-144-3p的相对表达量在组织中用2-ΔΔCt计算,细胞系中用2-ΔΔCt计算。
1.5划痕实验检测细胞迁移能力将对数生长期的PANC-1细胞铺板,待细胞密度达到60%融合后,按照Lipofectamine LTX试剂盒说明书将mimic NC和 mimic分别转染入细胞,48 h后用200 μl经高压灭菌的枪头进行划痕,PBS洗2次后换用无血清的培养基,拍照后放入培养箱,待24 h后再次拍照。
1.6Transwell小室检测细胞迁移和侵袭能力
1.6.1 细胞迁移实验:细胞转染2 d后,用无血清培养基配制成5×104ml-1的细胞悬液,在Transwell上室加入200 μl细胞悬液,即细胞数每孔约1×104个,下室加入500 μl 完全培养基,每组设置3个副孔。将24孔板放入细胞培养箱,24 h后取出小室,多聚甲醛固定,吉姆萨染色,显微镜下观察并拍照,每孔随机取5个视野进行细胞计数,计算平均值。
1.6.2 细胞侵袭实验:细胞转染2 d后,用无血清培养基配制成5×104ml-1的细胞悬液,在提前用Matrigel基质胶包被的小室中加入200 μl细胞悬液,即细胞数每孔约1×104个,下室加入500 μl 完全培养基,每组设置3个副孔。将24孔板放入细胞培养箱,24 h后取出小室,多聚甲醛固定,吉姆萨染色,显微镜下观察并拍照,每孔随机取5个视野进行细胞计数,计算平均值。
1.7Westernblotting检测蛋白表达水平利用RIPA裂解液(质量浓度为10 g/L的PMSF)裂解转染后的细胞,提取总蛋白,测定蛋白浓度,取40 μg蛋白样品进行聚丙烯酰胺凝胶电泳分离,并将其电转移至PVDF膜,质量浓度为50 g/L脱脂奶粉室温封闭1 h,一抗4 ℃孵育过夜,TBST洗涤3次后室温孵育二抗1 h,洗涤后经ECL底物显色,显影,成像仪扫描结果。

2 结果
2.1胰腺癌组织及细胞系中miR-144-3p的表达胰腺癌组织和癌旁组织中miR-144-3p的表达量分别为3.26±1.94、16.21±9.82 (t=5.25,P<0.05),胰腺癌组织中miR-144-3p的表达量显著低于癌旁组织(见图1A)。胰腺癌细胞系PANC-1、MIA PaCa-2、AsPC-1、BxPC-3、SW1990中miR-144-3p的相对表达量依次为0.48±0.08、0.43±0.05、0.69±0.08、0.56±0.08、0.42±0.10,与正常胰腺细胞(H6C7)相比,所有胰腺癌细胞系中miR-144-3p的表达均降低(t值分别为10.82、15.20、15.07、11.74、7.01,P<0.001)(见图1B)。
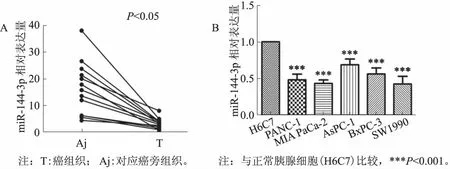
图1 胰腺癌组织及细胞系中miR-144-3p的表达 A:胰腺组织;B:细胞系Fig 1 Expression of miR-144-3p in pancreatic cancer tissues and cell lines A: the pancreatic tissues; B: the cell lines
2.2过表达miR-144-3p抑制PANC-1细胞的迁移和侵袭能力划痕实验显示,24 h后转染miR-144-3p mimic的细胞划痕愈合速度明显慢于mimic NC组(见图2)。同时,利用Transwell小室检测过表达miR-144-3p后细胞迁移侵袭能力的影响,结果显示,mimic组迁移细胞数为(239±22)个,mimic NC组为(569±26)个;mimic组侵袭细胞数为(132±16)个,mimic NC组侵袭细胞数为(228±21)个,过表达miR-144-3p组PANC-1 细胞迁移和侵袭到小室底部的细胞数明显减少(P<0.05,见图3)。

图2 过表达miR-144-3p抑制胰腺癌细胞PANC-1的迁移Fig 2 Overexpression of miR-144-3p inhibited the migrationof PANC-1 in pancreatic cancer cells
2.3过表达miR-144-3p靶向抑制PANC-1细胞ETS1蛋白表达利用生物信息学分析,在数据库TargetScan和miRDB中预测ETS1是miR-144-3p潜在的靶基因。软件预测ETS1 3′UTR区与miR-144-3p的结合位点,Western blotting结果显示,mimic组ETS1蛋白的表达水平明显低于mimic NC组(见图4A、4B)。
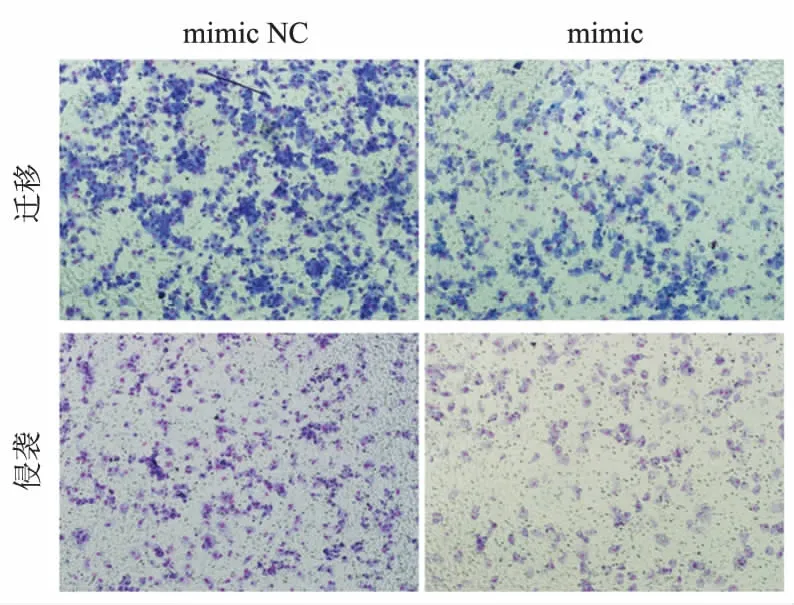
图3 过表达miR-144-3p抑制胰腺癌细胞PANC-1的迁移和侵袭Fig 3 Overexpression of miR-144-3p inhibited the migration andinvasion of PANC-1 in pancreatic cancer cells
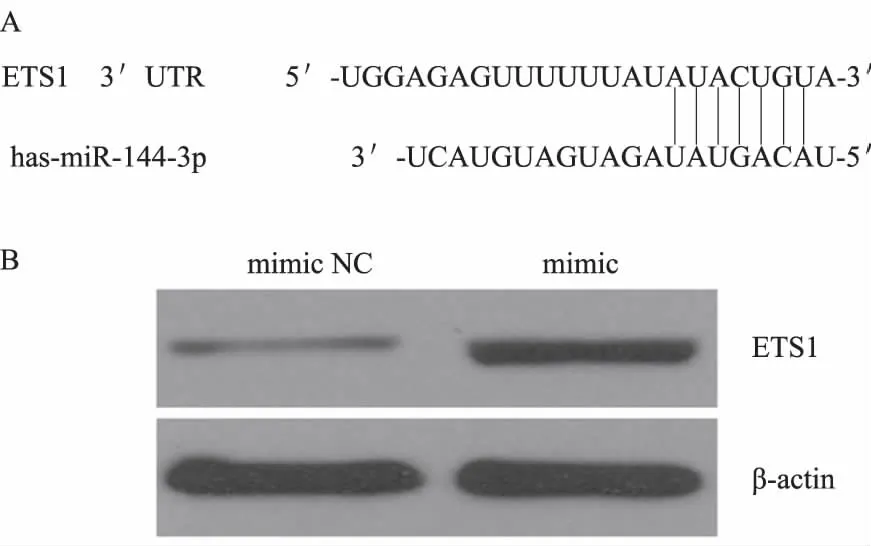
图4 过表达miR-144-3p靶向抑制PANC-1细胞ETS1蛋白表达 A:预测ETS1 3′UTR区与miR-144-3p的结合位点;B:过表达miR-144-3p抑制PANC-1细胞ETS1蛋白表达Fig 4 Overexpression of miR-144-3p target to inhibit the expressionof ETS1 protein in PANC-1 cells A: prediction of the binding sites of ETS1 3′UTR region and miR-144-3p; B: overexpression of miR-144-3p inhibited the expression of ETS1 protein in PANC-1 cells
3 讨论
胰腺癌发病隐匿,进展迅速,其发病率和死亡率在全球范围内仍在增长[6]。胰腺癌的高死亡率与其易发生侵袭转移密切相关,有研究[7]表明,约80%的胰腺癌患者确诊时已发生远处转移,失去了手术根治的机会。异常表达的miRNA对多种肿瘤的发生、发展至关重要,多种miRNA被证实扮演着癌基因或抑癌基因的双重角色。近期研究显示,miR-144-3p在多种肿瘤中发挥抑癌基因的作用。LAN等[8]发现,miR-144-3p在脑胶质瘤中低表达,并可通过靶向作用原癌基因MET抑制脑胶质瘤细胞的增殖和侵袭能力。LI等[9]在胃癌研究时发现,miR-144-3p可靶向下调前B淋巴细胞白血病转录因子(pre-leukemia transcription factor 3,PBX3)抑制上皮间质转化(epithelial-mesenchymal transition,EMT),从而阻遏癌症进展,且发现在晚期、瘤体大和有淋巴结转移的癌组织中miR-144-3p的表达更低,表明miR-144-3p的水平与转移程度、肿瘤的大小、淋巴结转移及TNM分期有密切的联系。本研究中miR-144-3p在胰腺癌组织的表达较癌旁组织明显降低,且与正常胰腺细胞相比,其在胰腺癌细胞系的表达也显著降低,提示miR-144-3p在胰腺癌的发生、发展中可能起着抑癌基因的作用,且在胰腺癌细胞PANC-1中过表达miR-144-3p后,发现其迁移和侵袭能力明显降低。
ETS转录因子家族是转录因子中最大的一个家族之一,通过识别并结合其靶基因的启动子或增强子的GGA核心序列调控着重要的生物进程,如细胞的增殖、分化和凋亡[10]。ETS1作为ETS家族中最具代表性的转录调控因子,在肿瘤的生长、浸润、转移[11]和血管生成[12]等方面均起着不可替代的作用。ZHANG等[13]证实,ETS1在侵袭性乳腺癌中高表达,并且上调的ETS1与其预后不良有关,而且发现miR-125b在侵袭性乳腺癌中低表达,miR-125b可靶向作用于ETS1抑制肿瘤的形成。有研究[14]表明,ETS1可通过调节EMT减弱喉鳞癌细胞的生长、侵袭和转移能力,而且指出ETS1诱导的EMT可能与血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达有关。本研究通过靶基因预测数据库筛选出ETS1是miR-144-3p的靶基因,并且过表达miR-144-3p可抑制ETS1的蛋白水平,并减弱胰腺癌细胞的迁移和侵袭能力。
综上所述,本研究发现,miR-144-3p在胰腺癌组织和细胞系中均低表达,并且通过靶向作用于ETS1抑制胰腺癌细胞的侵袭转移,然而,miR-144-3p抑制胰腺癌进展的具体机制是什么,调节miR-144-3p的表达是否抑制胰腺癌的发展并改善预后等问题还需进一步研究。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer Statistics, 2017 [J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI: 10.3322/caac.21387.
[2] LI Y, SARKAR F H. MicroRNA targeted therapeutic approach for pancreatic cancer [J]. Int J Biol Sci, 2016, 12(3): 326-337. DOI: 10.7150/ijbs.15017.eCollection 2016.
[3] LI B, ZHANG S, SHEN H, et al. MicroRNA-144-3p suppresses gastric cancer progression by inhibiting epithelial-to-mesenchymal transition through targeting PBX3 [J]. Biochem Biophys Res Commun, 2017, 484(2): 241-247. DOI: 10.1016/j.bbrc.2017.01.084.
[4] LIU F, CHEN N, XIAO R, et al. miR-144-3p serves as a tumor suppressor for renal cell carcinoma and inhibits its invasion and metastasis by targeting MAP3K8 [J]. Biochem Biophys Res Commun, 2016, 480(1): 87-93. DOI: 10.1016/j.bbrc.2016.10.004.
[5] LAN F, YU H, HU M, et al. miR-144-3p exerts anti-tumor effects in glioblastoma by targeting c-Met [J]. J Neurochem, 2015, 135(2): 274-286. DOI: 10.1111/jnc.13272.
[6] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016 [J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI: 10.3322/caac.21332.
[7] DART A. Metastasis: CXCR2-targeted therapy for pancreatic cancer [J]. Nat Rev Cancer, 2016, 16(7): 411. DOI: 10.1038/nrc. 2016.67.
[8] LAN F, YU H, HU M, et al. miR-144-3p exerts anti-tumor effects in glioblastoma by targeting c-Met [J]. J Neurochem, 2015, 135(2): 274-286. DOI: 10.1111/jnc.13272.
[9] LI B, ZHANG S, SHEN H, et al. MicroRNA-144-3p suppresses gastric cancer progression by inhibiting epithelial-to-mesenchymal transition through targeting PBX3 [J]. Biochem Biophys Res Commun, 2017, 484(2): 241-247.
[10] LI R, PEI H, WATSON D K. Regulation of Ets function by protein-protein interactions [J]. Oncogene, 2000, 19(55): 6514-6523.
[11] DEVES C, RENCK D, GARICOCHEA B, et al. Analysis of select members of the E26 (ETS) transcription factors family in colorectal cancer [J]. Virchows Arch, 2011, 458(4): 421-430. DOI: 10.1007/s00428-011-1053-6.
[12] HEO S H, CHOI Y J, RYOO H M, et al. Expression profiling of ETS and MMP factors in VEGF-activated endothelial cells: role of MMP-10 in VEGF-induced angiogenesis [J]. J Cell Physiol, 2010, 224(3): 734-742. DOI: 10.1002/jcp.22175.
[13] ZHANG Y, YAN L X, WU Q N, et al. miR-125b is methylated and functions as a tumor suppressor by regulating the ETS1 proto-oncogene in human invasive breast cancer [J]. Cancer Res, 2011, 71(10): 3552-3562. DOI: 10.1158/0008-5472.CAN-10-2435.
[14] ZHANG S Y, LU Z M, LIN Y F, et al. miR-144-3p, a tumor suppressive microRNA targeting ETS-1 in laryngeal squamous cell carcinoma [J]. Oncotarget, 2016, 7(10): 11637-11650. DOI: 10.18632/oncotarget.7025.
